La aparición en el campo de la oncología de moléculas terapéuticas en forma de anticuerpos monoclonales, cuyo objetivo consiste en estimular el propio sistema inmune del paciente para que sea este el encargado de destruir las células cancerígenas, ha revolucionado el tratamiento de diversos cánceres en los últimos años. Este tipo de terapia, denominada inmunoterapia, se caracteriza además por presentar efectos secundarios en forma de enfermedades autoinmunes que todavía estamos empezando a conocer. Desde el punto de vista de los efectos secundarios inmunomediados reumatológicos, podemos encontrar manifestaciones musculoesqueléticas mecánicas, inflamatorias o enfermedad autoinmune sistémica. El manejo terapéutico de estos efectos secundarios se mantiene variable debido a la ausencia de ensayos clínicos y de recomendaciones validadas, siendo el manejo multidisciplinar fundamental para tratar con éxito dichos casos. En este artículo presentamos nuestra serie de casos clínicos de pacientes en tratamiento con inmunoterapia y efectos secundarios inmunomediados reumatológicos en un hospital universitario.
The appearance in the field of oncology of therapeutic molecules in the form of monoclonal antibodies, whose objective is to stimulate the patient's own immune system to be responsible for destroying cancer cells, has revolutionized the treatment of many cancers in recent years. This type of therapy, called immunotherapy, is also characterized by presenting side effects in the form of autoimmune diseases that we are still beginning to understand. From the point of view of the immune-mediated rheumatological side effects, we can find musculoskeletal manifestations, mechanical, inflammatory or systemic autoimmune diseases. The therapeutic approach to these side effects remains uncertain due to the absence of clinical trials and validated recommendations. The multidisciplinary management is crucial to successfully treat such cases. In the following manuscript, we will describe our case reports of rheumatologic immune-related adverse events in a university hospital.
La inhibición de los puntos de control inmune dirigidos frente a la proteína 4 del linfocito T citotóxico y la proteína 1 de muerte celular programada y su ligando han mejorado significativamente la supervivencia de una gran variedad de cánceres. No obstante, la inmunoterapia es responsable de los denominados efectos adversos inmunorrelacionados (EAir), que se ocasionan a través de diversos mecanismos de acción1.
En el presente artículo describimos nuestra experiencia en la práctica clínica en pacientes que han desarrollado EAir reumatológicos secundarios a la inmunoterapia.
Descripción de la serie de casos clínicosSe revisaron retrospectivamente los pacientes tratados con inmunoterapia (n=170) en el Complejo Hospitalario Universitario Insular Materno Infantil desde 2014 a 2017. Se incluyeron aquellos pacientes que desarrollaron sintomatología reumatológica después de iniciar la inmunoterapia. Estos pacientes fueron valorados por Reumatología para confirmar o descartar enfermedad reumática establecida. De un total de 170 pacientes que recibieron inmunoterapia, 16 (9,4%) presentaron manifestaciones reumatológicas. Fueron excluidos 2 pacientes con lumbalgia por estar relacionada con metástasis óseas. La edad media de los 14 pacientes restantes fue de 59,71 años (46-80 años). El 64,2% eran hombres. El tiempo medio de aparición de los síntomas musculoesqueléticos fue de 21,21 semanas (1-71 semanas).
Entre las manifestaciones reumáticas que presentaron nuestros pacientes, 9 desarrollaron artromialgias sin evidencia de enfermedad inflamatoria, 4 desarrollaron enfermedad inflamatoria articular (una bursitis olecraniana, dos artritis inflamatorias en relación con la inmunoterapia y una artritis microcristalina) y un paciente desarrolló una vasculitis leucocitoclástica.
La distribución según el tipo de neoplasia fue la siguiente: melanoma metastásico (n=3), carcinoma epidermoide de pulmón (n=3), adenocarcinoma de pulmón (n=4), carcinoma adenoescamoso de pulmón (n=1), carcinoma renal de células claras (n=1), carcinoma escamoso de tráquea (n=1) y carcinoma neuroendocrino de pulmón (n=1).
La inmunoterapia utilizada fue nivolimumab en 11 pacientes, pembrolizumab en 2 pacientes y atezolizumab en un paciente.
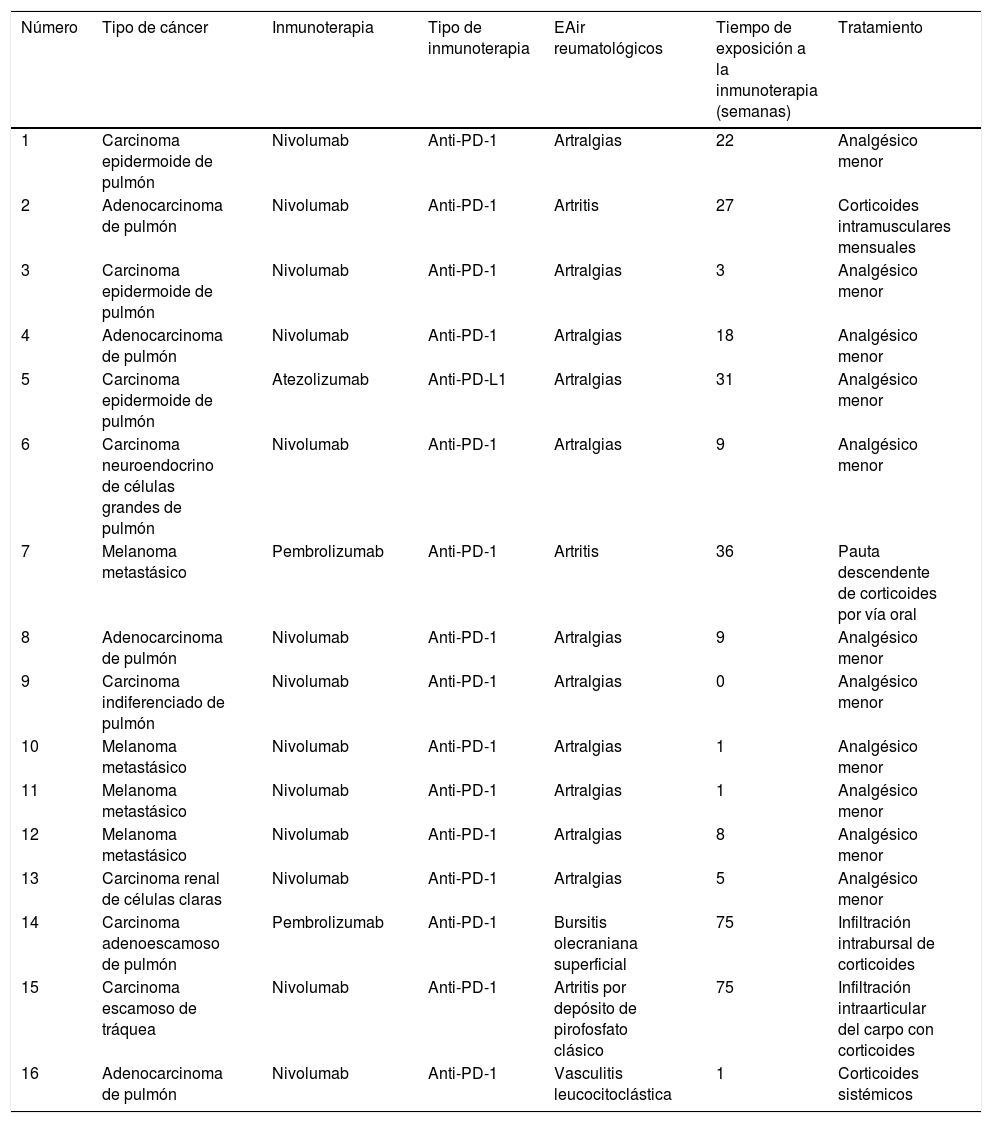
Los datos demográficos, clínicos y de tratamiento se resumen en la tabla 1.
Datos demográficos, clínicos y de tratamiento
| Número | Tipo de cáncer | Inmunoterapia | Tipo de inmunoterapia | EAir reumatológicos | Tiempo de exposición a la inmunoterapia (semanas) | Tratamiento |
|---|---|---|---|---|---|---|
| 1 | Carcinoma epidermoide de pulmón | Nivolumab | Anti-PD-1 | Artralgias | 22 | Analgésico menor |
| 2 | Adenocarcinoma de pulmón | Nivolumab | Anti-PD-1 | Artritis | 27 | Corticoides intramusculares mensuales |
| 3 | Carcinoma epidermoide de pulmón | Nivolumab | Anti-PD-1 | Artralgias | 3 | Analgésico menor |
| 4 | Adenocarcinoma de pulmón | Nivolumab | Anti-PD-1 | Artralgias | 18 | Analgésico menor |
| 5 | Carcinoma epidermoide de pulmón | Atezolizumab | Anti-PD-L1 | Artralgias | 31 | Analgésico menor |
| 6 | Carcinoma neuroendocrino de células grandes de pulmón | Nivolumab | Anti-PD-1 | Artralgias | 9 | Analgésico menor |
| 7 | Melanoma metastásico | Pembrolizumab | Anti-PD-1 | Artritis | 36 | Pauta descendente de corticoides por vía oral |
| 8 | Adenocarcinoma de pulmón | Nivolumab | Anti-PD-1 | Artralgias | 9 | Analgésico menor |
| 9 | Carcinoma indiferenciado de pulmón | Nivolumab | Anti-PD-1 | Artralgias | 0 | Analgésico menor |
| 10 | Melanoma metastásico | Nivolumab | Anti-PD-1 | Artralgias | 1 | Analgésico menor |
| 11 | Melanoma metastásico | Nivolumab | Anti-PD-1 | Artralgias | 1 | Analgésico menor |
| 12 | Melanoma metastásico | Nivolumab | Anti-PD-1 | Artralgias | 8 | Analgésico menor |
| 13 | Carcinoma renal de células claras | Nivolumab | Anti-PD-1 | Artralgias | 5 | Analgésico menor |
| 14 | Carcinoma adenoescamoso de pulmón | Pembrolizumab | Anti-PD-1 | Bursitis olecraniana superficial | 75 | Infiltración intrabursal de corticoides |
| 15 | Carcinoma escamoso de tráquea | Nivolumab | Anti-PD-1 | Artritis por depósito de pirofosfato clásico | 75 | Infiltración intraarticular del carpo con corticoides |
| 16 | Adenocarcinoma de pulmón | Nivolumab | Anti-PD-1 | Vasculitis leucocitoclástica | 1 | Corticoides sistémicos |
EAir: efectos adversos inmunorrelacionados; PD-1: proteína 1 de muerte celular programada; PD-L1: ligando 1 de muerte celular programada.
Los diferentes mecanismos de acción de los agentes inmunoterapéuticos se reflejan en los distintos efectos secundarios que ocasionan. Los inhibidores de la proteína 4 del linfocito T citotóxico tienden a producir efectos adversos más frecuentes y severos (afectación gastrointestinal tipo colitis, cutánea y endocrina tipo hipofisitis), mientras que los inhibidores de la proteína 1 de muerte celular programada y su ligando se asocian con más frecuencia a enfermedades autoinmunes sistémicas, neumonitis o tiroiditis2. La terapia combinada o doble bloqueo consigue una mayor mejoría en la respuesta clínica comparada con la monoterapia, así como un incremento en el riesgo de EAir1,2.
Los EAir suelen aparecer desde las primeras semanas de tratamiento hasta los primeros 3-6 meses de su administración1.
Una revisión sistemática de la literatura3 evidencia que los EAir reumáticos más frecuentemente observados en pacientes con inmunoterapia son las artralgias (1-43%), las mialgias (2-21%), la artritis reumatoide, la artritis psoriásica, el síndrome RS3PE (1-7%) y el síndrome sicca (3-24%).
En los últimos años se han publicado diversas series clínicas que han ido describiendo los EAir reumáticos en la práctica clínica3–6.
Existen recomendaciones para manejar los diferentes EAir reumatológicos elaboradas por el Grupo de Trabajo de Toxicidad de la Sociedad de Inmunoterapia del Cáncer7 y otros grupos de trabajo. En líneas generales, el algoritmo diagnóstico es similar al de un paciente con enfermedad reumatológica, mientras que en el tratamiento se suelen emplear pautas de corticoides más elevadas de las recomendadas, así como inmunosupresores tipo FAME (tanto sintéticos como biológicos). En raras ocasiones es necesaria la suspensión de la inmunoterapia7.
El empleo de tratamiento inmunosupresor o terapia biológica para tratar los EAir es controvertido, ya que podría incrementar el riesgo de desarrollo de algunos EAir8 o interferir en la eficacia de la inmunoterapia9–11. Existen estudios retrospectivos que muestran que la supervivencia no difiere entre los pacientes que fueron tratados con inmunosupresión y los que no la recibieron9.
La inmunoterapia abre un nuevo camino en el campo de la reumatología, quizás poco convencional pero excitante. Un abordaje multidisciplinar ayudaría a mejorar la calidad de la atención al paciente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.