La eficacia mostrada por los fármacos antagonistas del factor de necrosis tumoral (TNF) en los últimos años ha condicionado un aumento de su utilización en diferentes enfermedades inflamatorias articulares. Inicialmente, los estudios de seguridad de estos fármacos se focalizaron principalmente en el riesgo de infecciones y el desarrollo de neoplasias. Sin embargo, recientemente, se han comunicado diversos casos de lesiones cutáneas inducidas por estos fármacos, cuya incidencia ha ido en aumento, resaltando la importancia de la piel como uno de los principales órganos diana de los efectos secundarios de estos tratamientos. Además de las lesiones cutáneas relacionadas directamente con la administración del fármaco, se han observado un amplio espectro de lesiones cutáneas, de morfología y etiología diversa, llamando la atención el desarrollo de enfermedades cutáneas inmunomediadas como un fenómeno emergente relacionado con este tratamiento. Seguidamente se describen las principales lesiones cutáneas asociadas al tratamiento con anti-TNF y se realiza una revisión de la literatura.
The efficacy shown by biological therapy with tumor necrosis factor (TNF) antagonists has led in the recent years to its increased and extended use in different inflammatory arthopathies. Initially, safety studies of these drugs were mainly focused on the risk of infection and the development of malignancies. Recently, several cases of skin lesions induced by anti-TNF drugs have been reported with an increased incidence, highlighting the importance of the skin as a major target of the side effects of these drugs. In addition to skin lesions directly related to drug administration there is a wide spectrum of skin lesions of different morphology and etiology, especially the development of cutaneous immune-mediated conditions, an emergent phenomenon associated with this treatment. We describe the main skin lesions associated with treatment with anti-TNF drugs according to an extensive review of the literature.
En la última década el desarrollo de los denominados fármacos biológicos ha supuesto una nueva opción terapéutica en pacientes con enfermedades inflamatorias articulares crónicas refractarias a diversos y múltiples tratamientos. Los primeros y más conocidos son aquellos dirigidos contra el factor de necrosis tumoral (TNF), citocina proinflamatoria implicada en la fisiopatología de diversas enfermedades inflamatorias. El primer fármaco anti-TNF disponible en nuestro país fue el infliximab, anticuerpo monoclonal quimérico. Posteriormente, se aprobaron el etanercept, proteína de fusión del receptor TNF, y el adalimumab, anticuerpo monoclonal humano. Recientemente, 2 nuevos fármacos anti-TNF han sido aprobados: certolizumab pegol y golimumab. Aunque su indicación inicial fue en pacientes con artritis reumatoide (AR)1–3, estos fármacos han demostrado su eficacia en otras artropatías inflamatorias como espondilitis anquilosante (EA) o artritis psoriásica (APs), ampliándose su indicación terapéutica, y utilizándose incluso «off-label» en otras patologías de base autoinmune debido a sus buenos resultados4.
Asociada a la utilización de estos fármacos se ha descrito también la aparición de diversos efectos adversos relacionados con su administración. Inicialmente, el perfil de seguridad de los fármacos anti-TNF se basó en los datos de los estudios clínicos realizados para su aprobación, aunque, posteriormente a su comercialización, datos procedentes de notificaciones, alertas, estudios observacionales de práctica clínica, registros o bases de datos han contribuido a conocer mejor la seguridad de estos fármacos. Generalmente, la mayor preocupación asociada a la terapia anti-TNF ha sido el desarrollo de infecciones, tanto comunes como oportunistas, aunque otros efectos secundarios como el desarrollo de neoplasias, enfermedad desmielinizante, alteraciones analíticas y desarrollo de anticuerpos han sido también fuente de diversos estudios y publicaciones5,6.
La reciente publicación de diversos casos de psoriasis «de novo» inducida tras la administración de fármacos anti-TNF alertó sobre la importancia de la piel como un posible órgano diana para los efectos adversos relacionados con los antagonistas del TNF7. Posteriormente, se han publicado otros artículos en el que se describen diversas alteraciones cutáneas relacionadas con la administración de estos fármacos. Generalmente, la mayoría de información proviene de casos clínicos aislados o de series de pacientes, pero todavía son escasos los datos procedentes de estudios a largo plazo o de registros. La amplia y cada vez mayor utilización de estos fármacos en diversas enfermedades inflamatorias crónicas ha mostrado no solo un incremento de la tasa de efectos cutáneos en la práctica clínica sino también una amplia variabilidad en el tipo de efecto adverso cutáneo. Así, se han descrito casos de psoriasis, erupciones eccematosas, infección por herpes zoster, infecciones bacterianas y fúngicas, erupciones liquenoides, vasculitis cutánea, alopecia, pénfigo, lupus eritematoso cutáneo, vitíligo y linfomas cutáneos, entre otros8–10. Seguidamente se realiza una revisión de las principales lesiones cutáneas relacionadas con la utilización de fármacos anti-TNF (tabla 1).
Principales lesiones cutáneas asociadas al tratamiento con antagonistas del TNF
| 1. Lesiones cutáneas relacionadas con la administración del tratamiento |
| - Eritema, urticaria, eczema, rash |
| 2. Infecciones cutáneas |
| - Infecciones bacterianas: celulitis |
| - Infecciones víricas: herpes zoster |
| 3. Neoplasias cutáneas |
| - tumores no-melanoma: carcinoma basocelular y espinocelular |
| - tumores melanocíticos: nevus melanocítico benigno |
| - melanoma maligno |
| - linfomas cutáneos: de células T, micosis fungoide, síndrome de Sezary |
| 4. Enfermedades inmunomediadas: |
| - psoriasis «de novo» y exacerbación de psoriasis previa |
| - lupus cutáneo |
| - alopecia areata |
| - vasculitis cutánea |
| - vitíligo |
| - policondritis recidivante |
| - polimiositis/dermatomiositis |
| - esclerodermia localizada (morfea) |
| - granuloma anular |
| - liquen o reacción liquenoide |
| - pénfigo |
Las únicas lesiones cutáneas secundarias al tratamiento con fármacos anti-TNF comunicadas en los ensayos clínicos realizados para la aprobación del fármaco han sido aquellas relacionadas directamente con la administración del fármaco, bien por vía endovenosa como es el caso de infliximab, o por vía subcutánea, como en el resto de fármacos anti-TNF. La mayoría de estas reacciones son de intensidad leve o moderada sin requerir, en la mayor parte de los casos, la retirada del fármaco. El tipo de reacción cutánea asociada puede ser muy diverso, siendo las más frecuentes: eritema, urticaria, eczema o rash, que pueden, a su vez, acompañarse de dolor o tumefacción. En muchos casos podría tratarse de reacciones de hipersensibilidad al fármaco que cursan con lesiones cutáneas como su principal característica, lo que podría suponer un cierto sesgo en su clasificación. En general, estas lesiones ocurren principalmente en el primer mes de tratamiento y descienden, posteriormente, en frecuencia. Se han descrito con todos los fármacos anti-TNF, aunque con diferentes porcentajes. Así, se ha descrito la aparición de rash en un 6,9% de los pacientes que reciben infliximab1; y reacción en la zona de inyección entre el 3811 y el 42%2 de los pacientes en los estudios de etanercept, y en un 15% en los de adalimumab12. Con los nuevos anti-TNF, la incidencia de reacciones cutáneas en el lugar de la inyección son menores, siendo de 2,3% con certolizumab pegol13 y 2,4% con golimumab14. En general, este tipo de reacción se asocia de forma más frecuente con fármacos de administración subcutánea y se ha descrito con más frecuencia con etanercept.
Infecciones cutáneasOtra lesión cutánea frecuentemente observada con la administración de fármacos anti-TNF es aquella que traduce la existencia de una infección subyacente. Así, en un estudio prospectivo en pacientes con AR en el que se analizaba la incidencia y tipo de efecto cutáneo adverso relacionado con anti-TNF, el más frecuente fueron las infecciones cutáneas10. Aunque en ocasiones pueden cursar con manifestaciones sistémicas como fiebre, en muchos casos el único síntoma aparente puede ser la afección de la piel. Las lesiones cutáneas más frecuentemente asociadas son la celulitis, que en ocasiones puede afectar también a partes blandas, y suele ser de etiología bacteriana; y la infección por el virus del herpes zóster, caracterizada por la aparición de vesículas muy dolorosas siguiendo el recorrido de un nervio debido a la reactivación de la infección previa por el virus varicella-zóster. Las infecciones cutáneas son, además, una de las infecciones más frecuentes observadas en pacientes que reciben terapia anti-TNF, como demostró un estudio retrospectivo realizado en 709 pacientes con enfermedades articulares inflamatorias crónicas en tratamiento con anti-TNF en el que las infecciones cutáneas representaban el 21% de todas las infecciones, las segundas más frecuentes tras las del tracto respiratorio15. Asimismo, en otro estudio se halló un incremento del riego de infección cutánea y de partes blandas 4 veces mayor en pacientes con AR tratados con anti-TNF, respecto a pacientes que recibían FAMES16. Este hecho no es sorprendente ya que el TNF-α es una citocina proinflamatoria que juega un papel importante en la inmunidad innata y en la protección contra bacterias, virus y enfermedades parasitarias, y su inhibición puede incrementar el riesgo de infección, como se ha descrito previamente17. Además, estudios en pacientes con AR tratados con biológicos muestran un aumento del riesgo de infecciones comparado con aquellos pacientes que no reciben terapia biológica18–20. Pero la elevada incidencia de infecciones cutáneas sugeriría, además, un importante papel fisiológico del TNF en la defensa del huésped ante patógenos a nivel de la piel y partes blandas de forma más relevante que en otras localizaciones16. Además de las infecciones cutáneas de origen bacteriano, estudios recientes han mostrado un también un incremento del riesgo de infecciones víricas en pacientes en tratamiento con terapia biológica, especialmente herpes zoster21. Asimismo, se ha postulado que este incremento del riesgo se relacionaría más con el tratamiento con anticuerpos monoclonales como infliximab y adalimumab que con etanercept22. De todos modos hay que tener en cuenta que los pacientes afectados de AR presentan, de base, un incremento del riesgo para el desarrollo de infección por herpes zoster en relación con la población general23. En relación con el tipo de fármaco anti-TNF relacionado con el desarrollo de infecciones, infliximab ha mostrado, en algún estudio, tasas mayores de infección cutánea que otros fármacos15, aunque otros estudios muestran una ligera mayor incidencia relacionada con adalimumab22. Sin embargo, al analizar el riesgo global de infecciones, algunos autores no hallan diferencias entre los 3 anti-TNF etanercept, infliximab y adalimumab16,24.
Neoplasias cutáneasOtra de las lesiones cutáneas observadas en pacientes que reciben tratamiento con anti-TNF son los tumores cutáneos. Los más frecuentes son las neoplasias cutáneas no-melanoma, principalmente el carcinoma basocelular y, en menor frecuencia, el espinocelular. Cuando se analiza el riesgo global de neoplasia asociado a la terapia anti-TNF, algunos estudios muestran un incremento de su incidencia25, especialmente linfomas26, aunque otros no muestran un incremento del riesgo27,28. Teóricamente, la inhibición del TNF-α podría disminuir la vigilancia natural del organismo en el desarrollo de tumores, y su prolongada inhibición, como ocurre con el tratamiento continuado con anti-TNF, podría asociarse con un empeoramiento del control del huésped de las lesiones premalignas y un incremento del desarrollo de neoplasias29. Sin embargo, hay que tener en cuenta que la mayoría de estudios analizan el riesgo de neoplasia en pacientes con AR, que presentan, de base, un mayor riesgo de desarrollo de neoplasias, principalmente linfomas26. En el caso de los tumores cutáneos, la relación entre la administración de anti-TNF y el riesgo de carcinogénesis de piel es todavía un tema no aclarado. Así, diferentes estudios han mostrado la neoplasia de piel no melanoma como la neoplasia más frecuentemente hallada en estos pacientes28,30. Asimismo, en otro análisis realizado sobre la incidencia de cáncer en pacientes con AR tratados con biológicos hallan una asociación positiva entre terapia biológica y cáncer de piel31. Del mismo modo, en una cohorte de pacientes con AR seguida a largo plazo se describe un incremento del riesgo de cáncer de piel no melanoma en aquellos pacientes que reciben anti-TNF32. Además, se ha demostrado un incremento del riesgo de neoplasia cutánea no melanoma de hasta el 70% en pacientes con AR tratados con anti-TNF en relación con pacientes que no reciben terapia biológica, así como un aumento del riesgo relativo en relación con el tiempo de seguimiento27. Contrariamente, en un estudio abierto de 549 pacientes con AR que recibieron tratamiento con etanercept, con un seguimiento de 5 años, no se pudo demostrar un incremento del riesgo de neoplasia cutánea no melanoma33. Tampoco se halló un incremento del riesgo de neoplasia cutánea no melanoma en un metaanálisis que analizaba el riesgo de la terapia anti-TNF en pacientes con AR24. Asimismo, en un análisis del registro británico de fármacos biológicos no se halló un incremento del riesgo de neoplasias asociado a anti-TNF34, aunque sí hallaron un incremento del riesgo de incidencia de carcinoma basocelular de hasta el 10% en pacientes que previamente habían tenido un carcinoma basocelular34. El antecedente de neoplasia previa ya ha sido previamente descrito como un mayor riesgo de desarrollo de neoplasias28,30. Un reciente metaanálisis de certolizumab y golimumab no halló un incremento del riesgo de neoplasia cutánea con estos fármacos, aunque los resultados eran a corto plazo, lo que constituye una limitación importante para interpretar correctamente los resultados de este estudio35.
Además del desarrollo de las neoplasias cutáneas más frecuentes, el carcinoma basocelular y el espinocelular, se han descrito también casos de melanoma maligno tras tratamiento anti-TNF36–38, así como casos de erupción de nevus melanocítico benigno39,40, indicando una posible relación entre la administración de anti-TNF y la proliferación melanocítica tanto benigna como maligna. Sin embargo, el papel exacto de estos fármacos en la tumorogénesis no está todavía dilucidado, ya que algunos autores han hallado un incremento del riesgo de melanoma de hasta 3 veces más en pacientes con AR tratados con metotrexato41. De todos modos, se recomienda a los pacientes que reciben terapia biológica que identifiquen la aparición de nuevas lesiones pigmentadas o cambios en nevus preexistentes para aclarar su etiología y, en caso de duda, valorar su exéresis para el análisis histológico.
Otro de los tumores cutáneos que se han asociado al tratamiento con anti-TNF, aunque extremadamente infrecuente, son los linfomas cutáneos. Se han descrito muy pocos casos en la literatura, generalmente de células T, a diferencia de la mayoría de linfomas asociados a la terapia biológica que son de tipo B42. Se presentan como lesiones cutáneas generalizadas en forma de placas o nódulos rojo-azulados43,44. Entre los diferentes linfomas se han descrito también casos de micosis fungoide45 y de síndrome de Sézary46. En general, tienen mejor pronóstico que otros linfomas, habiéndose incluso descrito casos de regresión tras la retirada del anti-TNF43,44.
Enfermedades inmunomediadasUn tema emergente relacionado con la administración de terapia anti-TNF es el desarrollo de enfermedades inmunomediadas, cuya principal manifestación es a nivel cutáneo. La primera descrita en la literatura fue la aparición de psoriasis «de novo» en pacientes con diversas enfermedades articulares inflamatorias, sin psoriasis previa, que desarrollaban estas lesiones cutáneas tras el inicio de terapia anti-TNF7. Esta reacción se consideró como paradójica, dada la eficacia demostrada e indicación de los fármacos anti-TNF para el tratamiento de APs47 y psoriasis48. Posteriormente, se han publicado otros casos no solo de psoriasis «de novo»49 sino de exacerbación de psoriasis previa tras el tratamiento anti-TNF, en lugar de mejoría50,51. Esta ha sido, hasta el momento, la enfermedad inmunomediada más frecuentemente descrita tras el tratamiento anti-TNF, y que ha focalizado la atención hacia este tipo de efectos cutáneos.
Seguidamente, se describen las principales enfermedades cutáneas inmunomediadas relacionadas con el tratamiento anti-TNF.
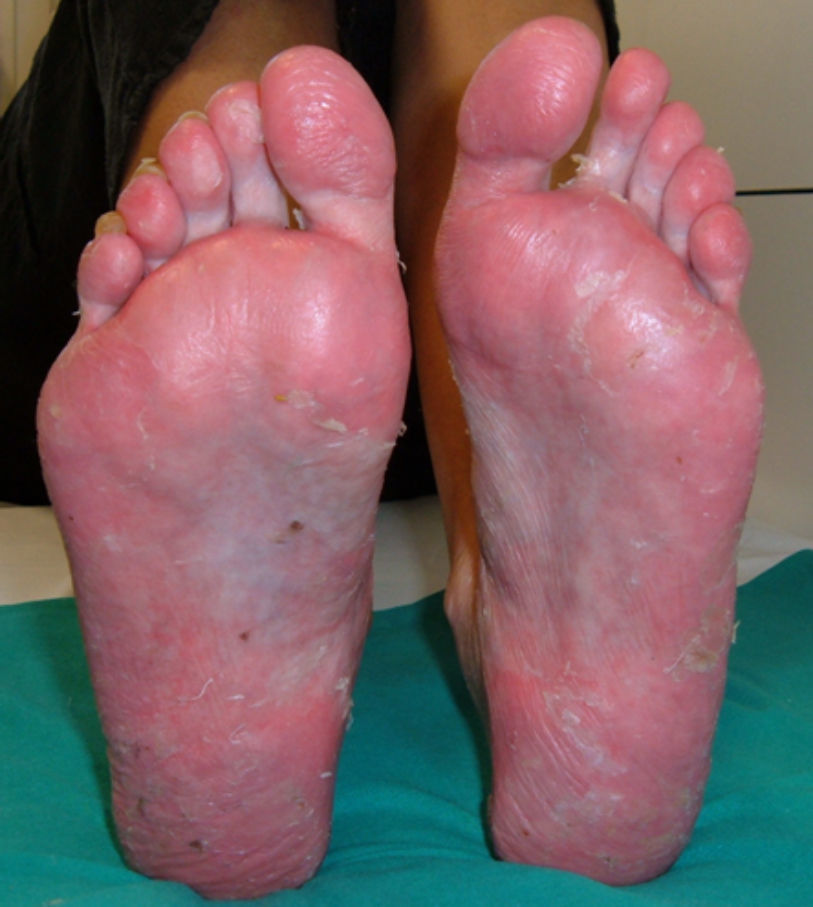
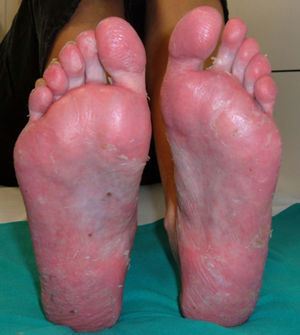
PsoriasisAunque el desarrollo de psoriasis se ha descrito tras la administración de diversos fármacos como antimaláricos o betabloqueantes52 en el caso de los anti-TNF lo que resulta paradójico es que las lesiones cutáneas de psoriasis se desarrollan con un fármaco indicado para su tratamiento. En la actualidad se han comunicado más de 200 casos de psoriasis inducida por el tratamiento anti-TNF53 aunque probablemente existen muchos más casos no comunicados. De hecho, aunque su prevalencia varía según los distintos estudios, se calcula entre el 0,6 a 5,3% dependiendo de la población de pacientes estudiada7,9,10,49, aunque, en general, se considera aumentada respecto a la población control49. La mayoría de casos se han descrito en pacientes con AR10,49,53,54, aunque se han descrito casos en casi todas las enfermedades inflamatorias, como EA, enfermedad inflamatoria intestinal, APs, artritis idiopática juvenil, psoriasis, enfermedad de Behçet o síndrome SAPHO, entre otras7,50,54–56. El desarrollo de estas lesiones cutáneas puede ocurrir en cualquier momento del tratamiento, desde días hasta años tras su inicio, aunque el tiempo medio de latencia es alrededor de 10 meses tras el inicio de la terapia biológica7,10,51,55,57. No se han hallado diferencias en edad o género de los pacientes, ni factores de riesgo predisponentes al desarrollo de este efecto adverso. Por otra parte, el tratamiento concomitante con otros fármacos inmunosupresores para psoriasis no ha demostrado ser efectivo como prevención para el desarrollo de este efecto adverso53. En general, la mayoría de pacientes que desarrollan este efecto adverso habían presentado una buena respuesta a la terapia biológica, sin que la aparición de la lesión cutánea afecte negativamente a la eficacia del fármaco. Desde el punto de vista cutáneo, se han descrito 3 principales morfologías de estas lesiones, cada una con diferente frecuencia: psoriasis pustular (56%), placas de psoriasis (50%) y psoriasis guttata (12%)53, aunque también pueden existir otras presentaciones cutáneas como psoriasis eritrodérmica o psoriasis invertida, entre otras, generalmente con una menor frecuencia58. Sin embargo, una de las lesiones más característica y frecuente asociada al tratamiento con anti-TNF es el desarrollo de pustulosis palmo-plantar (fig. 1). Se caracteriza por el desarrollo de pequeñas ampollas, de contenido estéril, localizadas en palmas y plantas, con sensación de quemazón y picor, que se asocia a eritema, e hiperqueratosis. Asimismo, se calcula que un 15% de los pacientes presentan más de un tipo de lesión, sin haberse hallado correlación estadística entre el tipo de lesión cutánea y la enfermedad de base53. También se ha descrito afección ungueal con cambios típicos de psoriasis como onicolisis, alteración de la coloración y pitting ungueal53.
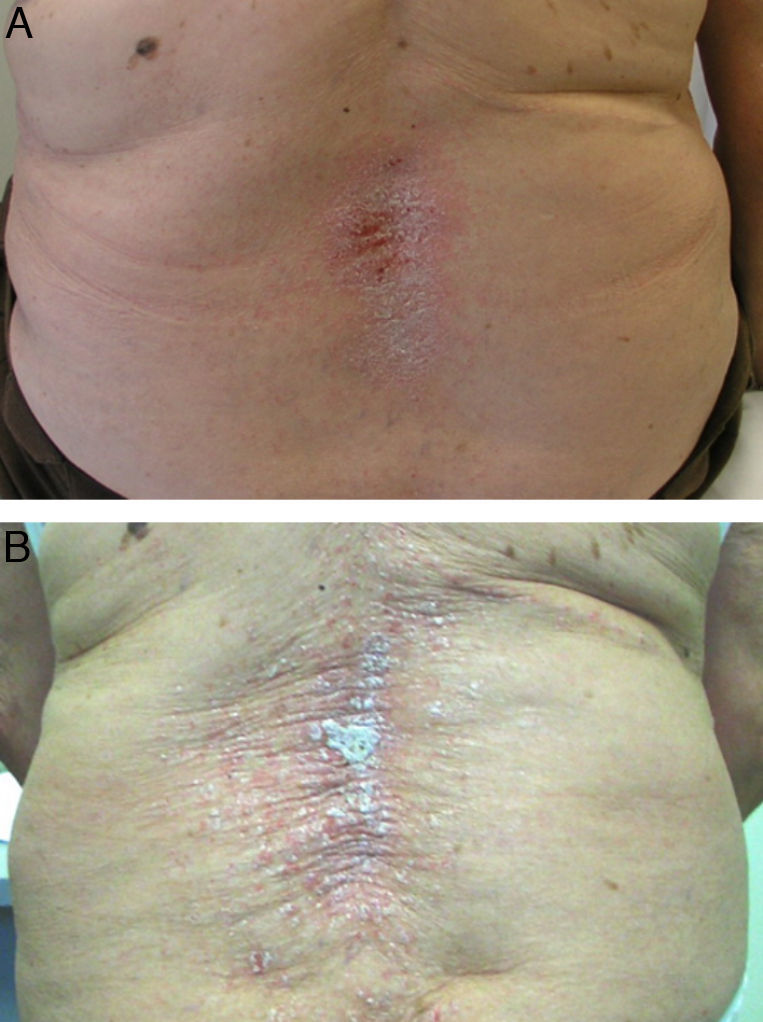
Además de los 3 anti-TNF «clásicos», se han descritos casos de psoriasis inducida con certolizumab59,60, por lo que este efecto adverso se considera un efecto «de clase» de estos fármacos. Sin embargo, algunos autores hallan una mayor incidencia de este efecto en relación con la administración de anticuerpos monoclonales como infliximab50 o adalimumab49. Asimismo, otros autores sugieren que los anticuerpos monoclonales estarían más relacionados con el desarrollo de psoriasis «de novo», mientras que el etanercept se asociaría principalmente con exacerbación de psoriasis previa61 (fig. 2). Este efecto podría deberse a que en individuos con psoriasis previa no se requerirían grandes oscilaciones de TNF para desencadenar un brote de psoriasis, sin embargo sería necesaria una reducción severa de TNF para inducir psoriasis ‘de novo’ en individuos predispuestos, efecto que sería más frecuente con los anticuerpos monoclonales, inhibidores más potentes del TNF.
Inicialmente, algunos autores consideraron que estas lesiones cutáneas podrían corresponder más a una reacción de hipersensibilidad que a una verdadera psoriasis, pero las biopsias cutáneas de casos seleccionados hallaron lesiones histológicas idénticas a las de los individuos con psoriasis idiopática10,55, incluyendo hiperplasia epidérmica, paraqueratosis, infiltrados linfocíticos epidérmicos, dilatación de capilares y pustulosis intradémica53, en contraste con la histología de los pacientes con psoriasis inducida por otros tratamientos62, sugiriendo que el mecanismo de acción de los 2 procesos es similar o idéntico. Asimismo, otros autores consideraron que podría tratarse de un error diagnóstico y que se tratara en realidad de pacientes con APs dado que la artritis puede preceder a la psoriasis en un 15% de pacientes. Sin embargo, la mayoría de casos se han descrito en pacientes con diagnóstico definido de AR49,54. Por otra parte, la coexistencia de estas 2 enfermedades, AR y psoriasis, es extremadamente infrecuente, habiéndose descrito en el 0,2% de los pacientes, mientras que la incidencia de psoriasis inducida por anti-TNF es del 3% en pacientes con espondiloartropatías y entre el 2,3-5% en pacientes con AR7,10,55, incidencia muy superior a la esperada.
Aunque su fisiopatología no se conoce exactamente, se han postulado diversas hipótesis para el desarrollo de psoriasis paradójica. Una de las más ampliamente aceptadas proviene de la relación entre TNFα e interferón tipo 1 α, factor este último que juega un papel importante en la patogénesis de psoriasis a través de su síntesis por las células dendríticas plasmocitoides dérmicas. En condiciones normales, el TNFα produciría una inhibición de la síntesis de interferón por parte de estas células. Tras el tratamiento con fármacos anti-TNF se podría producir un desequilibrio del balance de citocinas, induciendo localmente una producción de interferón que, en ciertos pacientes, podría desencadenar un brote de psoriasis55. Apoyando esta hipótesis se ha demostrado un incremento de la expresión de interferón en las lesiones cutáneas de estos pacientes en comparación con pacientes afectados de psoriasis idiopática55. Otros autores han observado en estos pacientes un incremento del número de células T periféricas que expresan el receptor CXCR363, receptor que promueve la infiltración de células T autorreactivas en la piel7,64. Parece ser que la inducción de este receptor sería mediada por el interferon-α55. Este incremento de la población de células T periféricas se ha observado en pacientes con AR tras tratamiento con anti-TNF, y se cree que es secundaria a una disminución del tráfico de estas células a áreas previamente inflamadas, como las articulaciones. Sin embargo, este incremento de células T periféricas se ha de confirmar en más estudios y en otras enfermedades diferentes a la AR63.
En el caso de las lesiones pustulosas, lesión frecuente en este tipo de efecto adverso y que afecta característicamente a palmas y plantas, estas difieren de las placas de psoriasis no solo clínicamente sino también inmunohistoquímicamente55. Así como es bien conocido que el TNF contribuye al desarrollo de placas de psoriasis, en el caso de pustulosis palmoplantar se ha hallado una disminución de su expresión a nivel de la glándula sudorípara ecrina palmar57. Asimismo, recientemente se han descrito tanto casos de pustulosis palmoplantar como de empeoramiento de lesiones basales de psoriasis inducidos por otros fármacos biológicos no anti-TNF65,66, lo que sugeriría que en la patogénesis de la psoriasis el verdadero mecanismo de acción podría afectar a múltiples citocinas, como IL-17, o IL-22 y no deberse solamente a un bloqueo del TNF.
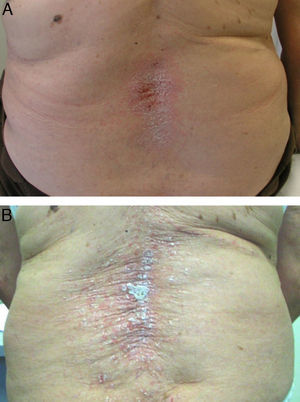
En cuanto al tratamiento de estas lesiones cutáneas, casi todos los autores coinciden en que la retirada del fármaco biológico va seguida de una mejoría o resolución de las mismas49,54 (fig. 2A), e incluso algunos autores sugieren que sería conveniente la retirada del fármaco anti-TNF51. Se calcula que, aproximadamente, tras la retirada del fármaco las lesiones persisten solo en un 5% de los casos53. Las tasas de discontinuación del biológico varían según los diferentes estudios, entre 14,810 y 19,5%67, hasta 3249 y 39%50 de los pacientes. Sin embargo, a diferencia de otras causas farmacológicas que producen psoriasis, en el caso de los anti-TNF su retirada puede producir una exacerbación de la enfermedad, que puede ser más grave que la propia reacción cutánea. Por otro lado, debido a la reagudización de la enfermedad de base tras la retirada del anti-TNF, muchos pacientes requieren reinicio del tratamiento biológico, observándose, en muchos casos, una reaparición de las lesiones cutáneas (fig. 2B) que, en ocasiones, pueden responder con éxito a tratamiento mientras continúan el biológico7,9,54,55,57,64,68. Este hecho sugeriría que, en muchos casos, un tratamiento apropiado de las lesiones cutáneas permitiría mantener la terapia biológica para el control de la enfermedad. Así, en un estudio publicado recientemente entre un 66 53 y un 79% de los pacientes 56 continúan el tratamiento anti-TNF, con tratamientos concomitantes para psoriasis, pudiendo muchos de los pacientes ser tratados de forma conservadora sin retirar el biológico. Asimismo, se observó en el 26% de los pacientes que mantenían el tratamiento anti-TNF una resolución completa, y en un tercio una resolución parcial de las lesiones.
Dado que este efecto adverso cutáneo puede diferir en su gravedad, algunos autores han sugerido un algoritmo de tratamiento basado en su serie de pacientes y en la revisión de los casos publicados en la literatura56. En primer lugar, aconsejan remitir al dermatólogo aquellos pacientes con sospecha de psoriasis inducida por anti-TNF para su evaluación y confirmación diagnóstica, así como confirmación histológica en aquellos casos que requieran excluir otras lesiones cutáneas. Asimismo aconsejan descartar una posible infección bacteriana o vírica. Una vez confirmado el diagnóstico de psoriasis, debe valorarse la extensión y tolerabilidad de las lesiones. Así, en aquellos pacientes con psoriasis severa, forma eritrodérmica, con lesiones que afecten la calidad de vida del paciente, o con lesiones que presenten un incremento del tamaño y severidad de las mismas tras cada infusión o inyección del tratamiento, recomiendan discontinuar la terapia biológica y realizar un tratamiento intensivo de las lesiones cutáneas por parte del dermatólogo. En aquellos pacientes en que las lesiones cutáneas afecten<5% del área corporal aconsejan tratamientos tópicos que incluyen corticosteroides, entre otros, y en caso de no mejoría en 2-3 semanas, considerar tratamiento con fototerapia ultravioleta o añadir metotrexato. En pacientes con lesiones afectando>5% de la superficie corporal o que presenten pustulosis palmo plantar aconsejan tratamiento tópico y fototerapia, y en aquellos que no respondan considerar tratamiento sistémico con metotrexato, retinoides o ciclosporina. En caso de no respuesta a estos tratamientos aconsejan considerar la discontinuación de la terapia biológica y cambio a un biológico no anti TNF, si es factible. En resumen, en la mayoría de casos este efecto adverso no requeriría la discontinuación del biológico, pero se recomendaría un tratamiento intensivo de las lesiones cutáneas y solo se consideraría un cambio en el anti-TNF si las lesiones no respondieran al tratamiento habitual de la psoriasis.
Lupus eritematoso cutáneoEl tratamiento con anti-TNF se ha asociado al desarrollo de diferentes autoanticuerpos como anticuerpos antinucleares, anti-DNA, anticardiolipina o antihistona, con frecuencias variables según los estudios69,70. Sin embargo, la aparición de estos autoanticuerpos suele cursar de forma asintomática y el desarrollo clínico de lupus eritematoso sistémico es extremadamente infrecuente71. Sin embargo, se han descrito algunos casos de lupus inducido en la literatura67,72–76 en los que es frecuente la afección cutánea, y excepcional la afección renal o neurológica. En general, las lesiones cutáneas suelen cursar en forma de rash máculo-papular, eritematoso y pruriginoso, generalmente afectando a zonas fotosensibles como cara, extremidades superiores y zona superior de tronco. Puede observarse en diferentes patologías y, aunque se ha descrito más frecuentemente con infliximab y etanercept73,77,78, también hay casos descritos con adalimumab79. Suele afectar predominantemente a mujeres, en la quinta década de la vida, y el inicio de los síntomas puede variar ampliamente, desde un mes hasta años tras el inicio del anti-TNF. En estos casos, los anticuerpos antinucleares y anti-DNA son frecuentemente positivos, pero otros anticuerpos como los antihistona suelen ser negativos. Se han sugerido diversos mecanismos patogénicos de este síndrome como consecuencia de los efectos de los anti-TNF sobre la inducción de apoptosis, de inmunosupresión o de autoinmunidad humoral72,78. Otros autores proponen un papel importante del interferón tipo 1 α en la patogénesis del lupus, habiéndose postulado que la disregulación del interferon 1 α podría provocar el desarrollo de anticuerpos antinucleares y síndrome lupus-like en pacientes con terapia anti-TNF80. En la mayoría de estos casos la discontinuación del fármaco va seguida de una resolución del cuadro, aunque, en ocasiones, los pacientes pueden requerir tratamiento con glucocorticoides, antimaláricos o inmunosupresores, según la gravedad. En caso de plantear reinicio de terapia biológica debido a una reactivación de la enfermedad, este efecto adverso cutáneo no constituiría una contraindicación absoluta para continuar el tratamiento con otro anti-TNF alternativo72.
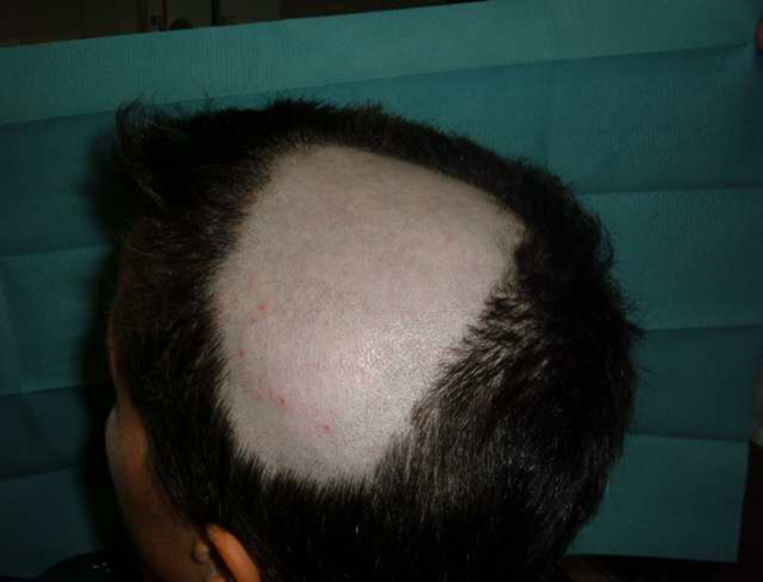
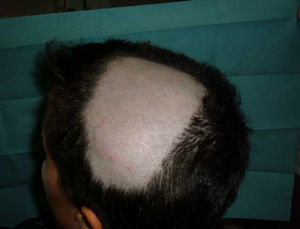
Alopecia areataTambién se han descrito casos de alopecia areata asociados al tratamiento con anti-TNF9,67,76,81–89. La alopecia areata se considera una enfermedad autoinmune, mediada por linfocitos T, que se caracteriza por la pérdida de cabello en áreas, generalmente circulares, afectando principalmente al cuero cabelludo81,82,84,89 (fig. 3), pero que, en ocasiones, puede extenderse y afectar a toda la calota (alopecia totalis)83,87 e incluso a todo el cuerpo (alopecia universalis)85,86. El tiempo de aparición de la alopecia areata puede variar, desde 1-2 días84, hasta 24 meses86 tras el inicio de la terapia biológica, y se ha hallado antecedentes de alopecia areata en casi la mitad de los pacientes. Aproximadamente, en la mitad de los casos descritos se decidió retirar el tratamiento anti-TNF81,84–86,89, a pesar de lo cual, en la mitad de ellos se describe una progresión de la alopecia81,85,86. En la mayoría de los casos los pacientes fueron tratados con corticoides tópicos. En los casos publicados, la alopecia areata no se acompaña de otra manifestación sistémica sino que la afección es exclusivamente cutánea. En los casos en los que se ha estudiado, no se han hallado otras anormalidades en los análisis, incluyendo cambios autoinmunes, descartándose el desarrollo de un síndrome lupus-like84. El hecho de que no se hayan descrito casos de alopecia areata «de novo» en individuos tratados con etanercept y que la mayoría de casos reportados hayan sido con anticuerpos monoclonales sugeriría una mayor asociación de estos fármacos con este efecto adverso. Su mecanismo patogénico no es bien conocido, y, de hecho, se considera el TNF-α una citocina asociada con el desarrollo de alopecia al haber demostrado in vitro una inhibición del crecimiento del cabello. Sin embargo, el tratamiento con fármacos anti-TNF no ha demostrado ser eficaz en el tratamiento de la alopecia, como se demostró en un ensayo clínico con etanercept90. Algunos autores sugieren que el bloqueo producido por los fármacos anti-TNF podría producir una disregulación de citocinas, como el α-interferon y la activación de células T autorreactivas produciendo el desarrollo de alopecia areata en individuos predispuestos85.
Vasculitis cutáneaSe ha descrito también el desarrollo de vasculitis cutánea asociada al tratamiento con anti-TNF, principalmente leucocitoclástica y, menos frecuentemente, necrotizante75,76,91–93, La lesión cutánea característica es la púrpura palpable, aunque también se han descrito otras lesiones como úlceras, nódulos o rash. En ocasiones, las lesiones cutáneas se inician en el lugar de la inyección del fármaco extendiéndose y afectando otras áreas cutáneas apoyando un posible mecanismo de vasculitis por hipersensibilidad mediada por antígeno. En la mayoría de casos se observa una mejoría de las lesiones tras la discontinuación del fármaco anti-TNF.
VitíligoOtra lesión cutánea inmunomediada descrita tras tratamiento anti-TNF es el desarrollo de vitíligo. Esta lesión, de naturaleza autoinmune, se caracteriza por la aparición de lesiones cutáneas hipopigmentadas debidas a una pérdida parcial o total del pigmento de los melanocitos. Sin embargo, y a diferencia de las lesiones de psoriasis, esta lesión cutánea es muy poco frecuente, habiéndose descrito pocos casos en la literatura, la mayoría con infliximab67,76,94,95, Asimismo, el desarrollo de vitíligo se ha asociado con otras enfermedades autoinmunes como la anemia perniciosa, la enfermedad de Addison o la tiroiditis autoinmune, por lo que en estos pacientes es importante descartar el desarrollo de alguna de estas otras enfermedades autoinmunes.
Policondritis recidivanteLa policondritis recidivante es una enfermedad inmunomediada, poco frecuente y de etiología desconocida que se caracteriza por la inflamación y progresiva destrucción de cartílagos, afectando especialmente el pabellón auricular, nariz, articulaciones y el árbol tráqueobronquial. Hasta el momento se han descrito solo 2 casos de policondritis recidivente asociada a terapia anti-TNF96, ambos con recuperación completa del cuadro inflamatorio y sin destrucción del cartílago afectado tras la retirada del anti-TNF.
Polimiositis/DermatomiositisSe han descrito casos aislados de polimiositis/dermatomiositis (PM/DM) asociados al tratamiento con fármacos anti-TNF97,98, la mayoría en pacientes con AR, con recuperación completa tras la retirada del agente biológico y tratamiento con glucocorticoides. Muchos de estos pacientes presentaban anticuerpos anti-Jo-1 antes del inicio de la terapia biológica, sugiriendo una correlación entre el inicio de PM/DM con AC anti-Jo-1 y el tratamiento anti-TNF para su enfermedad de base98. Al igual que en el desarrollo de lupus, psoriasis, o alopecia areata, algunos autores han asociado el desarrollo de dermatomiositis con disregulación de interferon 1α99.
Esclerodermia localizada (Morfea)Otra enfermedad inmunomediada descrita asociada a anti-TNF es la morfea o esclerodermia localizada, que se caracteriza por fibrosis de la piel y del tejido subcutáneo. Aunque puede desencadenarse o exacerbarse por fármacos como la isoniazida, antimaláricos, bleomicina o penicilamina, se ha descrito algún caso desencadenado tras terapia biológica100–102, generalmente con buena evolución tras la discontinuación del fármaco y sin progresión de la enfermedad. Se han postulado diversas hipótesis sobre su patogénesis incluyendo el efecto del bloqueo del TNF sobre el factor de crecimiento tumoral beta 1 (TGF-β1), citocina profibrótica103; o el aumento de células T activadas, con predominio de citocinas Th2, que correlacionan con la lesión y extensión de la fibrosis en la morfea, sobre las citocinas Th1, induciendo, como consecuencia, el desarrollo de morfea104.
Otras enfermedades cutáneas inmunomediadasAdemás de las descritas anteriormente, se han descrito otras enfermedades inmunomediadas con afección cutánea asociadas al tratamiento con anti-TNF como el granuloma anular76,105, el desarrollo de liquen o reacción liquenoide10,67,76,91,106,107, y el pénfigo108–110, sugiriendo que la piel sería una de las principales dianas de estos fármacos.
En conjunto, los patrones para el desarrollo de diferentes enfermedades autoinmunes se superponen en muchas ocasiones y el aumento de probabilidad de desarrollar una segunda enfermedad autoinmune tras el diagnóstico de la primera ha sido ampliamente aceptado. En este caso, los anti-TNF y, posiblemente todos los fármacos biológicos, tienen el potencial de desorganizar el delicado balance de citocinas o quimiocinas y favorecer en un individuo, con predisposición genética, el desarrollo de una de estas enfermedades autoinmunes de predominio cutáneo. Aunque se trata de cuadros en ocasiones poco frecuentes, revelan las diferentes enfermedades inmunomediadas inducidas por los anti-TNF con, en general, buena evolución tras la retirada del fármaco, a diferencia de la evolución habitual que suele seguir la enfermedad autoinmune primaria.
En conclusión, el desarrollo de lesiones cutáneas puede ser un efecto adverso cada vez más frecuente debido a la amplia utilización de los fármacos anti-TNF en diferentes enfermedades. El tipo de efecto adverso oscila entre las clásicas lesiones cutáneas descritas tras la administración del tratamiento, hasta otro tipo de lesiones cutáneas de mayor relevancia incluyendo no solo infecciones y neoplasias, sino también un efecto adverso emergente como son las enfermedades autoinmunes con afección predominantemente cutánea. Las ventajas terapéuticas del tratamiento anti-TNF sobrepasan, en la mayoría de casos, el riesgo de desarrollar este efecto adverso, pero algunos casos requieren la retirada del fármaco. Tanto médicos como pacientes deben conocer este posible efecto adverso para realizar un diagnóstico correcto y precoz y un apropiado tratamiento para su resolución que requiere, en muchos casos la participación del dermatólogo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.