En las espondiloartropatías, la marca distintiva del daño esquelético es la neoformación ósea en forma de entesopatía calcificante, axial o periférica, y de anquilosis ósea. Las terapias biológicas que neutralizan el factor de necrosis tumoral se han mostrado eficaces para controlar la actividad inflamatoria de estas enfermedades. Sin embargo, datos procedentes de modelos animales, estudios clínicos de imagen y datos ecográficos parecen indicar que la inflamación y la formación ósea podrían ser procesos independientes y que el control de la inflamación puede no ser suficiente para impedir el desarrollo de anquilosis en estos pacientes. En la diferenciación y la activación del osteoblasto para inducir la formación ósea, la vía Wnt (wingless) y las proteínas morfogenéticas óseas adquieren un especial protagonismo y pueden ser determinantes en el comienzo y la progresión de la osificación entesítica, y convertirse en posibles dianas terapéuticas. Por otro lado, otros hallazgos clínicos, estudios de imagen y de marcadores óseos respaldarían la hipótesis de que la osificación se relaciona con la inflamación como un proceso inicialmente reparador. Se revisan estos hechos y se exponen las últimas teorías que intentan establecer el nexo entre inflamación y formación ósea.
In spondyloarthropathies, the distinctive evidence of skeletal damage is de novo bone formation in the form of an ossifying enthesopathy, be it axial or peripheral, and bony ankylosis. Biologic therapy that neutralize the tumor necrosis factor have shown to be effective controlling the inflammatory activity of these diseases. However, data from animal models, clinical imaging studies and ecographic data seem to indicate that inflammation and bone formation could be independent processes and that control of inflammation might not be enough to impede the development of ankylosis in these patients. In the osteoblasts’ differentiation and activation that leads to bone formation, the Wnt (wingless) pathway and the bone morphogenic proteins acquire a special role and might be determinant in the onset and progression of enthesopathic ossification, as well as become therapeutic targets. On the other hand, clinical and imaging findings as well as the determination of bone markers support the hypothesis that that ossification is initially related to inflammation as a repair process. These facts are reviewed and the latest theories are exposed, in an attempt to establish a link between inflammation and bone formation.
Las manifestaciones clínicas en las espondiloartritis derivan de lesiones inflamatorias (entesitis, osteítis y sinovitis) y de cambios estructurales óseos.
El daño esquelético puede manifestarse como erosión, pero es la neoformación ósea en forma de entesopatía calcificante, axial o periférica y de anquilosis ósea la marca distintiva en la espondilitis anquilosante (EA).
La alteración del remodelado óseo en las artropatías inflamatorias parece mostrarse con dos fenotipos distintos1: en forma de progresiva resorción del cartílago y del hueso (patrón catabólico o erosivo) o en forma de neoformación cartilaginosa u ósea (patrón anabólico u osteoformador), dependiendo de qué moléculas se activen en el tejido articular.
En la artritis reumatoide (AR) la lesión característica es la erosión (fenotipo erosivo), mientras que el daño estructural en la EA principalmente está determinado por nueva formación ósea (fenotipo formador).
Mecanismos moleculares del remodelado óseo y su relación con la inflamaciónEl sistema OPG-RANKL-RANKEl descubrimiento y la definición del sistema constituido por la osteoprotegerina (OPG) y el ligando del receptor activador del factor nuclear κB (RANKL) ha permitido conocer el complejo mecanismo molecular que regula la interacción entre el osteoblasto y el osteoclasto, las dos células principales del remodelado óseo. El RANKL lo producen los osteoblastos e induce la diferenciación y la activación del osteoclasto, y se ha identificado como el principal mediador en la formación, la función y la supervivencia de los osteoclastos.
La OPG es una glucoproteína—también producida por los osteoblastos—cuya función principal es estimular la apoptosis de los osteoclastos y bloquear su formación y activación. La OPG se une al ligando RANK, neutraliza sus efectos y así inhibe la resorción ósea2.
Las alteraciones de la proporción RANKL/OPG son esenciales en la patogenia de las enfermedades óseas que tienen como resultado un aumento de la resorción ósea3.
La citocina inflamatoria factor de necrosis tumoral (TNF) tiene un papel relevante en el proceso de diferenciación osteoclástica, y tiene sinergias y potencia la función de RANKL en las fases finales de activación del osteoclasto, con lo que aumenta la resorción ósea, y ello podría explicar la eficacia que las terapias anti-TNF muestran frenando el daño erosivo óseo en las artropatías inflamatorias4.
Cuando se analizan biopsias sinoviales de articulaciones periféricas de pacientes con espondiloartropatías, se observa abundante expresión de RANKL y de OPG por las células inflamatorias (sinoviocitos seudofibroblásticos y linfocitos T), especialmente intensa en los infiltrados perivasculares5. En las espondiloartropatías, al igual que lo que ocurre en la AR, el aumento de RANKL por el TNF sería muy importante en la fase erosiva ósea.
Diferenciación osteoblástica y vías moleculares de formación óseaSin embargo, en las espondiloartropatías la marca diferenciadora del remodelado óseo es la formación ósea patológica, que ocurre en las entesis y puede evolucionar a una entesitis anquilosante, ya sea vertebral o de las articulaciones periféricas. En contraste con el remodelado óseo erosivo, el fenotipo osteoformador está mediado por el osteoblasto.
En la diferenciación y activación del osteoblasto (célula descendente de la stem cell mesenquimal) para inducir la formación ósea, intervienen principalmente dos complejas vías de señalización molecular: la vía Wnt (wingless) y la vía de las BMP (bone morphogenetic protein), cada una de las cuales incluye un número de diferentes ligandos, receptores y antagonistas endógenos6.
Las proteínas Wnt regulan la embriogénesis, la tumorogénesis y la homeostasis ósea entre otras funciones. Su unión a determinados receptores de membrana plasmática en las células mesenquimales induce la diferenciación de estas células a las de la estirpe osteoblástica y, por lo tanto, colaboran en la formación ósea. La vía Wnt requiere la interacción de LRP5 (lipoprotein receptor related peptide) y de receptores frizzled. Las BMP son factores proteínicos pertenecientes a la superfamilia del factor de crecimiento transformador beta (TGFβ) y han sido identificadas como proteínas que pueden inducir una cascada de formación ósea endocondral. El mediador de la vía canónica Wnt, la betacatenina, puede obtener sinergia de BMP2 para aumentar la diferenciación osteoblástica y la formación ósea endocondral.
Por otro lado, existen también inhibidores de la formación ósea, de los que destacamos la esclerostina, una proteína codificada por el gen SOST, que se expresa en los osteocitos e interfiere con la señalización de las BMP y de la vía Wnt y el Dickkopf (Dkk-1) un inhibidor endógeno del receptor LRP5, necesario para la señalización Wnt6.
¿Cómo se conexiona la inflamación con las fases del remodelado óseo en la patología inflamatoria articular?Para entender esta relación es clave el estudio de Diarra et al7 en un modelo animal de artritis reumatoide. El autor muestra que el TNF, al mismo tiempo que aumenta el RANKL, aumenta también el Dkk-1 que, inhibiendo la vía Wnt inhibe la formación ósea e induce la apoptosis del osteoblasto. Así, es probable que las citocinas producidas en el tejido sinovial inflamatorio supriman en cierta medida una formación ósea adecuada. En su modelo animal, Diarra et al fueron capaces de revertir la erosión ósea mediante la inhibición de Dkk-1, lo que aumenta la concentración de osteoprotegerina, con el consiguiente aumento de la formación ósea. Los autores, en su estudio original, objetivaron que la concentración sérica de Dkk-1 era muy baja o estaba ausente en pacientes con espondiloartropatía, comparados con los valores que encontraron en pacientes con AR, lo que sentó la base para un fenotipo formador de hueso en esta enfermedad.
Las terapias anti-TNF, al inhibir aún más la producción de Dkk-1, facilitarían la estimulación de la vía Wnt y la formación de hueso, por lo que no resulta extraño que no tengan efecto en la osteoproliferación. Estos hechos sirven de base para formular la hipótesis que considera que la inflamación y la formación ósea son hechos independientes, y sería posible que la anquilosis se desarrolle pese a que el paciente esté en remisión.
Inflamación y formación ósea como hechos independientesVamos a analizar algunos hechos que indican que anquilosis e inflamación pueden discurrir por vías independientes; son datos procedentes de estudios animales, estudios clínicos de imagen y datos ecográficos.
Modelos animalesEsta hipótesis se inicia con el modelo murino de entesitis anquilosante del ratón DBA/18. Este modelo animal tiene una serie de peculiaridades, pues en la enfermedad intervienen factores como el sexo (sólo se desarrolla en machos) y el estrés (los ratones están hacinados). En el modelo se produce un corto periodo de inflamación, proliferación celular del periostio y de la entesis, la diferenciación condrogénica y, por último, la formación ósea. En este modelo, la inflamación y las erosiones tienen poca relevancia y la anquilosis en el ratón es el resultado de la activación de los procesos de señalización Wnt y BMP de la formación ósea.
Recientemente, Lories et al9 demostraron que en este modelo de ratón la inhibición de TNFα con etanercept no impidió la formación ósea ni la anquilosis y no afectó a la incidencia ni la gravedad de la entesitis anquilosante. En ese mismo modelo los autores consiguieron inhibir la anquilosis administrando Noggin, un inhibidor natural de BMP10, y al mismo tiempo mostraron que la inhibición de Dkk-1 estimulaba la anquilosis en articulaciones periféricas y en sacroilíacas11. Todos estos hechos daban protagonismo a la vía de señalización Wnt y de las BMP en la patogenia de la formación ósea endocondral que ocurre en el proceso de osificación entesítica. El balance entre TNF, BMP y Wnt podría ser importante en el comienzo y la progresión de la anquilosis12.
Estudios clínicos de imagenLa reciente introducción de la resonancia magnética (RM) como prueba de imagen para valorar el grado de inflamación en las espondiloartropatías ha sido útil para confirmar el efecto de los fármacos biológicos en la inflamación vertebral y entesítica en la EA13. Sin embargo, estos fármacos no parecen capaces de evitar la progresión de la anquilosis ósea, el aspecto patológico y radiológico más característico de la enfermedad.
Un estudio controlado14 que utiliza como control la cohorte histórica OASIS (Outcome of Ankylosing Spondylitis International Study), formada por pacientes con EA evolucionada no tratados con biológicos, no observa diferencias significativas en la tasa de progresión radiológica a los 2 años en el grupo de pacientes tratados con etanercept respecto del control histórico. No obstante, en ese estudio, tras realizar un subanálisis que incluyó sólo a los pacientes de la cohorte OASIS que hubieran cumplido los criterios de eligibilidad para el ensayo clínico con etanercept, aunque los resultados no cambiaron de manera significativa, había tendencia a mayor daño radiológico en el subgrupo histórico.
Datos ecográficosMcGonagle et al15 estudiaron la localización de las alteraciones óseas en entesis del tendón de Aquiles de pacientes con espondiloartropatías en distintos estadios de evolución, y relacionaron los hallazgos con las características microanatómicas de la zona donde ocurren. Las erosiones óseas se detectan preferentemente en la inserción proximal o en la tuberosidad superior del calcáneo, en zonas cubiertas con periostio fibrocartilaginoso, mientras que las francas proliferaciones óseas se detectaron sólo en la inserción distal del tendón aquíleo, en una zona que anatómicamente presenta mayor densidad trabecular (reflejada por un mayor índice hueso/médula) y con la entesis más fibrosa, lo que indicaría que la presencia de osificación dependería más de la microanatomía regional y de las fuerzas biomecánicas que de la presencia previa de inflamación y erosión. Las erosiones se desarrollarían en regiones de compresión y las proliferaciones óseas en zonas de mayor fuerza tensil.
Datos moleculares, modelos animales, evolución radiológica clínica y estudios ecográficos confirmarían que los procesos de inflamación y proliferación ósea serían independientes o, en todo caso, no se debería considerar la proliferación como un simple proceso reparativo reactivo al proceso inflamatorio. Sin embargo, todos estos hechos tienen sus limitaciones (falta de estudios aleatorizados con controles adecuados, métodos radiológicos con escasa sensibilidad al cambio, errores estadísticos, etc.). Además, la presentación típica de la enfermedad, con síntomas y signos causados por la inflamación en una primera fase y una fase más tardía con anquilosis y limitación funcional, indica un orden cronológico de eventos, lo que plantea la hipótesis contraria a la expuesta.
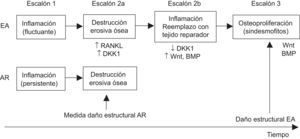
Inflamación y formación ósea como procesos dependientesLos autores16 que proponen esta hipótesis asumen un patrón de inflamación más fluctuante en la EA, comparado con el más estable de la AR, y el daño estructural ocurriría en varios escalones: un primer escalón con daño erosivo potenciado por el efecto osteoclastogénico del TNF, que aumenta el RANKL y el inhibidor de la formación ósea Dkk-1 y causa un defecto óseo que induciría la reparación con tejido fibroso; a medida que la inflamación disminuyera o se controlase de manera espontánea en un patrón de inflamación más fluctuante o por la intervención terapéutica, disminuiría Dkk-1 inducido por TNF y permitiría la actuación de la vía Wnt y de otros factores de crecimiento como las BMP, que osificarán ese tejido fibroso de reparación; sólo en el último escalón y por factores desconocidos, la formación ósea se podría perpetuar de manera independiente de la inflamación (fig. 1). Una vez que el proceso de formación ósea se ha puesto en marcha como probable respuesta fisiológica reparadora, ya no se podrá frenarlo con terapia anti-TNF. Sí se podría detenerlo si se suprime la inflamación antes de que se haya producido el daño erosivo.
Inflamación y formación ósea como procesos dependientes. Cronología de eventos según los autores que defienden esta hipótesis. BMP: proteína morfogenética ósea; DKK: Dickkopf; RANKL: ligando del receptor activador del factor nuclear-κB; Wnt: wingless. Adaptado de Sieper et al16.
También esta hipótesis se sustenta en algunos hallazgos clínicos y en estudios de imagen. Maksymowych et al17 estudiaron en pacientes que inician terapia biológica la evolución de lesiones inflamatorias por RM y de daño estructural por radiología. El seguimiento radiológico a los 2 años muestra que los nuevos sindesmofitos se desarrollaron significativamente más en los bordes vertebrales con inflamación previa (20%) que en aquellos sin inflamación en la RM basal (5,1%). Y más interesante fue el hallazgo de que los sindesmofitos se desarrollaron más frecuentemente en los bordes donde la inflamación se había resuelto (14,3%) que en aquellos donde la inflamación persistía (2,9%), lo que respalda el concepto de inflamación como reparación ósea.
También algunos estudios de biomarcadores óseos18 parecen respaldar la hipótesis de que la supresión de la inflamación induce la nueva formación ósea. En pacientes con EA tratados con adalimumab, se observó un significativo aumento del marcador de formación ósea fosfatasa alcalina a las 36–52 semanas de tratamiento, lo que se correlacionó de manera inversa con la metaloproteinasa 3 (MMP3), un marcador enzimático de actividad inflamatoria; por lo tanto, la resolución de la inflamación se seguiría de nueva formación ósea, que se puede interpretar como parte del proceso de reparación tisular. Estos cambios no se objetivaron en los pacientes con EA sin intervención terapéutica.
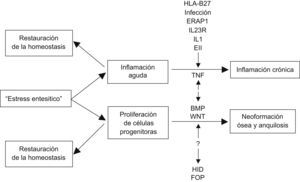
Inflamación y formación ósea: ¿cómo se relacionan?Lories et al12 proponen una explicación alternativa que puede tener parte de ambas hipótesis (fig. 2). Lo primero que acontece es “estrés/lesión entesítica”, en lo que probablemente intervengan factores biomecánicos y de microdaño óseo. Por un lado, se pone en marcha una reacción inflamatoria aguda y, por otro, se induce la diferenciación de células progenitoras mesenquimales residentes en la articulación, en células óseas que tenderían en una primera fase a restaurar la integridad tisular. Muchas veces esta agresión aguda se autolimita (sobre todo en ausencia de predisposición genética) y se restablece la homeostasis tisular, pero en otras condiciones específicas (propiedades estructurales del HLA B27, infección, enfermedad inflamatoria intestinal, etc.) se instaura una situación de inflamación crónica, con TNF en un papel estelar, y también un proceso de osificación continuo y anquilosis. La inflamación crónica y la osificación se desarrollan en vías moleculares diferentes, pero con probable influencia recíproca. La perpetuación de la formación ósea dependerá en mayor o menor parte de la inflamación, pero también de factores genéticos, aún no identificados y diferentes de los que determinan la susceptibilidad a la enfermedad inflamatoria (al igual que en otras enfermedades osificantes como la hiperostosis idiopática difusa o la fibrodisplasia osificante progresiva), así como de factores biomecánicos que llevan a respuestas de estrés o microdaño en la entesis, que se deberá explorar.
Modelo explicativo de la relación entre la inflamación y la formación ósea según Lories et al12. BMP: proteína morfogenética ósea; EII: enfermedad inflamatoria intestinal; ERAP: aminopeptidasa 1 de retículo endoplásmico; FOP: fibrodisplasia osificante progresiva; HID: hiperostosis idiopática difusa; IL-1: interleucina 1; IL23R: receptor de la intereleucina 23; TNF: factor de necrosis tumoral; Wnt: wingless.
Cualquiera que sea la hipótesis elegida, parece que de lo enunciado anteriormente se desprenden dos posibles pautas de actuación futura. Si la osificación se relaciona con la inflamación como un proceso inicialmente reparador, el control estricto, precoz y continuado de la inflamación podría impedir la osificación. Si son dos procesos independientes, habría que centrar los esfuerzos en encontrar nuevas dianas terapéuticas en la vía Wnt e investigar en el conocimiento de la osteoproliferación y la relevancia de nuevos protagonistas celulares y moleculares(p. ej., el osteocito y su proteína, la esclerostina) como algunos estudios muy recientes parecen indicar19.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.