El lupus eritematoso sistémico (LES) es la enfermedad autoinmune difusa del tejido conectivo que con mayor frecuencia afecta al pulmón, la cual oscila del 20 al 90%, porcentaje variable en función de los criterios empleados en las cohortes estudiadas (sintomatología hasta histopatología). Más del 50% de los pacientes presentan manifestaciones pleuropulmonares por lo menos una vez durante el curso de su enfermedad y tal afección se asocia a mayor mortalidad. Las anomalías pulmonares no correlacionan con marcadores séricos de actividad lúpica. Es prioritario descartar infección pulmonar en la evaluación inicial, ya que la afección parenquimatosa más frecuente es la infección bacteriana y constituye una de las principales causas de muerte. También se han descrito participación de agentes atípicos, que incluyen los que condicionan enfermedades granulomatosas y otros oportunistas. La afección pleuropulmonar en LES puede estar directamente asociada a LES o ser secundaria. Fármacos pueden ocasionar neumonitis e incluso progresión a enfermedad intersticial. Hay un incremento discreto en el riesgo de neoplasias pulmonares.
Systemic lupus erythematosus is the diffuse autoimmune connective tissue disease that most frequently involves pulmonary involvement, affecting 20% of 90% of the patients. The percentage varies depending on the defining criteria (symptoms, pulmonary tests or histopathological studies). At least once during the disease course, 50% of those affected have pleural and/or pulmonary manifestations, which are associated with higher morbidity and mortality. Pulmonary involvement has no correlation with lupus activity biomarkers, and it is necessary to rule out infectious processes in the initial approach. Bacterial infection is most frequently the cause of lung involvement in lupus and is one of the most important causes of death. Pulmonary involvement is considered to be primary when it is associated with disease activity, and secondary when other causes participate. Drugs have been reported to be associated with pulmonary damage, including interstitial disease. The incidence of malignant lung diseases is increased in systemic lupus erythematosus. Treatment depends on the type and severity of pulmonary involvement.
El lupus eritematoso sistémico (LES) es la enfermedad autoinmune con mayor prevalencia de afección pulmonar, la cual varía del 20 al 90%, en función de los criterios empleados en las cohortes estudiadas (sintomatología o histopatología)1,2. Más del 50% de los pacientes presentan manifestaciones pleuropulmonares por lo menos una vez durante el curso de su enfermedad; así mismo, la afección pleuropulmonar se ha asociado a mayor mortalidad3.
Síntomas como dolor pleurítico, tos y/o disnea suelen ser las primeras manifestaciones de afección pulmonar por LES, o bien, la primera manifestación de LES. Hasta el 60%4 de los pacientes han reportado disnea por lo menos una vez en su evolución, se han documentado pruebas de función respiratoria anormal en el 30 al 40%5-7, así como anomalías tomográficas en el 55 al 70%7. En la cohorte latinoamericana GLADEL (Grupo Latino Americano De Estudio del Lupus), se observó por lo menos una manifestación pleuropulmonar en 421 de 1.480 pacientes incluidos (28,4%)8.
Las anomalías pulmonares no se correlacionan con marcadores séricos de actividad lúpica. Es prioritario descartar infección pulmonar en la evaluación inicial, ya que se ha reportado que la afección parenquimatosa más frecuente es la infección bacteriana (67%)1 y constituye una de las principales causas de muerte9. En el 2007, Kinder et al.10 revisaron casos de neumonía en una cohorte de pacientes con LES e identificaron etiología bacteriana en el 75%, micobacteriana en el 12%, micosis en el 7% y etiología viral en el 5%. También se ha descrito participación de agentes atípicos y/o oportunistas11.
Dentro de los factores de riesgo descritos para afección pleuromulmonar en lupus eritematoso sistémico (LES) se encuentran: edad al diagnóstico de LEG ≥30 años (OR 1,42; IC 95%: 1,10-1,83), presencia de infecciones respiratorias bajas (OR 3,19; IC 95%: 2,05-4,96), enfermedad cardiaca no isquémica (OR 3,17; IC 95%: 2,41-4,18), isquémica (OR 3,39; IC 95%: 2,08-5,54), manifestaciones sistémicas (OR 2,00; IC 95%: 1,37-2,91), oftálmicas (OR 1,58; IC 95%: 1,16-2,14) y renales (OR 1,44; IC 95%: 1,09-1,83)8, hipocomplementemia (RR 3,38; IC 95%: 2,17-5,24), títulos elevados de anticuerpos dirigidos contra ADN bicatenario (RR 1,30; IC 95%: 0,78-2,24)12.
Las entidades que constituyen la afección pleuropulmonar en LES se catalogan como primarias cuando se atribuyen directamente a LES, o secundarias cuando son atribuibles a otras causas. Dentro de estas últimas, las infecciones alcanzan una prevalencia cercana al 60% y se les ha atribuido del 30 al 50% de las muertes de pacientes con LES9. El síndrome de insuficiencia respiratoria aguda (SIRA) tiene una prevalencia variable del 4 al 15% con mortalidad cercana al 70% y es en su mayoría secundario a sepsis.
Fármacos como metotrexato (MTX) y rituximab pueden ocasionar neumonitis e incluso progresión a enfermedad intersticial. Así mismo, se ha reportado incremento discreto en el riesgo de neoplasias en general, y pulmonares en particular, en pacientes con LES2.
Las entidades que constituyen la afección pleuropulmonar en LES se agrupan según las estructuras involucradas:
- •
Afección de parénquima2:
- ∘
Neumonitis lúpica: prevalencia del 1-12%.
- ∘
Enfermedad intersticial crónica: prevalencia del 3-13%.
- ∘
Hemorragia alveolar difusa (HAD): prevalencia del 2-6%, elevada mortalidad.
- •
Afección pleural: 50-70%, en forma de pleuritis y/o derrame2.
- •
Afección vascular:
- ∘
Hipertensión pulmonar: prevalencia del 0,5-4,2%13.
- ∘
Embolismo/tromboembolismo (TEP): trombosis venosa profunda con/sin TEP en el 9%, relacionado con actividad. La presencia de anticuerpos antifosfolípidos (hasta en el 30% de pacientes con LES) incrementa el riesgo de eventos tromboembólicos un 35-40%14.
- ∘
Hipoxemia aguda reversible: entidad rara, caracterizada por hipoxemia no explicada sin datos obvios de afección parenquimatosa. Su patofisiología es controversial, pero se ha propuesto agregación leucocitaria y activación de complemento en vasculatura pulmonar. Buena respuesta a esteroides en 72h3.
- •
Síndrome del pulmón encogido: prevalencia del 0,6 al 0,9%, caracterizado por disnea no explicable, elevación del diafragma y volúmenes pulmonares reducidos sin afección intersticial. Su etiología es debatible pero se ha propuesto neuropatía frénica, miopatía inflamatoria y más recientemente enfermedad pleural. Buena respuesta con esteroides14.
- •
Vías aéreas: tanto inferiores como superiores, con prevalencia variable del 0,3 al 30%, siendo su evolución predominantemente subclínica3.
A continuación, se revisarán aspectos epidemiológicos, clínicos, diagnósticos y de tratamiento referentes a las entidades consideradas de particular interés por los autores debido a su frecuencia elevada o bien, a la gravedad que representan.
Afección pleuralPrevalencia. La pleuritis constituye la manifestación torácica más común en LES. El dolor pleurítico se presenta en el 45-60% de los pacientes, el derrame pleural hasta en el 50% y en necropsias se ha reportado que ocurren hasta en el 93%2. La experiencia documentada en la cohorte GLADEL es similar, la afección pleural fue la manifestación pleuropulmonar más frecuente (24%)8 y en donde se observó que la enfermedad cardiaca isquémica y no isquémica (OR 2,99; IC 95%: 2,33-3,82 y OR 1,99; IC 95%: 1,28-2,09, respectivamente) constituyen factores de riesgo. Entre otros factores descritos se encuentran: presencia de nefritis lúpica, hipocomplementemia (C3 y C4) y niveles elevados de anticuerpos dirigidos contra ADN bicatenario12. Un estudio reciente que incluyó 119 pacientes con LES y afección pleural demostró que aún en áreas endémicas para tuberculosis, la principal etiología de derrame pleural en estos pacientes continúa siendo su enfermedad de base (52%)15.
Clínica. El síntoma principal es dolor pleurítico, habitualmente acompañado de fiebre, tos y disnea. En ocasiones el derrame pleural puede ser asintomático y detectarse solo radiográficamente. Habitualmente se trata de derrames pequeños y bilaterales, aunque también puede ser unilateral. Tienden a ser evanescentes y recurrentes16.
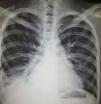
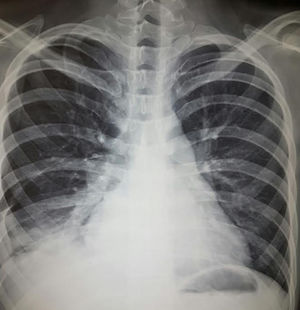
Diagnóstico. Entre los diferenciales se incluyen dolor musculoesquelético, embolismo pulmonar, infección, falla cardiaca, uremia y neoplasia. El análisis del líquido pleural es la principal herramienta diagnóstica. Típicamente, se trata de un exudado con elevación discreta de leucocitos, predominio de mononucleares (también hay polimorfonucleares) y niveles de glucosa normales o ligeramente bajos. El diferencial principal es con artritis reumatoide (AR), caracterizado por mayor elevación de leucocitos y DHL así como glucosa baja2. El papel que tiene la detección de anticuerpos antinucleares (ANA) en líquido pleural para el diagnóstico de pleuritis lúpica es controversial. Dos estudios recientes17,18 han reportado ANA a títulos >1:160 con sensibilidad del 85 al 90% y especificidad del 80% para diagnóstico de pleuritis lúpica en pacientes con lupus, sin embargo, títulos elevados también pueden encontrarse en otras entidades. En la figura 1 se muestra evidencia de derrame pleural en paciente con lupus que refirió datos clínicos de afección pleural.
Mujer de 22 años con LEG de 3 años de evolución caracterizado por manifestaciones cutáneas y musculoesqueléticas. Acude por cuadro de un mes de evolución caracterizado por dolor de tipo pleurítico y disnea. La radiografía de tórax simple reveló imágenes radiopacas que obliteran ángulos costodiafragmáticos compatibles con derrame pleural el cual fue abordado y posteriormente atribuido a actividad de su enfermedad de base.
Biopsia pleural. Rara vez realizada, habitualmente solo ante duda diagnóstica. Los hallazgos son inespecíficos: infiltración linfocítica y de células plasmáticas, fibrosis y pleuritis fibrinosa. La inmunofluorescencia muestra patrón nuclear con anti-IgG, anti-IgM y anti-C316.
Complicaciones. Evolución usualmente benigna; aunque se reportó un caso que desarrolló fibrotórax con restricción grave, su respuesta fue favorable a pleurectomía19.
Tratamiento. La mayoría de pacientes responden a antiinflamatorios no esteroideos (AINE) o esteroides orales (prednisona 10-30mg/día). La azatioprina se ha empleado como agente ahorrador de esteroide y la ciclofosfamida solamente cuando existe compromiso sistémico concomitante. Se ha empleado pleurodesis con tetraciclina o talco en derrames grandes recurrentes2.
Neumonitis agudaPrevalencia. Diversas series reportan una prevalencia variable entre el 2 y el 9%20-25. En los últimos 8 años se han reportado 5 casos corroborados. En la cohorte GLADEL se reportó en el 2,3% de los pacientes y se asoció a enfermedad cardiaca no isquémica (OR 2,48; IC 95%: 1,20-5,13)8.
Clínica. Inicio agudo e inespecífico: tos con o sin hemoptisis, disnea y fiebre. En casos graves puede existir hipoxemia e incluso insuficiencia respiratoria aguda. Puede ser la manifestación inicial de LES hasta en la mitad de los pacientes que la presentan26. La imagen radiográfica característica consiste en infiltrados alveolares uni/bilaterales, habitualmente con predominio basal27. Wan et al. recientemente reportaron una serie de 5 casos en los que la neumonitis lúpica constituyó la manifestación inicial; el 100% cursó con imágenes pulmonares en radiografías, la tomografía de tórax (realizada en 2) mostró opacidades en vidrio despulido y consolidación en parches bilateral. Todos presentaron manifestaciones adicionales de LEG que permitieron realizar el diagnóstico: mucocutáneas en el 100%, hematológicas en el 80%, serositis en el 40%, y positividad para anticuerpos dirigidos contra ADN bicatenario en el 60%28.
Manejo inicial y diagnóstico. Debido a que el principal diagnóstico diferencial es con infección, es necesario instituir cobertura antibiótica empírica posterior a toma de cultivos para posteriormente desescalar o retirarla si se descarta infección27.
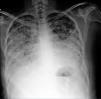
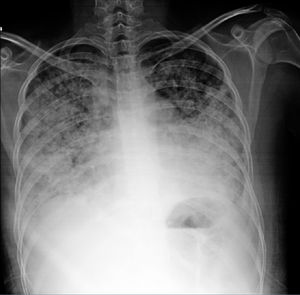
Se ha descrito asociación a títulos elevados de anticuerpos anti-dsDNA. La utilidad del lavado broncoalveolar (LBAV) reside en descartar infección, característicamente se observa celularidad incrementada a expensas de polimorfonucleares activados3. La toma de biopsia puede limitarse a casos con dudas diagnósticas para exclusión de etiologías alternativas. Los hallazgos son inespecíficos: daños a pared alveolar y necrosis, infiltración por células inflamatorias, edema, hemorragia y membranas hialinas16. Algunos expertos cuestionan la existencia de este síndrome a menos que se demuestre alguno de los siguientes: fibrosis intersticial, vasculitis, cuerpos de hematoxilina, neumonitis intersticial, alveolitis o pleuritis27. Resulta de utilidad recordar que, con fines de diagnóstico, el establecimiento de neumonitis lúpica es casi siempre simultáneo con exacerbación de la enfermedad en general con afección multiorgánica (p.ej., afección renal y serositis) y ocurre en la mayoría de casos en presencia de anticuerpos anti-SSA (82%). Por lo tanto, la combinación de neumonitis con afección multiorgánica y positividad para anti-SSA apoyan el diagnóstico29. En la figura 2 se muestra un ejemplo tomográfico de paciente con neumonitis lúpica.
Mujer de 24 años con LEG de 4 años de evolución caracterizado por manifestaciones predominantemente musculoesqueléticas y hematológicas (anemia hemolítica autoinmune). Ingresada al servicio de urgencias por cuadro de 10 días de evolución consistente en disnea, tos seca y posterior expectoración hemoptoica en 6 ocasiones. A su ingreso se encontraba taquicárdica e hipoxémica. En la tomografía destacó vidrio despulido de predominio bibasal. Tras descartar proceso infeccioso se consideró posibilidad de neumonitis lúpica. Recibió pulsos de metilprednisolona y ciclofosfamida con mejoría.
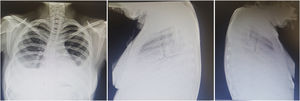
Pronóstico. Las series antiguas reportan una mortalidad de hasta el 50%; la serie más reciente reportó una mortalidad del 40%28. Si bien es una complicación poco común, la neumonitis lúpica durante el embarazo y en el postparto se ha asociado a desenlaces particularmente adversos29-31. El predominio de linfocitos en LBAV se asocia a evolución más favorable, mientras que el predominio de eosinófilos o neutrófilos se asocia a mayor mortalidad. Hasta en el 50% de los supervivientes persisten los infiltrados intersticiales y función respiratoria anormal con riesgo de progresión a neumonitis crónica intersticial3,14. En la figura 3 se muestran datos de neumonitis e hipertensión pulmonar.
Hombre de 22 años con hermano gemelo con lupus eritematoso sistémico, ambos con datos de síndrome de Schnitzler (cuadros intermitentes de fiebre, urticaria, dolor abdominal, angioedema, artritis), en los últimos 2 meses con disnea progresiva hasta la de mínimos, poliartritis, hipertensión, edema mecánico y en los días precedentes tos e incremento de disnea. A la exploración, con complejo de la pulmonar de Chávez y síndrome de condensación basal derecho; radiografía con datos de hipertensión pulmonar, 4 arcos, neumonitis basal derecha y derrame homolateral. Se realizó diagnóstico de neumonitis lúpica que se manejó con prednisona 0,5mg/kg/día y ciclofosfamida con adecuada respuesta.
Tratamiento. No existen estudios controlados, el esquema actual se basa en reportes de caso. Es indispensable la cobertura antibiótica de amplio espectro hasta descartar infección. La piedra angular del tratamiento es prednisona a dosis de 1-1,5mg/kg/día27. Si no existe respuesta en 72h, se recomienda la administración de pulsos intravenosos de glucocorticoides (metilprednisolona 1g/día por 3 días); es necesario considerar añadir inmunosupresores como ciclofosfamida. Aquellos pacientes con taquipnea o hipoxemia significativa y/o en los que se sospeche hemorragia alveolar idealmente deben ingresar al área de cuidados intensivos y resulta indispensable emplear pulsos de metilprednisolona como tratamiento inicial2. Existen reportes de casos con diferentes grados de éxito con azatioprina, gammaglobulina intravenosa, plasmaféresis y rituximab2,32,33. En la revisión retrospectiva de Wan et al., todos los pacientes recibieron altas dosis de glucocorticoide, 80% de ciclofosfamida intravenosa y 60% de inmunoglobulina intravenosa28.
Se ha observado que infecciones por influenza pueden activar y exacerbar LEG en general y también neumonitis lúpica. Aunque la respuesta humoral a vacuna de influenza es más débil comparada con población general, la vacunación en pacientes con LEG con actividad leve a moderada es moderadamente efectiva y segura. La información actual no permite hacer recomendaciones referentes a LEG con actividad elevada34.
Enfermedad pulmonar intersticial crónicaPrevalencia. Reportada entre el 3 y 8%, además se ha observado que incrementa con la duración de la enfermedad35. Diversas cohortes de pacientes con LES han encontrado disminución de la capacidad de difusión de monóxido de carbono en el 27-56%, patrón restrictivo en el 8-80%6,7,36 y afección intersticial en tomografías de alta resolución en el 30-40%; sin embargo, la mayoría se encuentran asintomáticos (50-90%)5,7,36,37. Lo anterior sugiere que tiene un curso subclínico en la mayoría de los afectados. Dentro de los factores de riesgo reconocidos se encuentran: enfermedad >10 años de evolución, fenómeno de Raynaud, anticuerpos dirigidos contra ribonucleoproteína U1, esclerodactilia, anomalías capilaroscópicas y edad mayor38.
Clínica. Suele predominar en hombres mayores de 50 años con LES de presentación tardía o de larga evolución (>10 años)26. El curso habitualmente es insidioso, pero puede presentarse posterior a uno o más episodios de neumonitis aguda. Generalmente consiste en disnea de esfuerzo, dolor pleurítico ocasional, tos no productiva y estertores bibasales2. En estadios tempranos las imágenes radiográficas pueden ser normales o mostrar opacidades lineales irregulares. Estudios posteriores muestran infiltrados difusos o bibasales, enfermedad pleural, patrón en panal de abeja y disminución de volúmenes pulmonares. La TAC de alta resolución define la presencia y el patrón de la enfermedad39. La severidad de la afección pulmonar no guarda relación con marcadores serológicos16. Sin embargo, se ha descrito asociación con anti-Ro/SSA hasta en el 80% de los pacientes40. Lo anterior sugiere una posible contribución del síndrome de Sjögren secundario. La neumonía linfocítica intersticial (NLI) se asocia a Sjögren hasta en el 53%; hay reportes de caso de NLI en LES sin y con Sjögren secundario41,42.
Diagnóstico. Entre las herramientas diagnósticas se cuenta con las siguientes:
- •
Tomografía de alta resolución: corrobora la presencia de enfermedad intersticial y es posible clasificarlas de acuerdo a los patrones observados, los cuales son muy similares a los que se presentan en esclerosis sistémica35,39:
- ∘
Neumonía intersticial no específica (NINE): vidrio despulido en parches y anomalías reticulares.
- ∘
Neumonía intersticial usual (NIU): opacidades reticulares con panal de abeja de predominancia subpleural y basal, con o sin bronquiectasias por tracción.
- ∘
Neumonía linfocítica intersticial (NLI): menos habitual. Opacidades en vidrio despulido difusas, anomalías reticulares y quistes perivasculares.
- •
Pruebas de función respiratoria: documentan la extensión y progresión. Es característico el patrón restrictivo, la capacidad de difusión de monóxido de carbono disminuida y la desaturación con ejercicio26,35.
- •
LBAV: su principal utilidad reside en la exclusión de otras etiologías. La relación con el pronóstico no está bien establecida. El análisis del líquido de LBAV en pacientes asintomáticos ha sugerido alveolitis subclínica26. Un estudio realizado por Chhajed et al. en pacientes con LES y AR demostró predominancia de macrófagos, seguido por linfocitos y neutrófilos, así como relación de predominio linfocítico en aquellos con síntomas pulmonares y de neutrófilos y linfocitos en aquellos con imágenes intersticiales43.
- •
Biopsia: aconsejable realizarla si existe duda diagnóstica a pesar de estudios no invasivos26,35.
- ∘
NINE: el más común. Destaca infiltrado crónico inflamatorio (linfocitos/células plasmáticas), ausencia de fibrosis.
- ∘
NIU: fibrosis en parches con remodelación de arquitectura pulmonar, inflamación intersticial crónica moderada.
- ∘
NLI: infiltrado inflamatorio intersticial difuso marcado con linfocitos, células plasmáticas e histiocitos.
- ∘
También se han reportado asociaciones menos frecuentes con amiloidosis y neumonía criptogénica organizada.
Tratamiento. No existen estudios clínicos controlados. Se cuenta con estudios pequeños en donde inicialmente se observó respuesta favorable e incremento de la capacidad de difusión de monóxido de carbono con prednisona a dosis de 60mg/kg. El resto de los esquemas terapéuticos se han extrapolado de los empleados en esclerosis sistémica debido a la similitud de la afección intersticial3,44. En enfermedad de severidad leve a moderada se ha empleado prednisona como monoterapia, pero más habitualmente asociada a otro inmunosupresor. En enfermedad grave o progresiva, se emplea prednisona 1-2mg/kg y ciclofosfamida, con posterior transición a azatioprina o mofetil micofenolato14. La experiencia real con ciclofosfamida es limitada; existen también reportes de caso con metotrexato y recientemente con rituximab, ambos con respuesta favorable45-48.
Pronóstico. El curso de la enfermedad es variable pero lento, rara vez progresivo con tendencia a estabilizarse con el tiempo26. Una serie antigua reportó cambios no significativos en parámetros principales de pruebas de función respiratoria49. Aquellos pacientes con rasgos de escleroderma o que cursan con síndromes de sobreposición suelen tener mayor prevalencia de restricción26. De acuerdo al patrón histológico, en una serie de biopsias en donde se incluyeron pacientes con AR, Sjögren, polimiositis y LES el patrón más frecuente fue NINE (41%), con mortalidad del 24% en donde la forma fibrótica era la más comúnmente asociada50.
Hemorragia alveolar difusa (HAD)Prevalencia. Es variable, del 0,6-5,7%; sin embargo, la supervivencia continúa siendo inaceptablemente baja en la mayoría de los reportes51-57. Investigadores de nuestro grupo reportaron prevalencia y supervivencia del 9 y 49,7% en 2011, respectivamente58. Uno de los trabajos más recientes reportó prevalencia del 1,6% y mortalidad del 28,6%58.
Patofisiología. No está completamente dilucidada. La evidencia apunta a que la actividad de la enfermedad juega un papel crucial ya que la mayoría de las series reportan puntajes de SLEDAI (por sus siglas en inglés systemic lupus erythematosus disease activity index) elevados (>12), prevalencia elevada de nefritis (66-100%), artritis (15-75%) y manifestaciones neuropsiquiátricas (20-60%) concomitantes59, así como infiltrado de polimorfonucleares y ocasionalmente depósito de complejos inmunes en capilares (capilaritis) y pared alveolar, si bien la mayoría de pacientes presentan hemorragia «blanda» (sangre en alvéolos sin inflamación ni destrucción de pared)60. Lo anterior, de acuerdo a las series de autopsias de pacientes con LES reportadas en 1981 y 2009, sugiere que procesos como aspiración, infección, falla cardiaca y renal pueden contribuir en gran medida en la patogénesis de HAD1,61. En la actualidad, se reconocen 3 patrones histopatológicos que pueden sobreponerse frecuentemente: capilaritis pulmonar (infiltración neutrofílica de septos alveolares, pérdida de integridad estructural capilar y paso de eritrocitos a espacios alveolares e intersticio; en algunos casos se ha implicado participación de anticuerpos antifosfolípidos en este proceso), hemorragia pulmonar blanda (acumulación de eritrocitos y fibrina en espacios alveolares sin inflamación ni destrucción de estructuras alveolares) y daño alveolar difuso (edema de septos alveolares y formación de membranas hialinas)62.
Factores de riesgo. Han sido pobremente descritos pero se ha establecido una asociación fuerte con actividad de la enfermedad; particularmente con nefritis tipos III y IV (90%)60,63, títulos elevados de anti-dsDNA, complemento bajo, puntaje de SLEDAI >1057 y manifestaciones neuropsiquiátricas56.
Clínica. La mayoría de casos descritos ocurren en mujeres, la duración de LES previo a HAD es variable (6 meses-14 años) y puede ser el evento inicial en el 10-30%54,64. Consiste en disnea, disminución de hemoglobina, infiltrados radiográficos cambiantes y pueden o no presentar hemoptisis (ausente hasta en el 30-50%)65. Dentro de las características radiográficas que sugieren la presencia de HAD se incluyen la aparición súbita de infiltrados, pobre respuesta a antibióticos y la rápida resolución radiográfica tras el manejo con corticoesteroides54. Se han descrito infiltrados alveolares difusos bilaterales en la mayoría; en ocasiones se observan infiltrados alvéolo-intersticiales que en el 20% pueden ser unilaterales o en parches en el 40%. La tomografía de alta resolución es más sensible para la correcta valoración del patrón y distribución de HAD, así como de cambios pulmonares asociados40,65.
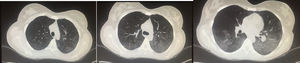
Diagnóstico. Puede corroborarse ante los hallazgos clínicos, el descenso no explicable de hemoglobina, hallazgos radiográficos característicos y la respuesta favorable al tratamiento. En la figura 4 se muestra radiografía con imágenes alveolares características de hemorragia alveolar. Algunas herramientas que pueden contribuir al diagnóstico son:
- •
Capacidad de difusión de monóxido de carbono: algunas series reportan incremento del 30% sobe el basal o elevación de >130% del valor predicho. Difícil de realizar o no viable en la mayoría de pacientes por estado crítico51.
- •
LBAV: confirma/descarta infección y la presencia de hemosiderófagos. Útil en pacientes con manifestaciones inespecíficas54,59.
- •
Biopsia: rara vez realizada por morbimortalidad en paciente crítico. Se ha descrito capilaritis con depósito de complejos inmunes y neutrófilos en paredes alveolares en el 14%. El hallazgo predominante es el de hemorragia blanda (72%)66,67.
Mujer de 20 años con historia de lupus eritematoso sistémico de 4 años de evolución. Con vasculitis necrosante en miembros inferiores, psicosis, eritema, fotosensibilidad, trombocitopenia, linfopenia, anemia grave, VDRL+ y AAN 1:640 homogéneo y periférico. Últimos meses con disnea progresiva hasta la de mínimos; últimos días con incremento de tos, disnea y hemoptisis; hemoglobina 3g, hipoxemia, proteinuria nefrótica y sedimento telescopiado. Tele de tórax muestra imágenes alveolares compatibles con hemorragia alveolar difusa. Recibió metilprednisolona 1g 3 días y ciclofosfamida con adecuada respuesta.
Dentro de los diferenciales se considera: embolismo pulmonar, falla cardiaca, neumonitis lúpica e infección, siendo estos últimos dos de los principales2.
Infección. Estudios recientes han mostrado la presencia de infección pulmonar concomitante en pacientes con HAD hasta en el 60% de los casos53; por sí mismo es un factor asociado a mayor mortalidad. Entre los microorganismos comúnmente reportados están Pseudomonas spp, Aspergillus, Staphylococcus aureus y citomegalovirus59. En la cohorte estudiada por nuestro grupo68 que incluyó 50 pacientes se reportó mortalidad del 42% e infección en el 38%. Los factores asociados a mayor riesgo de infección fueron: ventilación mecánica, hipocomplementemia y niveles elevados de PCR. Por el contrario, en aquellos pacientes sin tratamiento previo para LES se observó menor frecuencia de procesos infecciosos.
En un trabajo previo de nuestro grupo hemos enfatizado la importancia de realizar búsqueda sistemática de infección en todo paciente con HAD, con la posibilidad de oportunistas e incluso la necesidad de toracoscopia con toma de biopsia sopesando riesgo-beneficio en cada caso. Así mismo, es necesario instituir una cobertura antibiótica empírica de amplio espectro como parte del manejo inicial54,56.
Pronóstico y factores de mortalidad. Los episodios de HAD pueden recurrir y los supervivientes pueden cursar con pruebas de función respiratoria persistentemente alteradas. La mortalidad reportada hace 30 años llegó a ser del 90%; en los últimos 15 años oscila entre el 40 y 60%59. Entre los factores asociados a mayor mortalidad destacan la presencia de infección pulmonar concomitante, falla renal, necesidad de ventilación mecánica, trombocitopenia y puntaje de APACHE II elevado, siendo estos últimos 4 factores los más frecuentemente asociados51,54-56,69.
Tratamiento. Al igual que con las otras entidades ya descritas, no se cuenta con estudios clínicos controlados y el esquema de tratamiento actual deriva de reportes de caso y series. Entre los más empleados se encuentran los siguientes59:
- •
Pulsos intravenosos de metilprednisolona (mPDN) 1g/día durante 3 o más días hasta observar mejoría clínica, lo que se asocia a mayor supervivencia70.
- •
Ciclofosfamida: inicialmente asociada a mayor mortalidad (empleada en pacientes más graves), sin embargo, series recientes han mostrado efecto nulo o incluso protector sobre la mortalidad54,55,63.
- •
Plasmaféresis: habitualmente junto con mPDN y ciclofosfamida en casos con pobre respuesta; su utilidad aislada no se ha precisado, pero se ha documentado disminución de la mortalidad en el 20%59.
- •
Inmunoglobulina: empleado en una serie de casos, sin impacto sobre la mortalidad54.
- •
Rituximab: mediante mecanismos de inmunorregulación distintos a la depleción de linfocitos B71, se ha observado respuesta favorable y relativamente rápida en series de casos y reportes de casos aislados, particularmente con disminución de la recurrencia72-78.
- •
Existen pequeñas series y reportes de caso con tasas de éxito variable con terapias que incluyen: trasplante de células mensenquimatosas de cordón umbilical, oxigenación con membrana extracorpórea, factor VIIa y mofetil micofenolato79-86.
La afección pulmonar en el LES es altamente prevalente (si bien una proporción significativa de los pacientes pueden tener curso asintomático), puede involucrar virtualmente cualquier componente del sistema respiratorio y esta puede constituir la manifestación inicial de LES. A diferencia del compromiso observado en otros órganos (piel, riñón, sistema nervioso), la afección pleuropulmonar guarda pobre o nula relación con marcadores serológicos. Los cuadros son similares entre sí, inespecíficos y de gravedad variable.
El diagnóstico diferencial es amplio y el principal es con proceso infeccioso, que constituye la principal causa de mortalidad en LES, por lo cual es indispensable instituir una cobertura antibiótica de amplio espectro en el abordaje inicial.
La falta actual de estudios clínicos controlados limita el armamento terapéutico disponible para las entidades potencialmente fatales como neumonitis aguda y/o HAD; es poco probable contar en el futuro con estudios de esa naturaleza debido a la relativa poca frecuencia de estas afecciones y a la gravedad de las mismas. Los agentes terapéuticos disponibles resultan, en ocasiones, poco satisfactorios y su empleo en las manifestaciones pulmonares graves de LES deriva principalmente de series de casos y de la experiencia obtenida en otras enfermedades reumatológicas (como afección intersticial en esclerosis sistémica).
El papel que agentes biológicos podrían tomar en estas manifestaciones graves aún continúa bajo evaluación; se espera contar con más información al respecto derivada del uso de estos agentes en reportes de series de casos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés para la presente publicación.
Carlos Abud-Mendoza ha sido conferencista para BMS, Pfizer, UCB, Roche y participado en talleres como consejero ocasionalmente.