Es evidente que los pacientes con miopatías inflamatorias, en especial dermatomiositis, tienen mayor riesgo de neoplasias. Esta relación, descrita por primera vez por Sterz en 1916, ha sido corroborada en estudios de cohortes comparadas con la población general. El presente capítulo describe las características clínicas y serológicas de los pacientes con miopatía asociada a cáncer, los tipos de neoplasias más frecuentes, las teorías patogénicas entre miopatía y cáncer, así como aspectos de evaluación diagnóstica y de pronóstico.
There is a greater risk of developing cancer among patients with inflammatory myositis, specifically dermatomyositis. This relationship was first described in 1916 by Sterz and has been corroborated in population based studies. This chapter describes clinical and serological characteristics of patients with myositis and cancer, as well as the most common malignancies and diagnostic and prognostic considerations in this group of patients.
La frecuencia del cáncer en dermatomiositis/polimiositis (DM/PM) varía según los reportes de la literatura médica desde el 6 hasta el 60%. Esta enorme variabilidad se explica, al menos en parte, por factores metodológicos de los primeros reportes realizados, falta de uniformidad en cuanto al diagnóstico de la miopatía, inclusión en los estudios de diferentes tipos de miopatía, e incluso, la región del mundo en la que se realizó el estudio1.
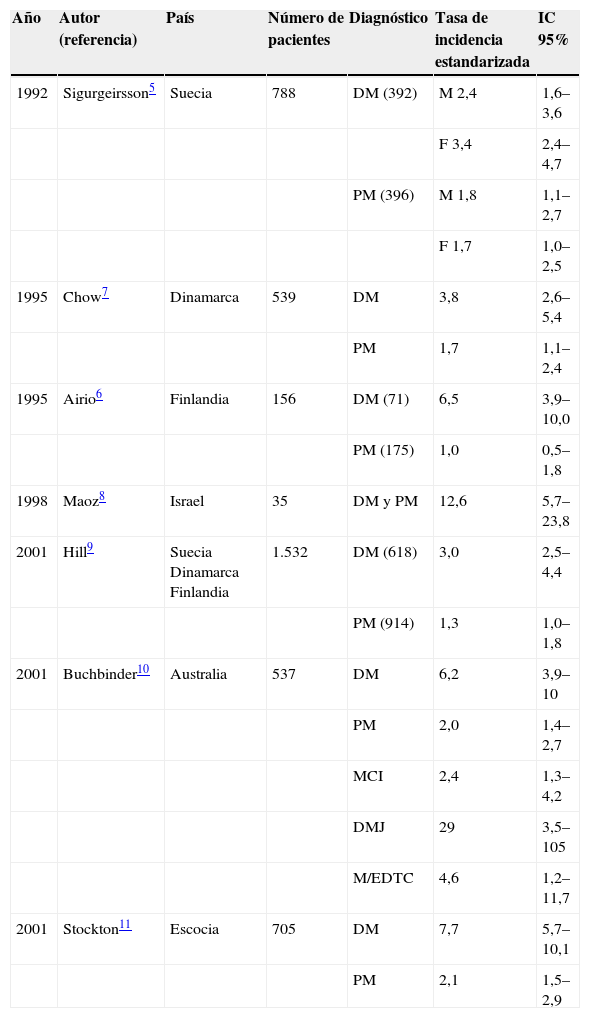
Los estudios de casos y controles y de cohortes comparadas con la población general demuestran un incremento importante en el riesgo de cáncer en la DM (razón de momios (RM): 4,4; IC 95%: 3,0–6,6) y un aumento más modesto, pero también significativo (RM: 2,1; IC 95%: 1,3–3,8) en la PM2,3. En la tabla 1 se comparan los resultados respecto a la incidencia de neoplasias en los diferentes tipos de miopatía en estos estudios4–10. Respecto a otros tipos de miopatía, se han descrito casos de pacientes con cáncer y miopatía asociada a enfermedades difusas del tejido conectivo, miopatía por cuerpos de inclusión, DM juvenil e incluso DM amiopática, aunque la asociación parece mucho menos consistente.
Incidencia de neoplasias en miopatías inflamatorias: estudios de cohortes comparadas con la población general
| Año | Autor (referencia) | País | Número de pacientes | Diagnóstico | Tasa de incidencia estandarizada | IC 95% |
| 1992 | Sigurgeirsson5 | Suecia | 788 | DM (392) | M 2,4 | 1,6–3,6 |
| F 3,4 | 2,4–4,7 | |||||
| PM (396) | M 1,8 | 1,1–2,7 | ||||
| F 1,7 | 1,0–2,5 | |||||
| 1995 | Chow7 | Dinamarca | 539 | DM | 3,8 | 2,6–5,4 |
| PM | 1,7 | 1,1–2,4 | ||||
| 1995 | Airio6 | Finlandia | 156 | DM (71) | 6,5 | 3,9–10,0 |
| PM (175) | 1,0 | 0,5–1,8 | ||||
| 1998 | Maoz8 | Israel | 35 | DM y PM | 12,6 | 5,7–23,8 |
| 2001 | Hill9 | Suecia Dinamarca Finlandia | 1.532 | DM (618) | 3,0 | 2,5–4,4 |
| PM (914) | 1,3 | 1,0–1,8 | ||||
| 2001 | Buchbinder10 | Australia | 537 | DM | 6,2 | 3,9–10 |
| PM | 2,0 | 1,4–2,7 | ||||
| MCI | 2,4 | 1,3–4,2 | ||||
| DMJ | 29 | 3,5–105 | ||||
| M/EDTC | 4,6 | 1,2–11,7 | ||||
| 2001 | Stockton11 | Escocia | 705 | DM | 7,7 | 5,7–10,1 |
| PM | 2,1 | 1,5–2,9 |
DM: dermatomiositis; DMJ: dermatomiositis juvenil; F: femenino; M: masculino; MCI: miositis por cuerpos de inclusión; M/EDTC: miositis/enfermedad difusa del tejido conectivo; PM: polimiositis.
Tipos de neoplasia. En general las neoplasias asociadas con DM son las esperadas por la edad y el sexo, esto es, cáncer de pulmón, estómago y próstata en los varones, y cáncer de pulmón, mama y ginecológico en las mujeres (en especial el cáncer de ovario parece más frecuente de lo esperado)11,12. Sin embargo, también se ha reportado asociación con neoplasias poco comunes y de muy diversos tipos (feocromocitoma maligno, mieloma múltiple, timoma, carcinoma papilar seroso, teratomas, sarcoma de Kaposi y melanoma, entre otros). En los pacientes con PM predominan los cánceres linfohematopoyéticos. En un estudio extenso, Hill et al8 encontraron mayor riesgo de cáncer de ovario (10,5×10−6), pulmón (5,9×10−6), páncreas (3,8×10−6), estómago (3,5×10−6), colon y recto (2,5×10−6) y linfomas en sus pacientes con DM, así como de linfoma no hodgkiniano (riesgo: 3,7×10−6), pulmón (2,8×10−6) y vejiga (2,4×10−6) en los pacientes con PM. Otros estudios han corroborado estos hallazgos10,12. En la población asiática varios estudios de casos y controles han demostrado alta frecuencia de carcinoma nasofaríngeo13,14.
Desde el punto de vista histológico, en los pacientes con DM predominan los adenocarcinomas y en los pacientes con PM, las neoplasias de origen hematopoyético-linfático8.
Manifestaciones clínicas y de laboratorio. Prácticamente todos los estudios que evalúan los factores demográficos coinciden en que los pacientes con miopatía asociada a cáncer (MAC) son de mayor edad15,16, pero en cuanto al sexo los resultados son contradictorios15. Aunque muchas de las manifestaciones clínicas de la DM/PM asociada a cáncer son semejantes a las de la miopatía idiopática y algunos autores piensan que el cuadro clínico es indistinguible en estas dos entidades, se han descrito algunas alteraciones que parecen ser más frecuentes en los casos asociados a neoplasia, principalmente manifestaciones cutáneas y vasculares. Se han descrito mucinosis cutánea, eritrodermia exfoliativa, necrosis epidérmica extensa, lesiones vesiculobulosas, urticaria y evidencia clínica e histológica de vasculitis leucocitoclástica, sugiriendo que la presencia de estas alteraciones justifica una mayor sospecha clínica de neoplasias subyacentes13,17–19. Por el contrario, la presencia de enfermedad pulmonar intersticial, artritis y afección cardíaca, parece menos frecuente en pacientes con MAC15,18,20.
Aunque no se ha observado relación entre la severidad clínica de la miopatía y la asociación con neoplasias, la evolución clínica puede ser un dato orientador, ya que el inicio rápido, la presencia de disfagia, la afección diafragmática y la falta de respuesta al tratamiento habitual justifica investigar una neoplasia oculta15,17,19.
Las primeras observaciones indicaron que los pacientes con MAC tenían menor elevación de enzimas de origen muscular (específicamente creatina cinasa), sin embargo, no todos los estudios han corroborado esta observación14,19,21. Varios estudios han encontrado que el incremento en la velocidad de sedimentación globular (>35mm/h) tuvo alto valor predictivo positivo para la asociación con neoplasia15,21.
Autoanticuerpos. En relación con los autoanticuerpos, en general se ha observado que en las miopatías asociadas a neoplasia es excepcional encontrar anticuerpos específicos de miositis (AEM), como anti-Jo-1 o anti-Mi-215,22. Sin embargo, un trabajo reciente encontró relación entre diversos síntomas reumáticos paraneoplásicos (incluyendo DM) y la presencia de anticuerpos antinucleares en pacientes con cáncer23, y Hengstman et al analizaron las características de los pacientes con anticuerpos contra fragmentos del antígeno Mi-2b y describen posible mayor riesgo de cáncer en los pacientes con anticuerpos contra el fragmento N-terminal24.
Recientemente se ha descrito un nuevo AEM dirigido contra las proteínas nucleares de 155 kDa o 155/140 kDa, muy específico para DM y que parece asociarse en forma significativa con riesgo de cáncer (el 71 vs. el 11%; p<0,005)25,26.
Fisiopatogenia. Se han propuesto varios mecanismos para explicar la relación patogénica entre miopatías y cáncer19,27–29.
- a)
Existencia de un factor ambiental común (virus, fármaco, sustancias químicas) que desencadena ambos padecimientos en un huésped predispuesto.
- b)
Miopatía y neoplasia como resultado de un trastorno en la inmunidad humoral y/o celular del huésped.
- c)
Mediadores bioactivos (v. gr. citocinas) o miotoxinas de origen tumoral que causen inflamación en el músculo y la piel.
- d)
Presencia de complejos inmunes o activación de la inmunidad celular con participación de antígenos tumorales que tengan reacción cruzada con antígenos del músculo y la piel.
En algunos casos de cáncer posterior al diagnóstico y tratamiento de la miopatía se ha sugerido la influencia de los inmunosupresores en la aparición del cáncer. Sin embargo, en estudios extensos4–6,8,29, el tratamiento con agentes inmunosupresores no parece aumentar la prevalencia de neoplasias en los pacientes con enfermedades difusas del tejido conectivo, incluyendo miopatías.
La DM como un evento paraneoplásico. En muchos de los casos, la miopatía (sobre todo la DM) asociada con cáncer se comporta como un verdadero síndrome paraneoplásico, con una asociación temporal estrecha, mejorando la miopatía después del tratamiento del cáncer, e incluso con recurrencia de la miopatía al recaer la neoplasia13,18,27. Sin embargo, los síndromes paraneoplásicos suelen asociarse con tipos histológicos específicos de cáncer, lo que no sucede con la DM/PM, en la que la asociación es diversa. Una excepción puede ser el carcinoma nasofaríngeo, que se asocia en forma significativa con la DM/PM en la población asiática13.
Relación temporal. En general, el período de riesgo de presentación de la neoplasia es máximo en el período de 1 año alrededor de la aparición de la miopatía (con una coincidencia de hasta el 80% (riesgo relativo [RR]: 26×10−6)6,9. Algunos autores han sugerido que en estas cifras puede existir un sesgo por una mayor evaluación dirigida; sin embargo, aun en los estudios en los que se han eliminado los casos diagnosticados durante este período, se ha mantenido un RR de cáncer mayor (2,3×10−6) en los pacientes con DM/PM comparados con la población general9. Al paso del tiempo, el RR de cáncer disminuye y, aunque no llega a normalizarse, muchos autores sugieren que el escrutinio y la vigilancia por la aparición de una neoplasia en los pacientes con miopatía inflamatoria está indicado durante un período de 3–5 años18,19.
Evaluación diagnóstica. Una de las principales controversias respecto a la asociación entre cáncer y miopatía consiste en la magnitud y la dirección de la evaluación que debe realizarse para investigar la posibilidad de neoplasia3,30. En general, los expertos consideran que la evaluación debe comenzar con una historia clínica y un examen físico cuidadosos y una evaluación de laboratorio y gabinete estándar, como la que se solicitaría para el escrutinio de neoplasia en una persona sana de la misma edad, sexo y raza. Por supuesto, cualquier alteración encontrada debe evaluarse en profundidad3, y en la población asiática se justifica una exploración cuidadosa y quizá invasora de cabeza y cuello por el riesgo de carcinoma nasofaríngeo13,14. También se ha sugerido una evaluación más agresiva ante la posibilidad de cáncer de ovario12.
En general, esta evaluación debe realizarse periódicamente durante los primeros 3 años posteriores al diagnóstico de la miopatía y en los pacientes con manifestaciones clínicas que sugieren mayor riesgo (ver antes).
Aún debe definirse si el perfil de autoanticuerpos, específicamente la positividad de anti-155/140kDa será un marcador serológico potencial de MAC25,26. Chinoy et al evaluaron este aspecto en un estudio reciente, encontrando que la combinación de un panel de rutina de AEM negativo con anti-155kDa positivo tenía alta sensibilidad para MAC y sugieren que estos resultados pueden ayudar a los clínicos a detectar a los pacientes con mayor riesgo de desarrollar una neoplasia22.
Algunos estudios han demostrado que los antígenos tumorales (antígeno carcinoembrionario, CA-125, CA 19-9 y antígeno prostático específico) son útiles como marcadores de MAC, tanto para el diagnóstico como para la vigilancia posterior de las neoplasias detectadas11,20,31.
Pronóstico. En los estudios de supervivencia a largo plazo de pacientes con miopatía inflamatoria es claro que, dentro de los diferentes subtipos, el grupo asociado a neoplasias tiene peor pronóstico y mayor mortalidad4,19,32,33. En los reportes que evalúan el pronóstico de las miopatías en general, se ha demostrado que entre las causas de muerte se encuentran, en primer lugar, las complicaciones pulmonares y cardíacas y, posteriormente, las neoplasias32–34; y no hay duda de que de todos los factores de mal pronóstico en las miopatías inflamatorias, la ocurrencia de neoplasia es uno de los de mayor peso19,33.
La miopatía en los pacientes con cáncer parece más resistente al tratamiento con esteroides y citotóxicos, y en realidad su evolución depende más del curso de la neoplasia. El tratamiento radical del cáncer suele causar regresión parcial o temporal de la DM/PM, mientras que la falla del tratamiento antineoplásico o la recaída suele asociarse con persistencia de la miopatía18,19,27. Es interesante mencionar que en la mayoría de los estudios que evalúan el estadio del cáncer en el momento del diagnóstico en los pacientes con miopatía, coinciden en que las neoplasias casi siempre se detectan en fases avanzadas12,13,35, y esto ha sido válido para prácticamente todos los tipos de neoplasias, en especial de mama, ovario y cáncer de cabeza y cuello. Aunque estudios previos han reportado supervivencias de sólo el 10% en los pacientes con MAC, en el estudio realizado por Dankó et al ésta fue del 71% a los 10 años, y en el reporte de Pony et al la supervivencia fue similar (el 61,8% a los 5 años)15,32,35. Si consideramos que la supervivencia global en las miopatías inflamatorias a 5 y a 10 años es de alrededor del 90%, es claro que el subgrupo de pacientes con MAC tiene el peor pronóstico.