Identificar la relación entre los niveles séricos de inmunoglobulinas, los componentes 3 y 4 del complemento, la presencia del alelo HLA-B27 y el diagnóstico de espondiloartropatía en pacientes con uveítis anterior no infecciosa.
Materiales y métodosSe incluyeron 197 pacientes con diagnóstico de uveítis anterior no infecciosa. Se determinaron las concentraciones de inmunoglobulinas séricas y proteínas C3 y C4 del complemento mediante turbidimetría. Se recogieron los antecedentes personales de sospecha de inmunodeficiencia, complicaciones oftalmológicas, de artralgias, antecedentes familiares de espondiloartropatías y la presencia del alelo HLA-B27.
ResultadosLos antecedentes familiares de espondiloartropatías, artralgias axiales y complicaciones oftalmológicas fueron más frecuentes en los pacientes positivos a HLA-B27 (p=0,0005, p≤0,0001 y p≤0,0001, respectivamente) y en aquellos con diagnóstico de espondiloartropatías (p≤0,0001, p≤0,0001 y p≤0,0001, respectivamente). Los antecedentes personales de sospecha de inmunodeficiencia, sepsis recurrentes y alteraciones gastrointestinales, se asociaron a la presencia del alelo HLA-B27 (p≤0,0001 y p=0,0240, respectivamente) y al diagnóstico de espondiloartropatía (p=0,0492 y p=0,0017, respectivamente). Se observó disminución de las IgG (χ2=18,5; OR 5,03; IC 95% 2,32-10,89; p=0,0001) e IgM (OR 7,13; IC 95% 1,40-36,4; p=0,0128) en pacientes positivos para el alelo HLA-B27 y en aquellos con diagnóstico de espondiloartropatías (p=0,0364 y p=0,0028, respectivamente). La disminución de las proteínas C3 (OR 4,82; IC 95% 1,35-17,11; p=0,0328) y C4 (OR 9,09; IC 95% 2,13-38,88; p=0,0074) se asoció al diagnóstico de espondiloartropatías.
ConclusionesLos pacientes con uveítis anterior no infecciosa, positivos para el alelo HLA-B27 y con diagnóstico de espondiloartropatías tienen alteraciones de los niveles séricos de inmunoglobulinas y los componentes 3 y 4 del complemento, las cuales pudieran contribuir a la perpetuación y peor curso clínico de esta enfermedad.
To identify the relationship between serum immunoglobulin levels, complement components 3 and 4, the presence of the HLA-B27 allele and diagnosis of spondyloarthropathies in patients with non-infectious anterior uveitis.
Materials and methodsThe participants were 197 patients with a non-infectious anterior uveitis. The concentrations of serum immunoglobulins, and C3 and C4 proteins of the complement were determined by turbidimetry. The personal history of suspected immunodeficiency, ophthalmological complications, arthralgia, family history of spondyloarthropathies and the presence of the HLA-B27 allele were collected.
ResultsA family history of spondyloarthropathy, axial arthralgias, and ophthalmological complications were more frequent in HLA-B27 positive patients (P=.0005, P≤.0001, and P≤.0001, respectively) and in patients with spondyloarthropathy diagnoses (P≤.0001, P≤.0001, and P≤.0001, respectively). A personal history of recurrent sepsis, and gastrointestinal abnormalities was associated with the presence of the HLA-B27 allele (P≤.0001, and P=.0240, respectively) and with the diagnosis of spondyloarthropathy (P=.0492, and P=.0017, respectively). IgG decrease was observed (χ2=18.5, OR 5.03, 95% CI 2.32-10.89; P=.0001) and IgM (OR 7.13, 95% CI 1.40-36.4; P=.0128) in patients positive for the HLA-B27 allele and in patients with a diagnosis of spondyloarthropathies (P=.0364 and P=.0028, respectively). The decrease of C3 proteins (OR 4.82; CI 95% 1.35-17.11; P=.0328) and C4 (OR 9.09; CI 95% 2.13-38.88; P=.0074) were associated with a spondyloarthropathies diagnosis.
ConclusionsPatients with non-infectious anterior uveitis, positive for the HLA-B27 allele and diagnosed with spondyloarthropathies have alterations in serum immunoglobulin levels and complement components 3 and 4, which could contribute to the perpetuation and worse clinical course of this disease.
La uveítis anterior es un grupo de enfermedades oculares inflamatorias heterogéneas con fenotipos complejos, que afecta fundamentalmente al tracto uveal y es la quinta causa de ceguera a nivel mundial1,2. En Cuba, esta enfermedad está considerada entre las primeras causas de demanda de atención en las consultas oftalmológicas3.
Las espondiloartropatías (EspA) son afecciones reumáticas inflamatorias crónicas que comparten múltiples características clínicas. Estas incluyen la espondilitis anquilosante (EA), la enfermedad inflamatoria del intestino, la artritis psoriásica, la artritis reactiva, la EspA juvenil y la indiferenciada1,2.
Las EspA se asocian a los genes del complejo mayor de histocompatibilidad, en particular, a la presencia del alelo antígeno leucocitario humano B27 (HLA-B27, del inglés human leukocyte antigen-B27)3–5. La uveítis es considerada la manifestación extraarticular más frecuente de las EspA y algunos autores consideran que la uveítis anterior no infecciosa (UANI) está asociada al alelo HLA-B27 dentro del grupo de las EspA5.
Se describen numerosas hipótesis que relacionan procesos infecciosos y otras alteraciones de la respuesta inmune con el desencadenamiento y la perpetuación de enfermedades autoinmunes y autoinflamatorias, dentro de las cuales se incluyen la UANI y las EspA, sobre todo cuando coexiste positividad del alelo HLA-B271,2,4,6.
Este trabajo tuvo como objetivo identificar la relación entre los niveles séricos de inmunoglobulinas, los componentes 3 (C3) y 4 (C4) del complemento, la presencia del alelo HLA-B27 y el diagnóstico de EspA en pacientes con UANI.
Materiales y métodosSe llevó a cabo un estudio analítico observacional transversal en el periodo comprendido de enero de 2013 a marzo de 2018.
PacientesSe incluyeron los pacientes con diagnóstico de UANI (197) procedentes del Instituto Cubano de Oftalmología, de ambos sexos, con edad igual o mayor de 18 años y que no siguieran tratamiento inmunosupresor en el momento de la inclusión. Los pacientes fueron evaluados por médicos especialistas en oftalmología e inmunología. El diagnóstico de EspA fue obtenido de las historias clínicas de los pacientes y realizado por un reumatólogo según los criterios del grupo Assessment of SpondyloArthritis International Society, e incluyó la EA, la artritis psoriásica, la enfermedad inflamatoria intestinal asociada a EspA, la artritis reactiva y la EspA indiferenciada7,8. Esta investigación fue aprobada por el comité de ética del Centro Nacional de Genética Médica de Cuba. Todos los participantes en la investigación firmaron el consentimiento informado. Se tuvieron en cuenta los principios éticos enunciados en la Declaración de Helsinki de la Asociación Médica Mundial, para las investigaciones médicas en seres humanos.
VariablesSe analizaron variables demográficas como el sexo y la edad. Se recogieron los antecedentes de artralgia axial (columna cervical, dorsal y articulación sacroilíaca) y periférica (miembros inferiores y manos9), los antecedentes familiares de EspA7 y la presencia del alelo HLA-B27. Las complicaciones oftalmológicas fueron obtenidas de las historias clínicas oftalmológicas e incluyeron sinequias posteriores, vasculitis, glaucoma, edema macular, hipertensión ocular, cataratas, desprendimiento de retina, queratitis, hipopion, esclerouveítis y disminución de la agudeza1,10. La agudeza visual con corrección mediante la cartilla de LogMAR3 se definió disminuida según lo establecido por la Standardization of Uveitis Nomenclature-SUN Working Group Standardization of Uveitis Nomenclature for Reporting Clinical Data12,13.
Se recogieron los antecedentes personales de sospecha de inmunodeficiencia14–16 (material suplementario, anexo 1). Se determinaron los niveles séricos de IgG, IgA e IgM y la cuantificación de los componentes C3 y C4 del complemento sérico mediante turbidimetría en un analizador químico (ELIMAT, Italia).
Se realizó la extracción del ácido desoxirribonucleico mediante la técnica de precipitación salina a partir de 10ml de sangre humana, y el genotipado molecular del alelo HLA-B27 mediante la técnica de la reacción en cadena de la polimerasa (PTC-200; MJ Research).
Análisis estadísticoLas variables cualitativas se expresaron como frecuencias y porcentajes. La normalidad de las variables se verificó mediante la prueba de Kolmogorov-Smirnov. Las variables con distribución diferente a la normal se expresaron como mediana y recorridos intercuartiles. La asociación entre variables del estudio con el alelo HLA-B27 y el diagnóstico de EspA se identificó mediante el estadígrafo Chi-cuadrado, la razón de disparidades (OR, del inglés odds ratio) como medida de asociación y su intervalo de confianza al 95%. Se realizó la comparación de las variables cuantitativas entre grupos con la U de Mann-Whitney. El análisis estadístico de los resultados se realizó con los programas Statistica 7.0 (Statistica Inc., Nueva York, Estados Unidos) y EPIDAT versión 3.1 (OPS, España). Se empleó un nivel de significación estadística de 0,05.
ResultadosVariables demográficas y clínicasDel total de los pacientes con UANI, el 31,5% fueron HLA-B27 positivos, y de estos, solo el 30,6% tenían diagnósticos de EspA. El diagnóstico de EspA se encontró en el 15,7% de todos los pacientes con UANI (tabla 1). Las EspA presentes en los pacientes con UANI fueron la EA (58,1%), la artritis psoriásica (16,1%), la enfermedad inflamatoria intestinal (12,9%) y el síndrome de Reiter (12,9%). El 61,3% de los pacientes con EspA fueron positivos al alelo HLA-B27. El diagnóstico de EspA se asoció a la presencia del alelo HLA-B27 (OR 4,53; IC 95% 2,0-10,1; p=0,0001).
Variables demográficas, clínicas, niveles séricos de inmunoglobulinas y de los componentes 3 y 4 del complemento según la presencia del alelo HLA-B27 y el diagnóstico de espondiloartropatías en pacientes con uveítis anterior no infecciosa
| Variables | Uveítis(n=197) | Uveítis HLA-B27 +(n=62) | EspA(n=31) | ||
|---|---|---|---|---|---|
| n (%) | n (%) | OR (IC 95%); p1 | n (%) | OR (IC 95%); p1 | |
| Sexo masculino | 81 (41,1) | 29 (46,8) | 1,4 (0,8-2,6); 0,2741 | 19 (61,3) | 4,5 (2,1-10,1); 0,0001* |
| Edad (años), mediana (RIC); p2 | 46 (34-54) | 45 (34-52); 0,9324 | 48 (37-54); 0,2731 | ||
| AF de SpAa | 15 (7,6) | 10 (16,1) | 6,9 (2,0-19,1); 0,0005* | 8 (25,8) | 7,9 (2,6-23,8); <0,0001* |
| Complicacionesb | 62 (31,5) | 55 (88,7) | 16,2 (6,8-38,6); <0,0001* | 25 (80,6) | 2,4 (8,4-60,0); 0,0000* |
| Artralgia axial | 55 (27,9) | 38 (69,1) | 11,0 (5,3-22,6); <0,0001* | 14 (82,3) | 45,6 (5,3-174,6); <0,0001* |
| Artralgia periférica | 32 (12,2) | 27 (84,4) | 20,1 (7,2-55,9); <0,0001* | 2 (11,8) | 0,7 (0,1-3,2); 1,0000 |
| Sepsis recurrentes | 71 (36,0) | 38 (61,2) | 4,9 (2,6-9,3); <0,0001* | 16 (51,6) | 2,1 (1,0-4,7); 0,0492* |
| Alteraciones GI | 61 (31,0) | 26 (41,9) | 2,1 (1,1-3,9); 0,0240* | 17 (54,8) | 3,4 (1,5-7,3); 0,0017* |
| Alergias | 54 (27,4) | 22 (35,4) | 1,8 (0,9-3,4); 0,0852 | 8 (25,8) | 0,9 (0,4-2,3); 0,8273 |
| Disminución IgG | 37 (18,8) | 22 (35,5) | 5,0 (2,2-10,9); 0,0010* | 10 (27,0) | 2,4 (1,0-5,8); 0,0364* |
| Aumento IgG | 5 (2,5) | 0 | NC | 1 (32,2) | 1,3 (0,1-12,5); 0,5793 |
| Disminución IgA | 2 (1,0) | 1 (1,6) | 2,2 (0,1-35,7); 0,5315 | 1 (50,0) | 5,5 (0,3-90,3); 0,2906 |
| Aumento IgA | 12 (6,1) | 3 (4,8) | 0,7 (0,19-2,73); 0,7562 | 1 (8,3) | 0,5 (0,1-3,8); 0,7507 |
| Disminución IgM | 8 (4,1) | 6 (9,6) | 7,1 (1,40-36,4); 0,0128* | 5 (17,2) | 10,4 (2,3-46,4); 0,0028* |
| Aumento IgM | 5 (2,5) | 1 (1,6) | 0,5 (0,06-4,90); 1,0000 | 0 | NC |
| Disminución C3 | 7 (3,5) | 4 (6,45) | 3,0 (0,66-13,99); 0,2094 | 4 (14,1) | 4,82 (1,3-17,1); 0,0328* |
| Aumento C3 | 78 (39,6) | 25 (40,3) | 3,0 (0,7-134,0); 0,2094 | 10 (32,3) | 2,20 (0,9-5,1); 0,0595 |
| Disminución C4 | 5 (2,5) | 3 (4,8) | 3,4 (0,55-20,8); 0,1804 | 4 (14,1) | 9,1 (2,1-38,9); 0,0074* |
| Aumento C4 | 34 (17,3) | 11 (17,8) | 1,0 (0,4-2,2); 1,000 | 6 (19,3) | 1,9 (0,6-5,6); 0,2524 |
AF: antecedentes familiares; C: proteína sérica del complemento; EspA: espondiloartropatías; GI: gastrointestinales; HLA-B27: antígeno leucocitario humano B27; IC 95%: intervalo de confianza al 95%; Ig: inmunoglobulina; NC: no calculado por frecuencia igual a cero; OR: razón de probabilidad; RIC: rango intercuartílico; p1: probabilidad de la asociación mediante χ2; p2: significación estadística entre grupos mediante análisis de Mann-Whitney.
Algún familiar con diagnóstico de EspA10: espondilitis anquilosante, artritis psoriásica, enfermedad inflamatoria intestinal asociada a EspA, artritis reactiva y EspA indiferenciada.
Aunque existió un predominio del sexo femenino en los pacientes con uveítis (53,2%), en aquellos con EspA predominó el sexo masculino y se asoció al diagnóstico de EspA (p=0,0001) (tabla 1).
El antecedente familiar de EspA se asoció con la presencia del alelo HLA-B27 (p=0,0005) en los pacientes con UANI y con el diagnóstico de EspA (p<0,0001) (tabla 1).
En los pacientes con UANI predominaron las artralgias axiales, las cuales se asociaron a la presencia de HLA-B27 (p<0,0001), y al diagnóstico de EspA (p<0,0001) (tabla 1).
Las complicaciones oftalmológicas se asociaron a la presencia del alelo de HLA-B27 (p<0,0001) y al diagnóstico de EspA (p<0,0001) (tabla 1). Las complicaciones encontradas incluyeron: sinequias posteriores, vasculitis, glaucoma, edema macular, hipertensión ocular, cataratas, desprendimiento de retina, queratitis, hipopion y esclerouveítis.
Antecedentes personales de sospecha de inmunodeficienciaLas sepsis recurrentes (36,0%) fueron los antecedentes personales de sospecha de inmunodeficiencia más frecuentes que se observaron en los pacientes con UANI. Las infecciones respiratorias recurrentes (73,2%) y las diarreas de etiología infecciosa (14,1%) fueron los de mayor frecuencia en ese grupo. Las sepsis recurrentes se asociaron a la presencia del alelo HLA-B27 (p<0,0001) y a las EspA (p=0,0492) (tabla 1).
En los pacientes con UANI, las alteraciones gastrointestinales (GI) fueron la gastritis crónica (73,8%), la úlcera péptica duodenal o gástrica (27,9%), las diarreas crónicas recurrentes de etiología no precisada (16,4%) y la enfermedad inflamatoria intestinal (4,9%). Estas alteraciones se asociaron a la presencia del alelo HLA-B27 (p=0,0240) y a las EspA (p=0,0017) (tabla 1).
Las alergias estuvieron representadas por el asma bronquial (75,9%), la rinitis alérgica (38,9%) y la dermatitis atópica (10%). Las alergias no se asociaron a la presencia del alelo HLA-B27 (p=0,0852) ni al diagnóstico de EspA (p=0,8273) (tabla 1).
Alteraciones de la respuesta inmune humoralLa disminución de IgG (18,8%) fue la alteración más frecuente de las relativas a las inmunoglobulinas en los pacientes con UANI y se asoció con la presencia del alelo HLA-B27 (p=0,0010), con el diagnóstico de EspA (p=0,0364) (tabla 1), con las complicaciones oftálmicas (p=0,0002), con las sepsis recurrentes (p=0,0001) y con las alteraciones GI (p<0,0001) (tabla 2).
Asociación de la disminución de IgG e IgM con el sexo, las complicaciones oftálmicas, las artralgias y los antecedentes personales de sospecha de inmunodeficiencia en pacientes con uveítis anterior no infecciosa
| Disminución IgG (n=37) | Disminución IgM (n=8) | ||||
|---|---|---|---|---|---|
| n (%) | OR (IC 95%); p1 | Mediana (RIC); p2 | n (%) | OR (IC 95%); p1 | |
| Sexo masculino | 16 (43,2) | 1,1 (0,5-2,3); 0,7705 | - | 5 (62,5) | 2,5 (0,6-10,7); 0,2772 |
| Edad (años), mediana (RIC); p2 | 45,6 (36-54); 0,3894 | 37,5 (31,5-54); 0,6099 | |||
| Complicacionesa | 21 (56,8) | 3,8 (1,8-8,0); 0,0002* | - | 5 (62,5) | 3,9 (0,9-16,7); 0,1116 |
| Artralgias | 23 (62,2) | 1,9 (0,9-3,9); 0,0937 | - | 5 (62,5) | 1,7 (0,4-7,4); 0,0037* |
| Sepsis recurrentes | 17 (64,9) | 4,4 (2,1-10,0); 0,0001* | - | 7 (87,5) | 2,3 (0,6-9,6); 0,2562 |
| Alteraciones GI | 31 (83,8) | 22,4 (8,6-58,5); <0,0001* | - | 4 (50,0) | 2,3 (0,6-9,6); 0,2562 |
| Alergias | 13 (35,1) | 1,6 (0,7-3,4); 0,2425 | - | 3 (37,5) | 1,9 (0,4-8,1); 0,4140 |
GI: gastrointestinales; IC 95%: intervalo de confianza al 95%; Ig: inmunoglobulina; OR: razón de probabilidad; p1: significación estadística para la asociación mediante χ2; p2: significación estadística entre grupos mediante análisis de Mann-Whitney; RIC: rango intercuartílico.
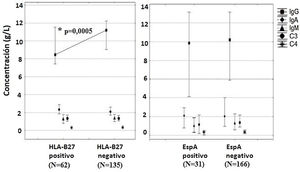
En los pacientes con UANI HLA-B27 positivos se observaron valores séricos inferiores de IgG (U=1.979,5; p=0,0005), con una mediana de 8,4g/l (7,4-11,5), mientras que en los pacientes con UANI HLA-B27 negativos la mediana fue de 11,2g/l (9,0-12,2) (fig. 1).
Concentración sérica de inmunoglobulinas y proteínas del complemento según la presencia del alelo HLA-B27 y el diagnóstico de espondiloartropatía.
C: complemento; EspA: espondiloartropatía; HLA-B27: antígeno leucocitario humano B27; Ig: inmunoglobulina.
* Diferencias significativas mediante la prueba U de Mann-Whitney entre los pacientes positivos y negativos de HLA-B27 (p<0,05).
La disminución de IgM se asoció con la presencia del alelo HLA-B27 (p=0,0028), con el diagnóstico de EspA (p<0,0001) y con la presencia de artralgias (p=0,0037) (tabla 1).
La disminución de al menos una de las inmunoglobulinas estudiadas se presentó en 42 pacientes (21,3%) (tabla 3).
Alteraciones de inmunoglobulinas por pacientes con diagnóstico de uveítis anterior no infecciosa
| Disminución | Aumento | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IgG | IgM | IgA | IgG IgM | IgG IgA | IgA IgM | Total | IgG | IgM | IgA | IgG IgM | IgG IgA | IgA IgM | Total | |
| N.o de pacientes | 33 | 5 | - | 3 | 1 | - | 42 | 3 | 1 | 10 | 2 | - | 2 | 18 |
| Porcentaje | 16,8 | 2,5 | - | 1,5 | 0,5 | - | 21,3 | 1,5 | 0,5 | 5,1 | 1,0 | - | 1,0 | 9,1 |
Ig: inmunoglobulinas.
De las alteraciones del complemento en los pacientes con UANI predominó el aumento de C3 (39,6%). No obstante, existió asociación de la disminución de C3 (OR 4,82; IC 95% 1,35-17,11; p=0,0328) y de la disminución de C4 (OR 9,09; IC 95% 2,13-38,88; p=0,0074) con el diagnóstico de EspA. No se observó asociación del aumento de C3 y C4 con las variables analizadas en el estudio (tablas 1 y 4).
Asociación de la disminución de C3 y C4 con el sexo, las complicaciones oftalmológicas, las artralgias y los antecedentes personales de sospecha de inmunodeficiencia en pacientes con uveítis anterior no infecciosa
| Disminución C3 | Aumento C3 | Disminución C4 | Aumento C4 | |||||
|---|---|---|---|---|---|---|---|---|
| n (%) | OR (IC); p1 | n (%) | OR (IC); p1 | n (%) | OR (IC); p1 | n (%) | OR (IC); p1 | |
| Sexo masculino | 2 (28,6) | 0,6 (0,1-3,0); 0,7022 | 40 (51,3) | 2,0 (1,1-3,6); 0,0189* | 4 (80,0) | 6,0 (0,6-54,5); 0,1613 | 13 (38,2) | 0,9 (0,4-1,8); 0,7074 |
| Edad (años), mediana (RIC); p2 | 51 (32-62); 0,4873 | 44 (34-53); 0,2844 | 56 (51-62); 0,1224 | 48 (34-52); 0,5166 | ||||
| Complicacionesa | 4 (57,1) | 3,1 (0,7-14,2); 0,2073 | 25 (32,0) | 1,1 (0,6-2,08); 0,8266 | 2 (40) | 1,5 (0,2-9,2); 0,6464 | 14 (41,2) | 1,7 (0,8-3,6); 0,1659 |
| Artralgias | 3 (42,9) | 0,7 (0,2-3,4); 1,0000 | 39 (50,0) | 1,0 (0,6-1,8); 0,9540 | 3 (60,0) | 1,5 (0,2-9,3); 0,6827 | 17 (50,0) | 1,0 (0,5-2,1); 0,9740 |
| Sepsis recurrentes | 2 (28,6) | 0,7 (0,1-3,7); 1,0000 | 30 (38,5) | 1,2 (0,7-2,1); 0,5667 | 3 (60,0) | 2,7 (0,4-16,8); 0,3532 | 14 (41,2) | 1,3 (0,6-2,8); 0,4929 |
| Alteraciones GI | 3 (42,9) | 1,7 (0,4-7,9); 0,6789 | 22 (28,2) | 0,9 (0,4-1,5); 0,4977 | 2 (40,0) | 1,5 (0,2-9,1); 0,6489 | 8 (23,5) | 0,6 (0,3-1,5); 0,3026 |
| Alergias | 2 (28,6) | 1,2 (0,2-6,4); 1,0000 | 20 (25,5) | 1,1 (0,6-2,0); 0,8469 | 3 (60,0) | 4,76 (0,8-29,3); 0,0987 | 11 (32,3) | 1,6 (0,7-3,4); 0,2845 |
C: proteína sérica del complemento; GI: gastrointestinales; IC 95%: intervalo de confianza al 95%; OR: razón de probabilidad; p1: significación estadística para la asociación mediante χ2; p2: significación estadística entre grupos mediante análisis de Mann-Whitney; RIC: rango intercuartílico.
La uveítis anterior representa un problema de salud por ser una de las causas más frecuentes de ceguera a nivel mundial4–6.
Alelo HLA-B27 en los pacientes con UANI y EspAEl porcentaje de pacientes positivos de HLA-B27 con UANI se encuentra dentro del rango descrito por otros autores, el cual puede variar del 12 al 88%, en dependencia de la zona geográfica y la población de estudio1,2,14.
La expresión del alelo HLA-B27 no es suficiente, por sí sola, para presentar UANI o EspA4. Sin embargo, varios planteamientos tratan de explicar la relación entre el alelo estudiado y la UANI. La hipótesis del mimetismo molecular y del péptido artritogénico considera que estas enfermedades son autoinmunes. La hipótesis del plegamiento incorrecto de las moléculas HLA-B27 y del depósito de cadenas β2 microglobulinas sobre tejidos sinoviales las incluye en el espectro de enfermedades autoinflamatorias4,17.
La hipótesis de un plegamiento anormal de las moléculas HLA-B27 se basa en la habilidad de las cadenas pesadas de estas moléculas de formar homodímeros estables, los cuales se retienen y acumulan en el retículo endoplásmico, lo que constituye una respuesta de estrés e inflamación crónica4,17.
En Cuba el diagnóstico de EspA en pacientes con UANI se ha descrito en un rango del 10 al 38%, similar al observado en otros estudios4,5.
El porcentaje de pacientes con diagnóstico de EspA y presencia del alelo estudiado fue bajo comparado con los encontrados en otros estudios, los cuales se encuentran entre un 40 y un 90%. La UANI puede estar presente al diagnóstico de la EspA, ser una complicación en el curso de esta enfermedad o preceder a las manifestaciones clínicas de las EspA5, lo que podría explicar la baja prevalencia de EspA en los pacientes con UANI positivos para HLA-B27 en este estudio. Otros autores han informado que la EspA no es la más prevalente de las etiologías en los pacientes con UANI18,19.
Por otra parte, muchos pacientes con UANI positivos para HLA-B27 que cumplen con los criterios clínicos y radiológicos de EspA no son diagnosticados5,20..
La UANI asociada a la presencia de este alelo es un requisito para sospechar la existencia de EspA no diagnosticada durante largos periodos de tiempo, la cual tiene un peor pronóstico5,21.
El mayor número de pacientes con diagnóstico de EspA fueron HLA-B27 positivos. La prevalencia de EspA en pacientes con UANI HLA-B27 positivo es superior al 50% en la mayor parte de los estudios1,2,4,6.
La presencia del alelo HLA-B27 se ha asociado con mayor frecuencia a la EA, como ocurrió en esta investigación1,4,5.
Características demográficas y clínicasEstudios precedentes evidencian una preponderancia del sexo femenino en los pacientes con UANI1.
Otros autores también han informado una preponderancia del sexo masculino en los pacientes con EspA2,5. La manifestación extraarticular más frecuente en pacientes con EspA del sexo masculino es la UANI, mientras que en el sexo femenino lo son la psoriasis y la enfermedad inflamatoria intestinal. Se postula que en las mujeres esto contribuye, en muchas ocasiones, a un diagnóstico demorado de EspA y a una preponderancia del sexo masculino en esta enfermedad, que también se explica porque los hombres tienen afectaciones radiológicas más severas. Además, se conoce que existen diferencias entre ambos sexos en la respuesta inmunológica, hormonal y genética22.
Estudios previos informaron medianas de la edad similares a las de esta investigación (6). La UANI ocurre en personas laboralmente activas2,3.
Tanto los antecedentes familiares de EspA como los antecedentes personales de artralgias constituyen criterios diagnósticos de EspA7,8, lo cual concuerda con la asociación de estos antecedentes tanto con el diagnóstico de EspA como con la presencia del alelo HLA-B27 en este estudio.
Otros autores encontraron un predominio de la disminución de la agudeza visual en pacientes con UANI y HLA-B27 positivos, como ocurrió en esta investigación10,23.
Antecedentes personales de sospecha de inmunodeficienciaUno de los hallazgos más importantes de esta investigación fue la relación de los antecedentes personales de sospecha de inmunodeficiencia de sepsis recurrentes y alteraciones GI con la presencia del alelo HLA-B27 y el diagnóstico de EspA.
Se han asociado antecedentes previos de infecciones o pobre higiene oral con el desarrollo de UANI, hecho que ha permitido soportar el modelo de infecciones sistémicas como potencial disparador de esta enfermedad en humanos1,24.
Un estudio de análisis de genes claves y de vías de señalización inflamatoria encontró que en los pacientes con UANI y HLA-B27 positivos existían alteraciones en las vías de señalización metabólica, de quimocinas, así como en la interacción de citosina con sus receptores y de procesos involucrados en respuestas frente a infecciones2,6.
Por otra parte, la hipótesis del mimetismo molecular y del péptido artritogénico propone que la hendidura de unión del péptido de la molécula HLA-B27 puede presentar péptidos microbianos similares a ciertos antígenos propios, lo que permite que la respuesta inmune de los linfocitos T CD8 (CD, del inglés cluster of differentiation) positivos restringidos a las moléculas HLA-B27 contra antígenos microbianos reaccionen con péptidos artritogénicos y desencadenen una inflamación crónica, característica de esta enfermedad. Estas células T CD8+ activadas inducen inflamación como resultado de una reactividad cruzada ente antígenos exógenos y péptidos localizados en el ojo1,7.
Se postula que estímulos inflamatorios como los procesos infecciosos son capaces de provocar la rotura de la barrera sangre-retina y facilitar la migración de células T, las cuales reconocen antígenos propios (antígenos retinianos) como extraños o reaccionan con ellos por mimetismo molecular y desencadenan la uveítis2,4. Varios autores consideran importante el rol de la infección crónica por el Helicobacter pylori en enfermedades oculares como el glaucoma, el linfoma asociado al tejido mucoso, la blefaritis, la coriorretinitis central serosa y la uveítis anterior25.
A la frecuencia aumentada de las gastritis crónicas y la úlcera péptica (duodenal o gástrica) encontrada en el estudio, podría asociarse la infección por Helicobacter pylori y la giardiasis. Pacientes con defectos en la respuesta de anticuerpos tienen una mayor predisposición a enfermedades autoinmunes o autoinflamatorias como la uveítis15. Otros investigadores observaron infección por Helicobacter pylori en pacientes con uveítis anterior e hipertensión ocular6,8.
Las diarreas crónicas de etiología no precisada y las aftas recurrentes pudieran ser parte del cuadro clínico de alguna enfermedad inflamatoria intestinal no diagnosticada o instaurada en el momento del estudio5. Además, un pequeño grupo de pacientes presentó como diagnóstico enfermedad inflamatoria intestinal. Estos elementos pueden contribuir a la asociación de alteraciones GI con la presencia del alelo estudiado y el diagnóstico de EspA.
Aunque las alergias no se asociaron a alteraciones de la respuesta inmune humoral, estas predisponen a las infecciones recurrentes por propiciar en un tejido inflamado la invasión por agentes infecciosos. Las inmunodeficiencias también predisponen a procesos de hipersensibilidades o alergias, por alteraciones de las respuestas inmunitarias14,15.
Alteraciones de la respuesta inmune humoralOtros resultados importantes de esta investigación fueron la asociación entre la disminución de IgG e IgM y la presencia de HLA-B27, así como entre la disminución de IgG e IgM y el diagnóstico de EspA.
Varios autores han publicado que una de las causas de uveítis anterior es la presencia de inmunodeficiencia variable común, que se caracteriza principalmente por la disminución de IgG6,15. Por otra parte, los pacientes con alteraciones de la respuesta inmune por inmunodeficiencias tienen una mayor predisposición a desarrollar procesos autoinmunes y autoinflamatorios3,15,26,27.
No obstante, se ha encontrado que otros autores han observado hipergammaglobulinemia y aumento de inmunocomplejos circulantes en pacientes con uveítis, sin evidencias de su relación con la evolución clínica ni con la patogenia de la enfermedad28. También se encontró en el estudio un aumento de algunas inmunoglobulinas, como la IgA, que pudiera corresponderse con una respuesta a las infecciones recurrentes de algunos pacientes. La asociación de disminución de IgG con la UANI HLA-B27 positiva, la EspA, las complicaciones, las sepsis recurrentes y las alteraciones GI puede explicarse debido a que la disminución de inmunoglobulinas predispone a procesos infecciosos, que a su vez perpetúan y agravan los procesos inflamatorios y también predisponen a otras enfermedades autoinmunes y autoinflamatorias4,14,16,17.
Las EspA, al ser enfermedades autoinflamatorias o autoinmunes, pueden requerir tratamientos con inmunosupresores, los cuales pueden contribuir a la disminución de inmunoglobulinas15,16.
En esta investigación no fue posible establecer un diagnóstico definitivo de inmunodeficiencia primaria debido a que es necesaria la evaluación de la respuesta de anticuerpos frente a antígenos vacunales, la evaluación del número y la función de las células T y estudios de biología molecular (9). Esto constituyó una limitación del estudio. Un elemento a tener en cuenta para el diagnóstico de las inmunodeficiencias primarias es descartar la presencia de inmunodeficiencias secundarias, como las debidas a tratamientos inmunosupresores, los cuales son necesarios en ocasiones en las EspA y en algunos pacientes con UANI16.
Aunque es de destacar la asociación encontrada entre la disminución de las proteínas C3 y C4 séricas del complemento y el diagnóstico de EspA, es controversial el papel de las mismas en la UANI.
En un estudio del análisis genético de la proteína C3 del complemento no se encontró riesgo de susceptibilidad para la uveítis1,4. Sin embargo, se publicó que pacientes con EspA que presentaron una disminución de las proteínas del complemento y anticuerpos exhibieron una mayor complicación y un curso severo de la enfermedad, que puede ser explicado por los efectos de las infecciones recurrentes en estos pacientes. Los pacientes con defectos de estas proteínas exhiben la compleja interacción bidireccional entre las inmunodeficiencias y las enfermedades autoinmunes27.
ConclusionesLos pacientes con UANI, positivos al alelo HLA-B27 y con diagnóstico de EspA tienen alteraciones de los niveles séricos de inmunoglobulinas y de los componentes C3 y C4 del complemento, los cuales pudieran contribuir a la perpetuación y un peor curso clínico de esta enfermedad.
FinanciaciónEl presente trabajo ha sido financiado por el Ministerio de Salud Pública de Cuba.
Conflicto de interesesLas autoras declaran no tener ningún conflicto de intereses.