Identificar los factores asociados con la respuesta al tratamiento en pacientes con nefropatía lúpica.
Material y métodosSe analizó una cohorte retrospectiva de pacientes con lupus eritematoso sistémico (LES) y nefritis lúpica (NL) corroborada por biopsia, clasificada de acuerdo a la Organización Mundial de la Salud (OMS) de junio del 2001 a diciembre del 2008. Todos los pacientes recibieron terapia de inducción a la remisión y fueron seguidos al menos 2 años. Se correlacionaron variables clínicas y de laboratorio con potencial valor predictivo de respuesta terapéutica, a los 6, 12 y 24 meses.
ResultadosSe incluyó a 168 pacientes, 84% mujeres. La tasa de respuesta al tratamiento fue del 69,2% a los 6 meses, el 86,9% a los 12 meses y el 79,7% a los 2 años. En el análisis multivariado se encontró que la edad > 25 años en el momento del diagnóstico de la NL y la presencia de microhematuria fueron variables asociadas con buena respuesta al tratamiento de inducción a la remisión. A los 12 meses, una depuración de creatinina basal < 30ml/min se asoció a mala respuesta al tratamiento. Finalmente, a los 24 meses, el retraso en el tratamiento fue un factor predictor de mala respuesta y la presencia de una forma histológica proliferativa de NL y de C3 bajo se asociaron con buena respuesta al tratamiento.
ConclusionesExisten factores modificables con el tratamiento que pueden alterar la actividad inmunológica aberrante de la NF. Por ello, la intervención terapéutica intensa en los primeros 3 meses de inicio de la nefritis puede llevar a una respuesta favorable a los 2 años.
To identify prognostic factors associated with response to induction therapy in lupus nephritis (LN) according to the stage of treatment.
Material and methodsWe analyzed a retrospective cohort of patients of systemic lupus erythematosus (SLE) with biopsy-proven LN from January 2001 to December 2008. LN was classified according to WHO. All patients received induction therapy and had a minimum follow-up period of two years. We analyzed 18 clinical and laboratory variables that potentially have predictive value for response to therapy. We identified predictors of therapeutic response at 6, 12 and 24 months by univariate and multivariate analysis; odds ratios (OR) with confidence intervals (CI) 95% were also calculated.
ResultsWe reviewed the clinical records of 168 patients, 141 female (84%). The response rate was 69% at 6 months, 86.9% at 12 months and 79.7% at 24 months. Multivariate analysis found that > 25 years of age at diagnosis of LN and the presence of microhematuria were factors associated with good response to induction treatment. At 12 months, baseline creatinine clearance < 30ml/min was associated with a poor response to treatment. Finally at 24 months, delay in treatment was a predictor of poor response to treatment and the presence of a histological proliferative NL and low C3 were associated with good response to treatment.
ConclusionsThere are treatment-modifiable factors that can alter aberrant immunologic activity of NF. Therefore, intensive early treatment of lupus nephritis is associated with favorable response to two years.
El lupus eritematoso sistémico (LES) es una enfermedad crónica causada por una respuesta autoinmune aberrante, que por diversos mecanismos lleva a la pérdida de la autotolerancia causando inflamación y disfunción multiorgánica; las mujeres en edad fértil es el grupo más frecuentemente afectado1,2. El riñón está comúnmente involucrado en la enfermedad y del 60 al 80% de los pacientes desarrollarán alteraciones urinarias o de la función renal en algún momento de la evolución3. Los cambios patológicos en el riñón de pacientes con LES afectan a diversas estructuras, tales como glomérulos, túbulos, intersticio y vasos sanguíneos4. El pronóstico se relaciona con la clase de glomerulonefritis encontrada en la biopsia. La sobrevida renal se estima entre el 83 y el 92% a 5 años y del 74 al 84% a 10 años5-8.
Aproximadamente, del 5 al 15% de los pacientes desarrollan fallo renal terminal a 10 años9 que, junto con las infecciones y la enfermedad cardiovascular, son las principales causas de mortalidad. La muerte asociada a enfermedad renal ha sido reportada en un 5 al 10%10,11.
Diversos factores se han asociado a un pronóstico renal adverso en pacientes con LES, entre los que se incluyen factores demográficos12-15, clínicos, bioquímicos16-18, genéticos19,20, inmunológicos21, histopatológicos16 y síndrome antifosfolipídico22, pero ninguno por si solo parece ser determinante.
Entre los predictores de pobres resultados renales a corto plazo (6-24 meses), se han encontrado títulos elevados de anticuerpos contra ADN de doble cadena (anti-dsADN), complemento sérico bajo, edad de presentación (niños, adolescentes y ancianos), trombocitopenia e hipoalbuminemia. Histológicamente, los depósitos subendoteliales son el predictor más fuerte, ya que la persistencia en la cantidad de depósitos subendoteliales correlaciona con el deterioro de la función renal. Los factores asociados a pobres resultados a largo plazo son hipertensión, hematuria, tiempo de evolución de la enfermedad y falta de respuesta al tratamiento23.
El tratamiento constituye un verdadero desafío, ya que una adecuada intervención con el empleo de terapias actuales pueden mejorar el pronóstico, pero también de manera indirecta ensombrecerlo por los efectos secundarios que pueden llegar a desarrollarse. Existen pacientes que, a pesar de una adecuada intervención y cambios en las estrategias de tratamiento, no alcanzan la respuesta esperada. Por ello el objetivo del presente estudio fue identificar los factores potencialmente predictores de respuesta al tratamiento a corto plazo.
Material y métodosSe analizaron los expedientes clínicos de pacientes mayores de 18 años de edad, con diagnóstico de LES de acuerdo con los criterios del Colegio Americano de Reumatología de 1982 y 1997 con nefritis lúpica (NL) confirmada por biopsia renal, atendidos en un hospital de referencia de tercer nivel. La estrategia de búsqueda de los casos fue a través de los registros del servicio de Anatomía Patológica de las biopsias renales reportadas durante el periodo del 1 de enero del 2001 al 31 de diciembre del 2008. La NL fue clasificada de acuerdo a la Organización Mundial de la Salud (1982) y se registraron los índices histológicos de actividad y cronicidad.
De los expedientes clínicos, se obtuvieron las variables de estudio que incluyeron: edad; sexo; fecha de diagnóstico de LES; fecha de diagnóstico de la NL; tratamientos de inducción a la remisión y de mantenimiento administrados; retraso del tratamiento (> 3 meses); parámetros bioquímicos,—como creatinina sérica, sedimento urinario (leucocitos, eritrocitos, cilindros celulares), depuración de creatinina con cuantificación de proteínas en orina de 24 h, y variables inmunológicas, tales como anticuerpos antinucleares, anti-dsADN, C3, C4, anticuerpos anticardiolipina, IgG e IgM. Los datos se analizaron en el momento de la detección de la NL y a los 6, 12 y 24 meses de seguimiento.
Definición de respuesta renalPara su análisis los pacientes fueron clasificados como respondedores y no respondedores. Se consideró como respondedor cuando el paciente presentaba aumento de al menos el 25% de la tasa de filtración glomerular (TFG) (asumiendo que el valor basal era anormalmente bajo: < 75ml/min) o función renal normal (TFG > 90ml/min), una relación proteínas en orina/creatinina en orina < 0,2-2, y sedimento urinario inactivo (≤ 5 eritrocitos por campo, ≤ 5 leucocitos por campo y ausencia de cilindros celulares en el examen general de orina). Un paciente se consideró no respondedor si no había modificación en la TFG o presentaba disminución del 25% de la TFG estimada (fórmula de Cockcroft), presencia de enfermedad renal terminal, sedimento urinario activo (> 5 eritrocitos, > 5 leucocitos y/o ≥ 1 cilindro celular por campo)24.
Análisis estadísticoLas variables cuantitativas fueron expresadas en desviación estándar y las cualitativas en porcentajes. Se llevó a cabo un análisis bivariado de los potenciales factores predictores de respuesta mediante la prueba de la chi al cuadrado o de la t de Student cuando así se requirió. Posteriormente, se realizó un análisis multivariado mediante un modelo de regresión de riesgos proporcionales para evaluar las variables clínicas, bioquímicas, serológicas, histológicas y terapéuticas potencialmente predictoras de respuesta al tratamiento. Se calcularon las odds ratio (OR), con un intervalo de confianza del 95%, de las variables relacionadas con la respuesta terapéutica mediante el programa SPSS V.17 software. Una p<0,05 se consideró estadísticamente significativa. Sin embargo, para el análisis multivariado se incluyeron aquellas variables con un valor de p<0,1 o que clínicamente se consideraran relevantes.
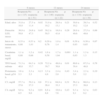
ResultadosPara el presente estudio se incluyeron los datos de 168 pacientes con registro clínico completo. Del total, 141 eran del sexo femenino (84%), con un promedio de edad al diagnóstico de la NL de 30,4±10,6 años y con un tiempo de evolución del LES de 28,0±48,8 meses. La NL fue la manifestación inicial de la enfermedad en 94 (56,5%) pacientes. La biopsia renal mostró NL de clase ii en 33 pacientes (19,6%), clase iii en 28 pacientes (16,6%), clase iv en 92 pacientes (54,7%), clase v en 7 pacientes (4,1%) y clases histológicas combinadas en 7 pacientes (4,1%). La tasa de respuesta al tratamiento fue del 69,2% a los 6 meses, del 86,9% a los 12 meses y del 79,7% a los 2 años (tabla 1).
Tratamientos utilizados
| n=168 (%) | |
| Tratamiento de inducción a la remisión | |
| Ciclofosfamida | 113 (67%) |
| Ácido micofenólico | 1 (0,5%) |
| Azatioprina | 26 (15%) |
| Combinado | 21 (12%) |
| Solo glucocorticoides | 4 (2%) |
| Tratamiento de mantenimiento | |
| Ciclofosfamida | 117 (69,4%) |
| Ácido micofenólico | 14 (8,3%) |
| Azatioprina | 23 (13,6%) |
| Combinado | 4 (2,3%) |
| Otros | 10 (5,9%) |
| Respuesta al tratamiento | |
| 6 meses | 115 (69,2%) |
| 12 meses | 146 (86,9%) |
| 24 meses | 134 (79,7%) |
Todos los pacientes fueron tratados con glucocorticoides a dosis altas (pulsos de metilprednisolona de 3g dosis total fueron administrados en el 60% de los pacientes; el resto recibió prednisona 1mg/kg/día) y 113 (67%) de ellos recibieron ciclofosfamida IV (0,5-1g/m2 SC/dosis) mensualmente (tabla 1). Los otros inmunosupresores principalmente usados fueron azatioprina (dosis 75-150mg/día) y ácido micofenólico (dosis 1-3g/24h). Ciento quince (69,2%) pacientes fueron respondedores. Los pacientes no respondedores tenían una edad menor (27,5 + 11,4 vs. 31,8 + 10,0, p=0,02) en comparación con los respondedores (tabla 2). En el análisis bivariado se encontró que los pacientes > 25 años de edad (p<0,01), la presencia de microhematuria (p=0,04) y cilindruria (p=0,01) fueron variables asociadas a mayor probabilidad de respuesta terapéutica (tabla 3) y no se encontraron factores asociados a falta de respuesta terapéutica. En el análisis multivariado, la edad > 25 años al momento del diagnóstico de la NL (OR 0,22; IC del 95%, 0,10-0,48; p=0,0001) y la presencia de microhematuria (OR 0,35; IC del 95%, 0,14-0,86; p=0,02) fueron variables asociadas a buena respuesta al tratamiento de inducción a la remisión. Se encontraron un riesgo incrementado en el género masculino y la creatinina sérica elevada de presentar una falta de respuesta terapéutica, pero con un valor no estadísticamente significativo.
Características demográficas basales de acuerdo con la respuesta terapéutica
| 6 meses | 12 meses | 24 meses | |||||||
| Respuesta (n=115) | No respuesta (n=51) | p | Respuesta (n=146) | No respuesta (n=22) | p | Respuesta (n=134) | No respuesta (n=34) | p | |
| Edad, años | 31,8±10,0 | 27,5±11,4 | 0,02 | 31,0±10,2 | 28,0±13,1 | 0,21 | 30,9±10,2 | 29,5±12,0 | 0,52 |
| Duración LES, meses | 30,9±50,8 | 24,6±47,3 | 0,45 | 30,2±50,5 | 18,0±41,6 | 0,28 | 28,9±49,6 | 27,5±49,6 | 0,88 |
| Inicio de tratamiento, meses | 0,33±0,88 | 0,53±1,01 | 0,2 | 0,29±0,76 | 1,0±1,4 | 0,01 | 0,39±0,93 | 0,38±0,85 | 0,97 |
| Creatinina basal, mg/dl | 1,1±0,88 | 1,2±0,66 | 0,42 | 1,0±0,58 | 1,7±1,64 | 0,001 | 1,1±0,63 | 1,3±1,3 | 0,15 |
| TFG basal, ml/min | 71,3±40,8 | 64,3±35,7 | 0,29 | 72,2±39,7 | 49,6±30,6 | 0,01 | 69,6±39,4 | 67,5±46,8 | 0,78 |
| Proteinuria basal, g/24 h | 3,6±5,3 | 2,3±2,3 | 0,13 | 3,3±4,9 | 2,4±2,0 | 0,43 | 3,4±5,0 | 2,3±2,2 | 0,19 |
| C3, mg/dl | 57,7±27,6 | 59,2±27,3 | 0,8 | 57,1±26,4 | 64,8±33,3 | 0,31 | 56,2±27,3 | 66,0±26,8 | 0,13 |
| C4, mg/dl | 9,0±8,5 | 9,2±9,0 | 0,91 | 8,8±8,8 | 10,6±7,6 | 0,43 | 9,3±9,1 | 8,3±6,2 | 0,63 |
Análisis bivariado
| 6 meses | 12 meses | 24 meses | |||||||
| Respuesta (n=115) | No respuesta (n=51) | p | Respuesta (n=146) | No respuesta (n=22) | p | Respuesta (n=134) | No respuesta (n=34) | p | |
| Género masculino | 13 | 23,5 | 0,09 | 15,1 | 27,3 | 0,15 | 16,4 | 17,6 | 0,86 |
| Edad > 25 años | 77,4 | 41,9 | 0,01 | 29,5 | 45,5 | 0,13 | 29,1 | 41,2 | 0,17 |
| NL proliferativa | 74,8 | 68,6 | 0,41 | 73,3 | 63,5 | 0,34 | 72,4 | 70,6 | 0,83 |
| CrS > 1,4 mg/dl | 17,4 | 29,4 | 0,08 | 19,4 | 31,8 | 0,18 | 14,9 | 32,4 | 0,01 |
| TFG ≤ 30 ml/min | 13,9 | 21,6 | 0,21 | 13,9 | 31,8 | 0,03 | 14,4 | 23,5 | 0,19 |
| Proteinuria > 1 g/24 h | 77,4 | 69,4 | 0,2 | 75,2 | 76,2 | 0,92 | 75,2 | 75,8 | 0,88 |
| Microhematuria | 79,1 | 64,7 | 0,04 | 75,0 | 72,7 | 0,81 | 75,0 | 73,5 | 0,86 |
| Cilindruria | 62,6 | 41,2 | 0,01 | 56,9 | 50,0 | 0,54 | 58,3 | 47,1 | 0,23 |
| C3 bajo | 75,0 | 75,0 | 1 | 76,3 | 66,7 | 0,42 | 78,7 | 60,9 | 0,07 |
| C4 bajo | 66,2 | 68,6 | 0,8 | 67,7 | 62,5 | 0,68 | 68,6 | 60,9 | 0,61 |
| Anti-dsADN (+) | 58,6 | 60,0 | 0,88 | 60,2 | 50,0 | 0,49 | 59 | 59,1 | 0,99 |
| aCL (+) | 21,2 | 26,1 | 0,63 | 25,0 | 0 | 0,13 | 21,7 | 26,7 | 0,67 |
aCL: anticuerpos anticardiolipina; anti-dsADN: anticuerpos contra ADN de doble cadena; CrS: creatinina sérica; NL: nefritis lúpica; TFG: tasa de filtrado glomerular.
Los resultados se expresan en porcentaje.
La mayoría de los pacientes recibió como terapia de mantenimiento ciclofosfamida IV (69,4%) cada 2 a 3 meses (tabla 1). El 86,9% de los pacientes presentó respuesta al año de tratamiento. Los pacientes no respondedores tenían una creatinina mayor y una depuración de creatinina menor basales en comparación con los respondedores (tabla 2). En el análisis bivariado, se encontró que una depuración de creatinina basal < 30ml/min se asoció a falta de respuesta (p=0,03) (tabla 3). En el análisis multivariado, este mismo parámetro de laboratorio (OR 3,82; IC del 95%, 1,28-11,43; p=0,02) persistió como variable independiente asociada a mala respuesta al tratamiento (tabla 4). De igual forma como a los 6 meses, se encontró un riesgo incrementado en el género masculino de no responder al tratamiento, pero con un valor no estadísticamente significativo.
Predictores de falta de respuesta terapéutica (análisis multivariado)
| OR | IC del 95% | p | |
| A los 6 meses | |||
| Edad > 25 años | 0,22 | 0,10-0,48 | 0,0001 |
| Género masculino | 2,08 | 0,81-5,34 | 0,13 |
| NL proliferativa | 0,63 | 0,27-1,47 | 0,29 |
| CrS > 1,4mg/dl | 2,29 | 0,91-5,78 | 0,08 |
| Microhematuria | 0,35 | 0,14-0,86 | 0,02 |
| Cilindruria | 0,47 | 0,22-1,02 | 0,06 |
| A los 12 meses | |||
| Género masculino | 2,67 | 0,90-7,93 | 0,08 |
| NL proliferativa | 0,49 | 0,17-1,37 | 0,17 |
| TFG < 30 ml/min | 3,82 | 1,28-11,43 | 0,02 |
| Microhematuria | 0,82 | 0,27-2,49 | 0,73 |
| A los 24 meses | |||
| NL proliferativa | 0,28 | 0,09-0,83 | 0,02 |
| Retraso en el tratamiento > 3 meses | 5,36 | 1,36-21,14 | 0,02 |
| Microhematuria | 2,49 | 0,72-8,57 | 0,15 |
| C3 bajo | 0,34 | 0,12-0,99 | 0,05 |
CrS: creatinina sérica; NL: nefritis lúpica; TFG: tasa de filtrado glomerular.
A los 2 años de seguimiento, el 79% de los pacientes presentaron respuesta terapéutica y no encontramos diferencias en las variables demográficas basales en ambos grupos (tabla 2). En el análisis bivariado, una elevación de la creatinina sérica > 1,4mg/dl (p=0,01) se asoció a falta respuesta terapéutica (tabla 3). En el análisis multivariado, el retraso en el tratamiento (OR 5,36; IC del 95%, 1,36-21,14; p=0,02) fue un factor de riesgo independiente asociado a mala respuesta terapéutica (tabla 4). Por otro lado, la presencia de una forma histológica proliferativa de NL (OR 0,28; IC del 95%, 0,09-0,83; p=0,02) y la presencia de C3 bajo (OR 0,34; IC del 95%, 0,12-0,99; p=0,05) se asociaron con buena respuesta al tratamiento.
DiscusiónEn nuestro estudio, analizamos diversas variables clínicas, bioquímicas, histológicas e inmunológicas que pueden influir en la respuesta terapéutica, tanto de inducción como de mantenimiento de pacientes con LES y NL a los 6, 12 y 24 meses. Los resultados arrojaron que los factores de riesgo asociados a mayor probabilidad de respuesta terapéutica en diferentes tiempos fueron la edad mayor que 25 años, microhematuria, NL proliferativa y C3 bajo. Por otro lado, las variables asociadas a mala respuesta terapéutica fueron una depuración de creatinina < 30ml/min basal y el retraso en el inicio del tratamiento inmunosupresor mayor a 3 meses a los 12 y 24 meses de tratamiento, respectivamente.
La presencia de afección renal en el curso clínico de LES es considerada un factor que influye de manera adversa en la morbimortalidad de la enfermedad. El curso de la NL es difícil de predecir por diversas razones, que incluyen la heterogeneidad de su presentación clínica, diferentes criterios de clasificación, la incidencia de transformación histológica y los diferentes tratamientos empleados. Ningún factor parece ser determinante por sí solo en el pronóstico de la NL y una serie de factores demográficos, clínicos, de laboratorio e histopatológicos se han indicado que influyen en los resultados y la respuesta al tratamiento. La interacción de esos factores es probable que determine el resultado final y hay que tener en cuenta todos los factores en la decisión de pautas terapéuticas más adecuadas para cada paciente25. El pronóstico renal no es el mismo en todos los grupos étnicos. La tendencia es claramente peor en afroamericanos y latinoamericanos, en que factores genéticos y socioeconómicos parecen estar implicados. Los pacientes latinoamericanos con un nivel socioeconómico medio tuvieron mayor índice Systemic Lupus International Collaborating Clinic y los pacientes que murieron eran de bajo nivel socioeconómico26. La pobreza es un factor de riesgo para la progresión de la NL proliferativa27. Llama la atención que en un alto porcentaje de nuestros pacientes, la NL fue la manifestación inicial. Estudios previos en población latinoamericana y caucásica reportan que en el 5,7 y el 10% de los pacientes, respectivamente, la NL es la manifestación inicial26,28. Esto puede explicarse porque nuestro hospital es un centro de referencia que atiende población altamente seleccionada.
Diversos factores que influyen en el desenlace renal han sido descritos. Dentro de las variables demográficas se han reportado el lupus de inicio juvenil12 y en adultos jóvenes13, encontrando que aquellos menores de 40 años tienen mayor número de exacerbaciones28.
En nuestro estudio, encontramos que los pacientes menores de 25 años tienen una menor probabilidad de respuesta al tratamiento de inducción a la remisión. Se ha reportado que los hombres tienen peor pronóstico en comparación con las mujeres14, quizá porque se realiza un diagnóstico tardío, tienen menor tasa de remisión, recaídas más frecuentes, con disminución en la sobrevida renal y mayor mortalidad29-31. A diferencia de otros estudios, encontramos que el sexo masculino tiene una menor probabilidad de respuesta al tratamiento, la cual no fue estadísticamente significativa quizá por efecto del tamaño de muestra (16%).
Por otro lado, se han identificado diversos predictores clínicos y bioquímicos presentes en el diagnóstico de la NL relacionados con pobres resultados renales, entre los que se encuentran creatinina sérica elevada, síndrome nefrótico, hipocomplementemia, hematocrito disminuido16-18, hemoglobina baja, trombocitosis32, hipertensión arterial persistente, proteinuria masiva y falla renal aguda33. En nuestro estudio, no se analizó ningún elemento de la biometría hemática; de los parámetros bioquímicos estudiados solo la depuración de creatinina < 30ml/min fue una variable bioquímica asociada a mala respuesta al tratamiento a los 12 meses. En contraste con lo reportado en la literatura, encontramos que la microhematuria y el complemento C3 sérico bajo fueron variables asociadas a buena respuesta al tratamiento16-18. Esta aparente contradicción puede deberse al tratamiento intenso ante la gravedad de la NL en nuestros pacientes. La hipertensión arterial sistémica fue analizada pero no mostró asociación con el tipo de respuesta.
Se ha investigado la asociación de diversos autoanticuerpos nefritogénicos con la actividad de la enfermedad renal y su pronóstico en diversas cohortes internacionales. La combinación de anti-ADN y anti-C1q indica mayor actividad renal y predice pobres resultados renales34. Los anticuerpos antifosfolípidos son positivos hasta en el 27% de los pacientes con nefritis y se han asociado a recaída renal y a menor sobrevida renal21,22, al ser un factor de riesgo independiente para el desarrollo de enfermedad renal crónica35. La presencia de anti-Ro se ha asociado a fracaso para alcanzar remisión17. Debido al diseño retrospectivo del estudio, no se lograron determinar todos estos anticuerpos.
Las características histológicas asociadas a pobre pronóstico renal que han sido reportadas son el retraso entre la toma de la biopsia y el inicio de la nefritis, las formas proliferativas16, membranosas32, altos índices de actividad33 y cronicidad16,36, que al relacionarse con la presencia de semilunas y microangiopatía trombótica empeoran los resultados37, lo que puede traducir un diagnóstico tardío, una presentación silente de la enfermedad, una transformación histológica38, una localización de depósitos inmunes y una trombosis capilar. Recientemente, se encontró que la presencia de α-actina en el músculo liso a nivel intersticial se relaciona con pobre respuesta al tratamiento, al ser un marcador útil para predecir fibrosis renal39. Nuestros pacientes con formas histológicas proliferativas de la NL tienen mayor probabilidad de responder al tratamiento, quizá debido a que son tratados con mayor intensidad. Este grupo de pacientes se asocia a mayor tasa de recaídas e insuficiencia renal terminal40. Por otro lado, no analizamos los índices de actividad y la cronicidad debido al bajo número de biopsias con índices calculados.
Los predictores de respuesta encontrados en nuestro estudio son distintos de acuerdo con las diferentes etapas del tratamiento, lo que refleja que los cambios histológicos son potencialmente reversibles. Se ha demostrado que en biopsias renales tomadas al diagnóstico de la NL clínicamente activa predominan los datos histológicos de actividad sobre los de cronicidad. Se ha encontrado que la cantidad de depósitos subendoteliales correlaciona con alteraciones bioquímicas, tales como proteinuria y creatinina sérica40. El tratamiento inmunosupresor intenso disminuye considerablemente el número de depósitos inmunes subendoteliales, lo que se traduce en la mejoría de los parámetros de laboratorio41. Estos cambios histológicos de pacientes con biopsias renales repetidas al término de la terapia de inducción a la remisión son diferentes entre los pacientes respondedores y no respondedores. Como ha sido reportado, el retraso en el inicio del tratamiento de inducción fue un predictor de pobre respuesta terapéutica, lo que puede traducir el predominio de cambios histológicos de cronicidad condicionados por una intervención terapéutica tardía42. Por otro lado, en nuestro estudio las clases histológicas proliferativas fueron asociadas a una mayor probabilidad de respuesta al tratamiento, lo cual puede representar mayor actividad inflamatoria potencialmente modificable. De interés, en nuestro estudio, los factores asociados a la respuesta terapéutica tienen diferente significado en el tiempo. Estos resultados indican que esta respuesta al tratamiento depende de cambios dinámicos en la patogénesis de la NL, lo que ha sido demostrado en modelos experimentales43. Por ejemplo, en la glomerulonefritis aguda dominan las citocinas y quimiocinas inflamatorias, así como marcadores de células mieloides. En la glomerulonefritis crónica existe incremento en los genes de remodelación y reparación tisular. Por otro lado, en un estadio transicional de la glomerulonefritis se ha encontrado un incremento en la expresión de genes involucrados en una vía común final que lleva a la fibrosis y el daño glomerular irreversible, tales como factor de crecimiento transformador beta 2 y la proteína unida al factor de crecimiento similar a la insulina 2, entre otros. Recientemente, se encontró en humanos que las concentraciones séricas de sIL-7R puede ser un marcador de actividad a nivel renal, incluso de manera más temprana que el anti-dsADN y el complemento sérico44.
Entre las limitaciones de nuestro estudio, se incluye su diseño retrospectivo. Es necesario realizar un análisis estratificado por esquema de tratamiento, lo que no pudimos realizar por el tamaño de muestra. Por otro lado, no se determinaron otros anticuerpos nefritogénicos, tales como anti-C1q o antinucleosomas. En nuestro hospital, la NL es tratada por múltiples disciplinas (nefrología, medicina interna y reumatología), por lo que son usadas diferentes dosis de los fármacos. Además, en nuestro estudio no analizamos recaídas, progresión a enfermedad renal terminal ni mortalidad como medidas de desenlace reportados en otros estudios45,46.
En conclusión, los predictores de respuesta al tratamiento encontrados en nuestros pacientes con NL fueron a los 6 meses, edad > 25 años y microhematuria; a los 24 meses, las formas proliferativas de la NL y complemento C3 bajo; como predictores de no respuesta a los 12 meses depuración de creatinina baja y retraso en el tratamiento a los 2 años. La intervención terapéutica oportuna para NL se asocia con una respuesta favorable a 2 años.
Estudios a largo plazo permitirán identificar el impacto de estos factores de respuesta encontrados en etapa temprana.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónNinguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.