La dificultad para el diagnóstico y la variedad de manifestaciones clínicas que pueden determinar la elección del tratamiento del síndrome antifosfolípido (SAF) primario ha impulsado a la Sociedad Española de Reumatología (SER) en la elaboración de recomendaciones basadas en la mejor evidencia posible. Estas recomendaciones pueden servir de referencia para reumatólogos y otros profesionales implicados en el manejo de pacientes con SAF.
MétodosSe creó un panel formado por cuatro reumatólogos, una ginecóloga y una hematóloga, expertos en SAF, previamente seleccionados mediante una convocatoria abierta o por méritos profesionales. Las fases del trabajo fueron: identificación de las áreas claves para la elaboración del documento, análisis y síntesis de la evidencia científica (utilizando los niveles de evidencia del Scottish Intercollegiate Guidelines Network [SIGN]) y formulación de recomendaciones a partir de esta evidencia y de técnicas de «evaluación formal» o «juicio razonado».
ResultadosSe han elaborado 46 recomendaciones que abordan cinco áreas principales: diagnóstico y evaluación, medidas de tromboprofilaxis primaria, tratamiento del SAF primario o tromboprofilaxis secundaria, tratamiento del SAF obstétrico y situaciones especiales. Se incluye también el papel de los nuevos anticoagulantes orales, el problema de las recurrencias o los principales factores de riesgo identificados en estos individuos. En este documento se reflejan las 21 primeras recomendaciones, referidas a las áreas de diagnóstico, evaluación y tratamiento del SAF primario. El documento contiene una tabla de recomendaciones y algoritmos de tratamiento.
ConclusionesSe presentan las recomendaciones de la SER sobre SAF primario. Este documento corresponde a la parteI, relacionada con el diagnóstico, la evaluación y el tratamiento. Estas recomendaciones se consideran herramientas en la toma de decisiones para los clínicos, teniendo en consideración tanto la decisión del médico experto en SAF como la opinión compartida con el paciente. Se ha elaborado también una parteII, que aborda aspectos relacionados con el SAF obstétrico y situaciones especiales.
The difficulty in diagnosis and the spectrum of clinical manifestations that can determine the choice of treatment for primary antiphospholipid syndrome (APS) has fostered the development of recommendations by the Spanish Society of Rheumatology (SER), based on the best possible evidence. These recommendations can serve as a reference for rheumatologists and other specialists involved in the management of APS.
MethodsA panel of four rheumatologists, a gynaecologist and a haematologist with expertise in APS was created, previously selected by the SER through an open call or based on professional merits. The stages of the work were: identification of the key areas for drafting the document, analysis and synthesis of the scientific evidence (using the Scottish Intercollegiate Guidelines Network [SIGN] levels of evidence) and formulation of recommendations based on this evidence and formal assessment or reasoned judgement techniques (consensus techniques).
Results46 recommendations were drawn up, addressing five main areas: diagnosis and evaluation, measurement of primary thromboprophylaxis, treatment for APS or secondary thromboprophylaxis, treatment for obstetric APS and special situations. These recommendations also include the role of novel oral anticoagulants, the problem of recurrences or the key risk factors identified in these subjects. This document reflects the first 21, referring to the areas of: diagnosis, evaluation and treatment of primary APS. The document provides a table of recommendations and treatment algorithms.
ConclusionsAn update of the SER recommendations on APS is presented. This document corresponds to partI, related to diagnosis, evaluation and treatment. These recommendations are considered tools for decision-making for clinicians, taking into consideration both the decision of the physician experienced in APS and the patient. A partII has also been prepared, which addresses aspects related to obstetric SAF and special situations.
El 20 de mayo de 2019, la AEMPS ha emitido una nota informativa sobre el uso de anticoagulantes orales directos en pacientes con Síndrome Antifosfolípido y antecedentes personales de trombosis.https://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/seguridad/2019/NI_MUH_FV-8-2019-anticoagulantes-orales.htm
El síndrome antifosfolípido (SAF) es una enfermedad autoinmune sistémica caracterizada por el desarrollo de trombosis venosa o arterial y/o morbilidad durante el embarazo, asociadas a la presencia confirmada de anticuerpos antifosfolípidos (AAF). Los AAF incluidos actualmente en los criterios de clasificación son el anticoagulante lúpico (AL), los anticuerpos anticardiolipina (aCL) y los anti-β2 glicoproteínaI (aβ2GPI)1-3 (tabla 1).
Criterios revisados de clasificación del síndrome antifosfolípido3
| Criterios clínicos |
|---|
| Trombosis vascular: uno o más episodios de trombosis arterial, venosa o de pequeño vaso en cualquier órgano o tejido del organismo, confirmado por pruebas de imagen apropiadas y/o análisis histopatológico (debiendo estar presente la trombosis sin evidencia de inflamación de pequeño vaso)Morbilidad durante el embarazo:•Una o más muertes de un feto morfológicamente normal de al menos 10 semanas de gestación, con morfología normal del feto documentada mediante ecografía o examen directo del feto•Uno o más partos prematuros de un neonato morfológicamente normal antes de la semana 34 de gestación debido a: 1) eclampsia o preeclampsia grave, o 2) características reconocibles de insuficiencia placentaria•Tres o más abortos espontáneos consecutivos antes de la semana 10 de gestación, habiendo descartado anomalías anatómicas y hormonales de la madre y anomalías tanto maternas como paternas |
| Criterios de laboratorio |
|---|
| Se deben obtener resultados positivos en suero o plasma en dos o más ocasiones separadas al menos 12 semanas:•Anticoagulante lúpico (AL) determinado de acuerdo con las recomendaciones de la International Society of Thrombosis and Hemostasis•Anticuerpos anticardiolipina (aCL) tipo IgG y/o IgM medidos por ELISA a títulos medios o elevados (> 40 GPL o MPL o > percentil 99)•Anticuerpos anti-β2 glicoproteína I (aβ2GPI) tipo IgG y/o IgM medidos por ELISA a títulos medios o elevados (> percentil 99) |
| SAF definitivo |
|---|
| Presencia de al menos un criterio clínico y uno de laboratorio. La prueba de laboratorio debe ser positiva en dos o más ocasiones separadas 12 semanas |
El SAF puede presentarse de forma aislada, denominándose SAF primario, o estar asociado a otras enfermedades autoinmunes, principalmente al lupus eritematoso sistémico (LES). De forma excepcional se puede presentar como múltiples trombosis en un corto espacio de tiempo, lo que se denomina síndrome antifosfolípido catastrófico (SAF catastrófico), situación clínica grave y con alta mortalidad4 (tabla 2).
Criterios preliminares para la clasificación del síndrome antifosfolípido catastrófico8
| Criterios diagnósticos |
| 1. Evidencia de la afectación de tres o más órganos, sistemas o tejidos2. Desarrollo de las manifestaciones de forma simultánea o en menos de una semana3. Confirmación histopatológica de la oclusión de pequeño vaso en al menos un órgano o tejido4. Confirmación analítica de la presencia de anticuerpos antifosfolípidos (anticoagulante lúpico y/o anticuerpos anticardiolipina y/o antiβ2 glicoproteína I) |
| SAF catastrófico definitivo |
| Los cuatros criterios |
| SAF catastrófico probable |
| • Los cuatros criterios, pero solo dos áreas afectadas• Los cuatro criterios, en ausencia de confirmación analítica• Criterios 1, 2 y 4.• Criterios 1, 3 y 4 y el desarrollo de un tercer episodio entre una semana y un mes después de su presentación, a pesar de anticoagulación; pero menos de un mes, a pesar de la anticoagulación |
El SAF primario es la causa más común de trombofilia adquirida, siendo el causante del 10-15% de todos los episodios de trombosis venosa profunda (TVP), con o sin embolia pulmonar; de un tercio de accidentes cerebrovasculares nuevos en pacientes menores de 50 años, y del 10-15% de los casos de pérdidas fetales recurrentes5.
En el momento actual siguen existiendo dudas razonables sobre si las complicaciones trombóticas y la morbilidad obstétrica aislada son manifestaciones de una sola enfermedad, o bien si son dos entidades diferenciadas que tienen en común la presencia de los AAF. Mientras que parece clara la asociación de los AAF con el desarrollo de los fenómenos trombóticos, la asociación de algunas manifestaciones obstétricas con dichos autoanticuerpos sigue siendo objeto de debate5.
Otro de los aspectos todavía por definir con exactitud es la relevancia de la presencia de los AAF en pacientes asintomáticos o sin manifestaciones incluidas en los criterios de la enfermedad. Por una parte, en estas situaciones clínicas es clave estratificar el riesgo de desarrollar complicaciones del SAF en el futuro, y por lo tanto de adoptar medidas de profilaxis primaria en esta población. Los principales factores de riesgo identificados en estos individuos son el perfil de AAF, la presencia de factores de riesgo cardiovascular, la presencia de otras manifestaciones asociadas al SAF (no incluidas en los criterios) y el padecer otra enfermedad autoinmune asociada, especialmente LES. Mientras que estos factores de riesgo han mostrado su posible utilidad a la hora de estratificar el riesgo de trombosis en este grupo de individuos portadores de AAF, su papel en el riesgo de desarrollar manifestaciones obstétricas no está tan claro6.
El tratamiento óptimo del SAF continúa suscitando dudas entre los expertos7. Estas dudas surgen fundamentalmente de la falta de ensayos clínicos adecuados que nos permitan contestar a las preguntas clave en la enfermedad: cuándo iniciar la profilaxis primaria y cuánto tiempo se debe mantener, cuál es el tratamiento óptimo de los fenómenos trombóticos y de las diferentes manifestaciones obstétricas, qué hacer en caso de recurrencias, cuál es el papel de los anticoagulantes orales de acción directa (ACOD), o cuál es el tratamiento de otras manifestaciones no trombóticas del SAF, entre otras muchas preguntas abiertas.
Por todo ello, es preciso establecer unas recomendaciones, basadas en la evidencia más reciente y en la opinión de expertos de diferentes especialidades, sobre el manejo y el tratamiento del SAF. El propósito de estas recomendaciones es que sirvan de apoyo al clínico en el manejo de la enfermedad, tanto a la hora de interpretar la presencia de estos AAF como en la elección de la estrategia terapéutica más adecuada.
MetodologíaDiseñoEn este proyecto se ha utilizado una síntesis cualitativa de la evidencia científica y técnicas de consenso que recogen el acuerdo de expertos en base a su experiencia clínica y la evidencia científica.
Fases del procesoEn el desarrollo del documento de Recomendaciones se han seguido una serie de pasos que se describen a continuación:
- 1.
Creación del grupo de trabajo. La elaboración del documento se inició con la constitución de un panel de expertos formado por cuatro reumatólogos miembros de la SER, una hematóloga y una ginecóloga. Los reumatólogos fueron elegidos mediante una convocatoria abierta a todos los socios de la SER. La Comisión de Guías de Práctica Clínica (GPC) y Recomendaciones SER valoró el currículum vitae de todos los solicitantes de acuerdo a criterios objetivos de aportación al conocimiento del SAF, principalmente por la participación en publicaciones en revistas de impacto en los últimos 5años. La coordinación de los aspectos clínicos y metodológicos se realizó, respectivamente, por uno de estos reumatólogos como investigador principal y una especialista en metodología, técnico de la Unidad de Investigación de la SER.
- 2.
Identificación de las áreas claves. Todos los miembros del grupo de trabajo participaron para estructurar el documento y establecer los contenidos y aspectos clave. Primero se identificaron las preguntas clínicas de investigación que podrían tener más impacto para ofrecer información sobre el manejo del SAF. Después se fijaron cuáles de ellas precisaban responderse mediante formulación de pregunta PICO (paciente, intervención, comparación, outcome o resultado). Se definió también la metodología a seguir en el proceso de elaboración de las recomendaciones.
- 3.
Búsqueda bibliográfica. Para responder a las preguntas clínicas no PICO se realizó una búsqueda de revisiones sistemáticas y GPC actualizadas en Medline y fuentes especializadas en guías. El resto de las preguntas clínicas se reformularon en cuatro preguntas con formato PICO. Para responder a las preguntas PICO se diseñó una estrategia de búsqueda y se realizó una revisión de la evidencia científica de estudios publicados hasta mayo de 2017. Se utilizaron las bases de datos: Pubmed (Medline), Embase y Cochrane Library (Wiley Online). Se completó el proceso con una búsqueda manual de referencias y pósteres y resúmenes de congresos que consideraron de interés los revisores y expertos.
- 4.
Análisis y síntesis de la evidencia científica. Las revisiones sistemáticas y GPC identificadas para las preguntas no PICO fueron evaluadas por la coordinadora metodológica. Se acordó que solamente aquellas de calidad alta serían consideradas aptas para su incorporación como fuente de evidencia. Varios reumatólogos, del grupo de trabajo de revisores de la evidencia de la SER, se encargaron de revisar sistemáticamente la evidencia científica disponible para las preguntas PICO. Tras la lectura crítica del texto completo de los estudios seleccionados para cada revisión elaboraron un resumen mediante el uso de un formulario homogeneizado incluyendo tablas y texto para describir la metodología, los resultados y la calidad de cada estudio. Se detallaron los motivos de exclusión de los artículos no incluidos en la selección. Se evaluó el nivel global de la evidencia científica utilizando los niveles de evidencia del Scottish Intercollegiate Guidelines Network (SIGN)9 (ver anexo).
- 5.
Formulación de recomendaciones. Finalizada la lectura crítica, el investigador principal y los componentes del grupo de expertos procedieron a la formulación de recomendaciones específicas basadas en la evidencia científica. Esta formulación se ha basado en la «evaluación formal» o «juicio razonado», resumiendo previamente la evidencia para cada una de las preguntas clínicas. Se tuvieron en cuenta también la calidad, la cantidad y la consistencia de la evidencia científica, la generalidad de los resultados, su aplicabilidad y su impacto clínico. La graduación de las recomendaciones se ha realizado con el sistema SIGN9 (ver anexo). Las recomendaciones se han dividido en cinco áreas principales: diagnóstico y evaluación, tromboprofilaxis primaria, tratamiento del SAF primario o tromboprofilaxis secundaria, tratamiento del SAF obstétrico y situaciones especiales.
- 6.
Revisión externa. Finalizadas las fases anteriores, se elaboró un borrador final del documento que fue enviado a profesionales seleccionados por su conocimiento sobre el SAF para llevar a cabo una fase de revisión externa independiente. El objetivo final fue aumentar la validez externa del documento y asegurar la exactitud de las recomendaciones.
- 7.
Exposición pública. El borrador de este documento de Recomendaciones SER fue sometido a un proceso de exposición pública por parte de socios miembros de la SER y de distintos grupos de interés (industria farmacéutica, otras sociedades científicas y asociaciones de pacientes) con objeto de recoger la valoración y su argumentación científica de la metodología o las recomendaciones. No se recibió ninguna alegación por parte de los posibles grupos de interés relacionados con el tema.
El documento recoge las recomendaciones formuladas subdivididas en las diferentes áreas ya referidas. A partir de las recomendaciones se han elaborado algoritmos de manejo que presentan de forma resumida la aproximación al tratamiento del SAF.
ResultadosLas recomendaciones formuladas sobre SAF primario ascienden a 46 y abordan cinco áreas principales: diagnóstico y evaluación, tromboprofilaxis primaria, tratamiento del SAF primario o tromboprofilaxis secundaria, tratamiento del SAF obstétrico y situaciones especiales. En este documento se reflejan las 21 primeras, referidas a las áreas de diagnóstico y evaluación, tromboprofilaxis primaria y tratamiento del SAF primario o tromboprofilaxis secundaria (tabla 3).
Recomendaciones SER sobre síndrome antifosfolípido primario (parte 1)
| Diagnóstico y evaluación | GR |
|---|---|
| Recomendación: En los pacientes con SAF se recomienda la detección simultánea de los tres anticuerpos antifosfolípidos incluidos en los criterios de clasificación (AL, aCL y aβ2GPI) para establecer el riesgo de trombosis o de complicaciones obstétricas | C |
| Recomendación: El riesgo de presentar manifestaciones clínicas del SAF es mayor cuando se detecta anticoagulante lúpico o más de un anticuerpo antifosfolípido diferente (doble y, en particular, triple positividad) en el mismo paciente | B |
| Recomendación: En la práctica clínica habitual, en la población general con sospecha de SAF o en pacientes ya diagnosticados de la enfermedad no se recomienda realizar la detección de los anticuerpos antifosfolípidos no incluidos en los criterios de clasificación | D |
| Recomendación: No se recomienda realizar la detección de anticuerpos antifosfolípidos si el paciente está anticoagulado y diagnosticado | √ |
| Recomendación: En pacientes con trombosis provocada, perfil de bajo riesgo trombótico y sin factores de riesgo cardiovascular convencionales se puede considerar la repetición de los anticuerpos para valorar la necesidad de anticoagulación indefinida | √ |
| Recomendación: Se recomienda repetir la determinación de los anticuerpos antifosfolípidos incluidos en los criterios de clasificación (excepto el anticoagulante lúpico), al menos a las 12 semanas | √ |
| Recomendación: Si el anticoagulante lúpico hubiera sido positivo en el diagnóstico inicial y se desea confirmar, individualizando cada paciente según el riesgo de trombosis, es recomendable suspender la anticoagulación oral al menos 1 o 2 semanas antes de la determinación, utilizando heparina a dosis terapéuticas (asociada a ácido acetilsalicílico a dosis antiagregantes en caso de trombosis arterial previa) y suspendiéndola la noche anterior para evitar interferencias en los resultados de laboratorio | √ |
| Tromboprofilaxis primaria | |
|---|---|
| Recomendación: En pacientes portadores de anticuerpos antifosfolípidos, sin clínica asociada a SAF, se recomienda el tratamiento profiláctico puntual con heparina de bajo peso molecular en situaciones de alto riesgo trombótico (inmovilización prolongada, cirugía reciente, puerperio, estimulación ovárica, etc.) | C |
| Recomendación: En pacientes con perfil de riesgo bajo solo se recomienda el tratamiento profiláctico cuando hay factores de riesgo cardiovascular asociados. Debe hacerse con dosis bajas de ácido acetilsalicílico y con la corrección o tratamiento de los factores de riesgo cardiovascular | C |
| Recomendación: En pacientes portadores de anticuerpos antifosfolípidos y trombocitopenia asociada se recomienda el tratamiento profiláctico con dosis bajas de ácido acetilsalicílico | C |
| Recomendación: En pacientes con perfil de riesgo medio/alto se recomienda el tratamiento profiláctico con dosis bajas de ácido acetilsalicílico de forma indefinida | C |
| Recomendación: En pacientes portadores de anticuerpos antifosfolípidos, sin clínica asociada a SAF, con deseo concepcional se recomienda valorar el tratamiento profiláctico con dosis bajas de ácido acetilsalicílico de acuerdo al perfil de riesgo | C |
| Tratamiento del síndrome antifosfolípido primario. Tromboprofilaxis secundaria | |
|---|---|
| Recomendación: Los pacientes con anticuerpos antifosfolípidos y un primer episodio de trombosis venosa deben ser tratados con heparina no fraccionada o heparina de bajo peso molecular y posteriormente antagonistas de la vitamina K | D |
| Recomendación: En la prevención secundaria de la trombosis venosa se recomienda la anticoagulación a rango terapéutico para un INR 2-3 | D |
| Recomendación: En la prevención secundaria de la trombosis venosa se recomienda que la anticoagulación se mantenga indefinidamente | D |
| Recomendación: Los pacientes con SAF primario y eventos trombóticos arteriales previos deben ser tratados con anticoagulación estándar (INR 2-3) para prevenir recurrencias de trombosis arteriales | B |
| Recomendación: En el SAF trombótico refractario al tratamiento convencional se recomienda asociar a la terapia convencional dosis antiagregantes de ácido acetilsalicílico, hidroxicloroquina o estatinas | D |
| Recomendación: Cuando hay una contraindicación formal a anticoagulantes orales se recomienda como terapia alternativa el uso de heparina de bajo peso molecular | D |
| Recomendación: En el caso de presentar recurrencias trombóticas arteriales recibiendo anticoagulación estándar, el tratamiento se puede optimizar asociando antiagregación o aumentando la dosis de anticoagulación (INR 3-4) | D |
| Recomendación: En el SAF trombótico refractario al tratamiento convencional se recomienda el control estricto de los factores de riesgo cardiovascular y el evitar las situaciones predisponentes a nuevos eventos trombóticos | D |
| Recomendación: Los anticoagulantes orales de acción directa podrían ser una opción terapéutica en pacientes que presentan alergia a dicumarínicos y/o dificultad para mantener el INR en rango terapéutico a los antagonistas de la vitamina K únicamente en caso de trombosis venosa y perfil de bajo riesgo trombótico (ausencia de triple positividad) | √ |
aβ2GPI: anti-b2-glicoproteína I; aCL: anticuerpos anticardiolipina; AL: anticoagulante lúpico; GR: grado de recomendación (ver anexo); SAF: síndrome antifosfolípido.
De los AAF incluidos en los criterios de clasificación (AL, aCL y aβ2GPI), ¿cuáles son los que tienen mayor riesgo de desarrollar trombosis venosas y/o arteriales y complicaciones obstétricas?
Recomendación:En los pacientes con SAF se recomienda la detección simultánea de los tres AAF incluidos en los criterios de clasificación (AL, aCL y aβ2GPI) para establecer el riesgo de trombosis o de complicaciones obstétricas (recomendación de gradoC).
Recomendación:El riesgo de presentar manifestaciones clínicas del SAF es mayor cuando se detecta anticoagulante lúpico o más de un AAF diferente (doble y, en particular, triple positividad) en el mismo paciente (recomendación de gradoB).
Las manifestaciones clínicas del SAF se asocian con la detección de AAF. Los AAF pueden ser detectados a través de la prolongación de pruebas de coagulación dependiente de fosfolípidos, lo que se denomina anticoagulante lúpico (AL), o mediante ensayos en fase sólida como los ELISA para los aCL, IgG y/o IgM o aβ2GPI, Ig y/o IgM. Actualmente los criterios de clasificación del SAF solo incluyen la detección de estos AAF. Un paciente cumple el criterio de laboratorio cuando se detecta al menos uno de estos AAF en suero o plasma, en dos o más ocasiones separadas al menos 12semanas. No obstante, el riesgo de trombosis o de complicaciones obstétricas puede ser diferente según se detecte uno solo de estos anticuerpos o sus combinaciones.
Los abortos recurrentes son más frecuentes en los pacientes con aCL de clase IgG y/o IgM10,11(NE 2++) o AL12,13(NE 2−). Los anticuerpos aβ2GPI de clase IgG y/o IgM se asocian con una mayor tasa de pérdidas fetales11,14,15 en comparación con aCL y AL16, en especial un mayor riesgo de pérdidas fetales tardías12(2−). La mayoría de los estudios encuentran que la detección de más de un AAF en la misma paciente aumenta el riego de abortos recurrentes10,13,15-19(NE 2++, 2+, 2−, 3).
Las trombosis venosas y/o arteriales recurrentes son más frecuentes en los pacientes con AL20-28(NE 2++, 2+, 2−), anticuerpos aCL16,21,22,26,29-35(NE 2++, 2+, 2−, 3) o anticuerpos aβ2GPI21,22,24,27,28,33,36-39(NE 2++, 2+, 2−). La detección de más de un AAF en el mismo paciente aumenta el riesgo de trombosis venosas y/o arteriales recurrentes24,25,37,39, en particular la triple positividad AL, aCL y aβ2GPI16,23,24(NE 2++, 2+).
A la vista de estos estudios, el grupo elaborador considera que en los pacientes con SAF el riesgo de abortos y trombosis venosas y/o arteriales recurrentes es mayor cuando se detectan diferentes AAF en el mismo paciente. Los resultados de los diferentes estudios son consistentes y la mayoría sugieren la detección conjunta de los AAF incluidos en los criterios de clasificación (AL, aCL y aβ2GPI).
El grupo elaborador entiende también que los resultados de los estudios evaluados son de aplicación directa a nuestro sistema sanitario, ya que la detección de los AAF incluidos en los criterios de clasificación (AL, aCL y aβ2GPI) está al alcance de todos los hospitales y centros de especialidades.
La detección de más de un AAF permite seleccionar al subgrupo de pacientes con SAF y mayor riesgo de abortos recurrentes y trombosis venosas y/o arteriales recurrentes, con las consiguientes implicaciones en el pronóstico y el tratamiento.
Anticuerpos antifosfolípidos no incluidos en los criterios de clasificación¿Cuándo es necesario realizar la detección de los AAF no incluidos en los actuales criterios de clasificación del SAF?
Recomendación:En la práctica clínica habitual, en la población general con sospecha de SAF o en pacientes ya diagnosticados de la enfermedad no se recomienda realizar la detección de los AAF no incluidos en los criterios de clasificación (recomendación de gradoD).
Los criterios de clasificación de Sídney solo incluyen tres de los AAF conocidos: AL, los aCL (IgM e IgG) y los aβ2GPI (IgM e IgG). La detección del resto de los AAF aún no está indicada en la práctica asistencial. No hay suficiente información sobre cuál es su significado clínico, pero muchos de los nuevos AAF descritos son potencialmente importantes en la fisiopatología del SAF y en el momento actual no se sabe si deben incluirse en el algoritmo diagnóstico y en el estudio rutinario de los pacientes con SAF.
Entre los nuevos AAF se describen a continuación los más relevantes en cuanto a su implicación en trombosis o en problemas obstétricos.
Dominio 1 de los anticuerpos aβ2GPIEstudios recientes han descrito una mayor prevalencia y mayores títulos del dominio1 de los anticuerpos aβ2GPI en pacientes con múltiples AAF, y varios estudios multicéntricos los asocian a trombosis, sobre todo venosa. Se ha postulado su detección para evaluar el riesgo trombótico de los pacientes con AAF, pero se necesitan estudios para validarlo40-42(NE 3, 4).
Isotipo IgA aCL y aβ2GPILos isotipos IgA de los aCL y aβ2GPI podrían ser útiles en el diagnóstico de SAF seronegativo, definido como manifestaciones clínicas del SAF en ausencia repetida de AAF detectados con las técnicas rutinarias. Por ello, aunque hay controversia, algunos expertos internacionales aconsejan solicitarlos en su estudio en pacientes con sospecha de SAF seronegativo43(NE 4).
Anticuerpos anti-protrombina y anti-complejo fosfatidilserina/protrombinaLa detección de los anticuerpos anti-protrombina se realiza directamente en placa, bien contra la protrombina, bien contra el complejo fosfatidilserina-protrombina (aPS-PT). Aunque pueden coexistir en el mismo paciente, son anticuerpos diferentes. La detección de anticuerpos aPS-PT se asocia con más riesgo de trombosis, y en especial con un mayor riesgo de complicaciones obstétricas, pero no se ha definido aún su papel en el diagnóstico del SAF44,45. Datos recientes de un estudio multicéntrico han demostrado que los anticuerpos frente al complejo fosfatidilserina-protrombina IgG son uno de los candidatos para en un futuro ser incluido en los criterios de clasificación del SAF46.
Anticuerpos anti-fosfatidiletanolamidaLa presencia de anticuerpos anti-fosfatidiletanolamida (aPE) se ha encontrado asociada tanto a manifestaciones trombóticas como con morbilidad obstétrica. En un estudio multicéntrico donde se evaluó tanto la prevalencia como el significado clínico y biológico de los aPE en 270 pacientes con eventos tromboembólicos se analizó su asociación con los pacientes que presentaban los AAF incluidos en los criterios y cumplían los criterios de clasificación de SAF. El 15% de los pacientes con trombosis presentaban aPE en comparación con el 3% de los controles (p<0,01). En el 63% de los pacientes con aPE y trombosis, los test para determinación de AAF fueron negativos. Los autores de este trabajo concluyeron que hay una fuerte asociación de aPE con el riesgo de trombosis, sugiriendo la posible utilidad de la determinación de este anticuerpo en pacientes con trombosis en los que los AAF son negativos47-50. Sin embargo, y como ocurre con los demás anticuerpos no incluidos en los criterios de clasificación, aún no se ha definido claramente su papel en el diagnóstico del SAF47-50.
Anticuerpos anti-vimentinaEstos anticuerpos activan las plaquetas y leucocitos, aumentan la P-selectina y son capaces de unirse a la cardiolipina51,52. Los pacientes con anticuerpos contra el complejo cardiolipina/anti-vimentina pueden presentar manifestaciones clínicas de SAF, pero también se detectan en pacientes con otras enfermedades autoinmunes.
Anticuerpos anti-anexina A5 y anti-anexina 2Los anticuerpos anti-anexinaA5 se han relacionado con complicaciones obstétricas53-55, y en algunos estudios con trombosis, pero no se ha establecido su papel en el SAF54.
La anexina 2 es un cofactor de la generación de plasmina y tiene actividad fibrinolítica56-58. Se han detectado anticuerpos anti-anexina2 en pacientes con SAF, y pueden tener un papel patogénico56-58.
Anticuerpos anti-proteína SAlteran la función de la proteína S, y hay estudios que los relacionan con un mayor riesgo de trombosis venosa, pero no se han realizado estudios de calidad en pacientes con SAF59.
La evidencia actual existente con respecto a los AAF no incluidos en los criterios de clasificación se basa en estudios observacionales o de cohortes con pocos pacientes, y por ello es difícil establecer recomendaciones sobre su detección para incluirlos de forma definitiva en el panel de los AAF. Para conocer su aplicabilidad clínica se deberá estandarizar su determinación a nivel de laboratorio. A nivel clínico, se necesitan estudios con mayor evidencia clínica para establecer si deben ser incluidos en los criterios diagnósticos de SAF59,60.
Paciente con síndrome antifosfolípido primario anticoagulado¿Cuáles son los anticuerpos antifosfolípidos que se pueden realizar y cuándo para el diagnóstico y el seguimiento de un paciente con SAF anticoagulado?
Recomendación:No se recomienda realizar la detección de anticuerpos antifosfolípidos si el paciente está anticoagulado y diagnosticado (recomendación de grado √).
Recomendación:En pacientes con trombosis provocada, perfil de bajo riesgo trombótico y sin factores de riesgo cardiovascular convencionales se puede considerar la repetición de los anticuerpos para valorar la necesidad de anticoagulación indefinida (recomendación de grado √).
Recomendación:Se recomienda repetir la determinación de los anticuerpos antifosfolípidos incluidos en los criterios de clasificación (excepto el anticoagulante lúpico) al menos a las 12semanas (recomendación de grado √).
Recomendación:Si el anticoagulante lúpico hubiera sido positivo en el diagnóstico inicial y se desea confirmar, individualizando cada paciente según el riesgo de trombosis, es recomendable suspender la anticoagulación oral al menos 1 o 2semanas antes de la determinación, utilizando heparina a dosis terapéuticas (asociada a ácido acetilsalicílico a dosis antiagregantes en caso de trombosis arterial previa) y suspendiéndola la noche anterior para evitar interferencias en los resultados de laboratorio (recomendación de grado √).
En la mayoría de los pacientes que hacen trombosis se realiza, al menos, una determinación de los AAF, pero una vez anticoagulados, los expertos coinciden en la necesidad de realizar una nueva determinación a las 12semanas, para cumplir los criterios Sídney y que el diagnostico de SAF sea correcto. Para los anticuerpos aCL y aβ2GPI no existen interferencias con los anticoagulantes y es posible su repetición estando bajo anticoagulación. Pero en el caso de AL, si hay interferencias a nivel de medición en el laboratorio, su interpretación puede ser errónea en presencia de anticoagulantes. De ahí que los consensos internacionales recomienden realizar la determinación de AL sin la presencia de anticoagulantes, por lo que en pacientes con antagonistas de la vitaminaK (AVK)se debería suspender la anticoagulación entre 1 y 2semanas, pasándose durante este periodo a heparina de bajo peso molecular (HBPM) a dosis terapéutica y suspendiéndola 12h antes de realizar la prueba61,62.
Hay también dos estudios, realizados para validar pruebas de detección del AL en pacientes anticoagulados, que concluyen que en la situación clínica en la que el paciente anticoagulado con riesgo elevado de trombosis precise la confirmación de la positividad del AL, se podría considerar realizar el tiempo de veneno de víbora de Taipan con tiempo de Ecarina para confirmar su positividad y así poder evitar la suspensión de la coagulación. Sin embargo, a pesar de su alta especificidad, su sensibilidad es baja, y no está disponible en todos los laboratorios de coagulación para su determinación rutinaria. En cualquier caso, el criterio clínico debe prevalecer, y ante un paciente con elevado riesgo de trombosis el panel considera que no es imprescindible la confirmación del AL para el diagnóstico de la enfermedad63,64.
La monitorización de los AVK en pacientes con SAF también es un punto importante, ya que diferentes estudios muestran que en los pacientes con SAF existe un fenómeno de resistencia a la warfarina, y que dadas las interferencias a nivel de detección del INR, se considera importante en el manejo del paciente que ya recibe anticoagulación mantener un INR≥3. La determinación de este parámetro debe realizarse utilizando un tubo citratado en el laboratorio. En caso de recurrencias de eventos trombóticos, los estudios concluyen que se debe realizar la determinación de un anti-Xa para valorar los niveles reales de anticoagulación. Además, los controles por punción digital, hoy por hoy, no son tan fiables como la punción venosa61,65-69.
En cuanto al significado clínico de la determinación de los AAF, en el seguimiento del SAF en pacientes anticoagulados la evidencia es escasa65-69. En un estudio prospectivo de pacientes anticoagulados por enfermedad arterial se comparan warfarina y aspirina en la prevención de recidiva de ictus, con seguimiento de 2años69. No hay diferencias significativas entre los pacientes con AAF positivo o no, pero los pacientes con AAF tienen una mayor tasa de eventos (31,7%) frente a los que no los tienen (24%). Los autores concluyen que una detección de AAF sin una confirmación posterior no identifica pacientes de alto riesgo, pero la doble positividad identifica a estos pacientes de alto riesgo. Concluyen también que en jóvenes con ictus deben estudiarse los AAF69.
La relevancia de estos estudios se basa en mejorar el conocimiento de la complejidad de la monitorización de la anticoagulación en pacientes con SAF. No está indicado realizar las pruebas de AAF en pacientes anticoagulados de manera indefinida para el seguimiento, ni durante el tratamiento anticoagulante. No existen datos de que ello suponga un cambio en la actitud terapéutica: tan solo identifica los pacientes de alto riesgo de recidiva70.
Tampoco existen datos en cuanto a su utilidad en determinar los AAF en pacientes con trombosis provocada, pero dado el riesgo hemorrágico asociado a los AVK, en algunos casos se puede individualizar el seguimiento para determinar si precisan tratamiento anticoagulante indefinido o no71,72.
En resumen, hay estudios que muestran la dificultad de medir el AL en presencia de anticoagulantes, tanto para el diagnóstico como para el seguimiento. Se pueden medir los otros AAF (IgM e IgG), pero no existe evidencia consistente en cuanto a su utilidad en el seguimiento a largo plazo, ni que ello suponga un mayor riesgo ni un cambio de actitud terapéutica.
Tromboprofilaxis primariaEn pacientes con AAF que no cumplen los criterios SAF, ¿cuál es la profilaxis más eficaz?
Recomendación:En pacientes portadores de anticuerpos antifosfolípidos, sin clínica asociada a SAF, se recomienda el tratamiento profiláctico puntual con heparina de bajo peso molecular en situaciones de alto riesgo trombótico (inmovilización prolongada, cirugía reciente, puerperio, estimulación ovárica, etc.) (recomendación de gradoC).
Recomendación:En pacientes con perfil de riesgo bajo solo se recomienda el tratamiento profiláctico cuando hay factores de riesgo cardiovascular asociados. Debe hacerse con dosis bajas de ácido acetilsalicílico y con la corrección o el tratamiento de los factores de riesgo cardiovascular (recomendación de gradoC).
Recomendación:En pacientes portadores de anticuerpos antifosfolípidos y trombocitopenia asociada se recomienda el tratamiento profiláctico con dosis bajas de ácido acetilsalicílico (recomendación de gradoC).
Recomendación:En pacientes con perfil de riesgo medio/alto se recomienda el tratamiento profiláctico con dosis bajas de ácido acetilsalicílico de forma indefinida (recomendación de gradoC).
Recomendación:En pacientes portadores de anticuerpos antifosfolípidos, sin clínica asociada a SAF, con deseo concepcional se recomienda valorar el tratamiento profiláctico con dosis bajas de ácido acetilsalicílico de acuerdo al perfil de riesgo (recomendación de gradoC).
En el momento actual, el riesgo trombótico en individuos portadores de AAF (cumpliendo los criterios serológicos), sin clínica asociada, no está bien establecido. Los datos obtenidos de series de pacientes con características muy heterogéneas oscilan en incidencias anuales que van desde el 0% hasta el 7,4%6,73. Los AAF son frecuentes en la población general, y no todos los portadores presentan el mismo riesgo de desarrollar manifestaciones de la enfermedad en el futuro74. De entre todos los factores de riesgo para desarrollar clínica de SAF los expertos coinciden en que cuatro de ellos son fundamentales, y son los que deben guiar la estratificación de los individuos portadores de AAF a la hora de decidir la necesidad o no de profilaxis primaria34,74-77. Estos cuatro factores son el perfil de AAF, la presencia de factores de riesgo cardiovascular, la presencia de otras manifestaciones asociadas al SAF (no incluidas en los criterios) y el hecho de padecer otra enfermedad autoinmune asociada, especialmente LES (tabla 4). Mientras que estos factores de riesgo han mostrado su posible utilidad a la hora de estratificar el riesgo de trombosis en este grupo de individuos portadores de AAF, su papel en el riesgo de desarrollar manifestaciones obstétricas no está tan claro6.
Factores de riesgo clínicos y serológicos para desarrollar manifestaciones clínicas en pacientes portadores de anticuerpos antifosfolípidos
| Clínicos | |
| Factores de riesgo cardiovascular clásicos | |
| Tabaquismo | |
| HTA | |
| Dislipemia | |
| Enfermedad autoinmune asociada | |
| LES | |
| Manifestaciones asociadas al SAF | |
| Trombocitopenia | |
| Serológicos | |
| Perfil de alto riesgo | |
| AL positivo | |
| Triple positividad (AL + aCL + aβ2GPI) | |
| aCL positivo de forma persistente a título medio-alto | |
| Perfil de bajo riesgo | |
| aCL o aβ2GPI positivo de forma intermitente a títulos medio-bajo | |
aβ2GPI: anti-β2 glicoproteina I; aCL: anticuerpos anticardiolipina; AL: anticoagulante lúpico; HTA: hipertensión arterial; LES: lupus eritematoso sistémico.
Elaboración propia. Factores serológicos modificados de Ruiz-Irastorza et al.74.
Aunque existe una clara controversia sobre qué pacientes con AAF positivos deben recibir profilaxis primaria, la mayoría de los expertos coinciden en que se debe administrar profilaxis a todos estos pacientes durante situaciones de alto riesgo protrombótico (inmovilización prolongada, cirugía reciente, embarazo y puerperio, estimulación ovárica, síndrome nefrótico, etc.)6,74. Esta recomendación se basa en los datos de dos estudios observacionales en los que los pacientes con AAF positivos sin clínica asociada presentaron una reducción significativa de los eventos trombóticos durante el seguimiento, cuando se les administró profilaxis únicamente durante las situaciones de riesgo (cirugía o inmovilización)25,78(NE 2+).
En el momento actual, solo existe un ensayo clínico que aborda la profilaxis primaria en pacientes portadores de AAF. El ensayo clínico de Erkan et al.79 incluyó 98 pacientes con AAF positivos, con o sin enfermedad sistémica autoinmune, que fueron aleatorizados a recibir ácido acetilsalicílico (AAS) (81mg/día) o placebo y fueron seguidos durante 3años. Este ensayo no encontró un resultado favorable para la profilaxis primaria con AAS. Tres de los 48 pacientes con AAS presentaron trombosis (2,75 casos por 100 pacientes-años) frente a ninguno de los 50 controles, lo que se traduce en un HR de 1,04 (IC95%: 0,69-1,56; p=0,830) (NE 1+). Sin embargo, este estudio ha sido ampliamente criticado por los expertos y presenta numerosas limitaciones. El número reducido de pacientes incluidos, el seguimiento escaso de los mismos, el perfil de AAF de los pacientes y la elevada proporción de pacientes con LES hacen que los resultados de este trabajo se deban interpretar con suma cautela6. A pesar de sus limitaciones, la mayoría de los expertos consideran que en individuos portadores de AAF y con un perfil de bajo riesgo el tratamiento con dosis profilácticas de AAS de forma crónica no está justificado6,74.
Arnaud et al.80 llevaron a cabo un metaanálisis de estudios observacionales, solicitando a los autores de los estudios datos de pacientes individuales para determinar si la AAS tiene un efecto protector sobre el riesgo de primera trombosis en pacientes con AAF positivos sin criterios clínicos de SAF. Se incluyeron 5 estudios de cohortes internacionales que sumaban 497 sujetos y 79 primeras trombosis (3.469 pacientes-años de seguimiento). Tras ajustar por factores de riesgo cardiovascular, por perfiles de AAF y por el tratamiento con hidroxicloroquina (HCQ), el HR para una primera trombosis de cualquier tipo en personas tratadas con AAS a dosis bajas frente a las no tratadas fue de 0,43 (IC95%: 0,25-0,75). El análisis por subgrupos según el tipo de trombosis mostró un efecto protector de la AAS frente a trombosis arterial (HR: 0,43; IC95%: 0,20-0,93) pero no venosa (HR: 0,49; IC95%: 0,22-1,11). El análisis por subgrupos según la enfermedad subyacente reveló un efecto protector de la AAS frente a la trombosis arterial en pacientes con LES (HR: 0,43; IC95%: 0,20-0,94) y en portadores asintomáticos (HR: 0,43; IC95%: 0,20-0,93) (NE 2++). En un estudio observacional prospectivo81 que incluía individuos portadores asintomáticos de AAF, y tras un seguimiento de 9años, se identificaron como principales factores asociados al desarrollo de trombosis la doble/triple positividad de los AAF, la presencia de factores de riesgo cardiovascular clásicos (tabaquismo) y la presencia concomitante de otras enfermedades autoinmunes. En este estudio, también la profilaxis durante las situaciones de riesgo se asoció con un menor desarrollo de trombosis81(NE 3).
Así pues, y aunque no se puede recomendar profilaxis primaria en todos los individuos portadores de AAF, de acuerdo con la escasa evidencia disponible, todos los expertos coinciden en la necesidad de estratificar el riesgo trombótico de acuerdo a los parámetros antes definidos, en la corrección y el tratamiento de los factores de riesgo cardiovascular clásicos, y en la necesidad de profilaxis primaria indefinida con dosis antiagregantes de AAS en los individuos considerados de riesgo6,74. En este grupo de riesgo deben incluirse los pacientes que presenten una enfermedad autoinmune asociada, especialmente el LES74.
De las diversas manifestaciones clínicas asociadas al SAF pero que no están incluidas en los criterios de clasificación de la enfermedad, la trombocitopenia es la única que ha demostrado de manera más concluyente su asociación con un mayor riesgo trombótico75,82-84. En otras manifestaciones, como la afectación cardiaca o cutánea, no se ha podido comprobar de forma concluyente una asociación tan clara con el desarrollo de trombosis o clínica obstétrica.
En el momento actual no existe ningún estudio bien diseñado que evalúe la eficacia de la anticoagulación en pacientes con AAF sin clínica asociada. Tan solo un estudio realizado en una población diferente (SAF obstétrico puro y pacientes con LES) ha comparado el tratamiento con AAS asociado a anticoagulación de baja intensidad (INR de 1,5) frente a dosis antiagregantes de AAS para la profilaxis primaria de fenómenos trombóticos73. A pesar de las limitaciones del estudio, no se encontraron diferencias significativas en cuanto a la prevención de eventos trombóticos entre ambos grupos de tratamiento, pero el grupo que incluía la anticoagulación de baja intensidad sí presentó un mayor número de episodios de sangrado.
Mientras que la información sobre tromboprofilaxis primaria en individuos portadores de AAF es reducida, los estudios publicados hasta la fecha respecto a la profilaxis de complicaciones obstétricas en esta población son todavía, si cabe, más escasos. En el momento actual se considera que las mujeres con SAF obstétrico presentan un mayor riesgo de desarrollar trombosis en el futuro85. Mientras que el tratamiento con heparina asociado a AAS parece eficaz en la prevención de pérdidas fetales tempranas86,87, dicha combinación no ha demostrado su eficacia en la prevención de complicaciones tardías de la enfermedad86-88. La situación clínica que nos ocupa —profilaxis primaria en mujeres portadoras de AAF— es difícil de contestar en el momento actual debido a la falta de estudios en esta población. Por un lado, la solicitud de AAF no suele realizarse en mujeres que no hayan presentado previamente clínica obstétrica, y por otro, en los escasos estudios disponibles se incluye una población de estudio sumamente heterogénea, y en varios de ellos se incluyen pacientes con LES u otras enfermedades autoinmunes89(NE 1+).
El estudio de Amengual et al.89, una revisión sistemática reciente donde se analizan 154 embarazos (92 con tratamiento profiláctico y 62 sin tratamiento), concluyó que no hay evidencia actualmente que demuestre que el uso de AAS a dosis profilácticas sea superior a placebo o a la atención habitual para prevenir resultados obstétricos desfavorables durante el primer embarazo en mujeres sanas portadoras de AAF90-92. En un estudio reciente publicado únicamente en forma de abstract93 se realizó una revisión de 70 embarazos en 62 mujeres portadoras de AAF. Los factores asociados con un peor pronóstico obstétrico fueron la triple positividad para AAF, la presencia de factores de riesgo adquiridos (fundamentalmente factores de riesgo cardiovascular), la presencia de manifestaciones asociadas al SAF y la de manifestaciones «lupuslike». Curiosamente, las pacientes con peor pronóstico obstétrico también recibieron con mayor frecuencia terapia combinada con dosis bajas de AAS y heparina.
Tratamiento del síndrome antifosfolípido primario. Tromboprofilaxis secundariaSíndrome antifosfolípido primario y trombosis venosa¿Cuál es el tratamiento de la enfermedad tromboembólica venosa?
Recomendación:Los pacientes con anticuerpos antifosfolípidos y un primer episodio de trombosis venosa deben ser tratados con heparina no fraccionada o heparina de bajo peso molecular y posteriormente antagonistas de la vitaminaK (recomendación de gradoD).
Recomendación:En la prevención secundaria de la trombosis venosa se recomienda la anticoagulación a rango terapéutico para un INR de 2-3 (recomendación de gradoD).
Recomendación:En la prevención secundaria de la trombosis venosa se recomienda que la anticoagulación se mantenga indefinidamente (recomendación de gradoD).
La forma más frecuente de trombosis venosa en el SAF es la TVP con o sin embolia de pulmón asociada. Las recomendaciones de los grupos de expertos concluyen que el tratamiento de la trombosis venosa aguda en el SAF es el mismo que en otros pacientes con trombosis venosa, y consiste en anticoagulación con heparina no fraccionada o HBPM durante al menos 5días, seguido de AVK94(NE 4).
El tratamiento a largo plazo, la duración y la intensidad de la anticoagulación son aspectos esenciales que han sido revisados en la literatura, aunque la evidencia científica publicada es escasa95-101.
En un primer momento, estudios retrospectivos realizados en pacientes con SAF sugirieron que la anticoagulación intensa (INR≥3) es más efectiva que las pautas con rangos inferiores estándar102. Dos ensayos clínicos aleatorizados (ECA) posteriores no confirmaron que este rango de anticoagulación sea mejor que el estándar para obtener un INR2-3103,104. Ambos estudios fueron diseñados para intentar demostrar que la anticoagulación con warfarina para obtener rangos elevados era mejor que con rango más moderado en la prevención de trombosis recurrentes. En el primer ensayo, 114 pacientes con SAF (74% con trombosis venosa previa) fueron aleatorizados y seguidos durante una media de 2,7años. La incidencia de trombosis recurrente fue del 10,7% en los pacientes tratados con rango alto de anticoagulación frente al 3,4% en el grupo tratado con rango moderado (HR3,1; IC95%: 0,6-15). El riesgo de sangrado fue comparable entre ambos grupos (5,4% en el grupo tratado con rango elevado y 6,9% en el tratado con rango moderado de anticoagulación; HR1; IC95%: 0,2-4,8). Globalmente, la proporción de complicaciones hemorrágicas fue también similar: 25 y 19% de los pacientes, respectivamente (HR1,9; IC95%: 0,8-4,2). Sin embargo, el estudio incluyó un grupo de pacientes muy heterogéneo; la mayoría de ellos solo tenían aCL IgG o AL positivo aislados, y con un amplio rango de edad. Por tanto, pocos pacientes con elevado riesgo por presentar más de un subtipo de AAF fueron incluidos. En el segundo ensayo, 109 pacientes con SAF (89% con trombosis venosa previa) fueron aleatorizados y seguidos durante una media de 3,6años. La incidencia de trombosis recurrente fue del 11,1% en los pacientes tratados con rango alto de anticoagulación frente al 5,5% en el grupo tratado con rango moderado (HR1,97; IC95%: 0,49-7,89). Tampoco el riesgo de sangrado fue diferente en los dos grupos (27,8% vs 14,6%; HR2,18; IC95%: 0,92-5,15). Cuando los resultados de ambos ensayos se combinaron en un metaanálisis utilizando el método Peto105, se observó un aumento significativo del riesgo de sangrado leve en los pacientes tratados con altas dosis de anticoagulación (OR2,3; IC95%: 1,16-4,58; p=0,02). Los datos acumulados no demostraron diferencias en el riesgo de recurrencia de trombosis (rango alto vs moderado; OR2,49; IC95%: 0,93-6,67), sangrado global (OR1,73; IC95%: 0,93-3,31) o sangrado importante (OR0,73; IC95%: 0,23-2,31). Estos resultados fueron refrendados posteriormente con las recomendaciones de expertos tras celebrarse el 13.° Congreso Internacional de AAF74.
La revisión sistemática realizada por Ruiz-Irastorza et al.106 incluye 16 artículos: 9 retrospectivos y cohortes prospectivas78,102,107-112, 5 análisis de subgrupos70,113-116 y 2 ECA103,104(NE 1+, 2+). Aunque tiene las limitaciones propias de incluir estudios con diseños diferentes, al ser menos restrictiva en los criterios de inclusión establece unas conclusiones más generalizables. Las conclusiones principales de esta revisión son que, en el caso de trombosis venosa, la profilaxis secundaria debe realizarse con anticoagulación en rango estándar para alcanzar un INR2-3. Solo en el caso de trombosis venosas recurrentes, de acuerdo con los resultados de los estudios de cohortes, se recomienda anticoagular a dosis suficientes para mantener INR≥3. Por otra parte, un estudio demostró que una anticoagulación de baja intensidad con INR<1,9 no previene adecuadamente el riesgo de recurrencias111. El riesgo de sangrado importante por la anticoagulación es del 2-3% por año100, concluyendo que la recurrencia de trombosis es más frecuente y conlleva una mayor mortalidad que las complicaciones hemorrágicas provocadas por la warfarina.
Todos los trabajos publicados en la literatura acerca del tratamiento de la trombosis venosa en el SAF hacen referencia a la warfarina. Sin embargo, en nuestro entorno el fármaco utilizado preferentemente es el acenocumarol. Aunque no hay ningún estudio que compare específicamente su eficacia en el SAF, sí hay publicaciones en otras situaciones clínicas de las que se puede extrapolar que son similares, ya que tienen el mismo mecanismo de acción pero con distinta farmacocinética117,118.
Respecto a la duración del tratamiento anticoagulante, se deben considerar diferentes aspectos, como son si la trombosis venosa es espontánea o provocada por otros factores de riesgo (p.ej., inmovilización, anticonceptivos orales, etc.), la localización de la trombosis venosa y su extensión (TVP con o sin embolia pulmonar) o el perfil de los AAF, entre otros.
A pesar de la variabilidad en las recomendaciones publicadas para prevención secundaria de la trombosis venosa en los pacientes con SAF, todos los autores coinciden en que el riesgo de recurrencia es elevado en los pacientes con SAF no anticoagulados, por lo que se recomienda anticoagulación prolongada.
En un estudio prospectivo116, 105 pacientes con una sola determinación positiva de aCL fueron aleatorizados al grupo en el que se suspendía la warfarina tras 6meses de tratamiento y presentaron 23 recurrencias, frente a 3 en el grupo de 106 pacientes tratados indefinidamente (HR7,7; IC95%: 2,4-25). Todos los pacientes que presentaron recurrencias en el grupo tratado indefinidamente habían suspendido el tratamiento antes del evento. Sin embargo, el estudio tiene importantes limitaciones, como que la determinación de aCL se realizó en una sola ocasión y que los títulos fueron bajos en el 88%. Por tanto, puede que algunos pacientes no presentaran criterios de clasificación de SAF. En un segundo estudio observacional prospectivo119, en el que se determinó la presencia de aCL y AL tras el primer episodio de trombosis venosa, el HR para recurrencia a los 3meses fue de 4 (IC95%: 1,2-13) en los pacientes con AAF positivos frente a los que eran AAF negativos. Aunque estos pacientes recibieron tratamiento anticoagulante, la incidencia de trombosis recurrente fue superior en los pacientes con AAF positivos frente a los que no los tenían. Estudios prospectivos en pacientes con SAF tratados con terapia antitrombótica reflejan una incidencia de recurrencia de trombosis del 3 al 24% por año31,70,103,104, mientras que en otros retrospectivos el rango fue superior (53-69%)102,111. En las últimas recomendaciones del American College of Chest Physicians (ACCP) se concluye que en pacientes con TVP proximal o embolia pulmonar no provocados (ausencia de factores como embarazo, terapia hormonal, reposo o cirugía reciente) se debe mantener indefinidamente la anticoagulación120. Por tanto, el consenso general es tratar a los pacientes con SAF y trombosis venosa con anticoagulación indefinida94.
Sin embargo, la fortaleza de estas recomendaciones es limitada, según algunos autores, debido a la baja calidad de los estudios y a sus limitaciones metodológicas121.
Un escenario diferente es el caso de los pacientes en los que los AAF son persistentemente negativos durante años tras sufrir un evento trombótico, y se desconoce si en esta situación es seguro suspender la anticoagulación122,123.
Síndrome antifosfolípido primario y trombosis arterial¿Cuál es el tratamiento de la enfermedad tromboembólica arterial en un paciente con SAF?
Recomendación:Los pacientes con SAF primario y eventos trombóticos arteriales previos deben ser tratados con anticoagulación estándar (INR2-3) para prevenir recurrencias de trombosis arteriales (recomendación de gradoB).
El manejo de la trombosis arterial en los pacientes con SAF continúa siendo controvertido en cuanto a si se debe realizar con antiagregación plaquetaria, con anticoagulación o con ambas. Y en el caso de la anticoagulación, existe el debate sobre si debe realizarse a dosis para mantener un INR2-3 o que sea más intensa.
Existe mucha controversia en cuanto al manejo de la trombosis arterial, y específicamente de la isquemia cerebral en pacientes con SAF. La dificultad es consecuencia de diversos factores, como: ausencia de estudios bien diseñados prospectivos y aleatorizados; el que en la mayoría de los trabajos no diferencian entre trombosis venosas y arteriales; heterogeneidad metodológica y terapéutica, y, por último, que el diagnóstico de laboratorio de SAF no siempre se ha realizado de forma estricta de acuerdo a los criterios de clasificación. Así pues, como la evidencia científica encontrada para esta pregunta es escasa y no se han identificado estudios primarios que hayan sido diseñados específicamente para responderla, a la estrategia de búsqueda inicial se añadió una búsqueda paralela; pero los artículos obtenidos con ella tampoco respondían a la pregunta clínica, por lo que no han sido incluidos. En los estudios encontrados no se pueden obtener datos individualizados según el tipo de trombosis venosa o arterial, sino que son estudios diseñados para valorar la eficacia del tratamiento de la trombosis, en general, de pacientes con SAF primario.
A la vista de esto, el grupo elaborador decidió al final incluir, por tanto, aquellos estudios en los que o bien no hay distinción entre trombosis venosa y arterial, o que incluyen solo pacientes con trombosis venosa, o pacientes con trombosis arterial, pero que no distinguen entre SAF primario o secundario a LES70,103,104,124.
El subestudio The Antiphospholipid Antibodies and Stroke Study (APASS), realizado en el contexto del ensayo clínico Warfarin vs Aspirin Recurrent Stroke Study (WARSS), no encontró diferencias significativas entre el uso de antiagregación con AAS y warfarina en la prevención de eventos trombóticos, si bien no hizo distinción entre trombosis venosas y arteriales. Incluso en este trabajo, los autores no encontraron que la presencia de AAF fuera un factor predictor de recurrencia trombótica70(NE 1+).
En un primer momento, estudios retrospectivos realizados en pacientes con SAF sugirieron que la anticoagulación intensa (INR≥3) es más efectiva que las pautas con rangos inferiores estándar106. Tampoco se han encontrado diferencias entre la anticoagulación con warfarina en rango alto (para un INR3-4) o estándar (INR2-3) en dos ensayos clínicos que tampoco discriminaban entre trombosis arteriales y venosas y con la limitación de que la evidencia de estos estudios no puede extenderse a pacientes con eventos trombóticos arteriales previos, pues excluyeron pacientes con ictus previo y aquellos con trombosis recurrentes estando con anticoagulación103,104. Un análisis secundario de estos ensayos muestra que la anticoagulación en rango elevado (INR3-4) podría disminuir el riesgo de recurrencia de eventos trombóticos en pacientes con SAF. No obstante, esta conclusión resulta controvertida. Por una parte, cuando se analizan en conjunto los resultados de los dos únicos ensayos clínicos103,104 paradójicamente se observa un ligero incremento de recurrencias en los pacientes tratados con anticoagulación en rango alto (INR3-4) sin alcanzar la significación estadística (NE 1+). Pero en la revisión sistemática de Ruiz-Irastorza et al.106 se presenta un subanálisis sobre el INR en el momento de la recurrencia trombótica de los trabajos que recogen este dato. Son estudios heterogéneos y el autor concluye que la mayoría de las recurrencias ocurren con un INR inferior a 3 y propone que la anticoagulación intensa podría ser una mejor opción para evitar dichas recurrencias (NE 1+).
Específicamente, las conclusiones relativas al manejo de la isquemia cerebral se basan en estudios que incluyen pacientes con ictus de cualquier origen, análisis conjunto de terapia y no realizan distinción entre SAF primario o secundario a LES. De forma global, no se han encontrado diferencias significativas entre la utilización de antiagregación con AAS y la anticoagulación con warfarina en rango estándar. Sin embargo, en pacientes con SAF primario y antecedentes de evento cerebrovascular isquémico la terapia combinada con AAS y anticoagulación en rango estándar (INR2-3) es eficaz en la prevención secundaria de las recurrencias124(NE 1−).
Aunque la evidencia es limitada, los estudios muestran también que el riesgo de trombosis recurrente y de mortalidad por trombosis es mayor que el riesgo de mortalidad por hemorragia en los pacientes con SAF que reciben anticoagulación incluso en rango INR3-4102-104,106,107,111,116.
Por último, se ha identificado además un documento de recomendaciones elaborado por la asociación americana para el estudio del ictus125, del que se destacan dos de las directrices que formulan para los pacientes con ictus o accidente isquémico transitorio que reúnen criterios de SAF: a)se debe considerar la anticoagulación teniendo en cuenta el riesgo de recurrencia de eventos trombóticos y de sangrado, y b)cuando la anticoagulación aún no se ha iniciado, está indicado el tratamiento con antiagregación (NE 4).
A la vista de los resultados, no se puede confirmar la efectividad de ninguna terapia específica en pacientes con SAF primario y trombosis arterial. No se ha podido demostrar que existan diferencias significativas en la efectividad entre antiagregación y anticoagulación, y tampoco entre utilizar dosis altas y estándar de anticoagulación en la prevención secundaria de trombosis arteriales.
Al no identificarse estudios primarios que evalúen la eficacia de terapias en pacientes con SAF primario y trombosis arterial no podemos generalizar los resultados de los estudios utilizados como evidencia científica a la población diana a la que van dirigidas las recomendaciones. No obstante, el panel de expertos después de revisar la evidencia ha considerado que en pacientes con SAF definido por criterios clínicos y analíticos, particularmente en aquellos con otros factores de riesgo vascular o de elevado riesgo por presentar triple positividad de AAF, se podría recomendar anticoagulación en rango estándar (INR2-3). Finalmente, el grupo elaborador ha decidido también emitir una recomendación para valorar la asociación de antiagregación en casos de haber presentado más de una recurrencia o de mal control de la anticoagulación.
Síndrome antifosfolípido primario y recurrenciaEn pacientes con SAF trombótico que presentan una recurrencia a pesar del tratamiento convencional, ¿cuál debe ser la actitud terapéutica?
Recomendación:En el SAF trombótico refractario al tratamiento convencional se recomienda asociar a la terapia convencional dosis antiagregantes de ácido acetilsalicílico, hidroxicloroquina o estatinas (recomendación de gradoD).
Recomendación:Cuando hay una contraindicación formal a anticoagulantes orales se recomienda como terapia alternativa el uso de heparina de bajo peso molecular (recomendación de gradoD).
Recomendación:En el caso de presentar recurrencias trombóticas arteriales recibiendo anticoagulación estándar, el tratamiento se puede optimizar asociando antiagregación o aumentando la dosis de anticoagulación (INR3-4) (recomendación de gradoD).
Recomendación:En el SAF trombótico refractario al tratamiento convencional se recomienda el control estricto de los factores de riesgo cardiovascular y el evitar las situaciones predisponentes a nuevos eventos trombóticos (recomendación de gradoD).
El tratamiento convencional del SAF trombótico continúa basado en el tratamiento anticoagulante con AVK100,126. El tratamiento con anticoagulación de moderada intensidad (INR entre 2 y 3) reduce el riesgo de un nuevo episodio trombótico venoso, y probablemente de nuevos episodios arteriales. En pacientes con accidente cerebrovascular agudo tanto el AAS a dosis antiagregante como la anticoagulación de moderada intensidad han demostrado su eficacia a la hora de prevenir nuevos eventos74,100. Sin embargo, y a pesar de un tratamiento convencional correcto, un porcentaje no despreciable de los pacientes con SAF trombótico desarrolla nuevos episodios trombóticos127. En el momento actual el tratamiento de los pacientes con SAF trombótico refractario sigue siendo controvertido y no existen estudios bien diseñados que aborden esta situación clínica.
Aunque se ha propuesto que el aumento en la intensidad de la anticoagulación (INR>3,0) puede ser una opción en pacientes con SAF trombótico refractario, 2ECA han demostrado la ineficacia de esta opción y un mayor riesgo de hemorragia103,104. A pesar de estos estudios, la intensidad de la anticoagulación en pacientes con eventos trombóticos arteriales sigue siendo controvertida128,129. En cualquier caso, en primer lugar, se debe comprobar si la recurrencia trombótica se produjo en un rango subterapéutico de INR para considerar el evento como refractario o no a la terapia anticoagulante130. En un documento elaborado por expertos se ha recomendado el uso de tratamiento con HBPM como alternativa a la anticoagulación oral convencional en pacientes con SAF trombótico refractario74. Esta recomendación está basada únicamente en series de pacientes con un limitado número de individuos tratados131,132 y en el aceptable perfil de seguridad de la HBPM (NE 3). La necesidad de inyección subcutánea diaria y las consideraciones sobre el riesgo de trombocitopenia inducida por heparina (poco frecuente con HBPM), y especialmente de osteoporosis con su uso prolongado, son las principales limitaciones de esta opción terapéutica133. En pacientes con SAF trombótico refractario se ha sugerido la posibilidad de añadir AAS a dosis antiagregante al tratamiento con anticoagulantes orales127,134. Aunque la combinación de ambos tratamientos puede ser más eficaz que la monoterapia a la hora de evitar la recurrencia de accidente cerebrovascular agudo, también se asocia a un mayor riesgo de sangrado70,124. Aunque solo publicado en forma de abstract, un estudio realizado en Japón ha sugerido la posible eficacia de la doble antiagregación en pacientes con SAF arterial recurrente135.
La hidroxicloroquina (HCQ) es un agente antimalárico de conocidas propiedades antiinflamatorias y antitrombóticas en pacientes con LES136. De igual modo, tanto en modelos experimentales de SAF como en estudios in vitro e in vivo la HCQ ha demostrado su capacidad antitrombótica133,136. Además, en un estudio retrospectivo la HCQ ha demostrado su capacidad para reducir los niveles de AAF y la incidencia de trombosis arterial en pacientes con SAF primario137 y de reducir los niveles de AAF en pacientes con LES138. En un estudio prospectivo no aleatorizado139 la HCQ asociada a anticoagulantes orales ha demostrado su capacidad de reducir el riesgo de recurrencia trombótica venosa comparado con anticoagulación en pacientes con SAF primario.
Las estatinas poseen una gran cantidad de propiedades que pueden ser de utilidad en la prevención y el tratamiento de los pacientes con trombosis140. En un estudio reciente que incluía diversos grupos de pacientes con AAF positivos se demostró que la asociación de fluvastatina disminuía significativamente los biomarcadores proinflamatorios y protrombóticos asociados a la presencia de AAF141.
El uso de terapia biológica en pacientes con SAF y SAF refractario está limitado a pequeñas series de pacientes y a casos individuales. En una revisión de la literatura reciente se ha descrito la posible utilidad de rituximab en algunas manifestaciones como las alteraciones hematológicas, la afectación cutánea, el deterioro cognitivo o la afectación renal, aunque su papel en el SAF trombótico estrictamente no está bien aclarado142,143. El uso de eculizumab ha sido descrito de forma anecdótica y habitualmente fuera de las indicaciones del SAF trombótico refractario. La posible utilidad de las inmunoglobulinas intravenosas en pacientes con SAF trombótico refractario también ha sido sugerida en pequeñas series de pacientes, aunque a día de hoy no existen estudios correctamente diseñados que lo demuestren144,145.
Como es bien sabido, tanto los factores de riesgo cardiovascular tradicionales como determinadas situaciones protrombóticas (fármacos, cirugía, enfermedades concomitantes, etc.) pueden jugar un papel fundamental en el desarrollo de trombosis en pacientes con AAF y/o SAF134,146,147. Aunque no existen estudios que evalúen de forma adecuada el impacto del control estricto de los factores de riesgo cardiovascular y/o la prevención adecuada en determinadas situaciones protrombóticas, parece razonable pensar que el control adecuado de ambas situaciones clínicas puede contribuir a una disminución del riesgo de recurrencia de trombosis en pacientes con SAF126.
Nuevos anticoagulantes orales¿Cuál es el papel de los anticoagulantes orales de acción directa (ACOD) en el tratamiento de los pacientes con SAF trombótico?
Recomendación:Los anticoagulantes orales de acción directa podrían ser una opción terapéutica en pacientes que presentan alergia a dicumarínicos y/o dificultad para mantener el INR en rango terapéutico a los antagonistas de la vitamina K únicamente en caso de trombosis venosa y perfil de bajo riesgo trombótico (ausencia de triple positividad) (recomendación de grado√).
La anticoagulación de elección en pacientes con SAF trombótico continúa siendo con AVK, dada la falta de estudios aleatorizados de los ACOD para estos pacientes y a pesar del uso de estos fármacos en el tratamiento de la enfermedad tromboembólica72,148-151.
Los ACOD tienen frente a la warfarina una eficacia similar en el tratamiento de la enfermedad tromboembólica y una mayor seguridad en cuanto a la aparición de hemorragias. Estos fármacos pueden ser útiles en el tratamiento del SAF, pero aún no se han establecido recomendaciones para su utilización frente a los AVK. Esta modalidad terapéutica resulta muy atractiva al no ser necesaria la monitorización y porque tiene menos interacciones con otros fármacos o con los alimentos. Sin embargo, los resultados en pacientes con SAF continúan siendo poco concluyentes.
Hay 4 ensayos clínicos faseII/III, de los cuales 2 han presentado datos sobre pacientes con SAF (EINSTEIN y RAPS)148,152 y 2 están en fase de reclutamiento150,153 (TRAPS y ASTRO-APS).
El objetivo del estudio EINSTEIN-TVP de faseIII era evaluar la no inferioridad de rivaroxabán frente a enoxaparina/AVK en el tratamiento de la TVP sintomática aguda sin embolia pulmonar sintomática y en la prevención de acontecimientos tromboembólicos venosos recurrentes. Incluye pocos pacientes con enfermedad trombofílica conocida (un 6,2%), y de estos solo un 14% tenían SAF. La incidencia de eventos para la variable principal de eficacia fue baja en comparación con el tratamiento estándar de enoxaparina/AVK (0,9% frente a 2,6%, respectivamente), pero el tamaño de la muestra fue tan reducido que no hay datos que avalen que el tratamiento con ACOD fuera más eficaz148.
El estudio RAPS es un ECA prospectivo abierto, de no inferioridad, en pacientes con SAF y antecedentes de enfermedad tromboembólica venosa, cuyo objetivo principal fue demostrar que la intensidad de la anticoagulación alcanzada con rivaroxabán no era inferior a la alcanzada con warfarina, empleando para ello la prueba de generación de trombina. Se incluyeron 116 pacientes con SAF, con o sin LES, que presentaron al menos un evento tromboembólico y que habían estado en tratamiento estándar con warfarina al menos durante 3meses tras el último evento tromboembólico venoso. No existieron diferencias en el desarrollo de nuevos eventos trombóticos y en el riesgo de sangrado entre rivaroxabán y warfarina. Aunque rivaroxabán no alcanzó el objetivo primario del estudio (efecto anticoagulante a nivel analítico) frente a warfarina, los autores concluyen que lo consideran un tratamiento alternativo seguro y efectivo en pacientes con SAF. También se pone de manifiesto la necesidad de realizar más estudios que evalúen el papel de los ACOD en pacientes con necesidad de una anticoagulación de mayor intensidad, tras eventos trombóticos recurrentes estando en intensidad estándar, y en aquellos con antecedentes de trombosis arteriales152.
El estudio TRAPS, en fase de reclutamiento, compara rivaroxabán y warfarina en pacientes de elevado riesgo de recurrencia, con SAF y antecedentes de eventos tromboembólicos arteriales o venosos150. El ASTRO-APS es un estudio piloto que está en marcha y compara apixabán con AVK en prevención secundaria153.
Hay varios estudios más, observacionales, registros y series de casos clínicos, realizados en práctica clínica real. En la mayoría de ellos no se produjeron eventos tromboembólicos recurrentes, sangrados mayores ni efectos adversos graves. En algunos casos pudo existir sesgo de selección de pacientes, pues previamente habían fallado también a warfarina. Los autores consideran a los ACOD como una alternativa terapéutica en pacientes con SAF, especialmente en aquellos con mal control de su INR, a la espera de los resultados de los ensayos clínicos en función del perfil de riesgo trombótico del paciente154,155.
Los estudios iniciales72,154,155 sugerían la posible utilidad de los anticoagulantes orales de acción directa, especialmente rivaroxabán en pacientes con SAF trombótico148,152; pero ante los resultados de un estudio reciente156 y la nota informativa emitida por la AEMPS157, el grupo de panelistas considera lo siguiente: En primer lugar, y aunque los resultados podrían ser consecuencia de un efecto de clase, se considera prematuro extender todos los hallazgos de un único estudio con un fármaco al resto de los ACOD. En segundo lugar, y dado que los eventos trombóticos fueron fundamentalmente trombosis arteriales, y en pacientes con un perfil serológico de alto riesgo (triple positividad), se debería evitar el uso de rivaroxaban en pacientes con este perfil clínico serológico. Sin embargo, la utilización de los ACOD podría considerarse, evaluando de forma individual con el paciente el riesgo/beneficio, como una opción terapéutica en pacientes que presentan alergia a dicumarínicos y/o dificultad para mantener en rango terapéutico a los AVK, únicamente en caso de trombosis venosa y perfil de bajo riesgo trombótico (ausencia de triple positividad).
ConclusionesSe presenta el primer consenso oficial de la Sociedad Española de Reumatología sobre el diagnóstico y tratamiento del SAF primario. Tras una exhaustiva revisión de la evidencia científica y al no existir muchos estudios de alta calidad, las recomendaciones se han basado fundamentalmente en revisiones sistemáticas, estudios de cohortes y de casos y controles, y en la opinión de expertos.
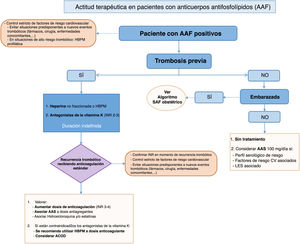
Se han elaborado 21 recomendaciones para las áreas de diagnóstico y evaluación; medidas de tromboprofilaxis primaria, y tratamiento del SAF primario o tromboprofilaxis secundaria. A partir de las recomendaciones se ha elaborado un algoritmo de manejo que presenta de forma resumida la aproximación al tratamiento del SAF (fig. 1).
Actualmente, en la práctica clínica diaria solo se deben determinar simultáneamente los AAF incluidos en los criterios de clasificación, detectados por técnicas ELISA (aCL y AB2GPI) o por pruebas coagulométricas (AL), para poder establecer el riesgo de trombosis o de complicaciones obstétricas. El riesgo de presentar manifestaciones clínicas del SAF es mayor cuando se detecta la presencia de AL, y especialmente si se detectan los 3 AAF (triple positividad) en un mismo paciente. El clínico debe tener en cuenta que la determinación del AL en pacientes anticoagulados no tiene la misma fiabilidad que en pacientes sin tratamiento.
La necesidad de profilaxis en individuos portadores de AAF sin clínica asociada a SAF es controvertida. El panel de expertos recomienda el uso de dosis antiagregantes de AAS en portadores con perfil serológico de riesgo y en los que presenten factores de riesgo cardiovascular y/o enfermedades autoinmunes asociadas (especialmente LES). En los portadores de AAF, independientemente del perfil de riesgo, se deberían utilizar puntualmente dosis profilácticas de HBPM en situaciones de alto riesgo trombótico.
Existen escasos estudios de calidad que permitan determinar cuál es la mejor opción terapéutica para las manifestaciones trombóticas del SAF. El panel de expertos recomienda ante un primer episodio de trombosis venosa iniciar tratamiento con heparina no fraccionada o HBPM, continuando con AVK con un rango terapéutico para un INR2-3 de forma indefinida. Para las manifestaciones trombóticas arteriales existe aún más controversia, pero el panel de expertos recomienda la misma actitud terapéutica inicial que con la trombosis venosa.
En el caso de recurrencia de las manifestaciones trombóticas a pesar del tratamiento estándar, el panel de expertos recomienda como opciones terapéuticas asociar AAS y/o HCQ o incrementar el rango de INR a 3-4.
Referente a la utilización de los ACOD en el tratamiento del SAF, y debido a la escasa información disponible en la actualidad, este panel de expertos recomienda su utilización prudente en determinadas situaciones como en SAF con alergia o intolerancia a los AVK, o en pacientes con trombosis venosas en los que no se consiga un buen control de INR con la terapia habitual.
Después de la exhaustiva revisión del diagnóstico y tratamiento del SAF, es evidente que se necesita realizar ensayos multicéntricos bien diseñados donde se estratifique a los pacientes no solo de acuerdo a las diferentes manifestaciones clínicas, sino también de acuerdo al perfil serológico y a la presencia de comorbilidades y que permitan determinar cuál es la mejor opción terapéutica en cada situación clínica. También son necesarios más estudios que proporcionen un conocimiento más profundo de la patogenia de la enfermedad, así como nuevos estudios que permitan aclarar el papel de los AAF no incluidos en los criterios de clasificación, y su posible utilidad en pacientes con sospecha de SAF pero que no cumplen los criterios vigentes en este momento.
Estas recomendaciones derivan de los datos disponibles en la actualidad y deben ser consideradas como una ayuda a la toma de decisiones del clínico directamente implicado en el cuidado del paciente con SAF. Las recomendaciones se consideran herramientas en la toma de decisiones para los clínicos, pero hay que tener en consideración tanto la decisión del médico experto en SAF como la opinión compartida con el paciente.
Agenda de investigaciónDespués de la revisión sistemática sobre la evidencia científica existente para el manejo del SAF primario, realizada para la elaboración de estas recomendaciones, el panel de expertos considera que quedan múltiples aspectos por incluir en la futura agenda de investigación. Entre otros se pueden mencionar los siguientes:
Detección de anticuerpos antifosfolípidos / Nuevos anticuerpos antifosfolípidos- -
Se necesitan investigaciones que puedan avanzar en un mejor conocimiento del valor patogénico tanto de los AAF incluidos como de los que no lo están en los criterios de clasificación del SAF primario.
- -
Se deberán realizar investigaciones que permitan consensuar las técnicas más idóneas para identificar los AAF relacionados con la patogenia de las trombosis y de la morbilidad durante el embarazo.
- -
Se necesitan estudios tanto in vitro como in vivo para identificar los AAF implicados en la patogenia del SAF, que ayuden a diseñar ensayos clínicos en pacientes sin manifestaciones clínicas.
- -
Es necesario realizar ensayos clínicos adicionales con ACOD y en diferentes situaciones clínicas para poder confirmar su eficacia y su seguridad en el SAF.
- -
Es necesario desarrollar nuevas herramientas o scores que permitan identificar los individuos asintomáticos portadores de AAF en riesgo de desarrollar fenómenos trombóticos, y especialmente manifestaciones obstétricas de la enfermedad.
- -
Se necesitan estudios prospectivos multicéntricos que permitan determinar cuál es la profilaxis primaria más efectiva en individuos asintomáticos portadores de AAF estratificados de acuerdo al perfil de riesgo.
- -
Es necesario realizar estudios específicos en pacientes con trombosis venosas y arteriales que incluyan pacientes con diferentes perfiles de riesgo (triple positividad o presencia concomitante de otros factores de riesgo protrombótico).
- -
Son necesarios estudios prospectivos que evalúen la posibilidad de suspender la anticoagulación en pacientes con trombosis venosas con bajo riesgo de recurrencia (no triple positividad, isotipos IgM o trombosis coincidiendo con otras situaciones de riesgo como anticonceptivos, cirugía, etc.).
- -
Se necesitan también estudios prospectivos que comparen la eficacia de tratar con anticoagulación aislada frente a la combinación con antiagregación en pacientes con trombosis arteriales.
Fundación Española de Reumatología.
Conflicto de interesesRafael Cáliz Cáliz ha recibido financiación de Abbvie, Pfizer, Roche, Novartis, MSD, UCB y GSK para la asistencia a cursos/congresos y ha recibido honorarios de la SER en concepto de ponencias y redacción de capítulos de libros.
Víctor Manuel Martínez Taboada ha recibido financiación de Abbvie, Menarini y Pfizer para la asistencia a cursos/congresos; honorarios de Abbvie, MSD, Novartis, BMS y Roche en concepto de ponencias; financiación de Servier por participar en una investigación; ayuda económica de Roche para la financiación de un proyecto de investigación independiente, y ayuda económica de Servier y Hospira en concepto de consultoría para compañías farmacéuticas u otras tecnologías.
María Galindo ha recibido financiación de Pfizer, UCB, Lilly, Abbvie, Menarini y MSD para la asistencia a cursos/congresos; honorarios de Rubió, Abbvie, MSD, UCB, BMS, Lilly y GSK en concepto de ponencias, y ayuda económica de GSK, Lilly, Celgene y UCB en concepto de consultoría para compañías farmacéuticas u otras tecnologías.
Francisco Javier López Longo ha recibido financiación de MSD, GSK, UCB y Pfizer para la asistencia a cursos/congresos; honorarios de GSK y Roche en concepto de ponencias; financiación de UCB y Roche para programas educativos o cursos; financiación de GSK por participar en una investigación y ayuda económica de Sanofi-Aventis en concepto de consultoría para compañías farmacéuticas u otras tecnologías.
María Ángeles Martínez Zamora ha declarado ausencia de intereses.
Amparo Santamaría Ortiz ha recibido financiación de Pfizer, Bayer, Boehringer, Daichi Saikyo, Sanofi, Leopharma, Rovi, CSL Behring, Sobi, Werfen, Octopharma, NovoNordisk, Roche, para la asistencia a cursos/congresos, y honorarios en concepto de ponencias y consultorías para compañías farmacéuticas u otras tecnologías.
Olga Amengual Pliego ha declarado ausencia de intereses.
María José Cuadrado Lozano ha declarado ausencia de intereses.
María Paloma Delgado Beltrán ha declarado ausencia de intereses.
El grupo de expertos del presente trabajo quiere manifestar su agradecimiento a Mercedes Guerra Rodríguez, documentalista de la SER, por su colaboración en las estrategias de búsqueda de la evidencia, y al Dr. Sixto Zegarra Mondragón por su colaboración en las revisiones de los informes de revisiones sistemáticas. También quieren agradecer al Dr. Federico Díaz González, director de la Unidad de Investigación de la SER, por su participación en la revisión del manuscrito final y por contribuir a preservar la independencia de este documento.
El 20 de mayo de 2019, la AEMPS ha emitido una nota informativa sobre el uso de anticoagulantes orales directos en pacientes con Síndrome Antifosfolípido y antecedentes personales de trombosis.https://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/seguridad/2019/NI_MUH_FV-8-2019-anticoagulantes-orales.htm