Analizar la seguridad del uso concomitante de antiinflamatorios no esteroideos (AINE) y fármacos hipoglucemiantes que permita la toma de decisiones en este sentido en la práctica diaria.
MétodosRevisión sistemática. Se definió una estrategia de búsqueda bibliográfica sensible en MEDLINE (desde 1961), EMBASE (desde 1980) y Cochrane Library hasta diciembre de 2007, definiendo la población (sujetos en tratamiento con fármacos hipoglucemiantes, tanto insulina como antidiabéticos orales [ADO]), la intervención (tratamiento concomitante con AINE) y los
resultados (variables relacionadas con la seguridad –toxicidad gastrointestinal, renal o cardiovascular– y con el control glucémico). Se seleccionaron ensayos clínicos (EC) y estudios de cohortes de calidad.
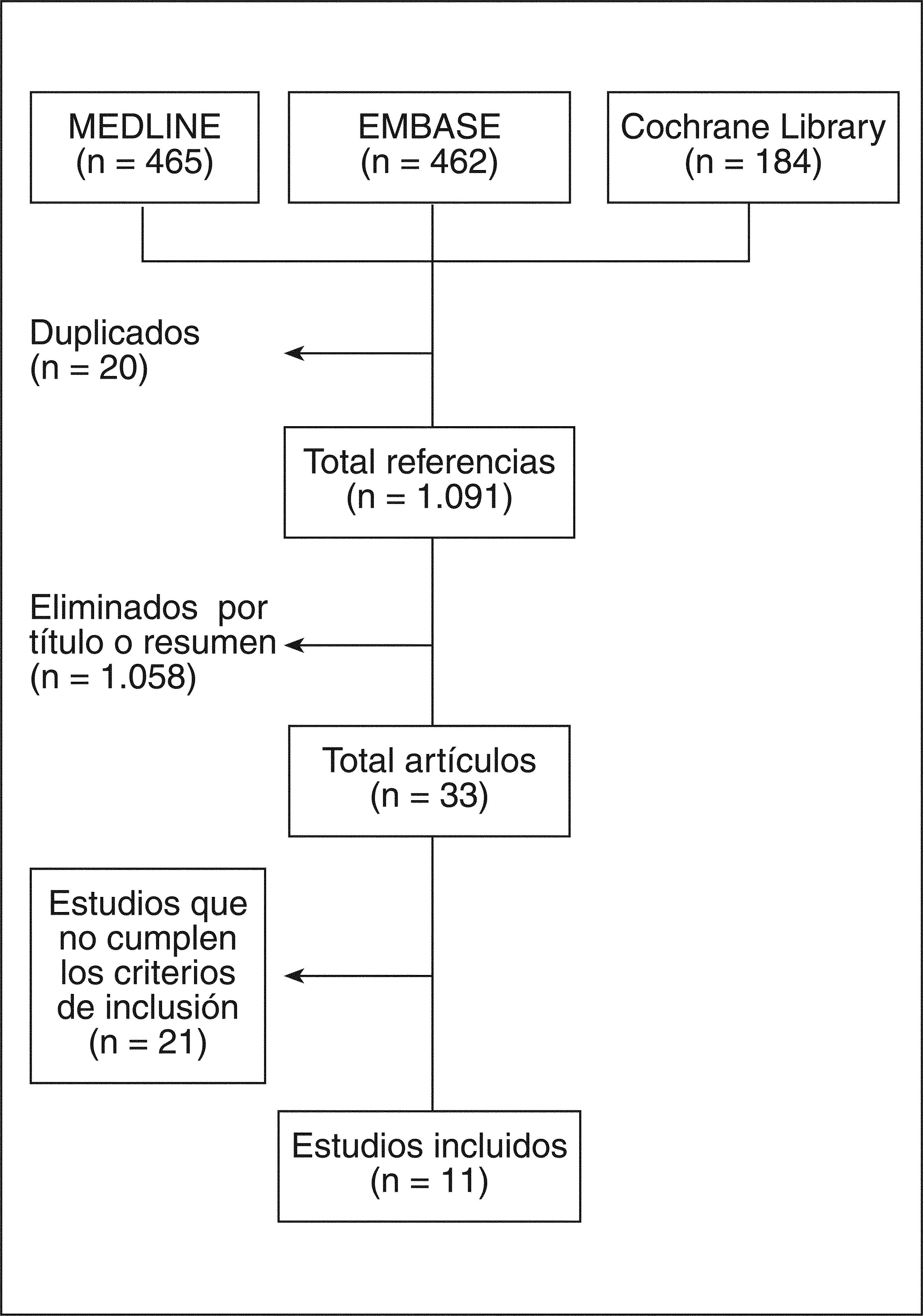
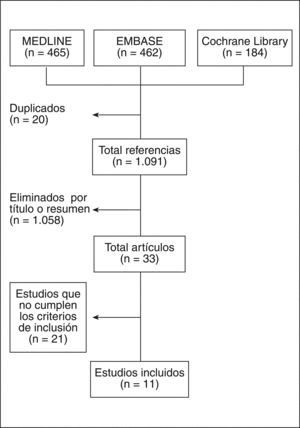
ResultadosSe encontraron 33 estudios para analizar en detalle, de los cuales finalmente se incluyeron 11 en los análisis, de los que 10 fueron EC, en general de baja calidad, y 1 estudio de cohortes prospectivas de calidad moderada, que en total incluyeron a 199 pacientes. Todos los pacientes eran diabéticos, la mayoría varones jóvenes o de mediana edad en tratamiento con diferentes AINE y fármacos hipoglucemiantes. El uso de AINE con fármacos hipoglucemiantes no parece estar claramente asociado a cambios importantes en el control glucémico de estos pacientes ni se ha visto que altere significativamente su función renal. Tampoco se ha constatado que esta asociación aumente el número de eventos adversos graves.
ConclusionesPor la evidencia obtenida, no encontramos argumentos suficientes que claramente contraindiquen, debido a efectos secundarios, el uso concomitante de AINE e hipoglucemiantes (tanto ADO como insulina).
To analyze the safety of combining nonsteroidal anti-inflammatory drugs (NSAID) and hypoglycemia-inducing drugs.
MethodsA systematic review following a sensitive search strategy was performed. All articles published in MEDLINE (since 1961), EMBASE (since 1961), and Cochrane Library, up to December 2007, were examined. Selection criteria: the population (subjects taking hypoglycemia-inducing drugs: insulin or oral antidiabetic drugs [OAD]), the intervention (concomitantly use of NSAID), and the outcomes related to safety (gastrointestinal, renal, cardiovascular toxicity) and glycemic control. Titles and abstracts of retrieved articles meeting inclusion criteria from the search were reviewed. Only randomized controlled trials (RCT), or cohort studies were included.
ResultsA total of 33 studies were reviewed in detail, and 11 were finally included, 10 low quality RCT, and 1 prospective cohort study with moderate quality, which included 199 patients. All patients were diabetics; mostly young or middle aged men, on different NSAID and hypoglycemic drugs. There was no evidence of important changes in patient's glycemic controls, nor in their renal function, when combining NSAID with hypoglycemiainducing drugs. Moreover, there is no clear increase in the number of serious side effects.
ConclusionsAccording to the published evidence, there are not enough arguments to contraindicate the use of NSAID with hypoglycemia-inducing drugs (insulin or OAD).
El uso de fármacos antiinflamatorios no esteroideos (AINE) es muy frecuente en los pacientes con enfermedades osteomusculares.
Distintos estudios han puesto de manifiesto la relación de los AINE con complicaciones gastrointestinales, algunas potencialmente muy graves, como ulcus, hemorragia o perforación digestiva1. Por otro lado, de la misma manera se ha demostrado en consumidores de AINE que existen otros posibles factores independientes de riesgo de estas complicaciones digestivas y también de otros eventos adversos de diferente naturaleza. Entre otros, se ha considerado la edad avanzada, los antecedentes de ulcus gastroduodenal o el uso de otras medicaciones, como los anticoagulantes2.
En relación con los eventos adversos menos frecuentes o menos estudiados relacionados con los AINE, en la literatura médica y algunos estudios de farmacocinética se señala la posibilidad de aparición de hipoglucemias graves por el uso de AINE en sujetos que se encuentran en tratamiento con hipoglucemiantes. Igualmente, se han descrito casos de insuficiencia renal aguda y acidosis láctica3–5.
Dado que en reumatología es frecuente el seguimiento de pacientes con afecciones reumáticas que además precisan tratamiento con fármacos hipoglucemiantes, tanto antidiabéticos orales (ADO) como insulina, y como es probable que muchos de ellos en algún momento puedan precisar algún AINE, determinar los posibles efectos del uso concomitante de AINE e hipoglucemiantes (especialmente en relación con el control glucémico y la función renal) es de gran interés en nuestro medio.
Por todo ello, el objetivo de la presente revisión sistemática es buscar la evidencia publicada en torno a la seguridad del uso concomitante de AINE y fármacos hipoglucemiantes, para así contribuir a un mejor manejo de nuestros pacientes.
Material y métodosSe realizó una revisión sistemática para analizar la seguridad del uso concomitante de AINE e hipoglucemiantes. Los criterios de selección de estudios fueron: a) estudios en que los pacientes tomaran fármacos hipoglucemiantes (tanto ADO como insulina), sin restricción en cuanto al tipo, la dosis o la vía de administración del fármaco hipoglucemiante; b) estudios en que los pacientes, además del fármaco hipoglucemiante, tomaran concomitantemente un AINE, sin restricciones en cuanto al tipo y la dosis de AINE, pero excluyendo los estudios en que los sujetos tomaban AINE a dosis antiagregantes y no analgésicas y/o antiinflamatorias, así como los tratamientos tópicos; c) para evaluar la seguridad del uso simultáneo de estos medicamentos, se incluyeron estudios en que se analizaran las siguientes variables: toxicidad gastrointestinal, renal, cardiovascular o control glucémico (glucemia basal, posprandial o glucohemoglobina), y d) ensayos clínicos (EC) y estudios de cohortes (prospectivas o retrospectivas), excluidos los estudios que sólo aportaran datos de farmacocinética y/o farmacodinámica, así como los estudios en sujetos sanos voluntarios y los estudios en animales. En cuanto al idioma, se seleccionaron artículos en inglés y español. Se buscó en las siguientes bases de datos electrónicas hasta diciembre de 2007: MEDLINE (desde 1960), EMBASE (desde 1980) y la Cochrane Library (Central). Se buscaron tanto términos MeSH como en formato texto libre. No se puso límites a la fecha de publicación. La estrategia de búsqueda específica se detalla en las tablas 1 y 2. No se realizó búsqueda manual en lo publicado en congresos nacionales (SER) o internacionales (ACR, EULAR), dado el gran volumen de artículos rescatados en las bases de datos electrónicas.
Estrategia de búsqueda y artículos rescatados en MEDLINE
| # | Estrategia de búsqueda | Resultados |
| 1 | diabetes mellitus OR Insulin OR hypoglicemics OR Agents, Hypoglycemic OR Hypoglycemic Drugs OR Hypoglycemics OR Antidiabetics OR Antidiabetic Agents OR Antidiabetic Drugs OR sulfonylurea Or metformin OR pioglitazone OR rosiglitazone OR glibenclamide OR glicazide OR glimepiride OR glipizide OR repaglinide OR nateglinide OR acarbose OR miglitol OR gliquidona OR tolbutamide OR butformine | 405.222 |
| 2 | NSAID OR Nonsteroidal Anti-Inflammatory Agents OR Nonsteroidal Antiinflammatory Agents OR Analgesics, Anti Inflammatory OR Non-Steroidal Anti-Rheumatic Agents OR Non-Steroidal Antirheumatic Agents OR Aspirin-Like Agents OR Agents, Aspirin-Like OR naproxen* OR ibuprofen* OR dexibuprofen OR dexketoprofen OR flurbiprofen OR Ketoprofen OR Ketorola* OR aceclofenac OR diclofenac OR lornoxicam Or meloxicam OR piroxicam OR tenoxicam OR indometacin OR sulindac OR tolmetin OR fenilbutazon OR Phenylbutazone OR nabumeton OR celecoxib OR etoricoxib OR parecoxib OR rofecoxib OR valdecoxib OR lumiracoxib OR salicylic acid OR acetylsalicylic acid OR diflunisal OR Cyclooxygenase 2 Inhibitors OR COX-2 Inhibitors OR COX2 Inhibitors, OR Coxibs | 150.391 |
| 3 | Randomized [All Fields] OR random allocation"[TIAB] NOT Medline[SB]) OR "random allocation"[MeSH Terms] OR randomized[Text Word] OR controlled[All Fields] AND ("clinical trials as topic"[MeSH Terms] OR trial[Text Word]) OR placebo OR blinded | 819.404 |
| 4 | #1 AND #2 AND #3 | 2.430 |
| 5 | acute [All Fields] OR acute OR post-operative [All Fields] OR post-surgical[All Fields] OR postsurgical [All Fields] OR postoperative [All Fields]OR postoperative OR Postoperative Complications [Mesh] OR intraoperative [All fields] OR Intraoperative Complications [Mesh] dysmenorrhoea[All Fields] OR dysmenorrhea OR orthodontic [All fields] | 28.328 |
| 6 | #4 NOT #5 | 2.411 |
| 7 | #6 LimitsLimits: Humans, Clinical Trial, Meta-Analysis, Randomized Controlled Trial, Clinical Trial, Phase I, Clinical Trial, Phase II, Clinical Trial, Phase III, Clinical Trial, Phase IV, Comparative Study, Controlled Clinical Trial, English, Spanish | 465 |
Estrategia de búsqueda y artículos rescatados en EMBASE
| # | Estrategia de búsqueda | Resultados |
| 1 | exp antidiabetic agent/ or antidiabetic agent.mp. or exp oral antidiabetic agent/ or exp Biguanide Derivative/ or oral antidiabetic agent.mp. or hypoglicemic.mp. or antidiabetics.mp. or acarbose.mp. or exp ACARBOSE/ or metformin.mp. or exp METFORMIN/ or rosiglitazone.mp. or exp ROSIGLITAZONE/ or pioglitazone.mp. or exp PIOGLITAZONE/ or repaglinide.mp. or exp REPAGLINIDE/ or nateglinide.mp. or exp NATEGLINIDE/ or miglitol.mp. or exp MIGLITOL/ or exp GLIBENCLAMIDE/ or glibenclamide.mp. or sulfonylurea.mp. or exp SULFONYLUREA/ or exp Gliclazide/ or glicazide.mp. or exp GLIMEPIRIDE/ or glimepiride.mp. or exp GLIPIZIDe/ or glipizide.mp. or repaglinide.mp. or exp REPAGLINIDE/ or nateglinide.mp. or exp NATEGLINIDE/ or tolbutamide.mp. or exp TOLBUTAMIDE/ | 150.823 |
| 2 | nsaid.mp. or Nonsteroid Antiinflammatory Agent/ or Nonsteroidal Anti-Inflammatory Agents.mp. or (coxib or Cyclooxygenase 2 Inhibitor).mp. or Acetylsalicylic Acid/ or Aspirin-Like Agents.mp. or naproxen.mp. or NAPROXEN/ or ibuprofen.mp. or IBUPROFEN/ or dexibuprofen$.mp. or DEXIBUPROFEN/ or dexketoprofen.mp. or DEXKETOPROFEN/ or flurbiprofen.mp. or FLURBIPROFEN/ or Ketoprofen.mp. or KETOPROFEN/ or KETOROLAC/ or Ketorolac.mp. or aceclofenac.mp. or ACECLOFENAC/ or diclofenac.mp. or DICLOFENAC/ or lornoxicam.mp. or LORNOXICAM/ or meloxicam.mp. or MELOXICAM/ or PIROXICAM/ or piroxicam.mp. or PIROXICAM/ or piroxicam.mp. or tenoxicam.mp. or TENOXICAM/ or INDOMETACIN/ or indometacin.mp. or sulindac.mp. or SULINDAC/ or tolmetin.mp. or TOLMETIN/ or Phenylbutazone.mp. or PHENYLBUTAZONE/ or nabumetone/ or nabumeton.mp. or celecoxib.mp. or CELECOXIB/ or etoricoxib.mp. or ETORICOXIB/ or parecoxib.mp. or PARECOXIB/ or rofecoxib.mp. or ROFECOXIB/ or salicylic acid.mp. or Salicylic Acid/ or acetylsalicylic acid.mp. or Acetylsalicylic Acid / or diflunisal.mp. or DIFLUNISAL/ or valdecoxib.mp. or VALDECOXIB/ or lumiracoxib.mp. or LUMIRACOXIB/ | 207.945 |
| 3 | exp clinical trial/ or evidence based medicine/ or outcomes research/ or crossover procedure/ or double blind procedure/ or single blind procedure/ or prospective study/ or major clinical study/ or exp comparative study/ or placebo/ or "evaluation and follow up"/ or follow up/ or randomization/ | 1.964.112 |
| 4 | controlled study/ not case control study/ | 2.568.695 |
| 5 | 3 or 4 | 3.774.593 |
| 6 | ((clinic$ adj5 trial$) or ((singl$ or doubl$ or trebl$ or tripl$) adj (blind$ or mask$)) or random$ or placebo$).ti,ab. | 489.355 |
| 7 | 5 or 6 | 3.890.101 |
| 8 | 1 and 2 and 7 | 17.876 |
| 9 | perioperative period.mp. or PERIOPERATIVE PERIOD/ or perioperative care.mp. or SURGERY/ or surgery.mp. or SURGICAL TECHNIQUE/ or surgical procedures.mp. or PEROPERATIVE CARE/ or preoperative care.mp. or intraoperative care.mp. or PEROPERATIVE COMPLICATION/ or POSTOPERATIVE COMPLICATION/ or dysmenorrhoea.mp. or Dysmenorrhea/ or orthodontic.mp. or Orthodontics/ or exp malignant neoplastic disease/ or cancer/ or exp metastasis/ or exp mixed tumor/ or exp “neoplasms of uncertain behavior”/ or exp neoplasms subdivided by anatomical site/ or exp “oncogenesis and malignant transformation”/ or exp paraneoplastic syndrome/ or exp “precancer and cancer-in-situ”/ or adolescent.mp. or adolescent/ or hospitalized adolescent/ or juvenile.mp. or juvenile/ or child.mp. or child/ or boy.mp. or boy/ or gifted child/ or girl.mp. or girl/ or handicapped child/ or hospitalized child/ or preschool child/ or school child/ or infant.mp. or infant/ or baby.mp. or baby/ or high risk infant/ or hospitalized infant/ or newborn.mp. or newborn/ or suckling.mp. or suckling/ or pediatric.mp. or review/ or guideline.mp. | 3.370.213 |
| 10 | 8 not 9 | 666.390 |
| 11 | exp musculoskeletal disease/ or musculoskeletal disease.mp. or rheumatic polymyalgia.mp. or polymyalgia/ or lupus erythematosus systemic.mp. or systemic lupus erythematosus/ or vasculitis/ or vasculitis.mp. or polymyositis.mp. or polymyositis/ or dermatomyositis.mp. or dermatomyositis/ | |
| 12 | 10 and 11 | 3.391 |
| 13 | Limit 12 to humans, abstracts | 462 |
Un único revisor analizó los artículos resultantes de la estrategia de búsqueda, así como el análisis en detalle de los artículos incluidos. El resultado de la búsqueda primeramente se depuró por título y resumen, o por artículo entero en caso de que no hubiera resumen, mediante sesiones de 20min de duración máxima. Se seleccionaron para revisión en detalle los artículos que explícitamente examinaban el uso conjunto de AINE y fármacos hipoglucemiantes, así como aquellos en que se trataba de un tratamiento concomitante de estados comórbidos. Tras este proceso, los artículos restantes se analizaron en detalle. Finalmente se realizó una búsqueda manual con las referencias de los artículos seleccionados para su análisis en detalle. Todas las referencias se recuperaron de internet y se introdujeron en el programa Procite 5.1 para facilitar su gestión.
Para evaluar la calidad metodológica de los estudios incluidos, se utilizó la escala de Jadad6 (1 a 5, considerándose de buena calidad los estudios con Jadad de 3–5) para los EC y la escala de calidad de Oxford para los estudios de cohortes.
ResultadosLos resultados de la búsqueda se detallan en la figura 1. De los artículos recuperados para ser revisados en detalle, finalmente se incluyeron 11; 10 son EC7–16 y 1, un estudio de cohortes prospectivas17. A continuación se describen los principales resultados de los estudios incluidos (tabla 3). El listado de artículos excluidos18–36 y la causa de su exclusión se detallan en la tabla 4. De los 36 artículos seleccionados para su revisión en detalle, 28 analizaban explícitamente el uso concomitante de AINE y fármacos hipoglucemiantes, los restantes 8 no, pero 3 de ellos aportaron información suficiente para ser incluidos.
Estudios incluidos, características y sus principales resultados
| Estudio | Participantes e intervención | Resultados |
| Baggio7; EC placebo control; seguimiento 165 días; Jadad 2 | n = 26 DMID (42% mujeres, media de edad, 37 años). CI: albuminuria (15–300mg/día) > 3 años, función renal normal. CE: HTA, otros fármacos distintos de insulina. ITF-182, 2.250mg/día + insulina. Insulina + placebo | En el grupo ITF-182 no hubo cambios estadísticamente significativos en PA, FC, glucemia, HbA1c, filtrado glomerular, analítica/bioquímica |
| Christiansen8; EC doble ciego, placebo control; seguimiento, 3 días; Jadad 2 | n = 9 DMID (100% varones; edad, 19–30 años). CE: microangiopatía diabética, otro AINE. Indometacina 140mg/día 3 días + insulina (n = 9). Placebo + insulina (n = 9) | No hubo cambios estadísticamente significativos en el grupo indometacina en: glucosuria, HbA1c, glucemia. En comparación con placebo, no hubo diferencias significativas en FG, FRP, FFG |
| Cohen9; EC placebo control cruzado; seguimiento 24 semanas; Jadad 2 | n = 18 pacientes con DM y neuropatía periférica (100% varones; media de edad, 58,4 años), 12 con insulina y 6 con antidiabéticos orales. CE: otras neuropatías, claudicación severa. Ibuprofeno 2.400mg/día 8 semanas (n = 18). Sulindac 400mg/día 8 semanas (n = 18). Placebo 50mg/día 8 semanas (n = 18). Continúan con fármacos antidiabéticos | Los AINE no modificaron: colesterol, HbA1c, glucosa posprandial, creatinina, función hepática, proteinuria 24h. Eventos adversos gastrointestinales leves: ibuprofeno (n = 5), sulindac (n = 0) (p < 0,006), placebo (n = 0); graves: ibuprofeno (n = 1), sulindac (n = 0) (p = 0,243), placebo (n = 0) |
| Cunha-Vaz10; EC doble ciego placebo control; seguimiento, 6 meses; Jadad 4 | n = 18 DMID (28% mujeres; media de edad, 34 años; duración media de la DM, 10,3 años). CE: > 5 microaneurismas en polo posterior del ojo, retinopatía proliferativa, otras complicaciones serias de la Dm, enfermedad hepática, renal, hematológica, cardiovascular, hipertiroidismo, ulcus péptico activo o hemorragia digestiva, enfermedad maligna, embarazo. Sulindac 400mg/día + insulina 6 meses (n = 8). Placebo + insulina 6 meses (n = 10) | Efectos en la visión: anormalidad en la permeabilidad, sulindac + insulina (6 ojjos) frente a placebo + insulina (17 ojos) (p < 0,001); aumento del tamaño de los microaneurismas, sulindac + insulina (n = 3) frente a placebo + insulina (n = 2) (p = 0,184); nuevos microaneurismas, sulindac + insulina (n = 1) frente a placebo + insulina (n = 1) (p = 0,441). Eventos adversos: 1 episodio de hemorragia digestiva alta en el grupo sulindac |
| Hattori11; EC; seguimiento, 3 años; Jadad 2 | n = 40 DM2 (49% mujeres; media de edad, 60 años). CE: mal control glucémico. Sulindac 200mg/día (n = 16). Control (n = 24). Continúan con medicación antidiabética | Retinopatía diabética no proliferativa: sulindac (n = 0), control (n = 3) (p = 0,283). Retinopatía diabética proliferativa: sulindac (n = 0), control (n = 1) (p = 0,295). Sin cambios en PA, HbA1c ni eventos adversos graves en el grupo sulindac c |
| Hommel12; EC doble ciego placebo control; seguimiento, 2 semanas; Jadad 2 | n = 8 DM1 insulinodependientes con neuropatía diabética (100% mujeres; media de edad, 36 años). Indometacina 150mg/día + insulina 3 días (n = 8). Placebo + insulina 3 días (n = 8) | Comparado con placebo la indometacina disminuyó significativamente más: excreción urinaria PGE2, FG, albuminuria y el aclaramiento fraccionado de albúmina |
| Nilsen13; EC cruzado; seguimiento, 18 días; Jadad 1 | n = 8 DM1 insulinodependiente con microalbuminuria (87,5 % mujeres; edad, 22–43). CE: IC, IH, enfermedades serias. Naproxeno 1.000mg/día + insulina 4 días (n = 8). Placebo + insulina 4 días (n = 8) | En comparación con el placebo el naproxeno disminuyó significativamente más la excreción de prostaglandina E2, no hubo diferencias en la disminución de albuminuria ni en el filtrado glomerular |
| Oli14; EC;seguimiento, 11 semanas; Jadad 2 | n = 16 DMNID + AR/OA/artritis de hombro (69% mujeres; edad, 31–62 años). Piroxicam 40mg/día + antidiabéticos 3–9 semanas (n = 16). Placebo + antidiabéticos las semanas 1, 2, 10, 11 (n = 16) | En comparación con el periodo de placebo, el uso de peroxicam no se asoció a cambios significativos en glucemias, glucosuria, peso o eventos adversos |
| Pedrazzi15; EC placebo control cruzado; seguimiento, 15 días; Jadad 2 | n = 24 DMNID + OA (50% mujeres; media de edad, 71). ADO + indoprofeno 600mg/día 4 día (n = 12)/placebo 5 días (n = 12). ADO + placebo 4 días (n = 12)/placebo 5 días (n = 12) | En comparación con el periodo de placebo, el uso de indoprofeno no se asoció a cambios significativos en glucemia basal y sobrecarga oral de glucosa. No se detectaron eventos adversos |
| Shah16; EC; seguimiento, 5 semanas; Jadad 2 | n = 22 DMNID controlada > 6 meses + síntomas reumatológicos que precisen AINE (edad, 42–69 años). Clorpropamida (62,5-375mg/día) + indoprofeno 1.200mg/4 semanas (n = 11). Clorpropamida (125–250mg/día) + fenilbutazona 300mg/día 4 semanas (n = 11) | La fenilbutazona produjo una reducción significativa en glucemias basales, sin relación con las glucemias posprandiales. El indoprofeno no se asoció a cambios significativos en las glucemias basales ni posprandiales |
| Whiting17; Cohorte prospectiva; seguimiento, 19 días; calidad 2c | n = 10 DM. CE: enfermedad renal, cardíaca, hemática, oftálmica o hepática, PAD > 100mmHg, alergia a sulfonamidas, ADO o AINE. Naproxeno 750mg/día 4 días. Tolbutamida 1g/día 7 días | No hubo diferencias estadísticamente significativas en la glucemia posprandial (p = 0,9) ni en el nadir (p = 0,25) con el naproxeno |
ADO: antidiabéticos orales; AINE: antiinflamatorios no esteroideos; AR: artritis reumatoide; CE: criterios de exclusión; DM: diabetes mellitus; DMID: diabetes mellitus insulinodependiente; DMNID: diabetes mellitus no insulinodependiente; EC: ensayo clínico; FC: frecuencia cardíaca; FFG: fracción de filtrado glomerular; FG: filtrado glomerular; FPR: flujo plasmático renal; HbA1c: glucohemoglobina; HTA: hipertensión arterial; OA: osteoartrosis; PA: presión arterial; PAD: presión arterial diastólica; PGE2: prostaglandina E2.
Estudios excluidos (por autor y fecha de publicación) y motivos de su exclusión
| Estudio | Motivo de exclusión |
| Aguilar18 (1986) | Usa como AINE el AAS a dosis bajas (antiagregantes) |
| Anderson19 (2002) | Voluntarios sanos |
| Bakris20 (1995) | Utiliza concomitantemente al AINE dosis muy altas de misoprostol |
| Chlud21 (1977) | No relacionado con la pregunta de investigación |
| Day22 (1995) | Voluntarios sanos |
| De Cosmo23 (1993) | Usa como AINE el AAS a dosis bajas (antiagregantes) |
| Farker24 (2002) | No indica si toman hipoglucemiantes o no |
| Hartmann25 (1990) | Voluntarios sanos |
| Haupt26 (1987) | Idioma alemán |
| Kubacka27(1986) | Voluntarios sanos |
| Mathiesen28 (1988) | No aporta datos nuevos de interés para la revisión en comparación con lo publicado en otro artículo de los mismos pacientes (Hommel 1987) |
| Micossi29 (1978) | No queda claro que estuvieran tomando hipoglucemiantes |
| Morrison30 (1982) | Voluntarios sanos |
| Pereira31 (2000) | No toman medicación hipoglucemiante |
| Pereira32 (2001) | No toman medicación hipoglucemiante |
| Pfeifer33 (1993) | Datos clínicos claros de eficacia, no de seguridad |
| Poggi4 (2006) | No analiza efectos clínicos, sólo farmacocinético/dinámicos |
| Price3 (2003) | Caso clínico |
| Rudberg34 (1993) | Todos los datos aportados son en relación con el ejercicio intenso |
| Sharma35 (1989) | Uso de AINE tópicos |
| Shimura36 (2007) | Uso de AINE tópicos |
AAS: ácido acetilsalicílico; AINE: antiinflamatorios no esteroideos.
Como ya se ha comentado, se incluyeron 11 artículos, 10 EC, en general de baja calidad (9 fueron Jadad 1 o 2 y sólo 1, Jadad 4), y un estudio de cohortes prospectivo de moderada calidad (2c). La duración del seguimiento varió entre 3 días y 3 años. Se analizó a un total de 199 sujetos, todos diabéticos y la mayoría varones jóvenes o de mediana edad. Los estudios analizaron la seguridad del uso concomitante de insulina o ADO con distintos AINE y todos ellos a diferentes dosis. Los estudios fueron aprobados por comités éticos y los pacientes firmaron el consentimiento informado antes de entrar en el estudio. La mayoría analizaron en detalle la evolución del control glucémico de los pacientes y los eventos adversos, al menos en general.
En cuanto a los resultados de seguridad, no se ha encontrado evidencia suficiente que contraindique el uso concomitante de AINE y fármacos hipoglucemiantes. Esto se basa en que no se ha visto una clara asociación entre el uso combinado de estos fármacos y la aparición de problemas en el control glucémico, la función renal y eventos adversos gastrointestinales graves.
Resultados en detalle del uso combinado de AINE e hipoglucemiantesEntre los resultados de los EC incluidos en la revisión sistemática destaca:
- –
En el estudio de Baggio et al7, el uso de ITF-128 con insulina, en comparación con la insulina en monoterapia, no produjo mayores cambios en presión arterial, frecuencia cardíaca, glucemia, glucohemoglobina, glucosuria o pruebas de función renal.
- –
Según el EC de Christiansen et al8, el uso de indometacina 400mg/día con insulina, en comparación con sus cifras basales, no produjo modificaciones significativas en la glucemia, glucosuria, glucohemoglobina y pruebas de función renal.
- –
Cohen et al9 objetivaron que el uso de ibuprofeno 2.400mg/día o sulindac 400mg/día con ADO o insulina no causó cambios en glucemia, glucohemoglobina, colesterol ni pruebas de función renal y hepática. Por otro lado, no hubo diferencias en cuanto al número de eventos adversos graves con los AINE e insulina.
- –
Según el EC de Cunha-Vaz et al10, el sulindac 400mg/día con insulina, en comparación con la insulina en monoterapia, no se asoció a mayor número de eventos adversos.
- –
En el estudio de Hattori et al11, el uso de sulindac 200mg/día con ADO o insulina no produjo cambios importantes en la presión arterial y la glucohemoglobina ni eventos adversos graves.
- –
Según Hommel et al12, el uso de indometacina 150mg/día, en comparación con la insulina en monoterapia, produjo mayor disminución en la excreción de PGE2, el filtrado glomerular, la albuminuria y el aclaramiento fraccionado de albúmina.
- –
En el estudio de Nilsen et al13 se vio que el uso de naproxeno 1.000mg/día con insulina, en comparación con la insulina sola, produjo mayor disminución en la excreción urinaria de PGE2. No hubo diferencias en relación con la albuminuria y el filtrado glomerular.
- –
El EC de Oli et al14 describe que el uso de peroxicam 40mg/día con ADO, en comparación con los ADO sin AINE, no se asoció a cambios significativos en glucemia, glucosuria, peso u otros eventos adversos.
- –
Según Pedrazzi et al15, el uso de ADO con indoprofeno 600mg/día, en comparación con los ADO en monoterapia, no se asoció a cambios significativos en las glucemias basales ni tras sobrecarga oral de glucosa y no se detectaron eventos adversos.
- –
En el estudio de Shah et al16, el uso de clorpropamida con fenilbutazona 300mg/día se asoció con una reducción significativa en las glucemias basales, no en las posprandiales. Por otro lado, el uso de ADO con indoprofeno no se asoció a cambios en glucemias basales ni posprandiales.
- –
El estudio de cohortes de Whiting et al17, el uso de naproxeno 1.000mg/día con tolbutamida 1g/día no produjo cambios en las glucemias ni en el nadir.
En esta revisión sistemática de la literatura se ha analizado la seguridad del uso conjunto de AINE y fármacos hipoglucemiantes (tanto ADO como insulina). Para alcanzar este objetivo, se llevó a cabo una extensa búsqueda en las principales bases de datos bibliográficas disponibles, tal y como se ha descrito en el apartado "Material y métodos". Sólo incluimos EC y estudios de cohortes de calidad, porque consideramos que ésta es la mejor forma de contestar a la pregunta de investigación. En general, podemos considerar que el uso de AINE con fármacos hipoglucemiantes no parece que produzca importantes alteraciones en el control glucémico de los pacientes ni en su función renal. Tampoco se ha descrito que aumente significativamente el número de eventos adversos graves de otra naturaleza, como los gastrointestinales.
Tras el análisis en detalle, se incluyeron 11 estudios (10 EC7–16 y 1 estudio de cohortes17). Destaca que la calidad de los EC en general fue baja, todos fueron Jadad 1 o 2, a excepción de uno que llegó a 4 puntos en dicha escala. En cuanto al estudio de cohortes incluido, fue de calidad moderada, 2c en la escala de Oxford. Representa una de las principales limitaciones del estudio, que debe tenerse muy presente a la hora de valorar las conclusiones derivadas de la revisión.
En cuanto a los pacientes estudiados, se incluyó a 199, todos diabéticos y la mayoría varones de edad joven o mediana. Sólo dos estudios15,16 incluyeron a pacientes que además tenían algún tipo de enfermedad osteomuscular. Por ello, y dada la poca evidencia publicada al respecto de la pregunta de investigación en pacientes con alguna afección reumática, finalmente se decidió no restringir la revisión a ese tipo de pacientes. Esto hace que, al igual que ocurre con la calidad de los estudios, la representatividad de la muestra estudiada también esté limitada y no refleje el espectro y las características de los pacientes habitualmente seguidos en las consultas de reumatología. Pero además es relevante destacar que la mayoría de los pacientes incluidos eran jóvenes o de mediana edad, sin enfermedades graves concomitantes, lo que puede hacer que de alguna manera los resultados estén sesgados, ya que estos pacientes pueden estar menos predispuestos a los eventos adversos.
Por otro lado, los AINE y los fármacos hipoglucemiantes estudiados fueron diversos, así como las dosis prescritas (en los que fue posible obtener este dato), lo que hace difícil el establecer comparaciones entre grupos de fármacos.
En relación con los eventos estudiados, todos los artículos incluidos evaluaron el control glucémico de los pacientes durante el periodo de seguimiento, y la mayoría también analizaron los eventos adversos clínicamente más relevantes y/o graves, como el ulcus gastroduodenal o las hemorragias digestivas. En general, estas medidas de resultado fueron definidas por criterios muy similares en todos los estudios. En cuanto a los resultados propiamente dichos, como ya se ha comentado, no se ha evidenciado el desarrollo de problemas en el control glucémico o en la función renal por el uso concomitante de AINE y fármacos hipoglucemiantes, como se había indicado en alguna publicación3–5. Sólo un estudio16 describió que la asociación de fenilbutazona con ADO produjo una reducción significativa de las glucemias basales (que no fueron clínicamente importantes). Tampoco se ha puesto de manifiesto que se produjera mayor número de otros eventos adversos graves como los gastrointestinales. Sólo en un estudio9 el uso de ibuprofeno se asoció a mayor número de eventos adversos gastrointestinales, pero leves, y no se asoció a mayor número de eventos adversos gastrointestinales graves.
Es importante señalar, llegado este punto, que en ocasiones es difícil determinar si ciertos eventos secundarios atribuidos al uso concomitante de AINE y fármacos hipoglucemiantes pudieran deberse a la enfermedad de origen y no tanto a sus tratamientos.
Teniendo en cuenta las limitaciones encontradas en esta revisión sistemática, consideramos que serán necesarios otros estudios de mayor calidad metodológica, y más representativos, para poder determinar los verdaderos efectos del uso de AINE con fármacos hipoglucemiantes, así como para dilucidar la posibilidad de que una asociación concreta de fármacos presente un perfil de seguridad mejor que otras.
Finalmente, en conclusión, no se ha encontrado evidencia suficiente que contraindique el uso concomitante de AINE y fármacos hipoglucemiantes, con una evidencia grado 2c, y fuerza de recomendación C/D.