Los ensayos clínicos de secukinumab han demostrado su eficacia y seguridad en la artritis psoriásica como biológico de primera opción o tras respuesta inadecuada a otros tratamientos biológicos.
ObjetivoAnalizar la eficacia y seguridad de secukinumab en la artritis psoriásica periférica durante 12 meses en práctica clínica real.
Material y métodosSe incluyó a pacientes con artritis psoriásica periférica activa que iniciaron tratamiento con secukinumab según ficha técnica. Se evaluó la eficacia y seguridad desde la situación basal hasta los 12 meses, comparando la respuesta de pacientes naive y no naive al biológico.
ResultadosSe incluyó a 76 pacientes (22 naive y 54 no naive al biológico) con una edad de 51,9 años (10,3) y una duración de la enfermedad de 9,5 años (7,1). El 31,6% con dactilitis, el 51,3% con entesitis y el índice DAPSA basal fue 19 (9,8). La tasa de retención fue elevada: 90,9% en naive y 81,5% en no naive, y el porcentaje de pacientes con un DAPSA menor o igual a 14 fue mayor en pacientes naive, incluso después de ajustar por edad, sexo y fármacos modificadores del curso de la enfermedad (p=0,016). Los datos de seguridad fueron similares a los descritos en los ensayos clínicos.
ConclusionesSecukinumab es eficaz y seguro en el tratamiento a 12 meses en la artritis psoriásica periférica activa en la práctica clínica real, tras respuesta inadecuada a los iTNF o como primer biológico.
Clinical trials of secukinumab have demonstrated their efficacy and safety in psoriatic arthritis as biological first choice or after inadequate response to other biological treatments.
ObjectiveTo analyze the efficacy and safety of secukinumab in peripheral psoriatic arthritis over 12 months in real clinical practice.
Material and methodsPatients with active peripheral psoriatic arthritis who started treatment with secukinumab according to the technical specifications were included. Efficacy and safety were evaluated from baseline to 12 months comparing naive and non-naive to biological therapy patients.
ResultsA total of 76 patients were included (22 naive and 54 non-naive to biological) with an age of 51.9 years (10.3) and duration of the disease of 9.5 years (7.1). Of them, 31.6% with dactylitis, 51.3% with enthesitis and the baseline DAPSA was 19.0 (9.8). The retention rate was high, 90.9% in naive and 81.5% in non-naïve patients, and the percentage of patients with a DAPSA less than or equal to 14 was higher in the naive patients even after adjusting for age, sex and FAMEsc (P=.016). The safety data were similar to those described in the clinical trials.
ConclusionsSecukinumab is effective and safe in 12-month treatment in peripheral active psoriatic arthritis in real clinical practice, after inadequate response to TNF or as first biological treatment.
La artritis psoriásica (APs) es una enfermedad inflamatoria crónica que afecta principalmente a la piel y al aparato locomotor, y que implica a las articulaciones periféricas y axiales, entesitis y dactilitis1. Tanto la European League Against Rheumatism como el Group for Research and Assessment of Psoriasis and Psoriatic Arthritis han desarrollado unas guías para el manejo y tratamiento más adecuado de estos enfermos2,3 y se considera que el objetivo del tratamiento para todos los pacientes con APs es alcanzar el nivel más bajo posible de actividad de la enfermedad en todas sus manifestaciones, minimizando las complicaciones tanto de la enfermedad activa no tratada como del tratamiento empleado4.
En la primera fase del tratamiento de las formas periféricas de APs se sigue considerando de elección el uso de antiinflamatorios no esteroideos, corticoides (principalmente locales) y los fármacos antirreumáticos modificadores de la enfermedad sintéticos convencionales (FAMEsc) como el metotrexato o la leflunomida. Cuando estos no consiguen el objetivo terapéutico, se opta por iniciar un tratamiento biológico que, hasta hace pocos años, eran sobre todo los inhibidores del TNF (iTNF). Actualmente, los tratamientos biológicos disponibles para la APs se han focalizado en citocinas claves en la patogenia de la enfermedad, como la IL23 o la IL17, con la irrupción de fármacos dirigidos a inhibir sus efectos.
Secukinumab, anticuerpo monoclonal humano que bloquea el efecto de IL17A, ha demostrado en los ensayos clínicos una buena respuesta clínica en la artritis psoriásica como biológico de primera opción o tras respuesta inadecuada a otros tratamientos biológicos. Supone actualmente un 25% de los tratamientos iniciales con biológicos en APs5 en EE. UU., lo que indica que los reumatólogos pueden considerar el uso de secukinumab en las primeras etapas del algoritmo de tratamiento biológico para dicha enfermedad. Y esto teniendo en cuenta que, en los ensayos clínicos, controlados y aleatorios de fase III con secukinumab, aproximadamente el 65-70% de los pacientes eran naive a los iTNF6-9.
Los resultados de los distintos ensayos clínicos muestran que los pacientes tratados con secukinumab logran mayores tasas de remisión mantenidas en el tiempo, principalmente si no han tenido tratamiento previo con iTNF10. También se logra alcanzar una MDA en mayor porcentaje en estos pacientes con ambas dosis, 300 y 150mg11. Además, en el FUTURE 5 se observó una remisión según DAPSA (Disease Activity index for Psoriatic Arthritis) en el 15,2% de los pacientes9. El perfil de seguridad fue similar en los distintos ensayos clínicos con secukinumab y con pocas diferencias con respecto al placebo, sin evidencia de dependencia de la dosis.
La intención de este trabajo fue analizar la respuesta clínica y la seguridad de secukinumab en la práctica clínica real, en pacientes con APs que iniciaron el tratamiento como primer biológico o tras haber estado en tratamiento con biológicos previamente.
Material y métodosSe trata de un estudio multicéntrico (participan 6 hospitales de España), observacional y descriptivo, no intervencionista, realizado con pacientes que iniciaron el tratamiento con secukinumab entre el 1 de abril de 2017 y el 1 de abril de 2018. Los pacientes que se analizaron tenían una edad ≥18 años y cumplían los criterios CASPAR de clasificación para la APs12. Tenían afectación musculoesquelética con moderada-alta actividad, medido por DAPSA13, a pesar de tratamiento con FAMEsc (metotrexato, leflunomida o sulfasalazina) y se consideraban como candidatos para recibir tratamiento biológico siguiendo las recomendaciones del manejo de la APs2,3,14. Se incluyó a los pacientes que iniciaban tratamiento con secukinumab (con o sin FAME asociado) como primer biológico o tras tratamiento fallido con un biológico previo, con una dosis mensual de 150 mg o 300 mg, respectivamente, y con dosis de inducción, como se recomienda en la ficha técnica del fármaco15, a las semanas 0, 1, 2, 3 y 4. Se excluyó a los pacientes con afectación puramente axial (sin inflamación periférica) y a aquellos cuya indicación principal del tratamiento fuera actividad axial o cutánea. Se revisó a los pacientes en las consultas de reumatología según práctica clínica habitual y la actividad de la enfermedad se evaluó mediante recuento articular, presencia de entesitis y dactilitis, así como el índice DAPSA y sus puntos de corte16 en el momento de empezar el tratamiento y a los 12 meses de su inicio o cuando el paciente interrumpía el tratamiento. La afectación cutánea medida por la body surface area fue categorizada como leve (<5%), moderada (5-10%) o grave (>10%)17. Se recogieron los eventos adversos acaecidos durante el período de seguimiento.
Los resultados obtenidos del análisis de las variables cualitativas o categóricas se presentan en forma de porcentajes y frecuencias y los de las variables cuantitativas se muestran como media y desviación típica tras verificar que siguen una distribución normal. Las diferencias se consideraron clínicamente significativas con p<0,05. Para todos los análisis se utilizó el software SPSS 17.0.
Todos los pacientes firmaron un consentimiento informado antes del inicio del tratamiento para permitir la recogida y análisis de los datos de forma anonimizada y su inclusión en un registro de estudio de pacientes con APs (código de registro: 2015/671).
ResultadosSe incluyó a 76 pacientes con una edad de 51,9 años (10,3). La distribución por sexos fue de 37 mujeres (48,7%) y 39 hombres (51,3%), con una duración de la enfermedad, desde el diagnóstico, de 9,5 años (7,1). Presentaban dactilitis 24 pacientes (31,6%) y entesitis 39 (51,3%) y la mayoría tenían una forma periférica poliarticular o una afectación mixta (axial y periférica), con 32 pacientes (42,1%) cada una. Los 12 restantes eran formas periféricas oligoarticulares (15,8%).
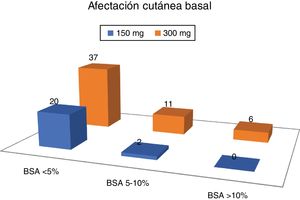
El DAPSA medio al inicio del tratamiento con secukinumab era 19,0 (9,8). En cuanto a la afectación cutánea, 8 pacientes (10.5%) no tenían psoriasis en el momento de iniciar secukinumab, 49 tenían una afectación leve (64,5%), 13 moderada (17,1%) y 6 grave (7,9%).
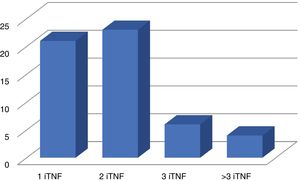
El motivo de prescripción del tratamiento con secukinumab fue la actividad de la enfermedad en 75 pacientes y solo en un paciente se prescribió por secundarismo asociado al tratamiento previo. Lo recibieron como primer tratamiento biológico 22 pacientes (28,9%) a la dosis de 150mg al mes. El resto, 54 pacientes (71,1%), a una dosis de 300mg al mes, tras haber recibido al menos un biológico previamente: iTNF en 54 (fig. 1) y ustekinumab en 2 pacientes. El 59,2% (45 pacientes) recibieron secukinumab sin un FAMEsc asociado, el 27,6% con metotrexato, el 10,5% con leflunomida y el 2,6% con sulfasalazina.
Más de 2/3 de los pacientes tenían una afectación leve de la piel y ningún paciente con afectación grave de la piel estaba con la dosis de secukinumab de 150mg (fig. 2).
En la tabla 1 se resumen las características basales de los pacientes según la dosis de secukinumab y en la tabla 2 la respuesta clínica y las retiradas del fármaco. En el análisis bivariante no se observaron diferencias significativas en las variables analizadas entre los pacientes con secukinumab 150 mg (sin biológico previo) y 300mg (tras al menos un biológico), excepto en la tasa de pacientes que alcanzaron baja o muy baja actividad medida por DAPSA. A pesar de que en ambos grupos de pacientes la tasa de retención a 12 meses era elevada y sin diferencias estadísticamente significativas: 90,9% para el grupo de 150mg y 81,5% para el de 300mg, el porcentaje de pacientes con un DAPSA menor o igual a 14 (VLDA y LDA) fue mayor en el grupo de pacientes naive (150mg; p=0,005). En el análisis de regresión logística binaria (teniendo en cuenta edad, sexo, años con APs, dactilitis y FAMEsc) se mantuvo esta diferencia con una OR ajustada de 5,502 (IC 95%: 1,371-22,070; p=0,016).
Características basales de los pacientes tratados con secukinumab (naive y no naive a biológicos)
| Pacientes sin biológico previo (N=22) | Pacientes con biológico previo (N=54) | p | |
|---|---|---|---|
| Edad (años) | 52,1 (9,4) | 51,9 (10,8) | 0,922 |
| Mujeres, n (%) | 7 (31,8) | 30 (55,6) | 0,060 |
| Años desde el diagnóstico de artritis psoriásica | 8,6 (8,0) | 9,9 (6,7) | 0,456 |
| Afectación mixta, n (%) | 12 (54,5) | 20 (37,0) | 0,161 |
| Fármaco modificador del curso de la enfermedad asociado, n (%) | 6 (27,3) | 25 (46,3) | 0,126 |
| Body surface area<5, n (%) | 17 (77,3) | 37 (68,5) | 0,445 |
| Dactilitis, n (%) | 8 (36,4) | 16 (29,6) | 0,567 |
| Entesitis, n (%) | 11 (50,0) | 28 (51,9) | 0,884 |
| DAPSA | 19,2 (8,4) | 18,9 (10,3) | 0,947 |
Resultados como porcentaje o media (desviación típica).
Datos de eficacia y seguridad a los 12 meses según la dosis
| Pacientes sin biológico previo (N=22) | Pacientes con biológico previo (N=54) | p | |
|---|---|---|---|
| DAPSA VLDA/LDA, n (%) | 18 (81,8) | 25 (46,3) | 0,005 |
| Continúan con secukinumab, n (%) | 20 (90,9) | 44 (81,5) | 0,491 |
| Fallo primario, n (%) | 1 (4,5) | 7 (12,9) | 0,501 |
| Fallo secundario, n (%) | 1 (4,5) | 3 (5,6) | 0,698 |
| Abandono por efecto adverso, n (%) | 0 (0,0) | 1 (1,9) | 0,640 |
DAPSA VLDA/LDA: muy baja actividad o baja actividad (<14).
Se recogieron 2 casos con candidiasis genitourinaria (pacientes con diabetes), uno por cada grupo de tratamiento, que no requirieron la suspensión. La tasa de retirada del secukinumab en los 12 meses fue baja y similar en ambos grupos y solo hubo una retirada por un acontecimiento adverso grave en el grupo de 300mg, motivada por una neumonía.
DiscusiónLos resultados obtenidos en estos pacientes en la práctica clínica real muestran que el secukinumab obtiene mejorías clínicas sustanciales en los pacientes con APs activas con altas tasas de retención y datos de seguridad a 12 meses similares a los observados en los distintos ensayos clínicos del fármaco.
Estos datos están en concordancia con el creciente cuerpo de evidencia que apoya el uso de los inhibidores de la IL17 en la APs y que es reconocido en el ámbito internacional por las diferentes guías y recomendaciones de manejo de la APs2,3, incluso como tratamiento biológico inicial después de una respuesta inadecuada a los FAMEsc.
El FUTURE 5 es el mayor ensayo clínico aleatorizado de fase III de un fármaco biológico en APs9 y en él se observó que la administración subcutánea de secukinumab de 300mg y 150mg proporcionaba una mejoría rápida y significativa en la mayoría de las manifestaciones clínicas en comparación con el placebo, aunque secukinumab 300mg proporcionaba mejores respuestas frente a la dosis de 150mg, con o sin dosis de carga, en los objetivos clínicos finales como ACR20/ 50/70 o resolución de entesitis y dactilitis, particularmente en pacientes naive a los iTNF.
El presente trabajo en la práctica clínica real muestra datos de una buena respuesta al fármaco tanto en pacientes naive a terapias biológicas como en aquellos tratados previamente con algún fármaco biológico, principalmente iTNF. Sin embargo, las mejores respuestas clínicas se observaron en pacientes naive a terapia biológica, que consiguieron alcanzar un DAPSA de baja actividad y remisión en mayor proporción que aquellos que procedían previamente de un tratamiento con un iTNF, lo cual está en consonancia con los datos ya reseñados procedentes de los ensayos clínicos9.
Hasta la fecha se dispone de escasa información de la eficacia y seguridad del secukinumab en práctica clínica real y lo que conocemos deriva de los distintos ensayos clínicos, estudios post hoc así como de los datos de supervivencia poscomercialización18.
El perfil de seguridad fue consistente con lo ya publicado en los ensayos clínicos del fármaco18,19. Así, las infecciones por Candida —probablemente atribuidas al papel de IL17 en la defensa de las mucosas del huésped frente a las infecciones por hongos— observadas en este estudio son acordes con los resultados de los estudios de fase III del secukinumab (FUTURE 1-5): fueron de leve intensidad, no precisaron la suspensión del fármaco y requirieron simplemente el manejo con terapia antifúngica recomendada19.
Entre las limitaciones de este estudio, destacamos en primer lugar su carácter observacional, aunque esta característica, en cierto modo, puede ser también una fortaleza pues permite observar qué es lo que ocurre en los pacientes con un determinado tratamiento sin ejercer ningún tipo de interferencia y nos muestra toda la heterogeneidad que presenta la población estudiada. Otra limitación es el tamaño de la población estudiada, que es pequeño, por lo que las conclusiones extraídas de su análisis siempre deben ser tomadas con cautela.
Teniendo en cuenta los resultados obtenidos en este trabajo, podemos concluir que secukinumab es un fármaco eficaz y seguro en el tratamiento a 12 meses en la APs periférica activa en la práctica clínica real, tanto en pacientes con experiencia previa a terapia biológica como sin ella, y que se obtienen incluso mejores datos de reducción de la actividad inflamatoria en estos últimos con o sin FAMEsc asociado.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesJosé A. Pinto Tasende ha recibido pagos por conferencia o consultoría científica de BMS, Celgene, Janssen, Novartis, Pfizer y MSD.
A la Sociedad Gallega de Reumatología.