El estudio de la seguridad a largo plazo de las terapias biológicas ha sido posible gracias a la creación de distintos registros nacionales. Éstos han permitido resolver varias de las dudas iniciales sobre seguridad derivadas de ensayos clínicos, estudios observacionales y metaanálisis. El problema principal asociado al uso de las terapias biológicas es un aumento moderado en el riesgo de infecciones graves con respecto al observado con las terapias convencionales. Sin embargo, este riesgo puede reducirse con las medidas preventivas adecuadas. No parece existir un mayor riesgo de cáncer ni de mortalidad. Estos efectos adversos y otros menos frecuentes como la inducción paradójica de psoriasis, la enfermedad desmielinizante o las reacciones relacionadas con la administración, han sido ampliamente estudiados en el registro español BIOBADASER. En el presente artículo se repasa el estado actual de la seguridad de las terapias biológicas, con mención especial a las aportaciones de BIOBADASER sobre este tema.
The study of the long-term safety of biological therapies has been made possible because of the creation of several national registries. These have resolved some of the safety-derived doubts from the initial clinical trials, observational studies and meta-analyses. The main problem associated with biological therapy use is a moderate increase in the risk of serious infections when compared to conventional therapies. However, this risk can be reduced with adequate preventative measures. It seems that there is neither an increased risk of cancer nor elevated mortality with the use of biological drugs. These adverse events, along with others such as paradoxical induction of psoriasis, demyelinating diseases and administration-related reactions, have been studied in BIOBADASER, the Spanish Registry of Biological Therapies. This paper reviews the safety of biological agents with a special focus on BIOBADASER studies
El pronóstico de enfermedades reumáticas inflamatorias crónicas como la artritis reumatoide (AR), la espondilitis anquilosante (EA), la artritis psoriásica (APs) o la artritis idiopática juvenil (AIJ) ha mejorado considerablemente en la última década con el uso de las terapias biológicas. En la actualidad se dispone de 9 fármacos biológicos, con estructuras y mecanismos de acción diferentes (anticuerpos monoclonales o proteínas de fusión) que han ampliado las posibilidades terapéuticas ante el fallo primario o secundario a cualquiera de los mismos. Su eficacia ha sido ampliamente demostrada de forma homogénea en ensayos clínicos (EC) y estudios observacionales (EO).
El uso de las terapias biológicas genera inquietud debido al desconocimiento sobre los efectos a largo plazo del bloqueo o inhibición persistente de citocinas o sus receptores (TNF, IL-1, IL-6R) o de células (linfocitos B y C) que desempeñan un papel primordial en los mecanismos inmunitarios de defensa contra la infección o contra el cáncer. Existe una amplia literatura sobre seguridad que, a diferencia de la de eficacia, aporta datos en muchos casos heterogéneos cuando no contradictorios. Esto puede deberse a los numerosos factores de confusión existentes, no siempre fáciles de identificar y de realizar las correcciones oportunas. Un factor frecuente en EO es la confusión por indicación, que se genera cuando una indicación para tratar es en sí misma un factor de riesgo para el desenlace que se quiere investigar, por ejemplo, la severidad de la AR, o bien la confusión por contraindicación, que ocurre cuando una contraindicación para tratar con terapias biológicas, por ejemplo, una alta comorbilidad, también es un factor de riesgo que influye en la aparición de toxicidad. Otro factor que se debe tener en cuenta es el de las propias fuentes de datos. Los EC y estudios de extensión, EO y metaanálisis proporcionan una información relevante pero también tienen sus limitaciones: seguimiento corto y condiciones ideales no representativas de la práctica real en los EC, posible sesgo de indicación o canalización en EO o bien sesgo de publicación en los metaanálisis.
Con la finalidad de conocer la seguridad a largo plazo de las terapias biológicas han ido creándose registros, muchos de ellos auspiciados por las sociedades científicas de reumatología, que se basan en el seguimiento prospectivo de pacientes que reciben fármacos biológicos en práctica clínica habitual. En el año 2000, la Sociedad Española de Reumatología (SER) tuvo la iniciativa de crear BIOBADASER, el registro español de acontecimientos adversos de terapias biológicas en enfermedades reumáticas1 con el objetivo de detectar y cuantificar riesgos de efectos adversos relevantes o inesperados. Inicialmente, se recibía la información de 100 centros y a partir de 2006 se restringió a 14 centros (BIOBADASER 2) con la intención de mejorar la fiabilidad de los datos recogidos. En 2007 se creó BIOBADAMÉRICA, el Registro Panamericano y en 2008 BIOBADADERM, el Registro para Enfermedades Dermatológicas. La cohorte de AR de BIOBADASER se compara con la cohorte EMECAR, que consta de 789 pacientes diagnosticados de AR y seguidos desde 1999 hasta 2005. Recientemente, EULAR ha recomendado los puntos importantes a considerar para homogenizar la recogida, análisis y comunicación de los datos de seguridad entre todos los registros2. El paso del tiempo nos ha dado una visión global del balance eficacia/toxicidad de los fármacos biológicos y ha permitido resolver varias de las dudas iniciales. El objetivo del presente artículo es repasar el estado actual de la seguridad de las terapias biológicas y, en concreto, las últimas aportaciones de BIOBADASER sobre este tema.
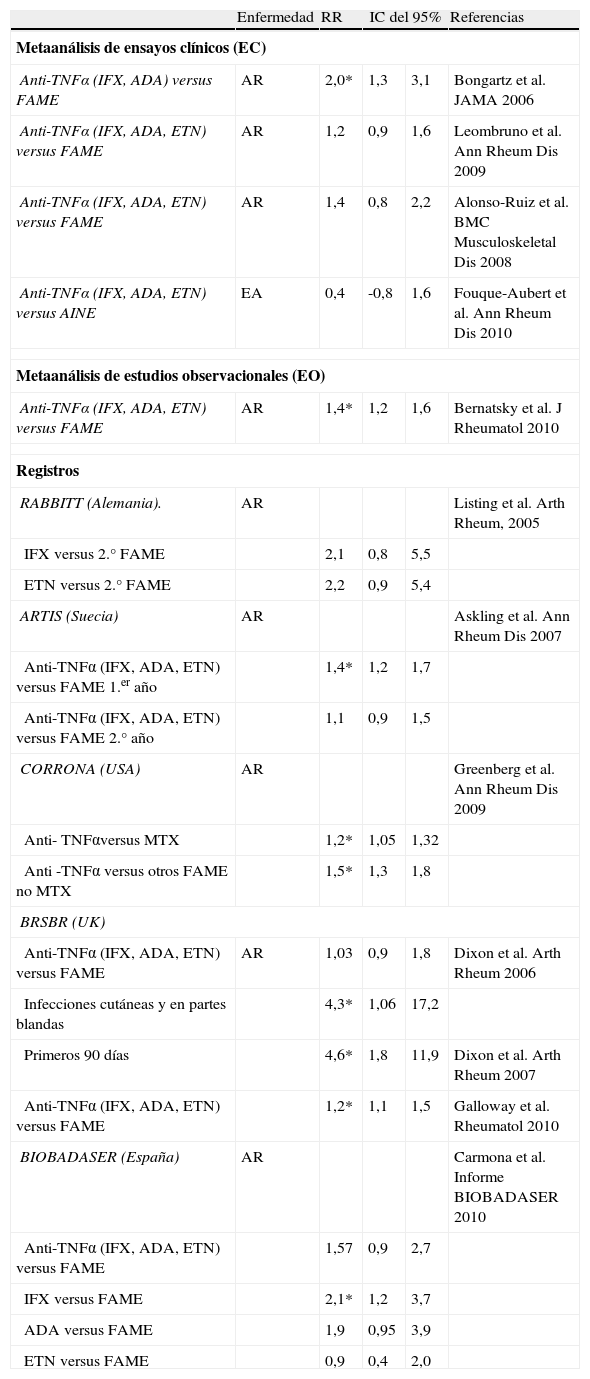
Seguridad de las terapias biológicasInfecciónEl uso de fármacos biológicos conlleva un incremento en el riesgo de infecciones. La prevalencia de infecciones graves en EC y EO se sitúa entre el 4 y el 13%, con una incidencia de alrededor de 5/100 pacientes y año (p-a). Las localizaciones más frecuentes son las vías aéreas, incluidos neumonía, piel y partes blandas y en tracto urinario. De los tres metaanálisis publicados basados en EC en AR, sólo uno encontró un aumento significativo del riesgo relativo de infección grave en pacientes expuestos frente a los no expuestos a anti-TNFα (tabla 1) pero este primer metaanálisis estaba basado en tratamientos con IFX y ADA solamente, y no ajustado a algunos factores de confusión. Hay coincidencia en que los pacientes con dosis más altas, en especial de IFX, tenían más riesgo y que éste disminuía con la duración del ECA. Un metaanálisis reciente basado en EO sobre AR mostró casi un 40% de aumento del riesgo en pacientes que reciben anti-TNFα. Por contra, un metaanálisis en pacientes con EA mostró un riesgo absoluto bajo para infección grave que no aumentaba con anti-TNFα. Los datos derivados de registros demuestran, en general, un incremento de entre el 20 y 40% del riesgo de infecciones graves en pacientes expuestos a anti-TNFα (tabla 1), especialmente en los primeros meses de tratamiento. En BIOBADASER, las tasas de infección son más altas en los pacientes que reciben anti-TNFα en conjunto y en especial con IFX, si bien sin diferencias significativas con la población no expuesta de EMECAR (RR ajustado 1,57; IC del 95%, 0,92-2,67). Los factores de riesgo asociados a infección grave son: edad superior a 65 años, diagnóstico de AR, comorbilidad (insuficiencia renal, enfermedad pulmonar obstructiva crónica, diabetes mellitus y enfermedad pulmonar intersticial), el uso de corticoides y el uso de IFX. También se encontró un mayor riesgo en los primeros meses de exposición.
Riesgo de infecciones graves con el uso de fármacos antagonistas del TNF
| Enfermedad | RR | IC del 95% | Referencias | ||
| Metaanálisis de ensayos clínicos (EC) | |||||
| Anti-TNFα (IFX, ADA) versus FAME | AR | 2,0* | 1,3 | 3,1 | Bongartz et al. JAMA 2006 |
| Anti-TNFα (IFX, ADA, ETN) versus FAME | AR | 1,2 | 0,9 | 1,6 | Leombruno et al. Ann Rheum Dis 2009 |
| Anti-TNFα (IFX, ADA, ETN) versus FAME | AR | 1,4 | 0,8 | 2,2 | Alonso-Ruiz et al. BMC Musculoskeletal Dis 2008 |
| Anti-TNFα (IFX, ADA, ETN) versus AINE | EA | 0,4 | -0,8 | 1,6 | Fouque-Aubert et al. Ann Rheum Dis 2010 |
| Metaanálisis de estudios observacionales (EO) | |||||
| Anti-TNFα (IFX, ADA, ETN) versus FAME | AR | 1,4* | 1,2 | 1,6 | Bernatsky et al. J Rheumatol 2010 |
| Registros | |||||
| RABBITT (Alemania). | AR | Listing et al. Arth Rheum, 2005 | |||
| IFX versus 2.° FAME | 2,1 | 0,8 | 5,5 | ||
| ETN versus 2.° FAME | 2,2 | 0,9 | 5,4 | ||
| ARTIS (Suecia) | AR | Askling et al. Ann Rheum Dis 2007 | |||
| Anti-TNFα (IFX, ADA, ETN) versus FAME 1.er año | 1,4* | 1,2 | 1,7 | ||
| Anti-TNFα (IFX, ADA, ETN) versus FAME 2.° año | 1,1 | 0,9 | 1,5 | ||
| CORRONA (USA) | AR | Greenberg et al. Ann Rheum Dis 2009 | |||
| Anti- TNFαversus MTX | 1,2* | 1,05 | 1,32 | ||
| Anti -TNFα versus otros FAME no MTX | 1,5* | 1,3 | 1,8 | ||
| BRSBR (UK) | |||||
| Anti-TNFα (IFX, ADA, ETN) versus FAME | AR | 1,03 | 0,9 | 1,8 | Dixon et al. Arth Rheum 2006 |
| Infecciones cutáneas y en partes blandas | 4,3* | 1,06 | 17,2 | ||
| Primeros 90 días | 4,6* | 1,8 | 11,9 | Dixon et al. Arth Rheum 2007 | |
| Anti-TNFα (IFX, ADA, ETN) versus FAME | 1,2* | 1,1 | 1,5 | Galloway et al. Rheumatol 2010 | |
| BIOBADASER (España) | AR | Carmona et al. Informe BIOBADASER 2010 | |||
| Anti-TNFα (IFX, ADA, ETN) versus FAME | 1,57 | 0,9 | 2,7 | ||
| IFX versus FAME | 2,1* | 1,2 | 3,7 | ||
| ADA versus FAME | 1,9 | 0,95 | 3,9 | ||
| ETN versus FAME | 0,9 | 0,4 | 2,0 | ||
En lo referente a infecciones víricas, se ha descrito tanto en el registro alemán RABBITT como en BIOBADASER, un incremento moderado del riesgo de infección por el virus de la varicela zóster, si bien la tasa de hospitalización por infecciones herpéticas es baja3. En relación con el virus de la hepatitis C parece existir un riesgo muy bajo de reactivación, aunque se recomienda monitorizar la carga viral y las transaminasas. Sin embargo, el riesgo de reactivación de la hepatitis B en pacientes estables tras el uso de anti-TNFα es más alto, en especial con IFX y en presencia de pacientes con HBsAg positivo, sin Ac o con ADN viral elevado no tanto en portadores crónicos asintomáticos. En pacientes con antecedentes de hepatitis B se recomienda el uso concomitante de antivirales, si bien hay que destacar un porcentaje creciente de resistencia a lamiduvina.
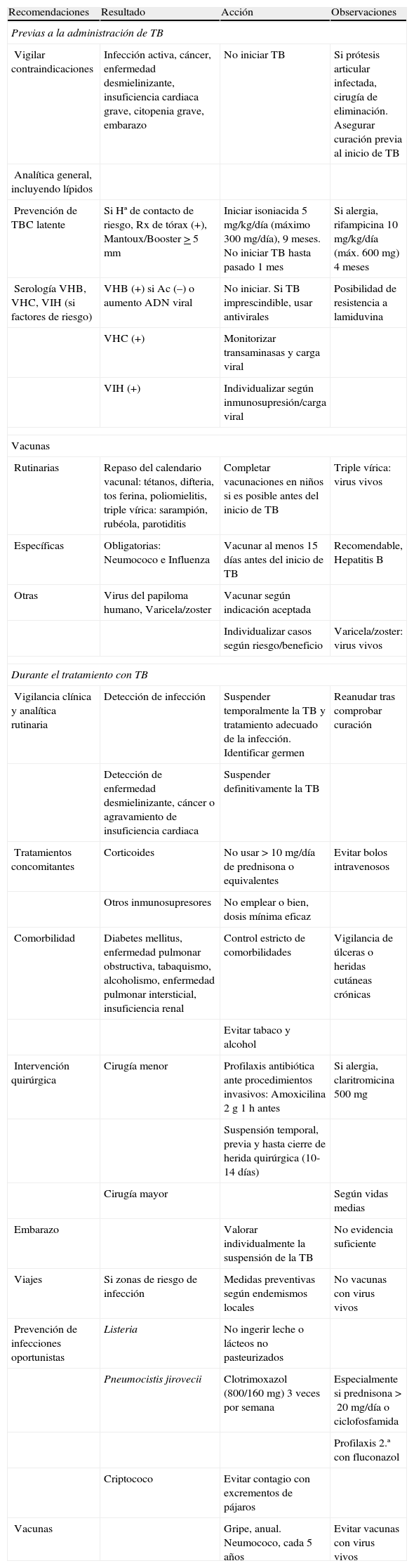
Se han comunicado numerosos casos de infecciones por gérmenes oportunistas, incluidos hongos e infecciones bacterianas no habituales. En BIOBADASER se ha encontrado una aumento del riesgo de listeriosis4, lo que obliga a extremar medidas preventivas en relación con el consumo de lácteos no pasteurizados y un aumento relativo en las bacteriemias por Salmonella no typhi, aunque no en la incidencia global de salmonelosis5. Pero, sin duda, la infección donde la aportación de BIOBADASER ha sido fundamental es la tuberculosis (TBC). En el año 2000 se detectó en los pacientes españoles tratados con anti-TNFα una alta incidencia de TBC en comparación con lo esperado en la población general (RR de entre 11 y 20 con respecto a las AR no expuestas)6, incluidas formas extrapulmonares y diseminadas en el 65% de los casos. La alerta generó que se dictaran en marzo de 2002 las recomendaciones oficiales sobre prevención de la TBC latente en pacientes que iniciaban anti-TNFα, con las que se consiguió una reducción del 80% de nuevos casos7. La validez de estas recomendaciones fue ratificada posteriormente al comprobar un riesgo 7 veces mayor de TBC si no se cumplían las mismas8. Estas y otras medidas preventivas útiles en pacientes que van a recibir terapias biológicas se muestran en la tabla 2.
Recomendaciones sobre seguridad en pacientes con terapias biológicas.
| Recomendaciones | Resultado | Acción | Observaciones |
| Previas a la administración de TB | |||
| Vigilar contraindicaciones | Infección activa, cáncer, enfermedad desmielinizante, insuficiencia cardiaca grave, citopenia grave, embarazo | No iniciar TB | Si prótesis articular infectada, cirugía de eliminación. Asegurar curación previa al inicio de TB |
| Analítica general, incluyendo lípidos | |||
| Prevención de TBC latente | Si Hª de contacto de riesgo, Rx de tórax (+), Mantoux/Booster>5 mm | Iniciar isoniacida 5 mg/kg/día (máximo 300 mg/día), 9 meses. No iniciar TB hasta pasado 1 mes | Si alergia, rifampicina 10 mg/kg/día (máx. 600 mg) 4 meses |
| Serología VHB, VHC, VIH (si factores de riesgo) | VHB (+) si Ac (–) o aumento ADN viral | No iniciar. Si TB imprescindible, usar antivirales | Posibilidad de resistencia a lamiduvina |
| VHC (+) | Monitorizar transaminasas y carga viral | ||
| VIH (+) | Individualizar según inmunosupresión/carga viral | ||
| Vacunas | |||
| Rutinarias | Repaso del calendario vacunal: tétanos, difteria, tos ferina, poliomielitis, triple vírica: sarampión, rubéola, parotiditis | Completar vacunaciones en niños si es posible antes del inicio de TB | Triple vírica: virus vivos |
| Específicas | Obligatorias: Neumococo e Influenza | Vacunar al menos 15 días antes del inicio de TB | Recomendable, Hepatitis B |
| Otras | Virus del papiloma humano, Varicela/zoster | Vacunar según indicación aceptada | |
| Individualizar casos según riesgo/beneficio | Varicela/zoster: virus vivos | ||
| Durante el tratamiento con TB | |||
| Vigilancia clínica y analítica rutinaria | Detección de infección | Suspender temporalmente la TB y tratamiento adecuado de la infección. Identificar germen | Reanudar tras comprobar curación |
| Detección de enfermedad desmielinizante, cáncer o agravamiento de insuficiencia cardiaca | Suspender definitivamente la TB | ||
| Tratamientos concomitantes | Corticoides | No usar>10 mg/día de prednisona o equivalentes | Evitar bolos intravenosos |
| Otros inmunosupresores | No emplear o bien, dosis mínima eficaz | ||
| Comorbilidad | Diabetes mellitus, enfermedad pulmonar obstructiva, tabaquismo, alcoholismo, enfermedad pulmonar intersticial, insuficiencia renal | Control estricto de comorbilidades | Vigilancia de úlceras o heridas cutáneas crónicas |
| Evitar tabaco y alcohol | |||
| Intervención quirúrgica | Cirugía menor | Profilaxis antibiótica ante procedimientos invasivos: Amoxicilina 2g 1 h antes | Si alergia, claritromicina 500 mg |
| Suspensión temporal, previa y hasta cierre de herida quirúrgica (10-14 días) | |||
| Cirugía mayor | Según vidas medias | ||
| Embarazo | Valorar individualmente la suspensión de la TB | No evidencia suficiente | |
| Viajes | Si zonas de riesgo de infección | Medidas preventivas según endemismos locales | No vacunas con virus vivos |
| Prevención de infecciones oportunistas | Listeria | No ingerir leche o lácteos no pasteurizados | |
| Pneumocistis jirovecii | Clotrimoxazol (800/160 mg) 3 veces por semana | Especialmente si prednisona>20 mg/día o ciclofosfamida | |
| Profilaxis 2.ª con fluconazol | |||
| Criptococo | Evitar contagio con excrementos de pájaros | ||
| Vacunas | Gripe, anual. Neumococo, cada 5 años | Evitar vacunas con virus vivos | |
En relación con el uso de terapias biológicas en indicaciones no aprobadas, una revisión reciente de los casos de BIOBADASER demuestra aumento del riesgo de infección en enfermedades de base inmunológica, con un perfil similar a la AR, y menor riesgo en otras artropatías crónicas, similar al encontrado en espondiloartropatías9.
No se dispone aún en BIOBADASER de estudios de seguridad sobre infecciones a largo plazo con fármacos biológicos no antagonistas del TNF.
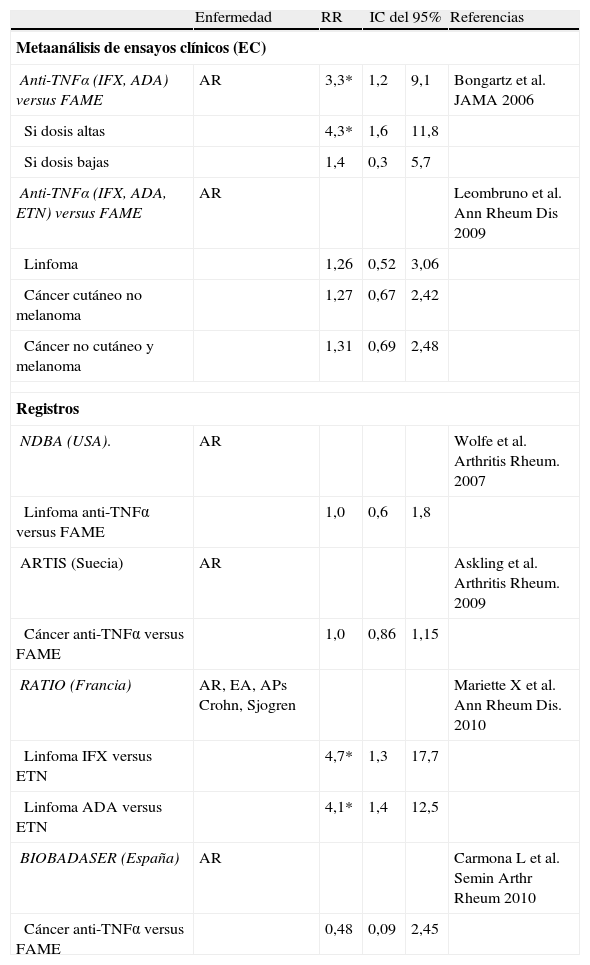
CáncerLos metaanálisis publicados ofrecen resultados discordantes (tabla 3) probablemente debido a problemas metodológicos. Sin embargo, registros como el National Data Bank for Rheumatic Diseases, el registro sueco ARTIS o el registro francés RATIO, no han mostrado en general un aumento del riesgo de cáncer, incluido el linfoma, en pacientes expuestos a anti-TNFα en relación con ninguna de las poblaciones de comparación a lo largo de los años de tratamiento acumulado. En el registro RATIO se encontró un mayor riesgo relativo con los anticuerpos monoclonales que con la proteína de fusión (tabla 3). En BIOBADASER, un análisis del seguimiento de 4.694 pacientes (15.662 p-a) con una mediana de exposición de 3,1 años, mostró 81 nuevos cánceres, con una incidencia similar entre los tres fármacos (IR 5,8/1000 p-a, en AR) y tendencia a disminuir después de los 4 primeros meses. Se observó un RR ajustado de 0,48 (IC del 95%, 0,09-2,45) en pacientes expuestos a anti-TNFα frente a los no expuestos y una tasa de incidencia estandarizada con respecto a la población general de un 34% inferior a la esperada. Sin embargo, es preciso tener precaución en pacientes con factores de riesgo tales como historia previa de cáncer (IRR 26,4), personas mayores, enfermedad pulmonar obstructiva crónica y en los tratados con glucocorticoides.
Riesgo de cáncer con el uso de fármacos antagonistas del TNF en pacientes con AR
| Enfermedad | RR | IC del 95% | Referencias | ||
| Metaanálisis de ensayos clínicos (EC) | |||||
| Anti-TNFα (IFX, ADA) versus FAME | AR | 3,3* | 1,2 | 9,1 | Bongartz et al. JAMA 2006 |
| Si dosis altas | 4,3* | 1,6 | 11,8 | ||
| Si dosis bajas | 1,4 | 0,3 | 5,7 | ||
| Anti-TNFα (IFX, ADA, ETN) versus FAME | AR | Leombruno et al. Ann Rheum Dis 2009 | |||
| Linfoma | 1,26 | 0,52 | 3,06 | ||
| Cáncer cutáneo no melanoma | 1,27 | 0,67 | 2,42 | ||
| Cáncer no cutáneo y melanoma | 1,31 | 0,69 | 2,48 | ||
| Registros | |||||
| NDBA (USA). | AR | Wolfe et al. Arthritis Rheum. 2007 | |||
| Linfoma anti-TNFα versus FAME | 1,0 | 0,6 | 1,8 | ||
| ARTIS (Suecia) | AR | Askling et al. Arthritis Rheum. 2009 | |||
| Cáncer anti-TNFα versus FAME | 1,0 | 0,86 | 1,15 | ||
| RATIO (Francia) | AR, EA, APs Crohn, Sjogren | Mariette X et al. Ann Rheum Dis. 2010 | |||
| Linfoma IFX versus ETN | 4,7* | 1,3 | 17,7 | ||
| Linfoma ADA versus ETN | 4,1* | 1,4 | 12,5 | ||
| BIOBADASER (España) | AR | Carmona L et al. Semin Arthr Rheum 2010 | |||
| Cáncer anti-TNFα versus FAME | 0,48 | 0,09 | 2,45 | ||
En niños, hay una evidencia insuficiente sobre el posible riesgo incrementado con respecto a la población general pediátrica, ya que no se conoce el riesgo basal de cáncer en pacientes con AIJ ni la influencia de los tratamientos como MTX o corticoides.
MortalidadUna correcta supresión de la actividad inflamatoria y por tanto, reducción de la severidad de la AR, podría incrementar la supervivencia de los pacientes. De hecho, en el registro sueco se observó una reducción de mortalidad en pacientes tratados con anti-TNFα, en especial en mujeres (HR=0,52; IC del 95%, 0,33-0,82)10 y en el registro británico (BSRBR) el tratamiento con anti-TNFα no se asoció con aumento, aunque tampoco con disminución de la mortalidad (HR=0,86; IC del 95%, 0,64-1,16)11. En BIOBADASER, la tasa de mortalidad en pacientes con AR tratados con anti-TNFα no es mayor que la esperada en la población general e incluso un 68% menor que la observada en pacientes con AR no tratados con anti-TNFα12. El seguimiento más reciente de BIOBADASER sigue mostrando los mismos resultados con una tasa de mortalidad relativa ajustada para edad, sexo y duración de la enfermedad de 0,35 (IC del 95%, 0,23-0,54) y una tasa de mortalidad estandarizada a la población general de 0,4 (IC del 95%, 0,3-0,5). Los efectos adversos mortales más frecuentes fueron las infecciones (34%), las enfermedades cardíacas (23%), las enfermedades respiratorias (12%) y las neoplasias (10%).
Manifestaciones relacionadas con la administraciónEn BIOBADASER, las reacciones relacionadas con la administración ocurrieron en el 6,3% de los pacientes con una incidencia de 18 casos/1.000 p-a (IC del 95%, 16-20), siendo la frecuencia mayor con IFX que con ETN y ADA, así como en la AR y en mujeres. Motivaron la suspensión del fármaco en el 64% de los casos. Es destacable el hecho de que en más del 20% de los casos estas reacciones ocurrieron al cabo de más de 15 meses del inicio del tratamiento13.
Inducción de autoinmunidadLa inducción de anticuerpos neutralizantes se ha observado fundamentalmente con los fármacos de origen quimérico IFX y RTX (HACA), en menor grado con los fármacos de origen humano como ADA, pero no con los receptores solubles. La presencia de dichos anticuerpos puede provocar un mayor número de reacciones a la infusión y podría influir en la pérdida o disminución de la eficacia y necesidad de aumentar la dosis. El uso concomitante de MTX parece reducir la frecuencia de los mismos. La inducción de autoanticuerpos es un efecto descrito con frecuencia variable (ANA: 8-62%; anti-ADN: 15%) según el fármaco o la enfermedad de base. Más raramente se han descrito enfermedades autoinmunitarias (síndromes lupus-like [0,2%], vasculitis, en especial leucocitoclásticas y uveítis autoinmunitarias) en relación temporal con la exposición al fármaco, que se resuelven por lo general al suspenderlo.
Toxicidad cutáneaEs relativamente frecuente la aparición de dermatitis eczematosa y erupciones liquenoides. En los últimos años se han descrito casos de inducción de novo o de exacerbación de una psoriasis ya existente como reacción paradójica de las terapias biológicas, aun sin una explicación clara, salvo el posible desequilibrio entre TNF-α e interferón (IFN) alfa. La incidencia en AR varía entre 1,04 (IC del 95%, 0,67-1,54) en el registro BSRBR14 y 3,0 (IC del 95%, 1,4-6,4)/1.000 p-a en BIOBADASER, donde se ha descrito una IRR de pacientes expuestos a anti-TNFα frente a los no expuestos de 1,57 (IC del 95%, 0,38-6,58). Suelen predominar las formas de psoriasis pustuloso palmo-plantar (56%) y de psoriasis en placas. Se ha descrito con los tres fármacos anti-TNFα, si bien en el registro británico se ha encontrado un mayor riesgo con ADA14. No se conocen los factores predisponentes. Las lesiones pueden resolverse en más de la mitad de los casos sin suspender el fármaco, aunque si persisten o son extensas se aconseja la retirada del mismo y uso de tratamiento tópico, retinoides, metotrexato o ciclosporina según la gravedad de las lesiones15.
Enfermedades desmielinizantesNo se conoce con seguridad si existe una relación causa-efecto, pero el riesgo de aparición de enfermedades desmielinizantes con el uso de terapias biológicas se incrementa en un 30%16. La incidencia es baja, entre 0,3 y 0,6 por cada 1.000 p-a de exposición. En BIOBADASER, tras un seguimiento en 9.256 pacientes (21.425 p-a) se han comunicado 9 casos, por lo que la tasa de enfermedad desmielinizante en pacientes tratados con anti-TNFα no fue superior a la esperada en población general17. Las terapias biológicas están contraindicadas en pacientes con esclerosis múltiple y han de emplearse con precaución si existen antecedentes familiares.
Otros efectos adversosLos anti-TNFα están contraindicados en pacientes con insuficiencia cardiaca (IC) avanzada pero se pueden emplear con precaución en grados más leves (clases I-II de la New York Heart Association). Sin embargo, tampoco está clara la relación causa-efecto en pacientes con enfermedades reumáticas. En el registro alemán RABBIT se observó un 40% de incremento en el riesgo de IC en los pacientes con AR y DAS 28 más alto, pero no hubo diferencias significativas en pacientes expuestos a anti-TNFα frente a los tratados con FAME (HR=1,66; IC del 95%, 0,67-4,10)18. Algo parecido ocurre con el riesgo de infarto agudo de miocardio (IAM). En el registro BSRBR, los pacientes que recibían anti-TNFα tuvieron un riesgo global de IAM similar al de los pacientes con FAME (IRR: 1,44; IC del 95%, 0,56-3,67), riesgo que se redujo considerablemente en los pacientes respondedores a anti-TNFα frente a los no respondedores (IRR: 0,36; IC del 95%, 0,19-0,69)19. Por tanto, es probable que la mejoría en la severidad de la enfermedad con anti-TNFα sea la causante de la disminución del riesgo de enfermedad cardiovascular en pacientes con AR. Se requieren más estudios para definir el efecto de los anti-TNFα en la enfermedad pulmonar. Se han descrito comunicaciones aisladas de beneficio en asma bronquial, enfermedad pulmonar intersticial o sarcoidosis y, por otra parte, el efecto paradójico de la aparición de sarcoidosis o fibrosis pulmonar como efecto secundario20. Las alteraciones de las transaminasas hepáticas son relativamente infrecuentes con el uso de anti-TNFα y no conllevan riesgo de progresión a insuficiencia hepática. En algunos estudios se han descrito alteraciones en el perfil lipídico con el uso de los fármacos anti-TNFα y de TCZ. La tendencia observada es elevación leve de colesterol total, HDL y triglicéridos sin cambios en el cociente ApoB/ApoA1, en el índice aterogénico ni repercusión en la frecuencia de eventos cardiovasculares21. Con el uso de TCZ se ha descrito además la aparición de neutropenia transitoria.
Riesgo en el embarazoLa evidencia es aún escasa, por lo que no hay efectos teratógenos claramente establecidos con ningún fármaco biológico22. Se han comunicado casos aislados de malformaciones pertenecientes al espectro del síndrome VATERL (anomalías vertebrales, atresia esofágica y anal, alteraciones renales y defectos preaxiales de miembros superiores como la polidactilia), en relación con el uso de anti-TNFα, si bien está por definir la magnitud del riesgo. En BIOBADASER, en 2006, no se comunicaron malformaciones en ninguno de los 7 embarazos a término registrados. Se recomienda suspender la TB durante el embarazo y en cualquier caso valorar casos individuales, evitando su utilización al menos durante el primer trimestre y lactancia.
ConclusionesLa preocupación principal derivada del uso de terapias biológicas es el aumento del riesgo de infecciones graves, que con respecto a terapias convencionales es moderado en magnitud relativa y pequeño en términos absolutos. El riesgo disminuye al extremar las medidas preventivas para la infección, especialmente las vacunaciones, la prevención de TBC y evitar los tratamientos concomitantes con glucocorticoides. No parece existir un mayor riesgo de cáncer ni de mortalidad e incluso algunos datos avalan una reducción de ésta, relacionada entre otras causas con el beneficio cardiovascular que conlleva el control adecuado de la inflamación crónica. La capacidad de inducción de autoanticuerpos no se traduce en general en riesgo de enfermedad autoinmunitaria clínicamente relevante. Es tranquilizador saber que no ha aparecido a lo largo del tiempo ningún nuevo efecto adverso que no hubiera sido ya detectado en los EC iniciales con anti-TNFα, por lo que se espera que ocurra lo mismo con los fármacos de introducción más reciente. Por último, es preciso ponderar la magnitud del riesgo de reacciones adversas menos graves, como la inducción de psoriasis paradójico, efectos adversos infrecuentes como la enfermedad desmielinizante, establecer el riesgo real en embarazos, el riesgo a largo plazo de los nuevos fármacos biológicos o el derivado de la exposición múltiple a los mismos. Para ello se requiere, si duda, la colaboración adecuada entre investigadores de los distintos registros nacionales entre los que BIOBADASER seguirá teniendo un papel muy relevante.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Dra. Loreto Carmona, por la valiosa aportación de datos de BIOBADASER, y al Dr. Antonio Naranjo, por la ayuda en la revisión del manuscrito.