El certolizumab pegol es un nuevo fármaco anti-TNF formado por el fragmento Fab’ de un anticuerpo monoclonal murino humanizado unido a dos moléculas de polietilenglicol. El certolizumab pegol reconoce y neutraliza el TNF-α humano, soluble y unido a membrana, y ha demostrado eficacia clínica en ensayos controlados en la AR y en la enfermedad de Crohn. En esta revisión se resumen las características estructurales y los datos de eficacia clínica, de prevención del daño estructural, así como los datos de seguridad de este anti-TNF en pacientes con AR.
Certolizumab pegol is a new anti-TNF drug formed by the Fab’ fragment of a humanized mouse monoclonal antibody bound to two molecules of polyethylene glycol. Certolizumab pegol recognizes and binds to human TNF-α, both in its soluble and membrane bound form, and has shown clinical efficacy in controlled trials for the treatment of RA and Crohns’ disease. In this review we summarize the structural characteristics and clinical efficacy data, as well as safety data of this anti-TNF agent in patients with RA.
La artritis reumatoide (AR) es una enfermedad sistémica, de origen desconocido y de naturaleza autoinmunitaria, que se caracteriza por la inflamación crónica de la membrana sinovial de las articulaciones diartrodiales. El curso natural de la AR tiende a la destrucción progresiva de la articulación generando deformidades, dolor e incapacidad funcional. El objetivo terapéutico es reducir la actividad de la enfermedad y preservar la capacidad funcional, de ahí que la eficacia de un tratamiento dependa de que sea capaz de detener o retrasar la progresión del daño estructural que presentan las articulaciones de los pacientes con AR1. En la última década se han desarrollado fármacos biológicos para el manejo de la AR que actúan a través de: a) bloquear citocinas proinflamatorias, tales como el factor de necrosis tumoral (TNF)-α; b) modular la activación de los linfocitos T, o c) eliminar las células B. Todos ellos han demostrado, en ensayos clínicos controlados y aleatorizados, eficacia en el control de los síntomas y signos de la enfermedad y que son capaces de prevenir el daño de las estructuras articulares2,3.
El TNF-α es una citocina proinflamatoria que se encuentra en forma soluble o unida a la membrana de los macrófagos y otras células que la producen en respuesta a diferentes estímulos. En pacientes con diversas enfermedades inflamatorias crónicas se han hallado concentraciones elevadas de TNF-α en sus tejidos diana. Este hallazgo, unido a los datos sobre la eficacia clínica del bloqueo farmacológico de esta citocina, ha confirmado el papel esencial del TNF-α en la patogenia de procesos como la AR, las espondiloartropatías, la psoriasis o en la enfermedad de Crohn. Hasta hace poco tiempo, los fármacos anti-TNF disponibles en el mercado eran: el infliximab (IFX) (anticuerpo monoclonal quimérico ratón/humano), el adalimumab (ADL) (anticuerpo monoclonal humano recombinante) y el etanercept (proteína de fusión del receptor soluble del TNF y el fragmento Fc de la IgG1). A ellos se han unido recientemente dos nuevos compuestos biológicos que comparten la misma diana terapéutica: el golimumab, un anticuerpo humano, y el certolizumab pegol (CZP). Este último es un fármaco biológico con características estructurales diferenciales del resto de los anti-TNF al estar formado por el fragmento Fab’ de un anticuerpo monoclonal murino humanizado unido a dos moléculas de polietilenglicol (PEG). El CZP reconoce y neutraliza el TNF-α humano, soluble y unido a membrana, y ha demostrado eficacia clínica en ensayos controlados en la AR4,5 y en la enfermedad de Crohn6,7.
En esta revisión se resumen las características estructurales y los datos de eficacia clínica, de prevención del daño estructural, así como los datos de seguridad del CZP en pacientes con AR.
Estructura y distribución tisular del cetolizumab pegolComo se ha comentado, el CZP es un fármaco biológico formado por la unión de un fragmento Fab¿ de un anticuerpo monoclonal murino humanizado a dos moléculas de PEG, un polímero no inmunógeno y no tóxico. Al carecer de la región Fc, presente en los anticuerpos monoclonales completos, el CZP no induce citotoxicidad mediada por anticuerpos ni por complemento. Además, su estructura pegilada le confiere una semivida plasmática de aproximadamente 14 días y le permite una mejor distribución en tejidos blandos. En experimentos in vivo en los que se ha comparado la distribución tisular del CZP con la del ADL e IFX en ratones con artritis inducida por colágeno, se observa que la cantidad de CZP que penetra en el tejido inflamado en comparación con el tejido normal fue mayor con este compuesto que con los otros dos anti-TNF8.
Mecanismo de acciónEl CZP reconoce y neutraliza específicamente al TNF-α humano, tanto su forma soluble como la unida a membrana, de una forma dependiente de la dosis. Se ha estudiado in vitro su mecanismo de acción comparativamente a IFX, ADL y etanercept9, observándose que la afinidad y la actividad para neutralizar el TNF-α soluble humano es superior a la de IFX y ADL. Como ya se ha comentado, al carecer de la región Fc, el CZP no produce in vitro citotoxicidad dependiente del complemento ni de anticuerpos. El CZP tampoco induce apoptosis en los cultivos de linfocitos T y monocitos obtenidos de sangre periférica de donantes sanos10–12.
Propiedades farmacológicasLas propiedades farmacológicas de los fragmentos Fab¿ en sangre son muy pobres. La pegilación retrasa la eliminación de las moléculas peptídicas del torrente sanguíneo al disminuir el aclaramiento renal, la proteólisis y la inmunogenicidad. El CZP tiene una vida media en sangre de aproximadamente 14 días para todas las dosis estudiadas. Su metabolismo no se ha estudiado en humanos, pero los datos obtenidos en animales indican que, una vez escindida de la fracción Fab, el PEG es eliminado por vía renal.
Los datos del perfil farmacocinético provienen de 4 estudios realizados en 126 voluntarios sanos que recibieron dosis de hasta 800mg de CZP por vía sc y hasta 10mg/kg por vía iv. Estos estudios demuestran que una sola dosis sc o iv de CZP produce una concentración en plasma con una relación lineal entre la dosis administrada y la concentración plasmática máxima a las 5 semanas usando el régimen posológico recomendado para la AR. Tras la administración subcutánea, el pico de concentración plasmática se alcanza entre la hora 54 y la 171, y la biodisponibilidad tras la inyección sc es del 80% en relación con la iv. La farmacocinética observada en pacientes con AR es similar a la observada en sujetos sanos.
En cuanto a la interacción con otros compuestos, la administración conjunta de CZP y metotrexato (MTX) no tiene efecto significativo sobre la farmacocinética de este último. Los pacientes tratados con MTX tienen menor incidencia de anticuerpos anti-CZP, por lo que los valores plasmáticos terapéuticos de CZP tienden a mantenerse de manera más prolongada cuando se administra de forma conjunta con MTX en pacientes con AR. No hay estudios que determinen las interacciones del CZP con corticoides, antiinflamatorios no esteroideos, analgésicos o inmunodepresores.
Eficacia clínica en artritis reumatoideEl CZP está aprobado en Estados Unidos para el tratamiento de la enfermedad de Crohn y para el control de los signos y los síntomas de AR moderada o grave y, recientemente, la European Medicines Agency lo ha aprobado para el tratamiento de la AR en Europa.
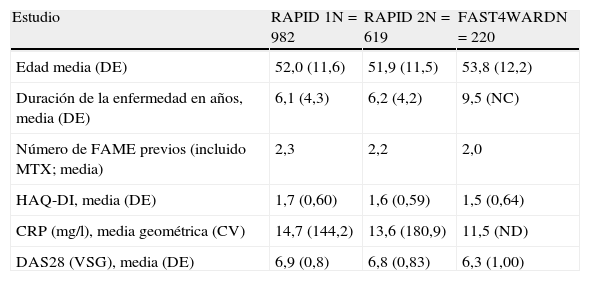
Los datos de eficacia y seguridad de CZP en el tratamiento de la AR que han permitido su comercialización provienen de un programa de ensayos clínicos de fase III en pacientes adultos con enfermedad activa. Se han realizado 3 estudios aleatorizados multicéntricos, doble ciego, controlados con placebo, en fase III: FAST4WARD, RAPID 1, RAPID 2. Estos dos últimos estudios se han prolongado de forma abierta. Las características de los pacientes que se incluyeron en estos estudios se muestran en la tabla 1.
Características basales demográficas y de actividad de la enfermedad en los estudios RAPID 1, 2 y FAST4WARD.
| Estudio | RAPID 1N=982 | RAPID 2N=619 | FAST4WARDN=220 |
| Edad media (DE) | 52,0 (11,6) | 51,9 (11,5) | 53,8 (12,2) |
| Duración de la enfermedad en años, media (DE) | 6,1 (4,3) | 6,2 (4,2) | 9,5 (NC) |
| Número de FAME previos (incluido MTX; media) | 2,3 | 2,2 | 2,0 |
| HAQ-DI, media (DE) | 1,7 (0,60) | 1,6 (0,59) | 1,5 (0,64) |
| CRP (mg/l), media geométrica (CV) | 14,7 (144,2) | 13,6 (180,9) | 11,5 (ND) |
| DAS28 (VSG), media (DE) | 6,9 (0,8) | 6,8 (0,83) | 6,3 (1,00) |
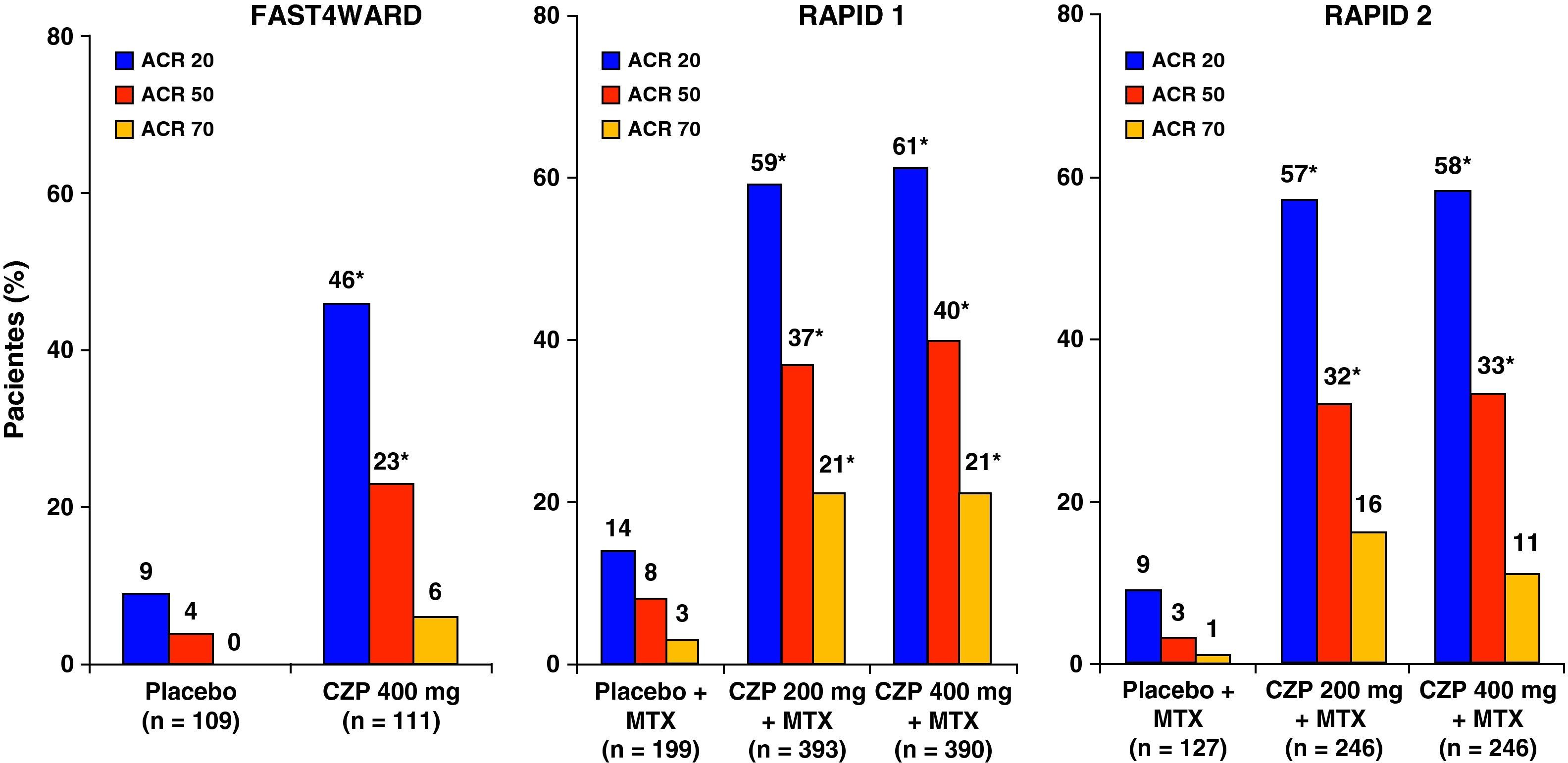
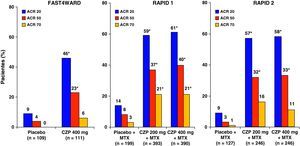
El estudio FAST4WARD (EFficAcy and Safety of CerTolizumab Pegol – 4 Weekly DosAge in RheumatoiD Arthritis)13 es un estudio aleatorizado, multicéntrico, internacional, doble ciego, controlado con placebo, de grupos paralelos de 24 semanas de duración. El objetivo fue evaluar eficacia y seguridad frente a placebo de una pauta de 400mg de CZP, en monoterapia, por vía sc, cada 4 semanas, en pacientes con AR activa que habían experimentado un fracaso con al menos un fármaco antirreumático modificador de enfermedad previo, incluido MTX. Se incluyó a pacientes que tenían una enfermedad activa: 9 o más articulaciones dolorosas, 9 o más tumefactas de un total de 68 y al menos uno de los siguientes: rigidez matutina ≥ 45min, velocidad de sedimentación glomerular ≥ 28mm/h o proteína C reactiva ≥ 10mg/l. Se incluyó a 220 pacientes aleatorizados 1:1 a recibir tratamiento con CZP 400mg sc (n=111) o placebo (n=109), cada 4 semanas. Como variable principal se realizó el análisis de la respuesta ACR 20 en la semana 24. No se analizaron los datos de progresión radiográfica. Hubo una elevada tasa de abandonos en el grupo placebo, un 68,8%, en relación con el hecho de que los pacientes que en la semana 12 no tenían una respuesta ACR 20 se retiraban del estudio por ineficacia, pudiendo entrar en una fase de extensión abierta. La figura 1 muestra que el porcentaje de pacientes que alcanzaron la respuesta ACR 20 en la semana 24 en el grupo de CZP (45,5%) era significativamente mayor (p<0,001) con respeto al grupo placebo (9,3%).
Los estudios RAPID (Rheumatoid Arthritis Prevention of Structural Damage) 15 y 24 eran ensayos aleatorizados, multicéntricos, internacionales, doble ciego, controlados con placebo, de grupos paralelos de 52 y 24 semanas de duración, respectivamente. En el RAPID 1 se empleo una formulación liofilizada y en el RAPID 2 una líquida igual a la que se ha comercializado. En ambos se comparó la eficacia para reducir los signos y síntomas de la AR, así como para prevenir progresión radiográfica, de 2 pautas de tratamiento con CZP 400mg o CZP 200mg cada 2 semanas por vía sc en combinación con MTX frente a placebo más MTX, en pacientes con respuesta inadecuada a la monoterapia con MTX. En ambos estudios, las tres primeras dosis de CZP fueron de 400mg sc cada dos semanas. Se incluyó a pacientes con enfermedad activa con los mismos criterios que en el FAS4WARD. Como variable principal se analizó la respuesta ACR 20 en la semana 24 en ambos estudios; además en RAPID 1 se analizó la progresión del daño articular en la semana 52. Al igual que en el FAST4WARD, en estos dos estudios se produjo una alta tasa de abandono en el grupo placebo por el hecho de que los pacientes que en la semana 12 y 14 no tenían una respuesta ACR 20 se retiraban por ineficacia, se les realizaba una radiografía, pudiendo entrar en una fase de extensión abierta.
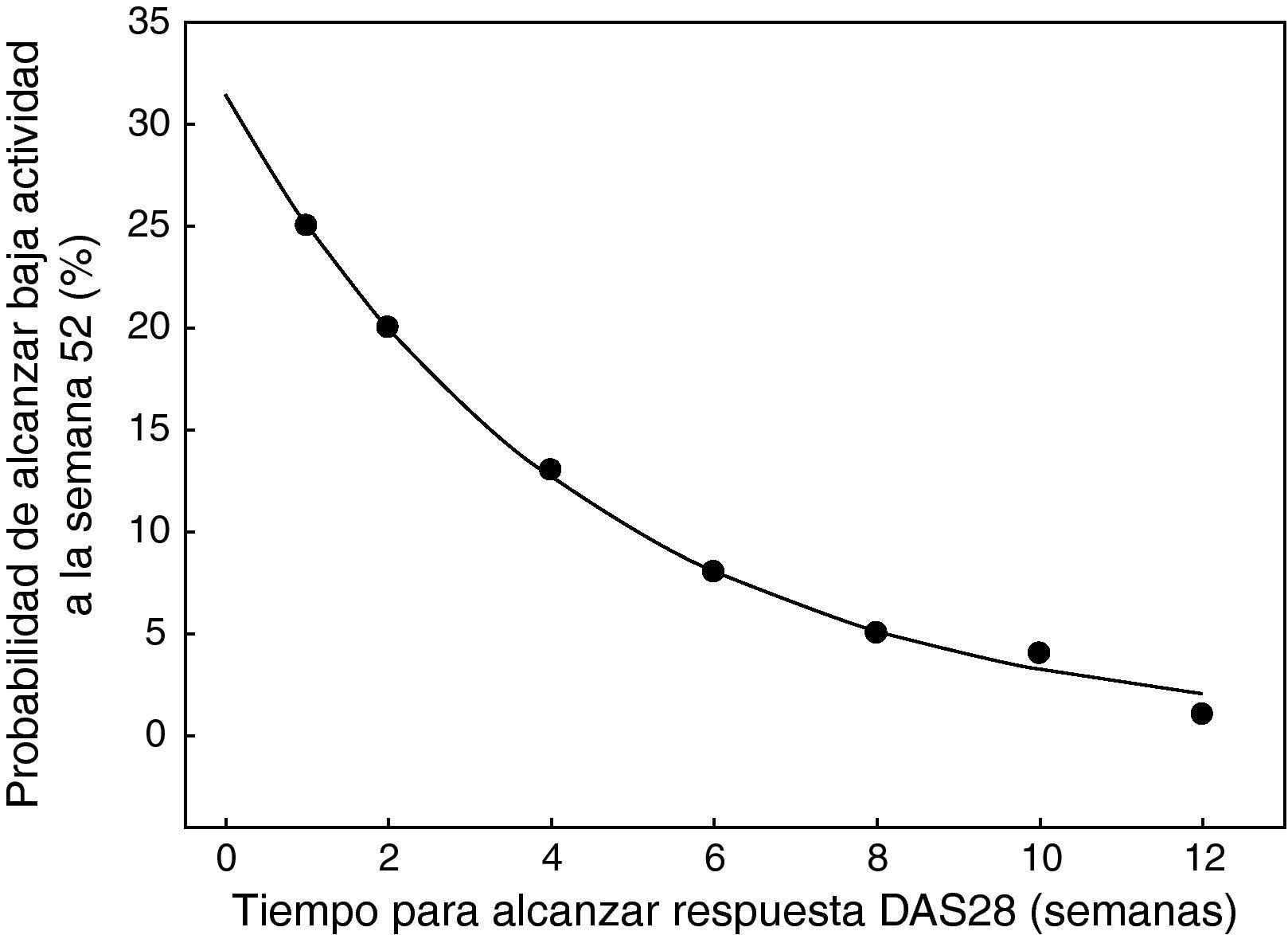
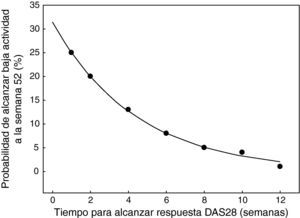
La respuesta ACR 20 en la semana 24 para los grupos que recibieron 200 o 400mg de CZP o placebo junto con MTX fueron del 58,8, el 60,8 y el 13,6% en el RAPID 1 y del 57,3, el 57,5 y el 8,7% en el RAPID 2. Estas diferencias fueron estadísticamente significativas en ambos estudios para los grupos de CZP frente a placebo. De igual manera, en la semana 24 se obtuvieron buenas tasas de respuesta ACR 50/70 en los grupos de tratamiento con CZP frente a los grupos de placebo, diferencias también estadísticamente significativas (fig. 1). En la semana 52 en el estudio RAPID 1 las tasas ACR 20/50/70 del grupo CZP se mantuvieron significativamente superiores a las del grupo placebo (p ≤ 0,001). El CZP mostró una gran rapidez de acción y se observaron diferencias significativas entre los grupos de 200 y 400mg frente a placebo en la respuesta ACR 20 en la semana 1, en la respuesta ACR 50 en la semana 2 y en las semanas 4-6 para la ACR 70. No hubo diferencias estadísticamente significativas para ninguna de las variables de eficacia entre las dosis de 200 y 400mg de CZP. El análisis de los datos del estudio RAPID5 ha permitido predecir la éxito clínico al año de tratamiento con CZP, basándose en la respuesta a lo largo de las 12 primeras semanas. Los pacientes que no alcanzaron una respuesta clínicamente significativa (mejoría del DAS28 ≥ 1,2) en la semana 12 tenían sólo un 1% de probabilidad de lograrla a las 52 semanas (fig. 2). Estos datos sugieren que la continuación del tratamiento con CZP debe considerarse cuidadosamente en los pacientes que no muestran evidencia de beneficio terapéutico dentro de las primeras 12 semanas de tratamiento. Esto puede ayudar en la toma de decisiones terapéuticas eficientes, evitando tanto demoras en el control de la enfermedad como gastos innecesarios.
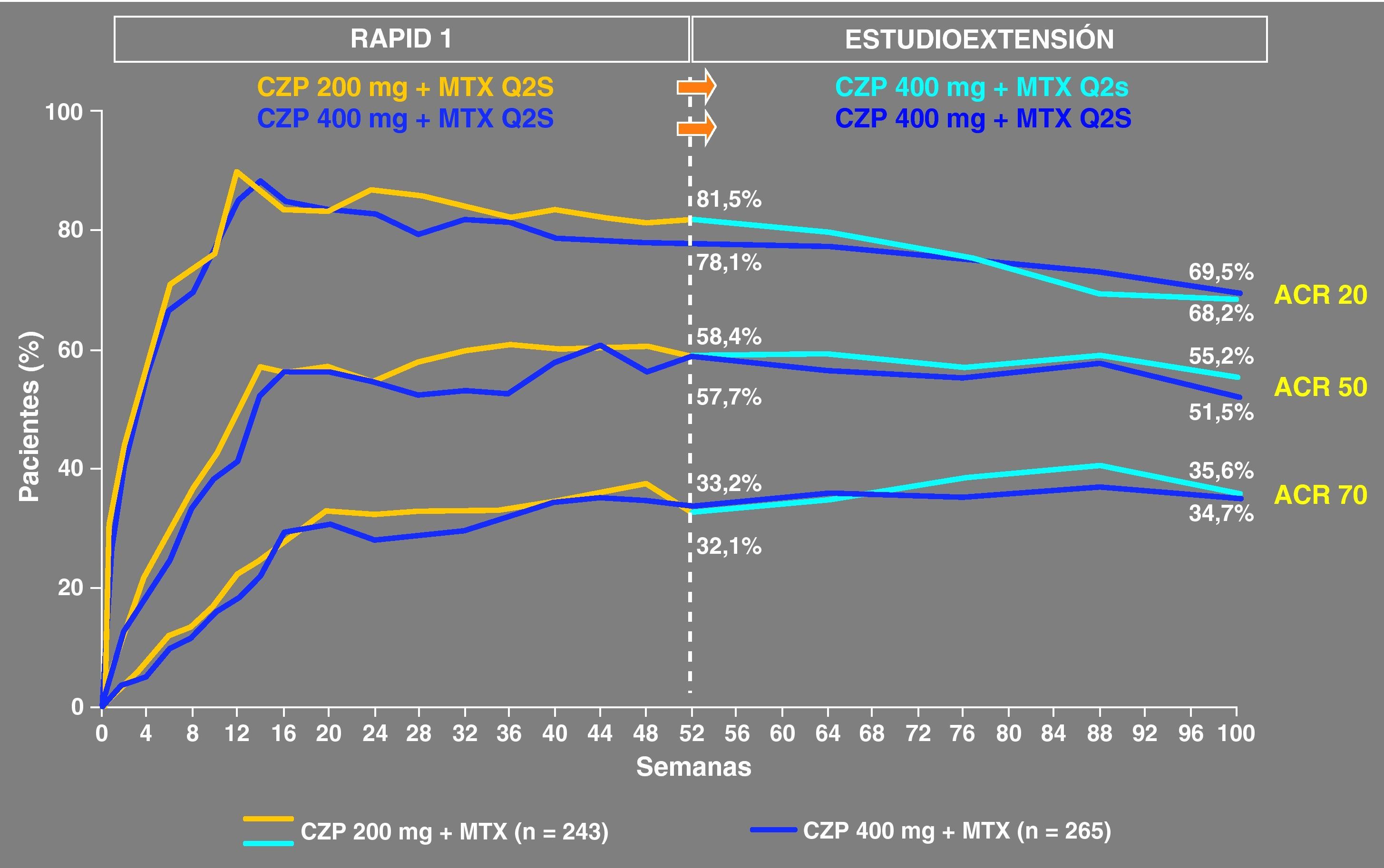
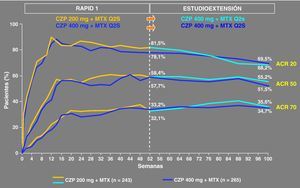
La extensión abierta del estudio RAPID 1 se realizó para comprobar la eficacia y la seguridad del tratamiento con CZP 400mg sc cada 2 semanas combinado con MTX a largo plazo. Se incluyó a los pacientes que habían completado las 52 semanas del RAPID 1 (grupo de tratamiento con 200mg y grupo de tratamiento con 400mg) junto a los que mostraron falta de respuesta clínica en la semana 12 y 14. La duración del seguimiento fue de 100 semanas y las variables que se analizaron fueron la tasa de respuesta ACR 20/50/70, el cambio de las variables de la respuesta ACR, variación en el DAS28, medidas de dolor, capacidad funcional, fatiga, datos de inhibición de la progresión radiográfica, así como análisis de seguridad. Se observó que la eficacia para cada grupo se mantuvo constante entre la semana 12 y 100, sin observar un aumento de respuesta en el grupo que pasó de la dosis de 200mg en RAPID 1 a 400mg en el estudio abierto (fig. 3).
Efecto sobre el daño estructuralComo se ha comentado, en los estudios RAPID 1 y RAPID 2 se analizó el efecto del CZP en combinación con MTX en la progresión del daño radiológico. El método utilizado fue el método de Sharp modificado4,5.
Los pacientes del RAPID 1 que fueron tratados con CZP asociado a MTX mostraron una progresión radiográfica significativamente menor que los tratados con placebo más MTX, tanto en la semana 24 como en la 52, sin diferencias entre la dosis de 200 y 400mg. Además, en los pacientes que abandonaron el estudio en la semana 16, la progresión radiográfica fue significativamente menor en los que recibieron alguna de las 2 dosis de CZP que en los tratados con placebo14. Un análisis adicional de las radiografías de los pacientes que abandonaron el estudio de manera temprana, por no alcanzar una respuesta ACR 20, demostró que CZP inhibía la progresión del daño articular, aunque no se hubiese alcanzado una respuesta clínica, ahondando en la convicción de que la respuesta radiográfica no siempre se asocia a los criterios de respuesta clínica.
En el estudio RAPID 2, en la semana 24 se observó que un mayor número de pacientes en el grupo que recibieron placebo más MTX mostraban una progresión radiológica de mayor intensidad que los pacientes tratados con CZP más MTX. Al igual que en los pacientes del RAPID 1, en los que interrumpieron el estudio en la semana 16, se observó una progresión radiológica menor en los que habían recibido CZP en comparación con los que habían recibido placebo.
En el estudio de extensión abierto con 400mg de CZP cada 2 semanas del RAPID 1, la inhibición del daño articular observada en el primer año con CZP asociado a MTX se mantuvo durante el segundo año, tanto a la dosis de 200 como de 400mg.
Efecto en la calidad de vida y discapacidadTanto en el RAPID 1 como en el RAPID 2 se utilizaron instrumentos para evaluar función física (HAQ), calidad de vida (SF-36), y también se evaluaron otros parámetros relacionados, como evaluación de la fatiga15, evaluación del dolor mediante una escala visual analógica16 y evaluación de los beneficios del CZP en la productividad laboral17, en el hogar y en las actividades diarias. En todos estos parámetros los pacientes tratados con CZP mostraron mejorías significativas respecto a los pacientes controles en los estudios RAPID.
Perfil de seguridadEn los ensayos clínicos, la exposición media al fármaco fue más larga en los grupos de pacientes tratados con CZP que en los del grupo placebo, por lo que los datos se presentaron como tasa de incidencia (eventos por 100 pacientes-año) para ajustar las diferencias. La mayoría de los acontecimientos adversos (AA) fueron de intensidad leve a moderada y se debieron fundamentalmente a un aumento en los procesos infecciosos. No obstante, la tasa de abandonos por esta causa fue baja.
Respecto a los cuadros infecciosos, la frecuencia de infecciones graves fue superior en los pacientes que recibieron agente activo5 y fueron similares a las que ocurren en el grupo de pacientes con AR que precisan tratamiento con otros antagonistas del TNF. Aparecieron algunos casos de tuberculosis en los ensayos RAPID 1 y 2, pero no cuando el CZP se usó en monoterapia, siendo todos los pacientes originarios de Europa del este13.
El riesgo de tumores de cualquier localización no fue mayor que en la población general de pacientes con AR y el riesgo de linfoma fue similar al esperado en la población con AR que recibe tratamiento con anti-TNF18.
La incidencia de reacciones en el lugar de inyección al CZP fue muy baja y se podría explicar por la inhibición de la degranulación de los mastocitos que parece producir la presencia del PEG19.
Insuficiencia cardíaca y acontecimientos adversos cardiovascularesNo se ha encontrado un incremento de los AA cardiovasculares de forma global, aunque uno de los AA más frecuentes no infecciosos es el desarrollo de HTA, especialmente con la dosis más alta de CZP y con mayor frecuencia en pacientes con historia previa de HTA.
Embarazo y lactanciaAunque la Food and Drug Administration ha clasificado a los anti-TNF como agentes clase B, es decir, que todavía no se ha documentado claramente su toxicidad en humanos, se recomienda evitar el embarazo durante su administración. La información clínica que disponemos con CZP se limita a 16 casos, sin que se hayan encontrado anomalías fetales en los 5 pacientes que terminaron el embarazo20,21.
Riesgo de muerteEl índice estandarizado de mortalidad en los pacientes con CZP es menor que el calculado en la población con AR22.
ConclusionesCZP es un fármaco biológico con una estructura exclusiva que le confiere un único mecanismo de acción bloqueando específicamente los efectos del TNF-α. El CZP es eficaz, combinado con MTX y en monoterapia, en el control de las manifestaciones clínicas, y del daño estructural de la AR. Su acción es rápida, con una ventana terapéutica muy bien definida de 12 semanas. Las inyecciones sc de CZP son bien toleradas y el perfil de seguridad del producto es coherente con la inhibición sistémica del TNF-α.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.