Describir las características demográficas y trastornos de pacientes con diagnóstico de síndrome de activación macrofágica (SAM) en el periodo comprendido entre diciembre de 2008-enero de 2014.
MétodosSe revisaron las historias clínicas desde el diagnóstico de SAM y tras su alta hospitalaria hasta enero de 2014. Los pacientes se agruparon en 4 grupos: autoinmunes (AI), hemato-oncólogicas (HO), infecciosas (Inf) y oncológicas (Onc). Las variables fueron analizadas entre los 4 grupos y entre AI y HO.
ResultadosTrece pacientes (7 hombres, con una mediana de 54 años [32-63]) se estudiaron. Las etiologías encontradas fueron: 5 AI, 5 HO, 2 Inf y una Onc. Se encontraron células hemofagocíticas en el líquido ascítico en uno de los pacientes. Se encontró un paciente con SAM secundario a enfermedad relacionada con la IgG4.
ConclusionesLa mortalidad, el pronóstico y la evolución de la enfermedad puede verse influida por el retraso en el diagnóstico, el inicio del tratamiento y la etiología del SAM. Los pacientes con enfermedades HO presentaron peor pronóstico.
Describe the demographic characteristics and disorders of patients with diagnosis of Macrophage Activation Syndrome (MAS) in the December 2008 - January 2014 period.
MethodsMedical records were reviewed from diagnosis of MAS and after discharge until January 2014. Patients were divided into 4 groups according to the primary disease: Autoimmune (AI), Hemato – oncologic (HO), Infectious (Inf) and Oncologic (Onc). The variables were analyzed among the 4 groups and between AI and HO.
ResultsThirteen patients [7 men, with a median of 54 years (32-63)] were studied. The etiologies were: 5 AI, 5 HO, 2 Inf. and 1 Onc. disease. Hemophagocitc cells were found in the ascitic fluid of one patient. A patient with MAS secondary to IgG4-related disease was found.
ConclusionsMortality, prognosis and disease progression may be influenced by the delay in diagnosis, treatment initiation and etiology of MAS. HO ill patients had a worse prognosis.
El síndrome de activación macrofágica (SAM) es un grupo de enfermedades que se caracteriza por tratarse de un síndrome inflamatorio agudo y grave, habitualmente infradiagnosticado1. Las manifestaciones clínicas habituales son: fiebre, rash, organomegalias y alteraciones del sistema nervioso central. Analíticamente suele presentar: pancitopenia, hepatitis, coagulopatía, hiperferritinemia e hipertrigliceridemia, e histológicamente la presencia de células hemofagocíticas (CH) en la biopsia de médula ósea (MO), bazo y/o ganglios linfáticos1,2.
Esta enfermedad es producida por la proliferación y activación de células T y macrófagos, produciendo una respuesta inflamatoria con hipersecreción de citoquinas como el interferón-gamma, factor de necrosis tumoral alfa, interleuquinas 1 (IL-1), IL-6, IL-10, IL-12, IL-18 y factor estimulante de colonias de macrófagos1,2. El SAM secundario es el resultado de una reacción inmunológica causada por una enfermedad autoinmune, infección, exposición a fármacos y neoplasias2,3. El SAM secundario a enfermedades autoinmunes (AI) presenta ciertas características diferentes al resto, como una hiperferritinemia muy elevada, un descenso de la velocidad de sedimentación globular, una citopenia leve y una coagulopatía más acentuada al inicio3. Esta puede ocurrir a cualquier edad, pero sobre todo al inicio de la artritis idiopática juvenil (AIJ) y en la enfermedad de Still del adulto (ESA), y durante la evolución del lupus eritematoso sistémico (LES). Se estima que ocurre en el 7% de las AIJ con una mortalidad entre el 10 al 20%2–4.
En los últimos años hemos presenciado un aumento de la incidencia de esta enfermedad, probablemente porque antes era infradiagnosticada debido a su desconocimiento; es por este motivo que querernos realizar un revisión de los casos presentados en nuestro hospital hasta la fecha.
ObjetivoDescribir las características demográficas, los datos clínicos y analíticos, los tratamientos utilizados, la mortalidad y los trastornos subyacentes durante el ingreso hospitalario y tras el alta de pacientes con diagnóstico de SAM durante el periodo comprendido entre diciembre de 2008-enero de 2014 en el Hospital Universitario Donostia, Guipúzcoa, España.
Materiales y métodosDescribir las características clínicas de pacientes con diagnóstico de SAM mediante la revisión de historias clínicas en papel e informatizadas. Posteriormente a la recogida de datos los pacientes se agruparon en 4 grupos según la enfermedad de base, siendo: AI, hemato-oncólogicas (HO), infecciosas (Inf) y oncológicas (Onc).
Las variables nominales recogidas fueron: diagnóstico, posibles desencadenantes del SAM y tratamientos utilizados durante el ingreso y actuales. Las variables dicotómicas recogidas fueron: sexo, fiebre, organomegalias, mortalidad hospitalaria y tras el alta, ingreso en la unidad de cuidados intensivos (UCI) y recidivas de SAM. Las variables cuantitativas fueron: edad, hallazgos analíticos, estancia hospitalaria en días, días desde el ingreso hasta la realización de la biopsia de MO, días desde la biopsia de MO hasta el alta o el fallecimiento del paciente y el tiempo de evolución tras el alta hospitalaria en meses. Las variables cuantitativas con distribución asimétrica se muestran con la mediana y el rango intercuartílico.
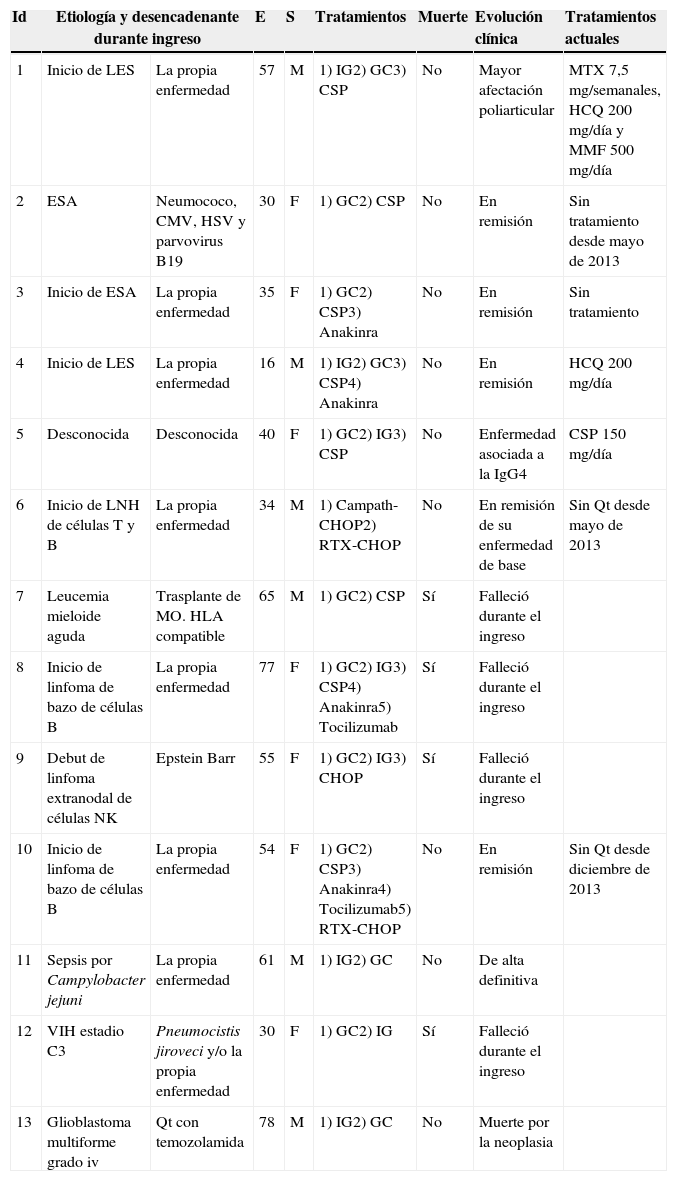
ResultadosSe encontraron 13 pacientes: 5 con enfermedades AI, 5 con enfermedades HO, 2 con enfermedades Inf y uno con enfermedad Onc. En la tabla 1 se muestran las características demográficas, etiologías, posibles desencadenantes del SAM, mortalidad, tratamientos utilizados durante el ingreso y actuales y evolución clínica tras el alta hospitalaria.
Características demográficas, etiologías, desencadenantes, evolución clínica, tratamientos y mortalidad de pacientes con síndrome de activación macrofágica secundario
| Id | Etiología y desencadenante durante ingreso | E | S | Tratamientos | Muerte | Evolución clínica | Tratamientos actuales | |
|---|---|---|---|---|---|---|---|---|
| 1 | Inicio de LES | La propia enfermedad | 57 | M | 1) IG2) GC3) CSP | No | Mayor afectación poliarticular | MTX 7,5mg/semanales, HCQ 200mg/día y MMF 500mg/día |
| 2 | ESA | Neumococo, CMV, HSV y parvovirus B19 | 30 | F | 1) GC2) CSP | No | En remisión | Sin tratamiento desde mayo de 2013 |
| 3 | Inicio de ESA | La propia enfermedad | 35 | F | 1) GC2) CSP3) Anakinra | No | En remisión | Sin tratamiento |
| 4 | Inicio de LES | La propia enfermedad | 16 | M | 1) IG2) GC3) CSP4) Anakinra | No | En remisión | HCQ 200mg/día |
| 5 | Desconocida | Desconocida | 40 | F | 1) GC2) IG3) CSP | No | Enfermedad asociada a la IgG4 | CSP 150mg/día |
| 6 | Inicio de LNH de células T y B | La propia enfermedad | 34 | M | 1) Campath-CHOP2) RTX-CHOP | No | En remisión de su enfermedad de base | Sin Qt desde mayo de 2013 |
| 7 | Leucemia mieloide aguda | Trasplante de MO. HLA compatible | 65 | M | 1) GC2) CSP | Sí | Falleció durante el ingreso | |
| 8 | Inicio de linfoma de bazo de células B | La propia enfermedad | 77 | F | 1) GC2) IG3) CSP4) Anakinra5) Tocilizumab | Sí | Falleció durante el ingreso | |
| 9 | Debut de linfoma extranodal de células NK | Epstein Barr | 55 | F | 1) GC2) IG3) CHOP | Sí | Falleció durante el ingreso | |
| 10 | Inicio de linfoma de bazo de células B | La propia enfermedad | 54 | F | 1) GC2) CSP3) Anakinra4) Tocilizumab5) RTX-CHOP | No | En remisión | Sin Qt desde diciembre de 2013 |
| 11 | Sepsis por Campylobacter jejuni | La propia enfermedad | 61 | M | 1) IG2) GC | No | De alta definitiva | |
| 12 | VIH estadio C3 | Pneumocistis jiroveci y/o la propia enfermedad | 30 | F | 1) GC2) IG | Sí | Falleció durante el ingreso | |
| 13 | Glioblastoma multiforme grado iv | Qt con temozolamida | 78 | M | 1) IG2) GC | No | Muerte por la neoplasia | |
CHOP: ciclofosfamida, hidroxidaunorrubicina, oncovina y prednisona; CMV: citomegalovirus; CSP: ciclosporina; E: edad en años; ESA: enfermedad de Still del adulto; F: femenino; GC: glucocorticoides; HCQ: hidroxicloroquina; HSV: herpes simple virus; Id: identificación; IG: inmunoglobulinas, LES: lupus eritematoso sistémico; LNH: linfoma no Hodgkin; M: masculino; MMF: micofenolato; MTX: metotrexato; NK: natural killer; Qt: quimioterapia; RTX: rituximab; S: sexo; VIH: virus de inmunodeficiencia humana.
La fiebre fue el único criterio en común. La organomegalia (esplenomegalia y/o hepatomegalia) estuvo presente en todos los paciente excepto en el paciente 13. En las tablas 2–4 se muestra el análisis descriptivo de los pacientes con SAM secundario según el tipo de enfermedad. A los pacientes 6, 7 y 8 se les realizó más de una biopsia de MO y el paciente 3 también presentó CH en el líquido ascítico.
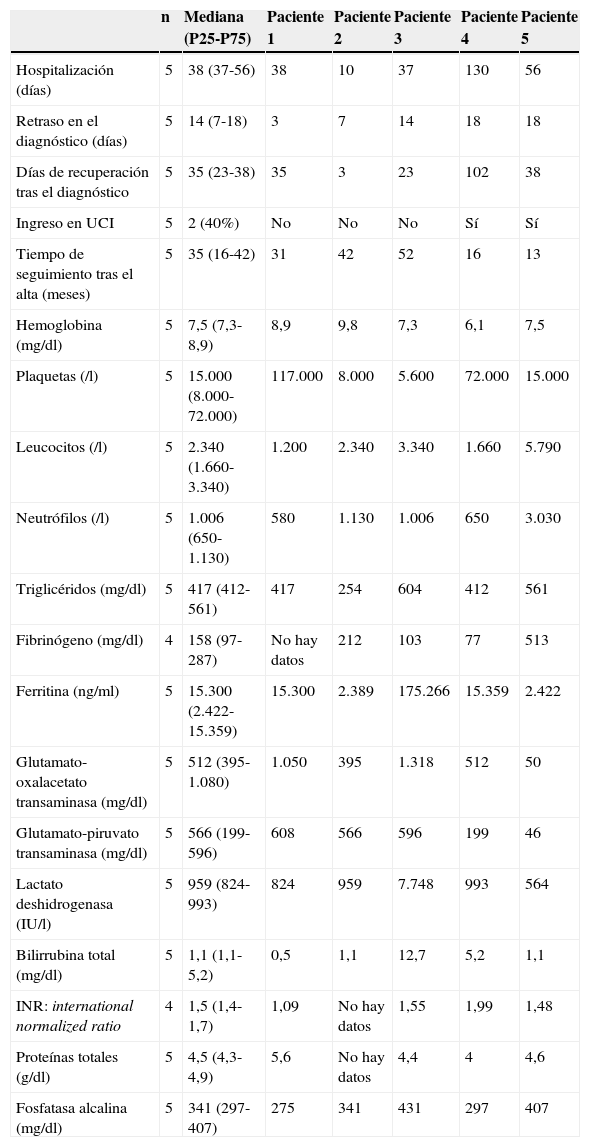
Análisis descriptivo de las variables de pacientes con síndrome de activación macrofágica secundario a enfermedades autoinmunes
| n | Mediana (P25-P75) | Paciente 1 | Paciente 2 | Paciente 3 | Paciente 4 | Paciente 5 | |
|---|---|---|---|---|---|---|---|
| Hospitalización (días) | 5 | 38 (37-56) | 38 | 10 | 37 | 130 | 56 |
| Retraso en el diagnóstico (días) | 5 | 14 (7-18) | 3 | 7 | 14 | 18 | 18 |
| Días de recuperación tras el diagnóstico | 5 | 35 (23-38) | 35 | 3 | 23 | 102 | 38 |
| Ingreso en UCI | 5 | 2 (40%) | No | No | No | Sí | Sí |
| Tiempo de seguimiento tras el alta (meses) | 5 | 35 (16-42) | 31 | 42 | 52 | 16 | 13 |
| Hemoglobina (mg/dl) | 5 | 7,5 (7,3-8,9) | 8,9 | 9,8 | 7,3 | 6,1 | 7,5 |
| Plaquetas (/l) | 5 | 15.000 (8.000-72.000) | 117.000 | 8.000 | 5.600 | 72.000 | 15.000 |
| Leucocitos (/l) | 5 | 2.340 (1.660-3.340) | 1.200 | 2.340 | 3.340 | 1.660 | 5.790 |
| Neutrófilos (/l) | 5 | 1.006 (650-1.130) | 580 | 1.130 | 1.006 | 650 | 3.030 |
| Triglicéridos (mg/dl) | 5 | 417 (412-561) | 417 | 254 | 604 | 412 | 561 |
| Fibrinógeno (mg/dl) | 4 | 158 (97-287) | No hay datos | 212 | 103 | 77 | 513 |
| Ferritina (ng/ml) | 5 | 15.300 (2.422-15.359) | 15.300 | 2.389 | 175.266 | 15.359 | 2.422 |
| Glutamato-oxalacetato transaminasa (mg/dl) | 5 | 512 (395-1.080) | 1.050 | 395 | 1.318 | 512 | 50 |
| Glutamato-piruvato transaminasa (mg/dl) | 5 | 566 (199-596) | 608 | 566 | 596 | 199 | 46 |
| Lactato deshidrogenasa (IU/l) | 5 | 959 (824-993) | 824 | 959 | 7.748 | 993 | 564 |
| Bilirrubina total (mg/dl) | 5 | 1,1 (1,1-5,2) | 0,5 | 1,1 | 12,7 | 5,2 | 1,1 |
| INR: international normalized ratio | 4 | 1,5 (1,4-1,7) | 1,09 | No hay datos | 1,55 | 1,99 | 1,48 |
| Proteínas totales (g/dl) | 5 | 4,5 (4,3-4,9) | 5,6 | No hay datos | 4,4 | 4 | 4,6 |
| Fosfatasa alcalina (mg/dl) | 5 | 341 (297-407) | 275 | 341 | 431 | 297 | 407 |
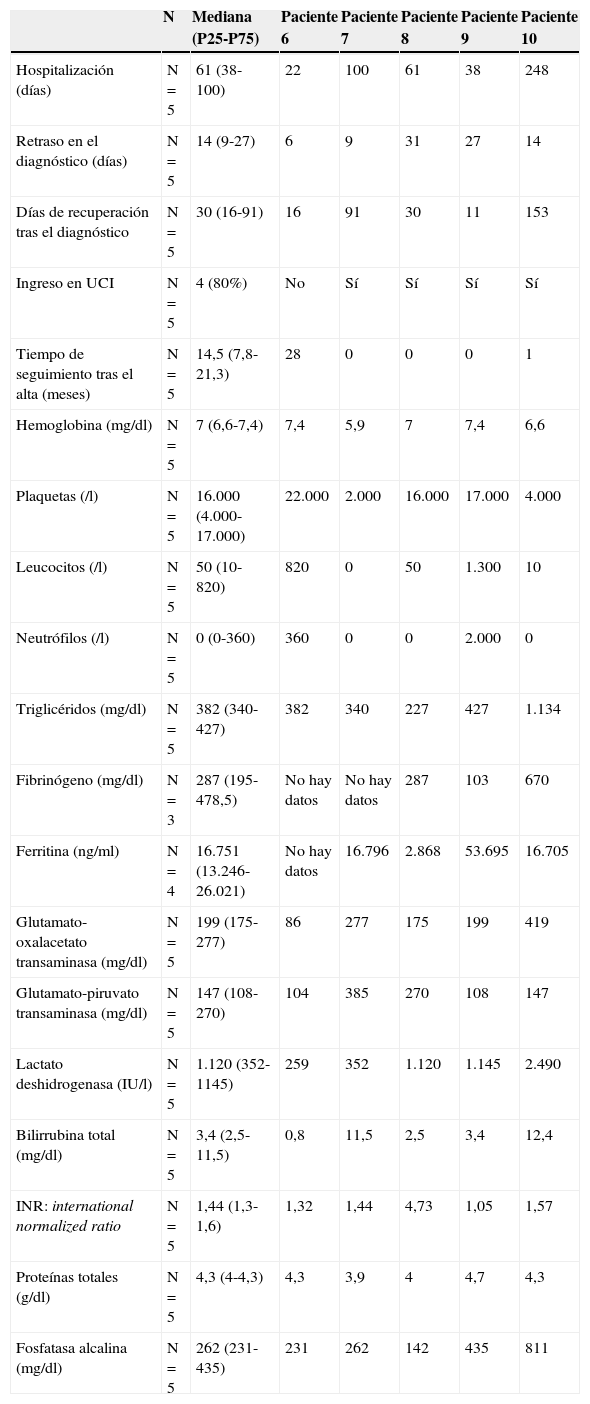
Análisis descriptivo de las variables de pacientes con síndrome de activación macrofágica secundario a enfermedades hemato-oncológicas
| N | Mediana (P25-P75) | Paciente 6 | Paciente 7 | Paciente 8 | Paciente 9 | Paciente 10 | |
|---|---|---|---|---|---|---|---|
| Hospitalización (días) | N=5 | 61 (38-100) | 22 | 100 | 61 | 38 | 248 |
| Retraso en el diagnóstico (días) | N=5 | 14 (9-27) | 6 | 9 | 31 | 27 | 14 |
| Días de recuperación tras el diagnóstico | N=5 | 30 (16-91) | 16 | 91 | 30 | 11 | 153 |
| Ingreso en UCI | N=5 | 4 (80%) | No | Sí | Sí | Sí | Sí |
| Tiempo de seguimiento tras el alta (meses) | N=5 | 14,5 (7,8-21,3) | 28 | 0 | 0 | 0 | 1 |
| Hemoglobina (mg/dl) | N=5 | 7 (6,6-7,4) | 7,4 | 5,9 | 7 | 7,4 | 6,6 |
| Plaquetas (/l) | N=5 | 16.000 (4.000-17.000) | 22.000 | 2.000 | 16.000 | 17.000 | 4.000 |
| Leucocitos (/l) | N=5 | 50 (10-820) | 820 | 0 | 50 | 1.300 | 10 |
| Neutrófilos (/l) | N=5 | 0 (0-360) | 360 | 0 | 0 | 2.000 | 0 |
| Triglicéridos (mg/dl) | N=5 | 382 (340-427) | 382 | 340 | 227 | 427 | 1.134 |
| Fibrinógeno (mg/dl) | N=3 | 287 (195-478,5) | No hay datos | No hay datos | 287 | 103 | 670 |
| Ferritina (ng/ml) | N=4 | 16.751 (13.246-26.021) | No hay datos | 16.796 | 2.868 | 53.695 | 16.705 |
| Glutamato-oxalacetato transaminasa (mg/dl) | N=5 | 199 (175-277) | 86 | 277 | 175 | 199 | 419 |
| Glutamato-piruvato transaminasa (mg/dl) | N=5 | 147 (108-270) | 104 | 385 | 270 | 108 | 147 |
| Lactato deshidrogenasa (IU/l) | N=5 | 1.120 (352-1145) | 259 | 352 | 1.120 | 1.145 | 2.490 |
| Bilirrubina total (mg/dl) | N=5 | 3,4 (2,5-11,5) | 0,8 | 11,5 | 2,5 | 3,4 | 12,4 |
| INR: international normalized ratio | N=5 | 1,44 (1,3-1,6) | 1,32 | 1,44 | 4,73 | 1,05 | 1,57 |
| Proteínas totales (g/dl) | N=5 | 4,3 (4-4,3) | 4,3 | 3,9 | 4 | 4,7 | 4,3 |
| Fosfatasa alcalina (mg/dl) | N=5 | 262 (231-435) | 231 | 262 | 142 | 435 | 811 |
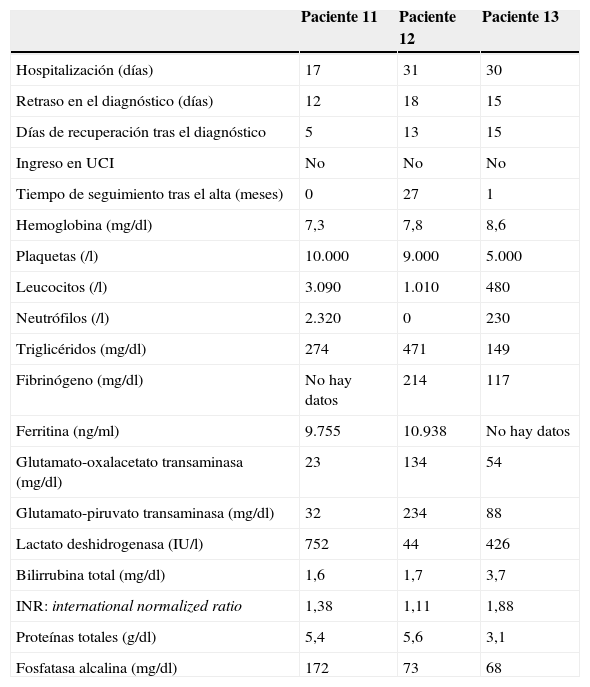
Análisis descriptivo de las variables de pacientes con síndrome de activación macrofágica secundario a enfermedades infecciosas y oncológicas
| Paciente 11 | Paciente 12 | Paciente 13 | |
|---|---|---|---|
| Hospitalización (días) | 17 | 31 | 30 |
| Retraso en el diagnóstico (días) | 12 | 18 | 15 |
| Días de recuperación tras el diagnóstico | 5 | 13 | 15 |
| Ingreso en UCI | No | No | No |
| Tiempo de seguimiento tras el alta (meses) | 0 | 27 | 1 |
| Hemoglobina (mg/dl) | 7,3 | 7,8 | 8,6 |
| Plaquetas (/l) | 10.000 | 9.000 | 5.000 |
| Leucocitos (/l) | 3.090 | 1.010 | 480 |
| Neutrófilos (/l) | 2.320 | 0 | 230 |
| Triglicéridos (mg/dl) | 274 | 471 | 149 |
| Fibrinógeno (mg/dl) | No hay datos | 214 | 117 |
| Ferritina (ng/ml) | 9.755 | 10.938 | No hay datos |
| Glutamato-oxalacetato transaminasa (mg/dl) | 23 | 134 | 54 |
| Glutamato-piruvato transaminasa (mg/dl) | 32 | 234 | 88 |
| Lactato deshidrogenasa (IU/l) | 752 | 44 | 426 |
| Bilirrubina total (mg/dl) | 1,6 | 1,7 | 3,7 |
| INR: international normalized ratio | 1,38 | 1,11 | 1,88 |
| Proteínas totales (g/dl) | 5,4 | 5,6 | 3,1 |
| Fosfatasa alcalina (mg/dl) | 172 | 73 | 68 |
Respecto a los tratamientos todos los pacientes recibieron glucocorticoides (GC), 8 pacientes (3 AI, 2 HO, 2 Inf y uno Onc) recibieron inmunoglobulinas (IG), 8 pacientes (5 AI y 3 HO) recibieron ciclosporina (CSP), 4 pacientes (2 AI y 2 HO) recibieron anakinra, 2 pacientes (2 HO) tocilizumab y quimioterapia. Todos los pacientes recibieron antibióticos de amplio espectro, excepto el paciente 11. La mayoría de pacientes recibió tratamiento de sostén como transfusiones de glóbulos rojos y plaquetas, factor estimulante de crecimiento de colonias, eritropoyetina y fármacos vasopresores. El paciente 5 requirió 3 sesiones de hemodiálisis durante el ingreso por sobrecarga hídrica, y además durante el ingreso no presentó un diagnóstico etiológico definitivo, sino 7 meses después del alta, que fue de enfermedad relacionada con la IgG4.
Los pacientes 7, 8 y 9 fallecieron durante el ingreso con el diagnóstico de síndrome de disfunción multiorgánica (SDM) y el paciente 12 por hemoptisis masiva; el paciente 13 falleció tras el alta por su enfermedad de base. Cinco pacientes ingresaron en la UCI, todos por SDM. Los pacientes de 4 y 7 presentaron 2 ingresos en la UCI, los diagnósticos de los segundos ingresos fueron en el paciente 7 SDM y sepsis y en el paciente 4 peritonitis bacteriana por Pseudomona aeruginosa, Enterococcus faecallis y Bacteriodes fragillis, requiriendo hasta 4 limpiezas quirúrgicas. Ningún paciente presentó recidiva de SAM tras el alta.
DiscusiónLas principales enfermedades relacionadas con el SAM en nuestro estudio fueron las AI y las HO, siendo estas las frecuentes. Respecto a las enfermedades AI se encontraron 3 pacientes que comenzaron con SAM y uno que presentó el diagnóstico etológico tras el alta hospitalaria, que fue enfermedad asociada con la IgG4, siendo el primer caso descrito en la literatura con esta enfermedad que presenta SAM. En una serie de 18 pacientes en EE. UU. se encontró un caso tras trasplante de médula ósea4,5. En una serie de 58 pacientes con VIH en Francia se describieron distintos agentes infecciosos, e inclusive el VIH como desencadenantes del SAM6. Los casos de SAM secundario a Pneumocystis jirovecii han sido reportados en pacientes con enfermedades HO y no en VIH6. El paciente 12 podría ser el primer caso de SAM secundario a P. jirovecii en un paciente con VIH, aunque el VIH también podría ser la causa del SAM.
Las bacterias más frecuentes relacionadas con el SAM son: Salmonella, Tuberculosis y Pseudomona5, y dentro de las enterobacterias se han descrito casos aislados por Serratia, Klebsiella y Campylobacter7–9. En 2001 se describió por primera vez un caso secundario a Campylobacter fetus en un paciente con síndrome de inmunodeficiencia adquirida. El paciente 11 es el primer caso de SAM secundario a Campylobacter jejuni.
En relación con el SAM secundario a quimioterapia se han descrito casos excepcionales. En 2012 se describió un paciente con neuroblastoma tras iniciar quimioterapia10. El paciente 13 probablemente sea el primer caso de SAM secundario a quimioterapia con temozolomida, aunque también se podría atribuir a la propia neoplasia, si bien esto es menos probable.
A ninguno de los pacientes se les realizó cuantificación de células natural killer y receptor de sIL-2 debido a que estas pruebas no se realizan en nuestro hospital. Estas pruebas no se realizan en todos los centros hospitalarios, y si se realizaran los resultados tardarían. Es por esto y la alta mortalidad del SAM que estas pruebas no deberían ser determinantes para el diagnóstico, y menos para el inicio del tratamiento, siempre y cuando exista una alta sospecha SAM1,10,11.
En el paciente 3 se encontraron CH en el líquido ascítico. En la literatura se han descrito algunos casos de CH en líquidos corporales patológicos. El primer caso descrito de CH en líquido ascítico fue en 2007 en un paciente con cirrosis hepática e infección por Escherichia coli, y en 2008 en un paciente tras una colecistectomía12,13. En el líquido pleural se han descrito 2 casos inducidos por EBV14,15. En 2007 se describió el primer caso de CH en el líquido cefalorraquídeo en un paciente con Leishmaniasis visceral16. Esto nos podría llevar a la conclusión de que las CH podrían encontrarse en cualquier líquido corporal patológico antes de realizar una BMO, o ante biopsias no concluyentes; un elemento más a tener en cuenta para el diagnóstico.
Se observó que a más días de hospitalización desde el ingreso hasta la BMO e iniciar el tratamiento mayor era la mortalidad, sobre todo en pacientes con enfermedades HO. La principal causa de mortalidad fue el SDM, a pesar de que los pacientes fueron tratados con antibióticos de amplio espectro, antifúngicos y antirretrovirales. Este hecho sugiere que la mortalidad se debe principalmente al SAM y no a una posible infección asociada.
El objetivo del tratamiento es detener el proceso inflamatorio. El tratamiento inicial son los GC como la metilprednisolona o dexametasona en niños por atravesar fácilmente la barrera hematoencefálica. Las IG son otra opción cuando se sospecha de una infección viral y en casos graves en los que no se puede esperar la respuesta de los GC. Los GC se deben reducir de forma lenta y progresiva para evitar posibles reactivaciones1. En casos refractarios o de reactivación la CSP a dosis entre 2 a 8mg/kg/día se podría asociar. Los tratamientos biológicos se utilizan cuando los GC y/o inmunosupresores sintéticos no han sido efectivos. Los inhibidores del receptor de TNF, IL-1 e IL-6 son una opción; estos se deben utilizar con precaución y monitorización de los posibles efectos secundarios o complicaciones como infecciones. El rituximab ha demostrado ser eficaz en pacientes con SAM secundario a LES3,17. El anakinra es eficaz en SAM secundario a AIJ sistémica; además muestra una ventaja respecto al resto de los tratamientos biológicos, y es que es un fármaco con un tiempo de vida media-corta2. También debemos recordar que se han descrito casos de SAM secundario a tratamientos biológicos5.
Otras medidas a tener en cuenta durante el tratamiento inmunosupresor son: la protección gástrica, la profilaxis con cotrimoxazol, los antifúngicos orales y evaluar el uso de antirretrovirales1. El inicio de la antibioterapia es un tema controvertido y depende de varios factores como las comorbilidades asociadas. En caso de reactivación se debe iniciar antibióticos de amplio espectro, aunque algunos autores recomiendan su uso al inicio del tratamiento inmunosupresor1.
El objetivo de este trabajo es recopilar y analizar la experiencia en nuestro hospital, y de esta forma aportar información para futuros trabajos. Podemos observar que el SAM se podría sospechar en pacientes con fiebre prolongada que no responden a antibióticos de amplio espectro y que presenten organomegalias, citopenias, coagulopatías y hepatitis. El diagnóstico e inicio del tratamiento de forma precoz puede mejorar el pronóstico, y el cumplimiento de todos los criterios diagnósticos para iniciar el tratamiento no debe ser estrictamente necesario, debido a la alta mortalidad.
ConclusionesLa mortalidad, el pronóstico y la evolución de la enfermedad pueden verse influidas por el retraso en el diagnóstico, el inicio del tratamiento y la etiología del SAM. Las CH no solo pueden estar presentes en la médula ósea, los ganglios linfáticos y el bazo, sino también en otros líquidos corporales patológicos, como el líquido ascítico. El SAM secundario a enfermedades hemato-oncológicas presentó peor pronóstico.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.