El síndrome de VEXAS (Vacuolas, enzima E1, ligado al X, Autoinflamatorio, Somático) es un síndrome autoinflamatorio de inicio en la edad adulta que se caracteriza por mutaciones somáticas en el gen UBA1 y se considera el prototipo de enfermedad hematoinflamatoria. Los pacientes con síndrome de VEXAS exhiben manifestaciones inflamatorias y hematológicas que pueden conducir a diagnósticos clínicos como policondritis recidivante, poliarteritis nodosa, síndrome de Sweet y síndrome mielodisplásico. El diagnóstico requiere la evaluación de la médula ósea en búsqueda de vacuolas citoplásmicas en precursores mieloides y eritroides. Sin embargo, la confirmación genética de las mutaciones en UBA1 es necesaria. El tratamiento es un desafío y a menudo incluye glucocorticoides e inmunosupresores, con respuestas variables. Las terapias hipometilantes y el trasplante alogénico de células progenitoras hematopoyéticas se consideran terapias prometedoras. El pronóstico es influido por factores genéticos y clínicos. El objetivo de esta revisión es proporcionar una visión general sobre la patogénesis, la presentación clínica, el tratamiento y el pronóstico del síndrome de VEXAS para la comunidad médica latinoamericana.
VEXAS (Vacuoles, E1 enzyme, X-linked, Autoinflammatory, Somatic) syndrome is an adult-onset autoinflammatory syndrome characterized by somatic mutations in the UBA1 gene and is considered the prototype of hematoinflammatory diseases. Patients with VEXAS syndrome exhibit inflammatory and hematological manifestations that can lead to clinical diagnoses such as relapsing polychondritis, polyarteritis nodosa, Sweet syndrome, and myelodysplastic syndrome. Diagnosis requires bone marrow evaluation to identify cytoplasmic vacuoles in myeloid and erythroid precursors. However, genetic confirmation of mutations in UBA1 is necessary. Treatment is challenging and often involves glucocorticoids and immunosuppressants with variable responses. Hypomethylating agents and allogenic haemopoietic stem cell transplant are considered promising therapies. Prognosis is influenced by genetic and clinical factors. The aim of this review is to provide an overview of the pathogenesis, clinical presentation, treatment, and prognosis of VEXAS syndrome for the Latin American medical community.
El síndrome de VEXAS (acrónimo de Vacuolas, enzima E1, ligado al X, Autoinflamatorio, Somático) es un síndrome autoinflamatorio identificado a finales de 2020 por Beck et al.1. Utilizando una metodología de cribado enfocada en genotipos, se encontró que 25 pacientes hombres con enfermedad inflamatoria de inicio en la edad adulta y citopenias portaban variantes genéticas de cambio de sentido en el gen UBA1, que codifica para la enzima activadora de la ubiquitinación E1, un regulador primordial del sistema ubiquitina-proteosoma. Se identificaron mutaciones en el gen UBA1 ligado al cromosomaX como monogénicas, somáticas y restringidas a células de la línea mieloide y eritroide1. Los pacientes con síndrome de VEXAS tienen una combinación de manifestaciones inflamatorias y hematológicas. Las manifestaciones más comunes incluyen lesiones en la piel, fiebre, condritis, artritis, infiltrados pulmonares, anemia macrocítica, trombocitopenia y trombosis venosas. Debido a la complejidad y a la diversidad de las manifestaciones clínicas, su manejo y su tratamiento requieren la colaboración de varios especialistas médicos.
El síndrome de VEXAS se considera el prototipo de enfermedad hematoinflamatoria, término utilizado para describir aquellas enfermedades causadas por mutaciones somáticas en células sanguíneas que presentan inflamación sistémica, alteraciones en la médula ósea y que son condiciones premalignas que pueden dar lugar a mieloproliferación, mielodisplasia o linfoproliferación2,3.
El objetivo de esta revisión es proporcionar una visión general sobre la patogénesis, la presentación clínica, el tratamiento y el pronóstico del síndrome de VEXAS.
Patogénesis y genéticaEl gen UBA1 se localiza en el cromosoma Xp11.23 y codifica para la enzima activadora de la ubiquitinaE1 considerada como la principal iniciadora de la activación, la conjugación y la ligación de la ubiquitina a sustratos proteicos para su degradación mediante el sistema ubiquitina-proteosoma4,5. UBA1 se expresa en una isoforma nuclear (UBA1a) de 1.058 aminoácidos y en una isoforma citoplasmática (UBA1b) de 1.018 aminoácidos que, a diferencia de la isoforma nuclear, inicia su traducción en p.Met416. Ambas isoformas constan de cinco dominios (fig. 1). La región N-terminal está formada por el dominio inactivo de adenilación (DIA), que flanquea al primer dominio catalítico de cisteína (PDCC). Hacia el extremo C-terminal se encuentra el dominio de adenilación activo (DAA), dentro del cual se sitúa el segundo dominio de cisteína catalítico (SDCC). El dominio de plegamiento de ubiquitina (DPU) que permite a UBA1 la conjugación de E1 comprende el extremo C-terminal de la proteína7.
Estructura y espectro de mutaciones del gen UBA1.DAA: dominio activo de adenilación; DIA: dominio inactivo de adenilación; DPU: dominio de plegamiento de ubiquitina; PDCC: primer dominio catalítico de cisteína; SDCC: segundo dominio catalítico de cisteína; VSI: variantes de significado incierto.
La patogénesis del síndrome de VEXAS se ha relacionado con la pérdida de la expresión de UBA1 como consecuencia de mutaciones somáticas de pérdida de función en los dominios DIA y DAA1,8. Las mutaciones en el dominio DIA son consideradas patogénicas y se les asocia con la pérdida global de la ubiquitinación, la respuesta a proteínas no plegadas, el incremento del estrés celular y la activación de vías inmunitarias innatas1,9-11. Una alta proporción de mutaciones ocurren en el exón3 dentro del dominio DIA. Las más frecuentes se encuentran en el codón41, donde inicia la traducción de UBA1b, dando lugar a la sustitución de metionina: p.Met41Thr (c.122T>C), p.Met41Val (c.121A>G) y p.Met41Leu (c.121A>C). La mutación en p.Met41 ocasiona que el inicio de la traducción se desplace a p.Met67 y, en consecuencia, que se produzca la disminución de la forma UBA1b citoplasmática y un incremento de la enzima UBA1c disfuncional producto de la mutación1. Como resultado, las vías inmunitarias innatas se activan anormalmente, lo que provoca una hiperproducción de citocinas inflamatorias, incluyendo factor de necrosis tumoralα, interleucina (IL)-1, IL-6, IL-8, proteína10 inducida por interferón (IFN)-γ e IFN-γ. Estas citocinas se han demostrado elevadas en el suero de los pacientes, incluso durante períodos clínicamente inactivos, y en modelos animales. Esta alteración inmunitaria es la responsable de las diversas manifestaciones clínicas presentes en el síndrome1. Además, a pesar de que las mutaciones ocurren en la misma posición genómica, el tipo de sustitución de aminoácidos afecta la traducción citoplásmica de UBA1 de manera heterogénea. La presencia de UBA1c en el citoplasma conduce a una mayor pérdida de UBA1b. Por ejemplo, los portadores de la variante p.Met41Val muestran niveles citoplasmáticos de UBA1b dos veces más bajos en comparación con aquellos con las variantes p.Met41Leu/Thr, debido a que existe más UBA1c. Estas variaciones a nivel molecular se correlacionan con los resultados clínicos, ya que se ha encontrado que el genotipo p.Met41Val se asocia a una disminución en la supervivencia12.
En el mismo dominio se han identificado las mutaciones c.118-1G>C; c.119-1 G>C, c.118-2A>C, que ocurren en el sitio de empalme del exón3 y cuyo efecto es el mismo que el de las mutaciones en p.Met4113,14. Poulter et al.14 identificaron una segunda mutación en el dominio DIA. La mutación p.Ser56Phe (c.167C>T) no tiene un efecto en la disminución de la expresión de UBA1b ni en la formación de la UBA1c; sin embargo, tiene un efecto sobre la actividad catalítica de UBA1, ocasionando la reducción de la ubiquitinación. Estudios in vitro muestran que la mutación produce una enzima UBA1b termolábil con la disminución de su actividad catalítica por efecto de la temperatura. Se hipotetiza que la variante p.Ser56Phe podría conducir a una inactivación preferencial de la isoforma UBA1b citoplasmática en las células o alternativamente las células pueden ser más sensibles a las reducciones de actividad de UBA1b.
Recientemente se han descrito otras variantes en los exones 14 y 16 ubicados en el dominio DAA: p.Glu441Ter, p.Gly477Ala, p.Ala478Ser, p.Asp506Gly, p.Asp506Asn, p.Asp585Ala, p.Asp585Glu y p.Ser621Cys, las cuales han sido categorizadas como variantes de significado incierto (VSI). Se ha demostrado que estas variantes no bloquean la síntesis de UBA1 pero reducen la función catalítica de las isoformas citoplasmática y nuclear entre un 40 y un 90%. Las variantes p.Asp506Gly y p.Asp506Asn afectan a la función de la UBA1 al interferir con la unión al ATP y todas alteran específicamente la transferencia de ubiquitina de UBA1 a la enzima E28,15,16. Otro hallazgo notable en los portadores de VSI son las manifestaciones autoinflamatorias leves. Por otra parte, se ha descrito que los portadores de p.Ala478Ser, p.Asp585Ala y p.Asp585Glu tienen una proporción de precursores con vacuolas similar a la de los pacientes con síndrome de VEXAS16.
Las mutaciones en UBA1 responsables del síndrome de VEXAS se describieron inicialmente como somáticas o poscigóticas, limitadas a las células de la línea mieloide y eritroide1. Como resultado, las variantes de UBA1 pueden detectarse en sitios donde estas células están presentes, como la sangre periférica y la médula ósea, o en tejidos afectados en los que hay infiltración de estas células, como la piel o el músculo1,17,18. En contraste, no se han observado variantes de UBA1 en la línea linfoide ni en los fibroblastos de los pacientes afectados1.
Recientemente, un estudio español identificó mutaciones en UBA1 en las uñas de pacientes con síndrome de VEXAS. Esto indica que las variantes de UBA1 no se limitan a los precursores mieloides y eritroides. Dado que las uñas forman parte del ectodermo, es posible que la mutación haya ocurrido en una etapa temprana del desarrollo embrionario19. Esta nueva evidencia conlleva implicaciones conceptuales sobre la patogénesis del síndrome, sugiriendo que la enfermedad podría manifestarse a cualquier edad. Hasta ahora, sin embargo, solo se ha diagnosticado en pacientes adultos, lo que resalta la necesidad de realizar estudios adicionales que profundicen en este aspecto.
EpidemiologíaDebido a su reciente caracterización, la incidencia y la prevalencia del síndrome de VEXAS no están completamente definidas. Solamente un estudio ha reportado la prevalencia de la enfermedad20. Este estudio utilizó ADN de 163.096 individuos participantes del Geisinger MyCode Community Health Initiative, un biobanco en Pennsylvania desarrollado para el estudio de la medicina de precisión. En este estudio se encontraron variantes patogénicas de UBA1 en 11 individuos (9 hombres y 2 mujeres), todos ellos con manifestaciones clínicas consistentes con el síndrome de VEXAS (penetrancia del 100%). Aunque 5 de los 11 individuos no cumplían con los criterios para el diagnóstico de alguna enfermedad reumatológica o hematológica definitiva, todos tenían anemia macrocítica y/o trombocitopenia. La prevalencia de mutaciones causantes del síndrome de VEXAS fue de 1 en 13.591 individuos no relacionados, 1 en 4.269 hombres mayores de 50años y 1 en 26.238 mujeres mayores de 50años20. Estos resultados sugieren que el síndrome de VEXAS podría tener una prevalencia mayor que algunas vasculitis sistémicas, como la granulomatosis con poliangitis (1/18.000) y la poliarteritis nodosa (1/33.000), y una prevalencia similar a los síndromes mielodisplásicos (SMD) (1/14.000)20.
En cuanto al grupo etario afectado, el trabajo seminal de Beck et al.1 describió que la edad promedio al inicio de la sintomatología es de 64años, aunque el inicio puede variar entre los 40 y los 85años21. Recientemente se ha identificado un caso de síndrome de VEXAS que comenzó a los 23años, lo que sugiere la posibilidad de un inicio temprano de la enfermedad, como fue propuesto por los hallazgos de la cohorte española22. Aunque los 25 pacientes caracterizados eran hombres, se han documentado menos de una decena de casos de síndrome de VEXAS en mujeres23-28. La mayoría de estos casos presentaban monosomía del cromosomaX congénita o adquirida. Una interesante observación de los estudios publicados es que no se han descrito casos en pacientes de raza negra.
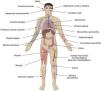
Manifestaciones clínicasLas manifestaciones clínicas del síndrome de VEXAS son diversas e incluyen tanto manifestaciones inflamatorias como hematológicas (fig. 2). Es común que los pacientes cumplan con criterios y hayan sido diagnosticados con otras enfermedades reumatológicas, dermatológicas y/o hematológicas (tabla 1), previo al diagnóstico definitivo de síndrome de VEXAS. Por ejemplo, en la cohorte del National Institutes of Health (NIH) de Estados Unidos y la Universidad de Leeds, los diagnósticos clínicos más frecuentes fueron policondritis recidivante en el 52% de los casos, síndrome mielodisplásico (SMD) en el 31%, síndrome febril indiferenciado en el 23% y síndrome de Sweet en el 22%12.
Diagnósticos clínicos de los pacientes con síndrome de VEXAS
| Reumatológicos |
| Policondritis recidivante1 |
| Poliarteritis nodosa1 |
| Arteritis de células gigantes1,29 |
| Vasculitis asociadas a ANCA30-32 |
| Vasculitis por IgA33 |
| Vasculitis crioglobulinémica31 |
| Síndrome de Behçet34 |
| Polimialgia reumática20 |
| Artritis reumatoide35 |
| Espondiloartritis36 |
| Dermatomiositis20 |
| Lupus eritematoso sistémico37 |
| Síndrome autoinflamatorio/febril indiferenciado12,25,29 |
| Enfermedad relacionada a IgG438,39 |
| Sarcoidosis20 |
| Dermatológicos |
| Síndrome de Sweet1 |
| Poliarteritis nodosa cutánea40 |
| Foliculitis pustular eosinofílica40 |
| Eritema nodoso41,42 |
| Lupus tumidus42 |
| Hematológicos |
| Síndrome mielodisplásico1,43 |
| Mieloma múltiple1,43 |
| Gammapatía monoclonal de significado incierto43 |
| Linfocitosis B monoclonal43 |
| Leucemia mieloide crónica24,44 |
| Mielofibrosis20 |
La fiebre recurrente es una de las características más comunes en el síndrome de VEXAS, que se presenta en un rango del 65 al 100% de los casos1,24,45,46. Aunque su patrón no es específico, se suele manifestar en períodos de actividad de la enfermedad y con un aumento de los niveles de reactantes de fase aguda. El tratamiento con corticoesteroides suele tener una buena respuesta, y en caso contrario, se deben buscar otras causas posibles, como una infección concurrente21,47. Regularmente se acompaña de otros síntomas, como diaforesis nocturna, malestar general y fatiga. Además, la pérdida de peso se ha observado en un porcentaje de casos que oscila entre el 31% y el 56%1,24,45,46. También se ha observado que hasta el 34,5% de los pacientes con síndrome de VEXAS pueden presentar linfadenopatías en distintas localizaciones, siendo más frecuentes a nivel mediastínico46,48.
OtorrinolaringológicasLa condritis nasal y/o auricular afecta a un alto porcentaje de pacientes que oscila entre el 46% y el 100% (fig. 3A)1,24,46. Aunque existen similitudes entre la policondritis recidivante idiopática (PR-I) y la asociada a VEXAS (PR-V), se han identificado algunas diferencias notables. Por ejemplo, un estudio francés que incluyó a 95 pacientes (40 con PR-I y 55 con PR-V) demostró que los pacientes con PR-I suelen ser más jóvenes (44 vs 66años) y presentan una menor prevalencia de fiebre (10 vs 60%), mientras que el cartílago nasal se afecta con mayor frecuencia (70 vs 47%) en comparación con los pacientes con PR-V49. En otro estudio realizado por Ferrada et al.45 se compararon las características clínicas de 85 pacientes con PR-I y 13 con PR-V, observando una mayor prevalencia de condritis de vías aéreas (44 vs 0%) y de costocondritis (85 vs 0%) en pacientes con PR-I en comparación con los pacientes con PR-V.
Manifestaciones del síndrome de VEXAS. A)Condritis auricular. B)Placas y pápulas eritematosas y edematosas sugerentes de síndrome de Sweet. C)Paniculitis septal con importante necrosis, fibrosis y escasa inflamación linfocitaria perivascular. D)Vasculitis neutrofílica y granulomatosa de vasos de mediano calibre. F)Tomografía simple de órbitas en corte coronal que muestra datos de miositis orbitaria previa, con hipodensidad central de los músculos rectos superiores (flechas). G)Tomografía de tórax mostrando infiltrados pulmonares bilaterales. H)Vacuolas características en las células precursoras mieloides en aspirados de médula ósea.
Además, se ha reportado hipoacusia neurosensorial hasta en el 29% de los casos12. Otras manifestaciones menos frecuentes son la sialoadenitis submandibular y la aftosis oral39,50.
CutáneasSe ha reportado la presencia de manifestaciones cutáneas en hasta el 84% de los casos de síndrome de VEXAS, las cuales se pueden dividir en lesiones no vasculíticas y vasculíticas12,24.
Las lesiones más comunes son pápulas y nódulos firmes y dolorosos, con apariencia eritemato-violácea y edematosa, que suelen aparecer en las extremidades y en el tronco, y con menor frecuencia en la cara, pudiendo sugerir clínicamente eritema nodoso40,41,51. En el 24% de los casos estas lesiones pueden ser pruriginosas40. Es común que se reporte una reacción local en el sitio de inyección de anakinra, que puede ser severa1,24,46. Además, se han descrito otras manifestaciones menos frecuentes, como livedo reticularis, livedo racemosa, vesículas, bulas, lesiones urticariformes y ulceraciones21,40.
En un estudio realizado en Francia se encontró que la dermatosis neutrofílica fue el hallazgo histopatológico más común en estas lesiones, y muchos de estos pacientes tenían el diagnóstico de síndrome de Sweet antes de ser diagnosticados con síndrome de VEXAS (fig. 3B)1,17,40. Otros patrones histopatológicos observados son paniculitis septal (fig. 3C), o leucocitoclasia sin otros hallazgos de vasculitis40,41.
VasculitisLa presencia de vasculitis se ha descrito en el 20 al 64% de los casos de síndrome de VEXAS y se considera una vasculitis secundaria de vasos de calibre variable, ya que puede afectar vasos de pequeño, mediano y gran calibre13,21,24,52. De hecho, en la cohorte inicial del NIH algunos pacientes tenían un diagnóstico clínico previo de vasculitis sistémica, en especial poliarteritis nodosa y arteritis de células gigantes1. Los pacientes con VEXAS pueden presentar síntomas atípicos y patrones de afectación vasculítica que no encajan del todo en la clasificación de las vasculitis sistémicas primarias conocidas21.
La vasculitis leucocitoclástica es la forma de vasculitis más frecuente, observada en el 26 al 38% de los pacientes, aunque también se han descrito otros tipos de vasculitis cutánea de vasos de pequeño calibre, como la linfocítica, la eosinofílica, la urticariana y la bulosa1,24,29. Como ya se mencionó, el síndrome de VEXAS se puede presentar con vasculitis cutánea de vasos de mediano calibre simulando poliarteritis nodosa (fig. 3D)1,52.
Aunque se ha observado una vasculitis similar a la asociada a ANCA, su presentación no es clásica y no responde de forma satisfactoria al tratamiento convencional con rituximab o ciclofosfamida26-28. Además, se ha observado engrosamiento arterial/periarterial principalmente a nivel carotídeo, así como en aorta torácica e iliacas23,24,53. Otras formas de vasculitis que se han reportado son vasculitis por IgA, vasculitis crioglobulinémica y presentaciones similares a síndrome de Behçet31,33,34.
OftalmológicasLas manifestaciones oftalmológicas se han observado en un porcentaje que oscila entre el 24% y el 46% de los casos, e incluyen manifestaciones inflamatorias oculares y orbitarias12,13,24,31. Entre las manifestaciones inflamatorias oculares se incluyen epiescleritis, escleritis, uveítis, conjuntivitis, quemosis, desprendimiento coroideo y vasculitis retiniana21,22,24,31,39,49,54. Por otro lado, las manifestaciones orbitarias incluyen edema periorbitario y orbitario, que se han descrito en un rango del 9% al 30% de los casos12,24. Las estructuras orbitarias que se han visto afectadas en estudios de imagen incluyen los párpados, las glándulas lagrimales (dacrioadenitis), la grasa preseptal y la orbitaria (celulitis), los músculos extraoculares (miositis orbitaria) y la vaina del nervio óptico (perineuritis) (fig. 3F)21,39,46,54-58. También se ha descrito angioedema en la piel de la cara, afectando a los párpados39. Es importante destacar que la inflamación orbitaria a menudo se confunde con celulitis infecciosa21,54.
ArticularesSe han registrado artralgias en hasta el 28% y artritis en hasta el 58% de los pacientes diagnosticados con el síndrome de VEXAS12,24. Por lo general, se manifiesta como un cuadro oligoarticular o poliarticular que afecta a articulaciones pequeñas y grandes tanto en las extremidades superiores como en las inferiores21. Aunque todavía no hay información que evalúe la presencia de cambios radiográficos a largo plazo, parece que la artritis no es erosiva. Solo se ha registrado un caso de artritis erosiva y otro de sacroilitis confirmada radiográficamente en un paciente con positividad para HLA-B2735,36.
PulmonaresLas manifestaciones pulmonares del síndrome de VEXAS pueden ser muy variables. Algunos pacientes pueden presentar síntomas leves, como tos y disnea, mientras que otros pueden requerir ventilación mecánica45,48. Los hallazgos tomográficos son comunes (entre el 72% y el 100% de los casos) y los principales patrones descritos incluyen opacidades en vidrio deslustrado (presentes en el 87% de los casos), consolidaciones (49%), reticulación (38%), nódulos (47%), adenopatías mediastínicas (58%) y derrame pleural (53%) (fig. 3G)48. Algunos patrones tomográficos descritos incluyen neumonía intersticial no específica, bronquiolitis obliterante y neumonía organizada21. En los casos en los que se ha realizado una biopsia pulmonar se ha reportado alveolitis linfocítica o neutrofílica, vasculitis neutrofílica o neumonía organizada1,46,59. Es importante recalcar que el compromiso pulmonar puede ocurrir en un corto periodo posterior al inicio de la disminución de la dosis de prednisona.
Otras manifestaciones inflamatoriasEn menor frecuencia, el síndrome de VEXAS también puede afectar otros órganos. Se ha descrito compromiso del sistema nervioso periférico en el 14,7% de los casos, afectación del tracto gastrointestinal en el 14%, esplenomegalia en el 13,8%, orquitis en el 12%, riñón en el 9,5% (principalmente nefritis intersticial), hepatomegalia en el 7,8%, pericarditis en el 4,3% y miocarditis en el 2,6%12,24,46. Además, se han descrito casos de meningitis aséptica, miofasciitis y miositis necrosante1,58.
Manifestaciones hematológicasObiorah et al.43 describieron las principales manifestaciones hematológicas del síndrome de VEXAS en 18 pacientes, las cuales incluyen anemia macrocítica (100%), trombocitopenia (50%), linfopenia (80%), monocitopenia (50%) y neutropenia en menor medida (13%). En cohortes más grandes se ha descrito anemia macrocítica en hasta el 97% de los casos y trombocitopenia en el 83% de los casos12. En el frotis de sangre periférica se observó macrocitosis leve a moderada, formas jóvenes de la serie granulocítica, neutrófilos vacuolados, hipogranulares, hiposegmentados y algunos con morfología pseudo-Pelger-Huet-like43,60.
Aspirado de médula ósea y biopsia de huesoEn las primeras series de síndrome de VEXAS se describió como dato típico la presencia de vacuolas en el citoplasma de la serie granulocítica y eritroide (fig. 3H). Sin embargo, esto no es patognomónico de la enfermedad, y es necesario descartar otras causas, como la intoxicación por zinc, la deficiencia de cobre, el alcoholismo y el SMD42,43,60,61. Por otro lado, Obiorah et al.43 describieron que la proporción de precursores mieloides y eritroides con vacuolas fue del 15%, con una mediana de 5 a 7 vacuolas por célula, caracterizadas por ser redondas, pequeñas y bien definidas. Estas vacuolas se localizan principalmente en precursores mieloides o eritroides. En menor grado, se pueden encontrar en monocitos, eosinófilos, células plasmáticas y megacariocitos. La ausencia de vacuolas en los linfocitos se explica porque la presencia de la mutación evita que los linfocitos sobrevivan. Beck et al.1 detectaron la mutación en las células progenitoras hematopoyéticas, progenitoras eritroide-megacariocíticas, progenitoras mieloides y progenitoras linfoides. Además, en casos raros, los pacientes con síndrome de VEXAS pueden presentarse sin vacuolización62.
Se han descrito tres patrones histopatológicos en médula ósea en pacientes con síndrome de VEXAS:
- 1.
Hallazgos morfológicos en pacientes que se presentan con una citopenia inexplicable/citopenia clonal de significado incierto. Hipercelularidad (87,5%), aumento de megacariocitos (50%), hiperplasia mieloide y una relación mieloide:eritroide que aumenta con el tiempo, y displasia en alguna de las tres líneas celulares pero en menos del 10% de las células43,60.
- 2.
Síndrome mielodisplásico. Los pacientes con síndrome de VEXAS también pueden desarrollar SMD, que se ha reportado en diferentes series desde un 24% hasta un 63% usando los criterios de la OMS 20161,12,23,45. Estos casos se caracterizan por ser de bajo riesgo según el IPSS-R, con menos del 5% de blastos y un 50% con un cariotipo normal8. La secuenciación de siguiente generación en 9 casos de la serie original de Beck mostró que solo 6 tenían mutaciones somáticas recurrentes, incluyendo MLL-PTD, DNMT3A, CSF1R, SF3B1 y EZH2, y solo un caso presentó dos mutaciones coexistentes1. La presencia de la mutación UBA1 sugiere que podría ser una «mutación driver» en SMD y debería ser incluida en el panel de mutaciones mieloides.
- 3.
Neoplasia de células plasmáticas y enfermedades linfoproliferativas. Se han reportado casos de mieloma múltiple, gammapatía monoclonal de significado incierto, linfocitosisB monoclonal y leucemia linfocítica crónica24,43.
También se han descrito casos de linfohistiocitosis hemofagocítica como complicación del síndrome de VEXAS63.
TrombosisDel 36 al 56% de los casos pueden presentar trombosis venosa. La trombosis arterial se presenta en menos del 10% de los casos. Las trombosis suelen ocurrir de manera temprana en los primeros dos años posteriores al inicio de los síntomas inflamatorios43,64. Aunque se desconoce la causa exacta de la trombosis, el proceso inflamatorio juega un papel importante en ella. El perfil del transcriptoma de las células sanguíneas de los pacientes con síndrome de VEXAS revela la expresión de genes inflamatorios1. Los niveles de factor de Von Willebrand, antitrombinaIII, proteínaC yS en los pacientes con síndrome de VEXAS suelen encontrarse normales43. En cinco pacientes se encontraron niveles altos de factorVIII, de los cuales solo dos tuvieron trombosis. Se ha reportado una correlación entre los niveles de factorVIII y la proteínaC reactiva. El tromboelastograma fue normal en dos casos.43,64 Además, se ha reportado positividad del 44% para anticoagulante lúpico, en algunos casos persistente después de 12 semanas. Sin embargo, la presencia de anticuerpos anti-cardiolipina y anti-β2-glicoproteínaI es poco común43. Actualmente, el papel del anticoagulante lúpico en el síndrome de VEXAS es incierto, y se desconoce si se debe considerar como un verdadero síndrome antifosfolípido.
DiagnósticoEn cuanto a los exámenes de laboratorio, la mayoría de los pacientes presentarán elevación de proteína C reactiva (PCR), velocidad de sedimentación globular (VSG) y ferritina. Estos marcadores pueden variar dependiendo del grado de actividad de la enfermedad1,24. En alrededor del 16% de los casos se pueden encontrar anticuerpos antinucleares positivos, y en el 20% de los casos, factor reumatoide positivo1,48. En general, otros anticuerpos suelen estar ausentes en el síndrome de VEXAS; sin embargo, se han descrito casos en los que los pacientes presentan diagnóstico clínico de vasculitis asociada a ANCA y positividad para anticuerpos anti-mieloperoxidasa o anti-proteinasa3 en el contexto de este síndrome31,32.
Cuando se sospecha de síndrome de VEXAS es importante buscar vacuolas citoplasmáticas en precursores mieloides y eritroides en el aspirado de médula ósea, si está disponible, ya que están presentes en la mayoría de los casos, como se mencionó anteriormente2.
Finalmente, aunque las características clínicas, los parámetros de laboratorio y la biopsia de médula ósea son importantes para identificar a aquellos con sospecha de síndrome de VEXAS, el diagnóstico requiere confirmación genética1.
Se han descrito mutaciones UBA1 en ADN obtenido de células mononucleares de sangre periférica, de biopsias de médula ósea o en biopsias de piel de dermatosis neutrofílicas y de músculo1,17,18. Actualmente, la prueba de mutaciones en UBA1 está principalmente restringida a laboratorios de investigación en algunas instituciones académicas, pero ahora está más disponible comercialmente en Estados Unidos y en algunos países de Europa. Al ordenar la prueba es importante asegurarse de que la muestra no se esté evaluando para una mutación germinal en UBA1, la cual está asociada con la atrofia muscular espinal ligada al cromosomaX de inicio infantil y no confirmará la presencia de la mutación somática21. Es importante conocer la metodología de la prueba utilizada en UBA1. La mayoría de los pacientes con VEXAS tienen frecuencias alélicas de variantes de UBA1>20%, por lo que la secuenciación de Sanger debería ser suficiente para detectar la gran mayoría de los casos1. Además, debido a que las mutaciones en UBA1 no se limitan al codón41, hay que solicitar la secuenciación de todo el gen de UBA165.
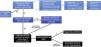
Cribado de pacientes con sospecha de síndrome de VEXASEl síndrome de VEXAS debe ser considerado como un posible diagnóstico en personas que presenten síntomas inflamatorios que no respondan a tratamientos convencionales o que dependan de glucocorticoides, y que también tengan anormalidades hematológicas progresivas, especialmente anemia macrocítica y trombocitopenia (fig. 4). Este síndrome es más frecuente en hombres mayores de 40años, por lo que se deben tener en cuenta la edad y el género del paciente al sospechar esta enfermedad2,21. Específicamente, las poblaciones con mayor probabilidad de tener una mutación positiva en UBA1 son aquellas con diagnósticos clínicos más frecuentemente reportados en pacientes con síndrome de VEXAS, como la policondritis recidivante, el síndrome de Sweet o el SMD.
Ferrada et al.45 han desarrollado un algoritmo para identificar posibles casos de síndrome de VEXAS en pacientes con policondritis recidivante. En un hombre con diagnóstico clínico de policondritis recidivante y un volumen corpuscular medio (VCM) superior a 100fL y/o menos de 200.000 plaquetas/μl se debe considerar el análisis genético para mutaciones en UBA1. Este algoritmo ha demostrado una sensibilidad del 100% y una especificidad del 96% en la identificación de pacientes con PR-V.
Además, en hombres que presentan dermatosis neutrofílicas que sugieren la presencia de síndrome de Sweet, especialmente si se asocia con anemia macrocítica, la probabilidad de que se trate de síndrome de VEXAS es elevada17,44.
Otro estudio encontró una alta tasa de positividad para UBA1 en pacientes con vasculitis sistémicas de cualquier calibre utilizando los siguiente criterios: 1)fiebre recurrente y al menos uno de los siguientes: afectación cutánea, infiltrados pulmonares, condritis de oído o nariz o tromboembolismo venoso; 2)niveles de PCR>20mg/l y al menos uno de los siguientes: anemia macrocítica (valor de hemoglobina <12g/dl y VCM>100 fl), trombocitopenia (<130,000/μl), neutropenia (<1.500/mm3) o un diagnóstico hematológico de SMD, y 3)falta de respuesta a al menos un fármaco antirreumático modificador de la enfermedad sintético o biológico y necesidad continua de tratamiento con glucocorticoides32.
En pacientes con SMD que presenten manifestaciones inflamatorias o hayan sido diagnosticados con alguna enfermedad autoinmune, se debe considerar la posibilidad de un diagnóstico de síndrome de VEXAS y se recomienda solicitar la prueba de mutación para UBA1. Dos estudios han investigado este tema y encontraron que, entre los pacientes evaluados, se detectó una prevalencia de mutación en UBA1 del 12% y del 33%25,29.
Por último, la presencia de vacuolas en precursores mieloides y eritroides en pacientes con SMD o enfermedades inflamatorias es otro escenario que debe hacer sospechar de síndrome de VEXAS42,61. Un estudio ha demostrado que la identificación de ≥10% de precursores de neutrófilos en un aspirado de médula ósea con >1vacuola tiene una sensibilidad y una especificidad del 100% para detectar pacientes con síndrome de VEXAS66.
TratamientoEl tratamiento del síndrome de VEXAS tiene dos objetivos principales: erradicar las células con la mutación UBA1 e inhibir las vías inflamatorias y citocinas involucradas67. Lo anterior constituye un reto debido al involucro multiorgánico, la heterogeneidad en la presentación, la frecuente asociación con condiciones hematológicas malignas, la dependencia al uso de glucocorticoides y la refractariedad a terapias inmunosupresoras convencionales68,69.
En la actualidad no existen algoritmos estandarizados para el tratamiento, por lo que las recomendaciones se basan en un número limitado de estudios retrospectivos y series de casos8. Por lo anterior, es necesario el diseño de ensayos clínicos, la definición de criterios de respuesta y eficacia significativos (más allá del «tiempo a la siguiente dosis o al siguiente tratamiento») y confiables, así como la identificación de biomarcadores predictivos.
Glucocorticoides e inmunosupresores convencionalesLos glucocorticoides a dosis de 20-40mg/día de prednisona constituyen la terapia anti-inflamatoria de mayor eficacia en los pacientes con síndrome de VEXAS, con efecto transitorio y dosis-dependiente (dificultad para reducir la dosis de prednisona por debajo de 10-20mg/día)21. Su uso a largo plazo se asocia a eventos adversos infecciosos y cardiovasculares, por lo cual se han intentado utilizar otros fármacos con efecto ahorrador de glucocorticoides. La selección del tipo de terapia depende del predominio de las manifestaciones inflamatorias o hematológicas8.
Los inhibidores de calcineurina (ciclosporina y tacrolimus) en combinación con glucocorticoides han demostrado respuesta clínica y biológica en los síntomas inflamatorios asociados al síndrome de VEXAS en un grupo pequeño de pacientes47,69.
Otros inmunosupresores, incluyendo metotrexato, ciclofosfamida, azatioprina y mofetil micofenolato, se han utilizado en el tratamiento de estos pacientes, con poca evidencia sobre su eficacia como monoterapia47,52,54.
Fármacos biológicosLa terapia con fármacos anti-IL-1 (anakinra y canakinumab) ha mostrado resultados contradictorios, en su mayoría asociados a descontinuación por reacciones en el sitio de aplicación o por recurrencia de los síntomas8. Los agentes anti-TNF alfa (infliximab, etanercept, golimumab y adalimumab) se han asociado a ineficacia o respuesta parcial47,70. El tratamiento con anti-IL-6 (tocilizumab) ha mostrado eficacia transitoria en algunos casos (mediana de tiempo al siguiente tratamiento de 8meses), con mejoría en las manifestaciones cutáneas y hematológicas, en los requerimientos transfusionales y en la dosis de glucocorticoides55,71. En otros pacientes no se ha observado respuesta, y existen dos reportes de casos de perforación intestinal en pacientes con síndrome de VEXAS que recibieron tocilizumab8,21,47,55. Otros fármacos que se han utilizado en pacientes con síndrome de VEXAS incluyen la terapia anti-CD20 (rituximab), anti-IL-17 (secukinumab) y anti-IL-12/IL-23 (ustekinumab), sin evidencia de eficacia47. En el caso del uso de rituximab, los pacientes con síndrome de VEXAS pueden experimentar un tiempo prolongado de recuperación de los CD19, lo que puede aumentar el riesgo de infecciones oportunistas.
Moléculas pequeñasEl tratamiento con inhibidores de las cinasas Janus (JAK), incluyendo ruxolitinib, baricitinib, upadacitinib y tofacitinib, se ha asociado a respuesta clínica después del primer mes de terapia (especialmente ruxolitinib), incluyendo la reducción de la dosis de glucocorticoides, la independencia de transfusiones, la mejoría cutánea y la normalización de los niveles de PCR. Sin embargo, se han descrito efectos secundarios, tales como infecciones graves bacterianas y virales, toxicidad hematológica, así como eventos trombóticos8,21,69,72.
Otros fármacos antiinflamatorios e inmunomoduladoresExisten reportes del uso de hidroxicloroquina, dapsona, colchicina, lenalidomida, bortezomib, abatacept e inmunoglobulina intravenosa en pacientes con síndrome de VEXAS, sin un beneficio clínico claro8,43,69.
Agentes hipometilantesLa azacitidina y la decitabina son inhibidores de la metiltransferasa del ADN y se utilizan en el tratamiento de pacientes con síndrome de VEXAS que desarrollan SMD68,69. El tratamiento con azacitidina, fármaco aprobado para el tratamiento de SMD de alto riesgo, ha demostrado mejoría en los síntomas inflamatorios, reducción en el requerimiento de glucocorticoides y de transfusiones, respuesta hematológica, normalización de las alteraciones en médula ósea y erradicación casi completa de las clonas mutadas, con variaciones en la respuesta de acuerdo a la presencia de mutaciones relacionadas con el SMD8,47,73,74. Estos agentes son una opción terapéutica para los pacientes con síndrome de VEXAS de alto riesgo asociado a SMD que no sean candidatos a trasplante alogénico69,74.
Trasplante alogénico de células progenitoras hematopoyéticas (TCPH)Esta estrategia se sustenta en la potencial erradicación de las células con la mutación en UBA1. Sin embargo, se asocia a elevada morbimortalidad por el riesgo de desarrollar enfermedad de injerto contra huésped y complicaciones infecciosas, por lo que es importante considerar factores tales como la edad, el estado funcional y la presencia de comorbilidades69. Menos de 20 casos de TCPH en síndrome de VEXAS han sido reportados, en la mayoría con respuesta completa, pero con tiempos de seguimiento muy cortos75.
En ausencia de otras terapias curativas, el TCPH puede considerarse de forma temprana en aquellos pacientes con dependencia a glucocorticoides que presenten inflamación activa y refractaria, SMD concurrente y buen estado funcional, mental y nutricional69,75-77. Así mismo, esta intervención puede considerarse en pacientes con citopenias progresivas u otros datos de alto riesgo, tales como la presencia de la mutación p.Met41Val, dependencia transfusional, requerimiento de dosis >20mg/día de prednisona para control de síntomas, falla a dos o más líneas de tratamiento, o presencia de otras mutaciones clonales en la médula (por ejemplo, DNMT3A, TET2)8. En la actualidad está en curso un estudio faseII para evaluar la eficacia del TCPH en pacientes con síndrome de VEXAS (ClinicalTrials.gov Identifier: NCT05027945).
Cuidados de soporteLos cuidados de soporte en los pacientes con síndrome de VEXAS juegan un papel sumamente importante, y deben individualizarse y considerar el riesgo de SMD, de sangrado y de trombosis. Incluyen las transfusiones sanguíneas, los factores de crecimiento, los agentes estimuladores de eritropoyetina, los miméticos de la trombopoyetina (eltrombopag) y la profilaxis contra infecciones oportunistas8,69.
La anticoagulación se considera en los pacientes con síndrome de VEXAS que desarrollan eventos trombóticos, con duración dependiente de la presencia de otros factores de riesgo. También debe considerarse la tromboprofilaxis en pacientes hospitalizados, con inmovilización prolongada o cirugía reciente, de no existir contraindicación. No existe evidencia sólida sobre el tipo de anticoagulantes, siendo los antagonistas de la vitaminaK los preferidos en aquellos casos con síndrome de VEXAS y positividad para anticuerpos antifosfolípidos o presencia de trombosis arterial64.
Dado que los pacientes con síndrome de VEXAS son generalmente de edad avanzada y están expuestos a esteroides a largo plazo, resulta crucial prevenir, evaluar y tratar las condiciones asociadas. En este sentido, en estos pacientes se recomienda tomar medidas para el diagnóstico, la prevención y el tratamiento de la osteoporosis. También se deben considerar otras medidas empíricas, como la profilaxis para Pneumocystis jirovecii y la reactivación del herpes zoster.
PronósticoDebido a su reciente caracterización, el pronóstico del síndrome de VEXAS aún no está completamente establecido. Sin embargo, se considera que es una enfermedad progresiva que puede presentar múltiples recaídas y acumulación de daño tanto por la propia enfermedad como por los tratamientos utilizados.
Las complicaciones relacionadas con la enfermedad y la toxicidad de los medicamentos inmunosupresores y glucocorticoides son causas comunes de muerte12,24. En la cohorte inicial del NIH se reportó una mortalidad del 40% al momento de la publicación, y algunos pacientes fueron identificados retrospectivamente después de su fallecimiento1. Otra cohorte holandesa reportó una mortalidad del 50% a una media de seguimiento de 4años, mientras que la cohorte francesa reportó una tasa de mortalidad menos elevada, del 15,5%, a un seguimiento de 3años24,46. En una actualización más reciente de la cohorte del NIH, compuesta por 83 pacientes, se reportó una mortalidad del 25%, con una mediana de supervivencia de 10años desde el inicio de los síntomas hasta la muerte. Además, en esta cohorte se identificaron factores asociados a mortalidad, tales como tener la mutación p.Met41Val o la dependencia a transfusiones, mientras que el tener condritis auricular se asoció a menor mortalidad12.
En contraste, en una cohorte francesa de pacientes con síndrome de VEXAS, se reportó que la variante p.Met41Leu se asociaba con una mejor supervivencia. Además, se identificaron otros factores asociados con mortalidad, como la presencia de afección gastrointestinal, infiltrados pulmonares y adenopatías mediastínicas24.
Conclusiones y perspectivasEl síndrome de VEXAS es una enfermedad que se produce como resultado de mutaciones somáticas en células mieloides, prototipo de un nuevo grupo de enfermedades denominadas síndromes hematoinflamatorios. A pesar de que inicialmente se creía que era una enfermedad poco común, la prevalencia reportada sugiere que es más común de lo que se pensaba. Este síndrome debe ser considerado en adultos, especialmente mayores de 40años, que presenten manifestaciones inflamatorias que no responden al tratamiento y/o citopenias progresivas.
Actualmente no se conoce el tratamiento óptimo para el síndrome de VEXAS, pero los glucocorticoides siguen siendo los fármacos más útiles, aunque su uso se asocia con la acumulación de efectos adversos. Aún no se ha establecido una opción de tratamiento alternativa a los glucocorticoides, aunque se han reportado mejores resultados con el tocilizumab, la azacitidina y el ruxolitinib. En casos graves, el TCPH puede ser una opción curativa.
Hasta la fecha, la mayoría de los casos de síndrome de VEXAS han sido descritos en poblaciones de Estados Unidos, Europa, Japón y Australia. En Latinoamérica solo se han reportado tres casos de síndrome de VEXAS22,54,78. Esta falta de información sobre la enfermedad en la región podría deberse a una menor capacidad de diagnóstico y a la falta de conocimiento sobre la enfermedad en la comunidad médica. Dado que el síndrome de VEXAS es una enfermedad rara pero potencialmente grave, es importante aumentar la conciencia sobre esta enfermedad en todo el mundo, incluyendo Latinoamérica. Esto podría permitir una detección más temprana, un diagnóstico preciso y un manejo adecuado de los pacientes afectados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a Silvia Méndez-Flores, Daniel Montante-Montes de Oca y Jesús Delgado-de la Mora su valioso apoyo en la obtención de imágenes clínicas e histopatológicas.