La experiencia clínica hace sospechar que la población española pudiera sufrir más efectos adversos por la sulfasalazina (SSZ). Se realizó una revisión sistemática de la literatura existente con el objetivo de analizar la susceptibilidad a desarrollar eventos adversos producidos por la SSZ en la población española.
Material y métodoSe definió una estrategia de búsqueda bibliográfica sensible en EMBASE, IBECS y MEDLINE desde 1973 hasta marzo de 2007. En los artículos seleccionados se buscó la descripción de los efectos adversos, tanto en el texto como en las tablas, así como los motivos de retirada, la población estudiada y la discusión sobre la opinión de las diferencias en los efectos adversos de los diferentes grupos de tratamiento.
ResultadosDe un total de 106 artículos rescatados se seleccionaron 36 para realizar un análisis detallado de los 34 artículos seleccionados en MEDLINE y EMBASE y de los 2 de IBECS. No se encontró ningún estudio que evidencie que la población española sea más susceptible a los efectos adversos por SSZ.
ConclusionesLos efectos adversos por SSZ varían según el patrón de acetilación. En la población española la prevalencia de acetiladores lentos es mayor que en otros grupos étnicos; por tanto, cabría inferir que la incidencia de efectos adversos secundarios a la SSZ podría ser mayor en la población española que en otros grupos. No encontramos evidencia en la literatura de que la población española sea más susceptible a los efectos adversos por la SSZ.
Clinical experience raises suspicion that the spanish population could suffer higher rates of side effects of sulfasalazine (SSZ) therapy. We conducted a systematic review of existing literature to analyze the susceptibility to developing adverse events produced by SSZ in the Spanish population.
Material and methodA literature search was conducted in EMBASE, IBECS, and MEDLINE from 1973 to March 2007. The items sought were those describing adverse effects, both in text and tables, and reasons for withdrawal, the population under study and discussion of differences in side effects of the different treatment groups.
ResultsOf the 106 retrieved articles, 36 were selected for review and detailed analysis. 34 articles were selected from MEDLINE and EMBASE and 2 from IBECS. We did not find any study that showed that the Spanish population was more susceptible to SSZ.
ConclusionsThe adverse effects of SSZ vary with the pattern of acetylation. Thus, in slow-acetylators, depending on the dosage of SSZ, the side effects increase significantly. In the Spanish population slow-acetylators prevalence is higher than in other ethnic groups. Therefore, one could infer that the incidence of adverse side effects by SSZ could be higher in the Spanish population than in others different ethnic groups. We found no evidence that the Spanish population was more likely to suffer adverse effects by SSZ than other ethnic groups.
La sulfasalazina (SSZ) se sintetizó en 1930 por la combinación de un compuesto de la familia de la aspirina (5 aminosalicílico) y un antibiótico (sulfapiridina). En los años cincuenta se utilizó en el tratamiento de la artritis reumatoide cuando se pensaba que ésta tenía una causa infecciosa, pero posteriormente cayó en desuso, y desde entonces se utiliza para el tratamiento de enfermedades inflamatorias intestinales. A partir de los años ochenta volvieron a aparecer trabajos sobre el uso de la sulfasalazina en el tratamiento de las enfermedades reumáticas, y en la actualidad es un fármaco que se utiliza en el tratamiento de la artritis reumatoide, la artritis psoriásica, la artritis crónica juvenil y las espondiloartropatías.
En la práctica habitual y en las publicaciones de los reumatólogos españoles se observa un uso de la SSZ menor que en el entorno anglosajón; entre otras razones, por la presunción de que la SSZ se tolera peor en nuestra población. La experiencia clínica hace sospechar que podría haber cierta predisposición en la población española a sufrir mayores tasas de efectos adversos por la SSZ, tal vez por la presencia de mayor número de acetiladores lentos, si bien en la información del producto no se refiere a ello.
Con el objetivo de contrastar si la población española es más susceptible a los efectos adversos por la SSZ, se realizó una revisión sistemática de la literatura existente al respecto.
Material y métodoEstrategia de búsquedaSe llevó a cabo una revisión sistemática1–36 en las bases de datos: EMBASE (en OVID), en el índice bibliográfico español IBECS y en MEDLINE (en PubMed), desde el año 1973 hasta marzo de 2007. La estrategia utilizada en las diferentes bases de datos fue especialmente sensible: “Sulfasalazine/advers effects” (MESH, medical subheadings), dado que las estrategias previas más restrictivas que se probaron no captaban suficientes estudios ni eran más informativos que los captados por esta estrategia. Adicionalmente se aplicaron filtros por lengua española o inglesa y se comprobó la existencia de ensayos clínicos mediante palabras clave (tanto para ensayo clínico como para ensayo clínico aleatorizado). También se cruzó con el término (MeSH) “ethnics groups”.
Criterios de selección de estudiosEl resultado de la búsqueda primeramente se depuró por título y resumen o por artículo entero en caso de no haber resumen. Tras este proceso, los artículos restantes se analizaron en detalle. Inicialmente se seleccionaron todos los ensayos y casos clínicos, sin otras limitaciones, que estuviesen realizados en población española o sobre grupos étnicos, y se rechazaron los estudios en población infantil. Dado que los resultados de estas búsquedas fueron nulos, se extendió a cualquier ensayo clínico, aleatorizado y controlado con placebo que incluyese la descripción de los efectos adversos, sin limitación de la población objeto de estudio, ni por enfermedad ni por procedencia. Se excluyeron estudios en niños por entender que la población infantil metaboliza de forma distinta de la adulta y por ello podría añadir confusión a la revisión.
Medidas de resultadoEn los artículos seleccionados se buscó la descripción de los efectos adversos, tanto en texto como en tablas, así como los motivos de retirada, la población estudiada y la discusión sobre la opinión de las diferencias en los efectos adversos de los distintos grupos de tratamiento.
ResultadosEl resultado de la búsqueda en MEDLINE (PubMed), dependiendo de los términos y filtros aplicados, fue el siguiente: “Sulfasalazine AND adverse effects”, 880 registros; “Sulfasalazine AND adverse effects in Spanish language”, 12; “Sulfasalazine AND adverse effects in Spanish OR English language”, 691. De estos 691, 122 eran ensayos clínicos y 75 además eran ensayos controlados. Se encontraron 66.219 citas en grupos étnicos, pero ninguna cuando se cruzaba con “Sulfasalazine/ adverse effects [MESH]”.
En EMBASE (OVID) los resultados para “Sulfasalazine/adverse effects” fue de 891, ninguno en español, 678 en inglés. De estos 678, 119 eran ensayos clínicos aleatorizados y sólo 20, además, controlados. También se cruzaron los resultados de “Sulfasalazine/adverse effects” con las 11.787 citas de grupos étnicos, y no se encontró ninguna publicación.
En IBECS, índice bibliográfico español, utilizamos los términos “sulfasalazina” y posteriormente “salazopyrina” y “5-ASA”. Con el término “salazopyrina” no obtuvimos ningún resultado, con “5-ASA” tampoco y con “sulfasalazina”, 11 citaciones.
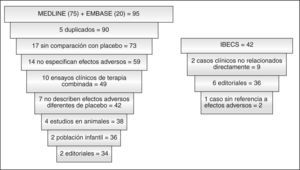
La comparación de los resultados de las bases de datos MEDLINE (n = 75) y EMBASE (n = 20) dio como resultado 90 artículos (5 duplicados fueron descartados) para analizar, de los que se descartaron: 17 por comparar SSZ con otros fármacos, no con placebo, 14 por no especificar los efectos adversos o los motivos de retirada, 10 por ser ensayos clínicos de terapia combinada, 7 por no describir efectos adversos diferentes de los del placebo, 4 por ser estudios en animales, 2 editoriales y 2 en población infantil. En total, fueron revisados en detalle 34 artículos.
De los 11 registros hallados en IBECS se rechazaron por título y abstract: 6 editoriales o revisiones, 2 casos clínicos no directamente relacionados y 1 caso clínico de eficacia sin referencia a efectos adversos.
La figura 1 muestra el flujo de selección de estudios de las 3 bases de datos.
Revisión detalladaSe realizó un análisis detallado de los 34 artículos seleccionados en MEDLINE y EMBASE y de los 2 de IBECS.
La frecuencia de efectos adversos en el tratamiento es alta (86%), principalmente gastrointestinales (61%): anorexia, trastornos gastrointestinales, erupción cutánea inespecífica, elevación de las fosfatasas alcalinas y de la glutamato-piruvato transaminasa (GPT), leucocitopenia, y disminución de inmunoglobulinas33–35. La mayor parte de los efectos adversos ocurrían en los 4 días siguientes de aumentar la dosis y todos dentro de la primera semana.
Los efectos adversos encontrados se pueden dividir en 2 grupos: los no dependientes de la dosis (exantema, depresión medular, hemólisis autoinmunitaria y alteraciones pulmonares, que generalmente no aparecen en el inicio del tratamiento) y los dependientes de la dosis, que aparecen al subir de 2 a 4 g/día (náuseas, cefaleas y malestar, que guardan una estrecha relación con la concentración plasmática de la SSZ total). Éstos se dan predominantemente en los acetiladores lentos, aunque el patrón de acetilación no es el único factor, ya que la SSZ también se metaboliza por hidroxilación y glucuronización35.
Azad et al36 compararon 3 dosis diferentes de SSZ (1 g, 2 g o 4 g) al día en el mantenimiento de la colitis ulcerosa. Describieron que el porcentaje de efectos adversos dependía de la concentración plasmática, y ésta, de la relación entre los metabolitos de la SSZ total y la SSZ libre en plasma. A partir de este estudio se relaciona el patrón de acetilación con la frecuencia de los efectos adversos.
Sin embargo, no encontramos ningún estudio que compare si hay diferentes tasas de efectos adversos por SSZ entre la población española y otros grupos étnicos.
DiscusiónLa SSZ es metabolizada por las bacterias intestinales a los metabolitos: sulfapiridina y ácido 5-aminosalicílico; la dosis absorbida y posteriormente metabolizada en el hígado es de aproximadamente un 15%. La vida media en plasma de la SSZ es de 3,4 a 7,6 h. Posteriormente, la sulfapiridina es metabolizada por acetilación para formar la acetilsulfapiridina; la velocidad de metabolización de la sulfapiridina a la acetilsulfapiridina es dependiente del fenotipo acetilador. En acetiladores rápidos, la vida media plasmática de sulfapiridina es 10,4 h, mientras que en acetiladores lentos es 14,8 h. Aproximadamente, el 60% de la población caucásica correspondería a un fenotipo de acetilación lenta, manifestado por la prolongación de la vida media plasmática de la sulfapiridina (14,8 h frente a las habituales 10,4 h), lo que da lugar a concentraciones plasmáticas de sulfapiridina elevadas y acumulación del primer metabolito de la SSZ respecto de los acetiladores rápidos33.
Tras nuestra revisión bibliográfica1–36, no encontramos evidencia en la literatura revisada de que la población española sea más susceptible a los efectos adversos por la SSZ que otros grupos étnicos diferentes.
Se ha objetivado que los efectos adversos por SSZ varían según el patrón de acetilación. Así pues, en individuos acetiladores lentos, según la dosis de SSZ, los efectos adversos aumentan de forma significativa36.
En la población española la prevalencia de acetiladores lentos es mayor que en otros grupos étnicos37,38. Por tanto, cabría inferir que la incidencia de efectos adversos secundarios a la SSZ podría ser mayor en la población española que en la descrita en otros grupos étnicos diferentes.
No obstante, serían necesarios nuevos estudios de comparación de efectos adversos debidos a la SSZ entre diferentes grupos poblacionales para poder corroborar dicha suposición.
Este trabajo ha recibido el apoyo de la Unidad de Investigación de la Fundación Española de Reumatología.