La psoriasis y la artritis psoriásica (APs) son entidades frecuentes en la consulta del dermatólogo y el reumatólogo, respectivamente. En muchas ocasiones ambos trastornos generan una importante merma en la calidad de vida del enfermo, y en el caso de la AP, el daño estructural es frecuente con el paso del tiempo. Por ello, los clínicos se ven con frecuencia ante la necesidad de usar terapias altamente eficaces, fundamentalmente agente inhibidores del factor de necrosis tumoral alfa (TNFα) que, no obstante, pueden tener efectos adversos paradójicos en esta población, como la aparición de novo (o la exacerbación de casos previos) de psoriasis o lesiones psoriasiformes. A pesar de la eficacia clínica de los agentes anti-TNF, recientes estudios de registros con estos fármacos revelan que hasta un 25% de los casos de pacientes con APs tratados con fármacos anti-TNF abandonan el tratamiento antes del primer año. Por lo tanto, es necesario conocer y emplear terapias biológicas alternativas en estos casos. La presente revisión se ocupa de este tema.
Psoriasis and psoriatic arthritis (PsA) are common conditions in the clinical practice of both dermatologists and rheumatologists. Both entities may cause an important loss in quality of life, and in the case of PsA, joint structural damage may arise over time. For these reasons, clinicians may be faced with the need for treating these cases with highly effective therapies, such as TNFα blocking agents, although these drugs may be paradoxically related with de novo onset (or exacerbation of previous lesions) of psoriasis or psoriasiform lesions. In spite of the clinical efficacy of these therapies, recent registry studies show that up to 25% of PsA cases exposed to anti-TNF therapies are withdrawn from these drugs within the first year of therapy. Therefore, there is a need for the use of alternative biologic therapies in this context. The present review deals with this subject.
La psoriasis y la artritis psoriásica (APs) son dos entidades frecuentes en los campos de la dermatología y la reumatología, respectivamente. Se estima que un 1–3% de la población general de los países occidentales está afecta de psoriasis y que, de esa prevalencia, en un 7–40% de los casos se desarrolla una peculiar forma de artropatía inflamatoria, que es lo que conocemos como APs. La APs comparte rasgos genéticos (HLA-B27), clínicos (artritis axial, entesitis, artritis periférica) y radiológicos (sacroileítis) y manifestaciones extraarticulares (uveítis) con las otras entidades de la gran familia de las espondiloartritis, y por ello se la recoge en este grupo taxonómico en la actualidad1.
Muchos trabajos atestiguan que la APs no es esa condición benigna de antaño. De hecho, sabemos que 1/5 pacientes con APs va a sufrir una forma de artritis grave y erosiva, que conduce con frecuencia a grados severos de limitación, pérdida funcional y disminución de la calidad de vida. En pacientes con APs precoz seguidos prospectivamente, se halló que un 35% presentaban las clases funcionales III y IV del ACR y que a los 2 años un 47% tenía enfermedad erosiva. Sólo el 17% de los casos de una cohorte de APs seguida durante 20 años alcanzó la remisión clínica; sin embargo, tras 1año en remisión, el 52% presentó rebrotes de la enfermedad2.
La psoriasis es una dermatosis inflamatoria crónica caracterizada, en su forma más común, por la aparición de placas eritematosas bien demarcadas, cubiertas por una descamación nacarada no adherente y de localización habitual en codos, rodillas, cuero cabelludo, región periumbilical y pliegues interglúteos. La superficie total afectada por psoriasis, ciertas localizaciones y la onicopatía psoriásica se han asociado al desarrollo de APs. Por su parte, los trabajos que han analizado la calidad de vida en pacientes con psoriasis encuentran que el impacto generado por esta enfermedad puede llegar a ser equiparable al que generan el cáncer o la artritis reumatoide3.
Los agentes anti-TNF se han convertido en los últimos años en la piedra de toque de las terapias destinadas a los pacientes con enfermedad moderada a severa que no han respondido a la escalada terapéutica estándar consensuada para ambas entidades, y en ese sentido, las Sociedad Española de Reumatología y la Sociedad Española de Dermatología han emitido documentos de consenso para el uso de agentes biológicos en este tipo de pacientes4,5. Con todo, y a pesar de su innegable eficacia contrastada en numerosos ensayos clínicos y en la práctica clínica cotidiana, estas terapias no están exentas de efectos adversos potencialmente graves, algunos de los cuales suponen la aparición de novo o la exacerbación de casos de psoriasis por mecanismos no claramente establecidos, pero probablemente ligados a las complejas interacciones entre el TNF y el interferón alfa en la piel de estos pacientes6. Además, trabajos recientes procedentes de grandes registros de agentes biológicos indican que hasta un 25% de los pacientes con APs y terapia anti-TNF abandonan esta terapia ya al primer año, y que el cambio a un segundo anti-TNF se acompaña incluso de un peor cumplimiento con el segundo agente antes del primer año7.
Por lo tanto, en la presente revisión nos ocuparemos del uso de las terapias biológicas distintas de los anti-TNF empleadas en psoriasis y APs y la experiencia alcanzada hasta la fecha.
Bases inmunológicas para el uso de terapias distintas de los agentes anti-TNF en la psoriasis y la APs.La psoriasis y la APs probablemente sean el resultado de complejas interacciones entre determinantes genéticos, inmunitarios y ambientales. A pesar del carácter netamente poligénico de la psoriasis, la principal evidencia apunta al locus HLA-C (en concreto, HLA-Cw6) como el principal determinante del riesgo génico de la enfermedad, sobre todo de la variante tipo I. Aunque este locus posiblemente confiere un riesgo artritogénico adicional, sito en HLA-Cw*0702, este punto necesita de ulteriores estudios de confirmación8,9. HLA-Cw6 puede participar en la presentación de un antígeno, aún no definido, por parte de las células dendríticas y los queratinocitos de la piel de pacientes psoriásicos a las células CD8+, con lo que se produce una primera señal de activación para éstas. Sin embargo, la plena capacidad operativa de esta estirpe celular sólo se alcanza tras las interacciones entre diversos ligandos y sus contrarreceptores en linfocitos T y células presentadoras de antígeno (CPA), lo que conocemos como segunda señal o segunda sinapsis de activación inmunitaria (coestimulación)3.
A través del empleo de la tecnología de los single nucleotide polymorphisms (SNP), se ha podido comprobar que existen otras dos regiones con fuerte vinculación con el riesgo de psoriasis: IL12B e IL23R. El locus IL23R codifica uno de los componentes proteicos del receptor de la interleucina (IL) 23, mientras que IL12B codifica la subunidad P40, elemento común de la estructura de ambas citocinas, IL-12 e IL-23. La IL-12 es la citocina clave en la expansión de las células con fenotipo Th1, mientras que IL-23 es la principal promotora de la diferenciación y expansión de un nuevo fenotipo dentro de las células T efectoras, las llamadas células Th17. La psoriasis se ha considerado una de las enfermedades prototipo de la llamada inmunidad Th1; no obstante, en la piel de pacientes con psoriasis se halla sobre todo una alta expresión de IL-23 y, algo menos, IL-12 que, como citamos antes, es la principal promotora de la diferenciación Th1. Por consiguiente, en el momento actual se tiende a etiquetar a la psoriasis como una enfermedad dependiente de Th17, si bien este modelo necesita más sustentación, dado que para algunos autores la importancia de las citocinas Th1, como el interferón (IFN) alfa, el TNFα o la IL-12, sigue siendo clave en la patogenia de la enfermedad10–12.
Ya sea por una u otra vía, se sabe que el evento primigenio en el desarrollo de la psoriasis es la llegada y la expansión de linfocitos T de memoria CD4 a la dermis de estos pacientes, y son estas células T CD4 las que priman sobre las CD8+ como efectoras principales de la expansión descontrolada de los queratinocitos; en suma, lo que caracteriza la enfermedad. La presencia de IL-12 en la piel psoriásica, junto con la expresión aumentada de su receptor en las células T lesionales, puede facilitar la diferenciación hacia una respuesta inmunitaria de tipo I (IFNα) tanto en linfocitos lesionales como en sangre periférica. Además, la IL-12 es importante en la activación del sistema inmunitario innato, pues potencia la producción de citocinas proinflamatorias en células NK y linfocitos T. Esta sería una hipotética vía por la que algunas infecciones pueden desencadenar o exacerbar la psoriasis de algunos enfermos. De ese modo, se sabe que la producción de IL-12 se puede poner en marcha tanto por mecanismos dependientes de células T como por activación directa a través de ciertos productos bacterianos y virales10–12.
La IL-23 comparte con la IL-12 la subunidad P40 en su estructura. Producen la primera de estas citocinas fundamentalmente los macrófagos y las células dendríticas, y se cree que la IL-23 ejerce una función de nexo entre la inmunidad innata y la adquirida, y su principal célula diana es la célula Th17. De muchas de las funciones inicialmente atribuidas a la IL-12, hoy se sabe que las ejecuta la IL-23. En el modelo etiopatogénico actualmente imperante para explicar la psoriasis se tiende a pensar que la IL-12 y, por lo tanto, la inmunidad Th1 son clave en los pasos iniciales de la psoriasis, mientras que el eje IL-23-Th17 tiene un papel dominante en el mantenimiento de la inflamación crónica y la regulación de las vías inflamatorias finales10–12.
En los estudios de pacientes con psoriasis en los que se ha empleado la tecnología de los SNP, se ha encontrado ciertas asociaciones entre el riesgo de psoriasis y determinados genes involucrados en la expresión de péptidos de la defensa epidérmica antimicrobiana (betadefensina, catelecidina, proteínas 3C y 3B, etc.). Hay evidencia experimental de que las citocinas Th17 (IL-17A, IL-17F, IL-22, IL-6) regulan la expresión de alguno de esos péptidos antimicrobianos, cuya regulación al alza está sumamente aumentada en queratinocitos psoriásicos10–12.
No está claro si los linfocitos T que desencadenan el proceso psoriásico en la piel son los mismos que desencadenan la APs. Los casos en que ambas entidades se inician sincrónicamente indican esa posibilidad; sin embargo, el hecho de que algunas de las terapias contra las células T que han sido eficaces para la psoriasis no funcionen para el tratamiento de la artritis iría en contra de esa conexión. Por otra parte, en el modelo de APs basado en el concepto de órgano entesosinovial, se entiende que los mecanismos efectores del daño se pueden poner en marcha más por la activación de la inmunidad innata que por la participación de linfocitos T activados por un antígeno contextual dentro del sistema HLA. Un apoyo a esta tesis procede de la reciente observación de que los receptores tipo inmunoglobulina 2DS1 y 2DS2 de las células NK, en ausencia de un ligando HLA, se asocian a riesgo de APs. Con todo, no se puede excluir categóricamente el papel de los linfocitos T (inmunidad adaptativa) en la patogenia de la APs, ya que en el modelo animal de psoriasis y APs inducido por la delección de los genes JunB/C, para el desarrollo de artritis, pero curiosamente no de psoriasis, fue necesaria la concurrencia de linfocitos T y B y una activación nuclear por vía del receptor 1 del TNF. También disponemos de evidencia experimental de que las células Th17 inducidas por IL-23 son capaces de promover osteoclastogénesis en pacientes con artritis y que en modelo animales de artritis experimental la vía que se activa es el eje IL-23-Th17, y no el IL-12-Th11,2,10–12.
Potencialmente, por lo tanto, la intervención terapéutica sobre las vías de activación/coactivación del linfocito T y sobre el eje IL-23-Th17 representa en el momento actual la mejor alternativa a la terapia biológica con anti-TNFα para la psoriasis y la APs. Seguidamente repasaremos las terapias biológicas distintas de los anti-TNF con indicación o uso potencial en la psoriasis y la APs.
EfalizumabEfalizumab (Raptiva®, MerckSerono) es un anticuerpo monoclonal humanizado recombinante tipo IgG1 que se une específicamente a CD11a, la subunidad alfa del antígeno 1 asociado de función linfocitaria (LFA-1, en inglés), una molécula de adhesión de los leucocitos que tiene un importante papel en la activación y el tráfico de los linfocitos T. Al unirse a CD11a, efalizumab bloquea la interacción entre LFA-1 y la molécula de adhesión intercelular tipo 1 (ICAM-1, en inglés), lo que, por una parte, bloquea una de las señales de coestimulación de los LT, tanto en ganglios como en dermis lesional, pero por otro lado también bloquea la interacción LFA-1/ICAM-1 en el endotelio y limita el tráfico de los LT a los lugares de inflamación. En suma, se trata de una terapia contra células T13.
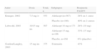
Se administra vía subcutánea a una dosis inicial de 0,7mg/kg, seguida por dosis semanales de 1mg/kg. En la fase de poscomercialización, hacia mayo de 2007, se estimaba que la exposición mundial al fármaco superaba los 40.000 pacientes a una tasa de 28.000 pacientes-año. En la tabla 1 se recogen los resultados de los principales ensayos en fase III con este producto. Los metaanálisis realizados hasta la fecha indican que el riesgo relativo (RR) de alcanzar una respuesta PASI75 a la semana 12 con efalizumab es RR=7,34 (intervalo de confianza [IC] del 95%, 5,23–10,3) con respecto a placebo, y que el número de pacientes que es necesario tratar (NNT) para alcanzar dicha respuesta es 4. Por otro lado, el tiempo medio hasta la recaída para los pacientes que alcanzan respuesta PASI75 a los que se decide retirar el fármaco varía de 54 a 84 días. Las respuestas PASI75/90 en los pacientes sometidos a tratamiento prolongado con efalizumab (36 meses) fueron del 45,4 y el 24,5%, respectivamente. Un estudio fase II con 117 pacientes con APs no pudo demostrar la superioridad de efalizumab frente a placebo, por lo que este fármaco no se emplea en el tratamiento de la APs5,13.
Resultados de los principales ensayos en fase III con efalizumab en psoriasis
| Autor | Características basales | Respuesta PASI75, n (%) | ||||
| Efalizumab | Placebo | Efalizumab | Placebo | |||
| n | PASI | n | PASI | |||
| Lebwohl, 2003 | 232 | 20 | 122 | 20 | ||
| Gordon, 2003 | 369 | 19,4 | 187 | 19,4 | 98 (26,6) | 8 (4,3) |
| Menter, 2005 | ||||||
| Leonardi, 2005 | 162 | 18,6 | 170 | 19 | 63 (39) | 4 (2,4) |
| Papp, 2006 | 250 | 19,1 | 236 | 18,7 | 106 (23,6) | 7 (3) |
| Dubertret, 2006 | 529 | 23,6 | 264 | 23 | 166 (31,4) | 11 (4,2) |
PASI: Psoriasis Area and Severity Index.
El perfil inicial de seguridad de este producto fue bueno; las manifestaciones adversas más frecuentes fueron síndrome seudogripal (27%), sobre todo tras las primeras dosis, leucocitosis/linfocitosis (40–50%) y elevación de FA/GPT (5%); más raramente, se han visto casos de trombocitopenia, anemia hemolítica, pancitopenia, polirradiculopatía inflamatoria y desmielinización periférica. También se han descrito exacerbaciones de la psoriasis, con cambio en el patrón morfológico de la lesión, y el llamado efecto rebote se ha descrito hasta en el 15% de los casos que no alcanzan la respuesta PASI50. En una reciente serie francesa se describieron 16 casos de AP de reciente comienzo en sujetos expuestos a efalizumab, y los autores del trabajo calcularon que en torno al 3,5% de los pacientes con psoriasis sometidos a terapia con este agente podían contraer APs. Finalmente hay que señalar que el 19 de febrero de 2009, la EMEA decidió retirar este producto del mercado ante la aparición de varios casos fatales de leucoencefalopatía multifocal progresiva5,13.
AlefaceptAlefacept (Amevive®, Astellas Pharma US, Inc.) es una proteína de fusión dimérica humana que se compone de la porción extracelular del antígeno de función leucocitaria-3 (LFA-3, en inglés), unido a la fracción Fc de una inmunoglobulina tipo IgG1. El fármaco se une de modo competitivo a la molécula CD2 en la superficie de los LT, e interfiere con la activación linfocitaria que utiliza la señal de coestimulación LFA-3/CD2 por un lado, mientras que por el otro, la fracción Fc de la molécula se engancha al receptor inmunoglobulínico FcγIII en la superficie de las células NK, con lo que promueve la apoptosis de los LT de memoria, que en general expresan más CD2 que los LT vírgenes14. En suma, se trata de una terapia contra las células T.
La dosificación recomendada en la actualidad es 7,5mg semanales vía intravenosa o 15mg semanales vía intramuscular, durante 3 meses, seguidos de 3 meses sin tratamiento. La tabla 2 muestra los resultados de los principales ensayos en fase III llevados a cabo con esta molécula en el tratamiento de la psoriasis. En general, en la mayoría de los estudios con este agente se aprecia que los resultados de cursos repetidos de la medicación son superiores a un solo curso terapéutico. Así, se ha visto que alcanzan las respuestas PASI75 un 29% de los pacientes en el primer curso y un 54% tras el quinto ciclo de tratamiento14. En un reciente trabajo que investigó los efectos benéficos tars el tratamiento con diversos agentes biológicos para la psoriasis en placa, se comprobó que dichos efectos duraban 7–8,6 meses en los expuestos a alefacept, 4,7 meses en los expuestos a infliximab, 2,8–3,5 meses en los que usaron etanercept y 2,8 meses en los que usaron efalizumab15.
Principales resultados de los ensayos en fase III con alefacept en psoriasis
| Autor | Dosis | Total, n | Subgrupos | Respuesta PASI75 |
| Krueger, 2002 | 7,5mg iv | 553 | Alefacept (n=367) | 28% en 1 curso |
| Placebo (n=186) | 40% en 2 cursos | |||
| Lebwohl, 2003 | 10/15mg im | 507 | Alefacept 10mg n:173 | 28% (10mg) |
| Alefacept 15mg, n=166 | 33% (15mg) | |||
| Placebo, n=168 | 8% (placebo) | |||
| Gordon/Langley, 2003 | 15mgim | 375 | Extensión | 43% |
El ensayo de Gordon y Langley de 2003 es una extensión del estudio de Lebwohl del mismo año.
Los eventos adversos más comunes con este agente biológico son cefalea (14%), nasofaringitis (10%), síndrome seudogripal (8%), infecciones del tracto respiratorio superior (8%) y prurito (8%)14.
Los resultados de un estudio exploratorio en 11 pacientes con APs sometidos a dosis de 7,5mg semanales i.v. durante 3meses demostraron que este agente era seguro y bien tolerado. Además de mejorías en los índice clínicos, en el estudio se pudo comprobar que el fármaco conducía a notables reducciones en los recuentos linfocitarios y de macrófagos CD68 en la membrana sinovial16. En 2006, Mease et al publicaron los resultados de un ensayo aleatorizado, a doble ciego y controlado con placebo en el que se probó la eficacia y la seguridad de la combinación alefacept-metotrexato frente a metotrexato-placebo. A la semana 24, el 54% de la rama combinada alcanzó la respuesta ACR20, en comparación con el 23% en la rama metotrexato-placebo (p<0,001). Los pacientes de la rama combinada experimentaron una significativa reducción en el recuento de articulaciones dolorosas (–8 frente a –4,5; p=0,02) y en el recuento de tumefactas (–6,3 frente a –3,5; p=0,013). Los pacientes del grupo con alefacept obtuvieron mejores resultados en los desenlaces de dolor, función física (HAQ) y PASI. Los únicos efectos secundarios más frecuentes en el grupo combinado frente al grupo metotrexato-placebo fueron el aumento de la concentración de GPT (el 6 frente al 2%) y el dolor lumbar (el 6 frente al 3%). No se apreciaron infecciones graves ni tumores. En la fase de extensión abierta de este ensayo, los pacientes que alcanzaron respuestas ACR50 y 70 después de un segundo curso de tratamiento fueron el 32 y el 12%, respectivamente17,18. Hasta la fecha esta combinación no ha conseguido aprobación para su uso en APs.
AbataceptAbatacept (Orencia®, Bristol-Myers-Squibb) es una proteína humana de fusión compuesta por la parte extracelular del antígeno 4 asociado a los linfocitos T citotóxicos (CTLA-4, en inglés) y la fracción Fc de una inmunoglobulina tipo IgG1. La molécula establece un desplazamiento competitivo con el ligando CD28 de los LT por sus contrarreceptores en las CPA, CD80/86. El bloqueo de la interacción CD28-CD80/86 impide una de las señales de coactivación clave para los LT. También disminuye el pool de LT recirculantes a nivel cutáneo y sinovial, y secundariamente reduce la cascada inflamatoria (downstream effect)19. Recientemente Cañete et al han proporcionado una prueba de este concepto, quienes trataron un caso de poliartritis psoriásica resistente a agentes anti-TNF con esta molécula, y obtuvieron unos espectaculares resultados clínicos, artroscópicos e inmunohistoquímicos (tabla 3)20.
Resultados del tratamiento con abatacept en un caso de poliartritis psoriásica resistente20
| Visita basal | Visita 6 meses | |
| PASI | 16,9 | 4,8 |
| DAS 66/68 | 7,6 | 2,09 |
| Citocinas (pg/ml) | ||
| IL-6 | 35.362 | <1,2 |
| IFNγ | 3,1 | 0,2 |
| TNFα | 25,7 | 7,5 |
| IL-1β | 4,5 | 2,8 |
| Inmunohistoquímica | ||
| Vasos/mm2 | 112 | 83 |
| CD15/mm2 | 436 | 1 |
| CD68L/mm2 | 214 | 142 |
| CD68SL/mm2 | 859 | 139 |
| CD3/mm2 | 128 | 50 |
DAS: Disease Activity Score; IFN: interferón; IL: interleucina; PASI: Psoriasis Area and Severity Index.
Los resultados de este caso son la prueba de concepto de que abatacept interviene en un momento muy precoz de la cascada inflamatoria (downstream effect). La drástica caída en las concentraciones de IL-6 e IFNγ, así como la disminución en el número de neutrófilos y macrófagos, revela un potencial uso como biomarcadores de la respuesta a abatacept de estas citocinas y células.
No existe una dosis definida para abatacept en psoriasis o en APs, aunque en el caso citado anteriormente se usó el esquema habitual empleado en AR19,20.
En el aspecto dermatológico, sólo existe un estudio en fase I exploratorio de escalada de dosis publicado en 1999, en el que se emplearon cuatro infusiones del producto con análisis de los desenlaces a las 26 semanas. En ese estudio, 9 de los 11 pacientes que recibieron la dosis más alta (50mg/kg) de abatacept alcanzaron mejorías ≥50% en las medidas de desenlace. En la histología se apreciaron reducciones considerables en el número de LT infiltrantes, queratinocitos y células dendríticas, y disminución en el número y la tortuosidad de los vasos dérmicos21. A pesar de estos resultados, hasta la fecha no se han publicado ensayos en fases II y III con esta molécula en psoriasis.
En el campo de la APs, sólo disponemos de los datos de un estudio en fase II publicado como abstract en el Congreso Americano de Reumatología de este año, que resultan prometedores para un futuro uso de este agente en la APs (tabla 4).
Resultados de un ensayo en fase II de abatacept en artritis psoriásica (Mease P, et al Poster 1260. Philadelphia: ACR/ARHP annual scientific meeting; 2009)
| Desenlace | ABA 30/10mkp (n=43) | p | ABA 10mkp (n=40) | p | ABA 3mkp (n=45) | p | Placebo (n=42) |
| ACR20 | 42% | 0,022 | 48% | 0,006 | 33% | NS | 19% |
| Anti-TNF | |||||||
| No | 48% | 56% | 35% | 20% | |||
| Sí | 36% | 31% | 31% | 17% | |||
| TL50 | 30% | 33% | 36% | 17% | |||
| TL75 | 16% | 10% | 29% | 10% | |||
| HAQa | 35% | 45% | 36% | 19% | |||
ABA 30/10mkp: en este grupo se dio una dosis de 30mg/kg en el día 1, 30mg/kg en el día 15, y se siguió con 10mg/kg en el día 29, y después cada 4 semanas; las dosis se emplearon vía intravenosa con el esquema estándar: días 1, 15, 29, y luego cada 28 días; ABA: abatacept; ACR: American College of Rheumatology; Anti-TNF: exposición previa a estos agentes; en este caso las respuestas ACR20 fueron netamente mejores en los no expuestos a anti-TNF; HAQ: Health Assessment Questionnaire; TL: lesión diana ≥2cm; TL50/75: porcentaje de pacientes con una mejora del 50/75% desde la visita basal.
El desenlace primario en este estudio fue la respuesta ACR20 en el día 169.
Ustekinumab (Stelara®, Janssen-Cilag) es un nuevo anticuerpo monoclonal humano que se une con elevada afinidad a la subunidad común p40 de IL-12 e IL-23. Este anticuerpo neutraliza la bioactividad de estas citocinas bloqueando la interacción entre p40 y el receptor β1 de la IL-12 (IL-12Rβ1) presente en la membrana de los LT y las células NK, y consecuentemente reduce las señales proinflamatorias dependientes de esta vía de señalización. En suma, se trata de un agente que reduce las respuestas inmunitarias dependientes de Th1 y Th1722.
La dosificación habitual en psoriasis es de 45 o 90mg vía subcutánea (s.c.), según peso del paciente, en las semanas 0 y 4, y después cada 12 semanas22.
Hasta la fecha se han publicado dos ensayos en fase III (PHOENIX I y II) que han incluido cerca de 2.000 pacientes, con diseños similares. El ensayo PHOENIX I consistió en la administración s.c. de una dosis de 45 o 90mg de ustekinumab a las semanas 0 y 4, y luego cada 12 semanas. El estudio se realizó en tres fases: una fase controlada con placebo (semanas 0 a 12), una fase de tratamiento activo y cruzada a placebo (semanas 12 a 40), y una fase de retirada aleatorizada (semanas 40 a 76). El desenlace primario fue la repuesta PASI75 que lograron el 67% de los pacientes en ambas ramas de tratamiento activo, frente a un 3% del grupo placebo. El comienzo del efecto se apreció ya a las 2 semanas y alcanzó una máxima eficacia entre las semanas 20 y 24. El tiempo medio para perder la respuesta PASI75 en los retirados aleatoriamente fue de 15 semanas. No se comunicó efecto rebote tras la suspensión del fármaco. En PHOENIX II, los respondedores parciales a ustekinumab fueron realeatorizados en la semana 28 para mantener el régimen de tratamiento que tenían hasta ese momento o reducir el intervalo entre dosis a 8 semanas manteniendo la dosis que venían usando (45 o 90mg). Los resultados de este segundo ensayo fueron similares a los de PHOENIX I, con respuestas PASI75 en el 75,7 y el 66,7% en los grupos de 90 y 45mg, respectivamente23,24.
Los efectos adversos más comunes comunicados en ambos ensayos fueron síntomas del tracto respiratorio superior, cefaleas, artralgias, elevación transitoria de creatincinasa y linfocitopenia. Se comunicaron dos infecciones serias en el grupo ustekinumab 90mg, pero ningún caso de infección por micobacterias o agentes oportunistas23,24.
Este año, Gottlieb et al publicaron los resultados de un ensayo en fase II en pacientes con AP, en el que se asignó aleatorizadamente a 76 pacientes (grupo 1) a recibir cuatro dosis de 90mg s.c. de ustekinumab (semanas 0 a 12) seguidas de placebo (semanas 12 a 36), frente a 70 pacientes (grupo 2) aleatorizados a placebo (semanas 0 a 12) seguido de dos dosis de ustekinumab 90mg (semanas 12 a 36). El desenlace primario fue la respuesta ACR20 a la semana 12, aunque también se publicaron los resultados hasta la semana 36. Ustekinumab produjo un efecto rápido y sostenido en el grupo 1 que fue igualado por el grupo 2 a partir de la semana 12 hasta el final del seguimiento en la semana 3625. Los principales desenlaces de este estudio a la semana 12 se muestran en la tabla 5. De los resultados de este ensayo parece inferirse que este fármaco es eficaz en los dos esquemas de dosificación propuestos, aunque se precisa de los resultados de un estudio más ambicioso en fase III para establecer el esquema terapéutico estándar, así como evaluar la eficacia de este agente contra la progresión del daño estructural. El perfil de eventos adversos en este estudio fue similar al de los ensayos PHOENIX.
Resultados de un ensayo en fase II de ustekinumab en artritis psoriásica
| Desenlace | Grupo 1 (n=76), n (%) | Grupo 2 (n=70), n (%) | p |
| ACR20 | 32 (42) | 10 (14) | 0,0002 |
| ACR50 | 19 (25) | 5 (7) | 0,0038 |
| ACR70 | 8 (11) | 0 | 0,0055 |
| HAQ (cambio medio) | –0,25 | 0 | 0,0005 |
| PASI75 | 33/63 (52) | 3/55 (5) | <0,0001 |
| DLQI (cambio medio) | –6 | 0 | <0,0001 |
ACR: American College of Rheumatology; DLQI: Dermatology Life Quality Index; HAQ: Health Assessment Questionnaire; PASI: Psoriasis Area and Severity Index.
Los resultados corresponden a la fase doble-ciego (semanas 0 a 12). Grupo 1: rama activa. Grupo 2: rama placebo.
Los reumatólogos y dermatólogos deben familiarizarse con terapias biológicas distintas de los anti-TNF, puesto que no es raro que éstas pierdan eficacia con el tiempo y, además, den lugar a eventos adversos no deseados e incluso paradójicos (psoriasis de novo). En el momento actual, abatacept y ustekinumab se perfilan como alternativas válidas a los agentes anti-TNF convencionales para tratar los casos de psoriasis o APs en que los anti-TNF, ya sea por falta o pérdida de eficacia o por el perfil de los efectos secundarios, no sean la opción idónea. Ustekinumab ya está indicado para el tratamiento de la psoriasis moderada a severa y su perfil de eficacia se sitúa al mismo nivel (o incluso por encima) que los agentes anti-TNF. Los resultados de los ensayos en fase III en APs, actualmente en marcha, le darán su definitiva posición en el arsenal terapéutico de esta entidad. Igualmente, se espera un camino similar para abatacept. Por otra parte, dado que la AR y la APs comparten vías inflamatorias y de daño estructural comunes, no será extraño atisbar en el futuro próximo usos comunes de las nuevas terapias biológicas en ambas entidades.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.