El tratamiento de los pacientes con artritis reumatoide (AR) que presentan en forma concomitante infección crónica por el virus de la hepatitis B o el virus de la hepatitis C plantea un reto terapéutico debido a la posibilidad de que los tratamientos usados en la AR puedan agravar o reactivar la hepatitis, ya sea debido a hepatotoxicidad de los fármacos o al aumento de la replicación vírica con los inmunosupresores. El problema de la reactivación de la hepatitis ha surgido con mayor fuerza en los últimos 5 años con la publicación de diversos casos de reactivación de hepatitis B asociados al tratamiento con antifactor de necrosis tumoral. En el presente artículo se revisan ambos problemas, la hepatotoxicidad y el aumento de la replicación vírica, así como las estrategias más adecuadas para tratar a estos pacientes.
Treatment of patients with Rheumatoid Arthritis (RA) who also present a chronic infection by the hepatitis B or C virus represents a therapeutic challenge due to the possibility that treatments used for RA can aggravate or reactivate hepatitis, either due to the drugs hepatic toxicity or the increase in viral replication after immunosuppresive treatment. The problem of reactivation of hepatitis has assumed a larger importance in the past 5 years with the publication of several cases of reactivation of hepatitis B associated with anti-TNF therapy. In this article we revise both problems, hepatotoxicity and the increase of viral replication, as well as the better strategies to treat these patients.
El tratamiento de los pacientes con artritis reumatoide (AR) que presentan en forma concomitante infección crónica por el virus de la hepatitis B (VHB) o por el virus de la hepatitis C (VHC) plantea un reto terapéutico debido a la posibilidad de que los tratamientos usados en la AR puedan agravar o reactivar la hepatitis, ya sea debido a hepatotoxicidad de los fármacos o al aumento de la replicación vírica con los inmunosupresores. El problema de la reactivación de la hepatitis ha surgido con mayor fuerza en los últimos 5 años con la publicación de diversos casos de reactivación de hepatitis B (HB) asociados al tratamiento con anti-TNF (tumor necrosis factor ‘factor de necrosis tumoral’).
Ante un paciente con serología positiva de HB o hepatitis C (HC) los reumatólogos desean saber qué tratamientos de fondo se pueden usar con seguridad, cuáles son menos hepatotóxicos, cuáles son más seguros, qué fármacos pueden reactivar la hepatitis, si hay que tomar alguna medida preventiva antes de iniciar un tratamiento biológico y cuál es el seguimiento más adecuado para estos pacientes.
HepatotoxicidadEntre los fármacos antirreumáticos modificadores de la enfermedad (FAME) clásicos, los 2 más eficaces y con los que se suele iniciar el tratamiento de la AR, el metotrexato (MTX) y la leflunomida, son hepatotóxicos, por lo que no se recomiendan en los pacientes con serologías positivas de HB o de HC. La toxicidad hepática del MTX se estima entre el 6 y el 10% de los pacientes. Está contraindicado en pacientes con alcoholismo, hepatopatía alcohólica o hepatopatía crónica. La ficha técnica del MTX no lo contraindica en pacientes con serologías positivas de HB o HC pero hace una advertencia sobre su uso en estos pacientes. La hepatotoxicidad de la leflunomida también es bien conocida. En su ficha técnica viene contraindicada en casos de insuficiencia hepática y no se recomienda su uso en casos de serologías positivas de HB o de HC. Tanto el MTX como la leflunomida, debido a su perfil de seguridad, no se emplean en primera instancia en estos pacientes, al revés de lo que se hace con cualquier otro paciente con AR; pero, en caso de ser necesario, si sólo preocupara la posible hepatotoxicidad, se podrían usar con estricto control de enzimas hepáticas. Sin embargo, está el problema de la posible reactivación de la hepatitis (en especial de la HB) y las medidas que hay que adoptar para prevenirla, que se analizarán más adelante.
La posible hepatotoxicidad del resto de los FAME es mucho menos frecuente, sin embargo no siempre se va a poder controlar la enfermedad con ellos.
Los tratamientos biológicos de los que hoy se dispone son seguros desde el punto de vista de la hepatotoxicidad. No obstante, hay raros casos descritos de toxicidad hepática. Se ha descrito un caso de hepatitis granulomatosa no tuberculosa asociada a tratamiento con etanercept en una mujer con AR1. También se han publicado casos de granulomatosis pulmonar y cutánea en pacientes tratados con etanercept y con infliximab, así como casos de sarcoidosis y de enfermedad seudosarcoidea en pacientes tratados con etanercept. Han sido descritos varios casos de colestasis hepática y otros de hepatitis autoinmune inducida en pacientes tratados con infliximab2. La hepatitis autoinmune suele manifestarse desde los primeros meses hasta poco más de un año desde el inicio del tratamiento. Hay diversas hipótesis sobre el mecanismo de la hepatitis autoinmune que contemplan la pérdida de tolerancia contra el propio tejido hepático del paciente, donde el infliximab contribuiría al desarrollo de hepatitis autoinmune a través de la formación de autoanticuerpos antinucleares y antiácido desoxirribonucleico inducidos por el infliximab, o la posibilidad de que el bloqueo del TNF interfiera con la normal supresión de las células autorreactivas B por parte de los linfocitos T citotóxicos.
Reactivación de la hepatitisLas infecciones víricas crónicas pueden verse afectadas por los tratamientos inmunosupresores usados en las enfermedades reumáticas. Estas infecciones incluyen las producidas por el VHB, el VHC, el virus de la inmunodeficiencia humana (VIH), el virus de Epstein-Barr y el virus de la varicela zóster. El riesgo de reactivación de estas enfermedades debe estar presente cuando se decide iniciar un tratamiento inmunosupresor en estos pacientes3.
Se ha demostrado tanto in vivo como in vitro que los inmunosupresores aumentan la replicación vírica y pueden precipitar la exacerbación de una infección crónica por el VHB o el VHC. La mayoría de los datos disponibles de reactivación de hepatitis por inmunosupresores proceden de pacientes que recibieron inmunosupresión durante períodos limitados de tiempo debido a enfermedades hematológicas, principalmente linfoma, u otras neoplasias, en especial cáncer de mama. En estos pacientes, la frecuencia de reactivación de hepatitis tras quimioterapia es del 20 al 44% de los infectados por el VHB4. Se ha descrito reactivación de la HB en el 38% de los pacientes con los regímenes de quimioterapia que incluyen rituximab. También se ha descrito reactivación de la HC asociada a rituximab, pero con una frecuencia menor (aproximadamente del 3 al 4%)5. Sin embargo, no se ha descrito casos de reactivación de hepatitis asociada al rituximab en pacientes con AR o lupus eritematoso sistémico. Probablemente se deba a que la quimioterapia para el linfoma lleva asociados, además de rituximab, otros inmunosupresores y prednisona en dosis altas, y a que se ha tratado con rituximab a muy pocos pacientes reumáticos con hepatitis. Actualmente se realiza profilaxis con antivíricos análogos de los nucleótidos como la lamivudina, que ha demostrado su eficacia en reducir la frecuencia de reactivación de la HB tras quimioterapia6–9.
La reactivación de la hepatitis casi siempre ocurre tras la quimioterapia; sólo en ocasiones ocurre durante ésta. Esto es debido a que la hepatitis vírica es una enfermedad inmunomediada. El virus es hepatotropo pero no citotóxico. La citólisis hepática ocurre como consecuencia de la respuesta inmune del huésped frente a los hepatocitos infectados. Mientras el paciente está inmunosuprimido, esta respuesta no tiene lugar, pero en el momento en que tras la suspensión del tratamiento inmunosupresor, la respuesta inmune celular se restaura, tiene lugar una hiperrespuesta inmune dirigida contra los hepatocitos infectados, que es la que provoca la hepatitis. La clínica es variable: desde leves elevaciones asintomáticas de las aminotransferasas hasta citólisis masivas que dan lugar a hepatitis graves, fulminantes, con frecuente resultado de muerte o necesidad de trasplante hepático3,10,11.
Casi siempre ocurre en pacientes con HBsAg+ (hepatitis B surface antigen ‘antígeno de superficie del virus de la hepatitis B’), pero en ocasiones la reactivación de la HB tiene lugar en pacientes con infecciones ocultas de hepatitis. Estos pacientes presentan una serología idéntica a una infección por el VHB pasada, resuelta. Sin embargo, pese a no presentar antígeno de superficie, se detecta ácido desoxirribonucleico (ADN) vírico en sangre o en el tejido hepático de estos pacientes con infección oculta. La frecuencia de estas infecciones ocultas por el VHB es rara, inferior al 5% de los donantes sanos de sangre.
En las enfermedades reumáticas ha habido pocos casos de reactivación de hepatitis asociada a los inmunosupresores clásicos. Se ha descrito reactivación de HB en 6 pacientes con AR tras la suspensión del tratamiento con MTX, en 3 de ellos con resultado de fallecimiento y en otro con necesidad de trasplante hepático10,12–14. También hay casos anecdóticos de reactivación de HB tras tratamiento con dosis elevadas de corticoides y tras ciclofosfamida en pacientes con conectivopatías, y casos aislados en pacientes con AR en tratamiento con azatioprina, sulfasalazina o hidroxicloroquina. Sin embargo, la ciclosporina tiene propiedades antivíricas. Se ha demostrado tanto in vivo como in vitro que la ciclosporina es capaz de inhibir la replicación del VHC. Por sus efectos inmunosupresores y antivíricos, se ha usado en pacientes con trasplante hepático debido a HC crónica15.
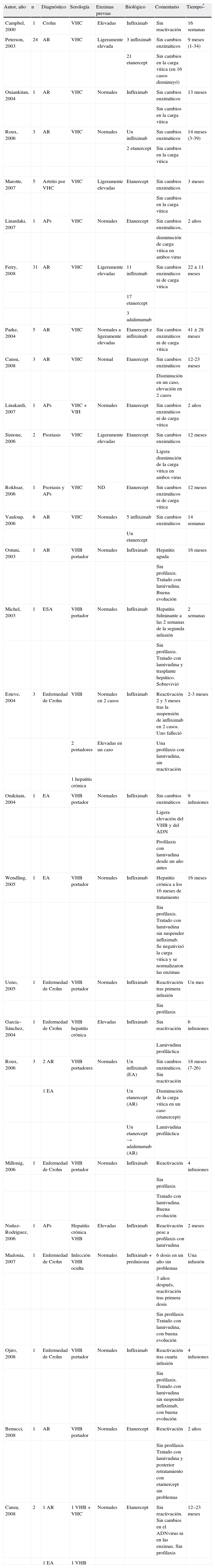
En los últimos 4 o 5 años han surgido diversos casos de reactivación de HB en pacientes tratados con infliximab debido a distintas enfermedades reumáticas y a enfermedad de Crohn (tabla 1)16–30. La experiencia que hay con anti-TNF en pacientes con HB es escasa, y se limita a publicaciones de casos aislados y series de pocos casos, incluidos, en total, una veintena de pacientes; en 12 de ellos hubo reactivación de la hepatitis. La mayoría de los casos ocurrieron en pacientes en tratamiento con infliximab y casi siempre la reactivación tuvo lugar antes de la cuarta infusión. En algún caso la hepatitis fue fulminante con resultado de fallecimiento del paciente. No obstante, en otros casos se administró tratamiento antivírico sin suspender el anti-TNF, con lo que se consiguió normalizar las enzimas hepáticas y la carga vírica. Entre los pacientes que presentaron reactivación de la HB, la mayoría eran pacientes en estado de portación crónica del virus, pero también hubo alguno con hepatitis crónica y otros con infección oculta por el VHB. Hay que destacar que la mayoría de los pacientes en los que se reactivó la hepatitis no hacía profilaxis con lamivudina, mientras que sí la hacía la mayoría de aquéllos en los que la hepatitis no se reactivó. Sólo ha habido un caso de reactivación de la HB en un paciente en tratamiento con etanercept y ningún caso en pacientes en tratamiento con adalimumab, rituximab o abatacept. Tal vez la mayor frecuencia de reactivación de HB tras tratamiento con infliximab y el hecho de que ocurra casi siempre antes de la cuarta infusión se deban al esquema de periodicidad del tratamiento. Entre la tercera y la cuarta dosis pasan 8 semanas (un tiempo superior al de las dosis anteriores), y este tiempo bastaría para que la respuesta inmune celular se restaure lo suficiente como para provocar la hepatitis. Es posible que el menor tiempo entre dosis del resto de anti-TNF se relacione con la menor casuística de reactivación de HB.
Casos de virus de hepatitis C y virus de hepatitis B tratados con antifactor de necrosis tumoral
| Autor, año | n | Diagnóstico | Serología | Enzimas previas | Biológico | Comentario | Tiempo* |
| Campbel, 2000 | 1 | Crohn | VHC | Elevadas | Infliximab | Sin reactivación | 16 semanas |
| Peterson, 2003 | 24 | AR | VHC | Ligeramente elevada | 3 infliximab | Sin cambios enzimáticos | 9 meses (1-34) |
| 21 etanercept | Sin cambios en la carga vírica (en 16 casos disminuyó) | ||||||
| Oniankitan, 2004 | 1 | AR | VHC | Normales | Infliximab | Sin cambios enzimáticos | 13 meses |
| Sin cambios en la carga vírica | |||||||
| Roux, 2006 | 3 | AR | VHC | Normales | Un infliximab | Sin cambios enzimáticos | 14 meses (3-39) |
| 2 etanercept | Sin cambios en la carga vírica | ||||||
| Marotte, 2007 | 5 | Artritis por VHC | VHC | Ligeramente elevadas | Etanercept | Sin cambios enzimáticos | 3 meses |
| Sin cambios en la carga vírica | |||||||
| Linardaki, 2007 | 1 | APs | VHC | Normales | Etanercept | Sin cambios enzimáticos, | 2 años |
| disminución de carga vírica en ambos virus | |||||||
| Ferry, 2008 | 31 | AR | VHC | Ligeramente elevadas | 11 infliximab | Sin cambios enzimáticos ni de carga vírica | 22 ± 11 meses |
| 17 etanercept | |||||||
| 3 adalimumab | |||||||
| Parke, 2004 | 5 | AR | VHC | Normales a ligeramente elevadas | Etanercept e infliximab | Sin cambios enzimáticos ni de carga vírica | 41 ± 28 meses |
| Cansu, 2008 | 3 | AR | VHC | Normal | Etanercept | Sin cambios enzimáticos | 12-23 meses |
| Disminución en un caso, elevación en 2 casos | |||||||
| Linakardi, 2007 | 1 | APs | VHC + VIH | Normales | Etanercept | Sin cambios enzimáticos ni de carga vírica | 2 años |
| Simone, 2006 | 2 | Psoriasis | VHC | Ligeramente elevadas | Etanercept | Sin cambios enzimáticos | 12 meses |
| Ligera disminución de la carga vírica en ambos virus | |||||||
| Rokhsar, 2006 | 1 | Psoriasis y APs | VHC | ND | Etanercept | Sin cambios enzimáticos ni de carga vírica | 12 meses |
| Vauloup, 2006 | 6 | AR | VHC | Normales | 5 infliximab | Sin cambios enzimáticos | 14 semanas |
| Un etanercept | |||||||
| Ostuni, 2003 | 1 | AR | VHB portador | Normales | Infliximab | Hepatitis aguda | 16 meses |
| Sin profilaxis. Tratado con lamivudina. Buena evolución | |||||||
| Michel, 2003 | 1 | ESA | VHB portador | Normales | Infliximab | Hepatitis fulminante a las 2 semanas de la segunda infusión | 2 semanas |
| Sin profilaxis. Tratado con lamivudina y trasplante hepático. Sobrevivió | |||||||
| Esteve, 2004 | 3 | Enfermedad de Crohn | VHB | Normales en 2 casos | Infliximab | Reactivación 2 y 3 meses tras la suspensión de infliximab en 2 casos. Uno falleció | 2-3 meses |
| 2 portadores | Elevadas en un caso | Una profilaxis con lamivudina, sin reactivación | |||||
| 1 hepatitis crónica | |||||||
| Onikitain, 2004 | 1 | EA | VHB portador | Normales | Infliximab | Sin cambios enzimáticos | 9 infusiones |
| Ligera elevación del VHB y del ADN | |||||||
| Profilaxis con lamivudina desde un año antes | |||||||
| Wendling, 2005 | 1 | EA | VHB portador | Normales | Infliximab | Hepatitis crónica a los 16 meses de tratamiento | 16 meses |
| Sin profilaxis. Tratado con lamivudina sin suspender infliximab. Se negativizó la carga vírica y se normalizaron las enzimas | |||||||
| Ueno, 2005 | 1 | Enfermedad de Crohn | VHB portador | Normales | Infliximab | Reactivación tras primera infusión | Un mes |
| Sin profilaxis | |||||||
| García–Sánchez, 2004 | 1 | Enfermedad de Crohn | VHB hepatitis crónica | Elevadas | Infliximab | Sin reactivación | 6 infusiones |
| Lamivudina profiláctica | |||||||
| Roux, 2006 | 3 | 2 AR | VHB portadores | Normales | Un infliximab (EA) | Sin cambios enzimáticos. Sin reactivación | 18 meses (7-26) |
| 1 EA | Un etanercept (AR) | Disminución de la carga vírica en un caso (etanercept) | |||||
| Un etanercept → adalimumab (AR) | Lamivudina profiláctica | ||||||
| Millonig, 2006 | 1 | Enfermedad de Crohn | VHB portador | Normales | Infliximab | Reactivación | 4 infusiones |
| Sin profilaxis | |||||||
| Tratado con lamivudina. Buena evolución | |||||||
| Nuñez-Rodríguez, 2006 | 1 | APs | Hepatitis crónica VHB | Elevadas | Infliximab | Reactivación pese a profilaxis con lamivudina | 2 meses |
| Madonia, 2007 | 1 | Enfermedad de Crohn | Infección VHB oculta | Normales | Infliximab + prednisona | 6 dosis en un año sin problemas | Una infusión |
| 3 años después, reactivación tras primera dosis | |||||||
| Sin profilaxis Tratado con lamivudina, con buena evolución | |||||||
| Ojiro, 2008 | 1 | Enfermedad de Crohn | VHB portador | Normales | Infliximab | Reactivación tras cuarta infusión | 4 infusiones |
| Sin profilaxis. Tratado con lamivudina sin suspender infliximab, con buena evolución | |||||||
| Benucci, 2008 | 1 | AR | VHB portador | Normales | Etanercept | Reactivación | 2 años |
| Sin profilaxis Tratado con lamivudina y posterior retratamiento con etarnercept sin problemas | |||||||
| Cansu, 2008 | 2 | 1 AR | 1 VHB + VHC | Normales | Etanercept | Sin reactivación. Sin cambios en el ADNvirus ni en las enzimas. Sin profilaxis | 12–23 meses |
| 1 EA | 1 VHB |
ADN: ácido desoxirribonucleico; AR: artritis reumatoide; APs: artritis psoriásica; EA: espondilitis anquilosante; ESA: enfermedad de Still del adulto; ND: dato no disponible; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C.
La experiencia con anti-TNF en pacientes con HC también se limita a series de casos pero, en conjunto, todas ellas abarcan cerca de un centenar de pacientes tratados con infliximab, etanercept o adalimumab, y con períodos de seguimiento de hasta 3 años y medio. No hay ensayos clínicos pero hay series algo mayores que en el caso de la HB, de hasta 24 o 31 pacientes, alguna de ellas con datos parcialmente prospectivos19,31–37. Las conclusiones de todas estas series son unánimes en el sentido de que el tratamiento con anti-TNF no estuvo seguido de elevación significativa de carga vírica ni de las enzimas hepáticas. Al contrario, lo que describen frecuentemente es disminución de carga vírica con el tratamiento. Aunque en algún paciente hubo aumento de viremia, ésto no se acompañó de aumento de enzimas hepáticas. Incluso se ha llevado a cabo un estudio con etanercept dado como coadyuvante al interferón (IFN) y a la ribavarina en pacientes con HC crónica38 y se vio que el etanercept mejoraba la respuesta de los antivíricos. El 63% de los pacientes tratados durante 24 semanas con etanercept, además de IFN y ribavarina consiguieron negativizar la carga vírica en contraste con sólo el 32% del grupo que no utilizó el anti-TNF. También el porcentaje de pacientes que normalizó las enzimas hepáticas fue mayor entre los que llevaron etanercept como tratamiento coadyuvante. Los datos disponibles apoyan que la infección crónica por el VHC no contraindica el uso de anti-TNF.
Historia natural de la hepatitis y mecanismos de reactivaciónPara entender por qué se reactiva la HB y no lo hace la HC con los anti-TNF conviene repasar la historia natural de ambas infecciones víricas y entender por cuáles mecanismos se elimina el virus del organismo39,40.
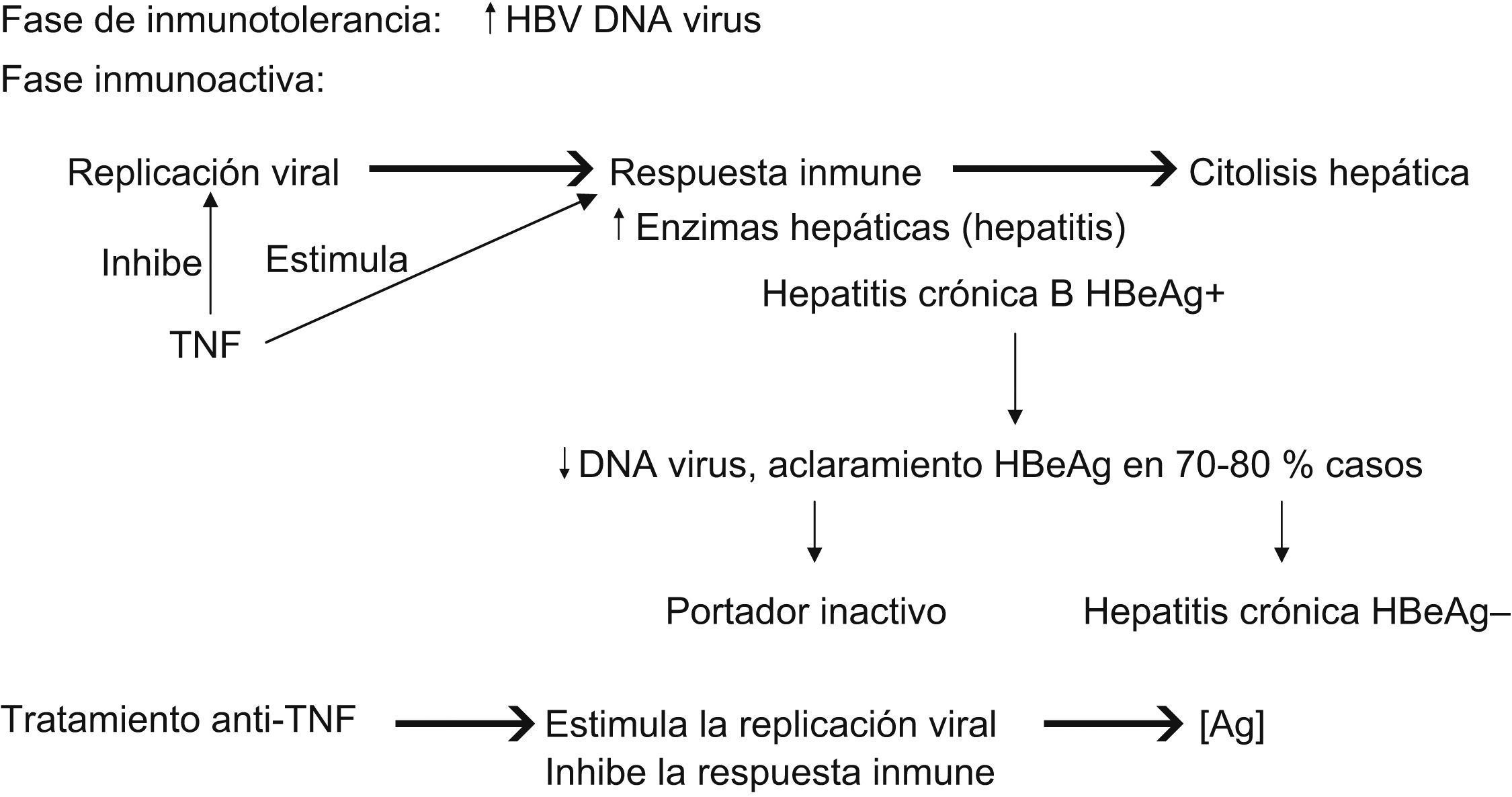
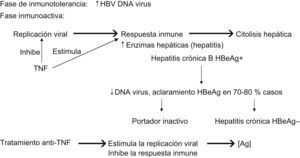
El VHB es un ADN virus hepatotropo que infecta los hepatocitos pero no provoca la citólisis hepática. Es la respuesta inmune celular del huésped frente a los hepatocitos infectados lo que provoca la citólisis hepática. En el 95% de los infectados, la infección se resuelve en esta fase aguda y se consigue negativizar el HBsAg, lo que es seguido de la detección de anticuerpo contra el antígeno de superficie del virus de la hepatitis B (anti-HBs) inmunoglobulina M. Este proceso suele durar de 4 a 6 meses. Sólo en el 5% de los casos la infección se vuelve crónica. La HB se considera crónica cuando la presencia del HBsAg perdura por más de 6 meses. Se reconocen varias fases dentro de la infección crónica por el VHB. La presencia del antígeno e de la HB (HBeAg) se relaciona con la infectividad. En una primera fase, llamada de inmunotolerancia, hay presencia de ADN vírico en sangre pero no hay elevación de aminotransferasas ni lesión histológica hepática. Esta fase puede durar años en las infecciones transmitidas durante el período neonatal (que son la mayoría en los países endémicos), pero dura poco en las infecciones de la edad adulta, más frecuentes en nuestro medio. Esta fase va seguida de una segunda fase de inmunoactividad en la que el aumento de la replicación vírica va seguido de una respuesta inmune que provoca la citólisis hepática y la elevación consiguiente de enzimas hepáticas. El objetivo de esta respuesta inmune es aclarar el HBeAg con aparición del anti-HBe: la denominada seroconversión del antígeno “e”, lo que se consigue entre el 70 y el 80% de los casos. Cuando esto ocurre, el paciente puede quedar como portador crónico de HBsAg del VHB, con HBeAg (−), enzimas hepáticas normales, daño histológico escaso o nulo en la biopsia hepática y pocas copias de ADN vírico en sangre (<105/l) o bien puede presentar hepatitis crónica con HBeAg (−), con persistencia de ADN vírico en mayor cantidad (>105/l), enzimas hepáticas persistentemente elevadas y daño hepático histológico (necroinflamación). En caso de no producirse la seroconversión «e», el paciente queda con hepatitis crónica HBeAg (+) (fig. 1).
Las principales citocinas implicadas en el aclaramiento del virus B son el TNF y el IFN. El TNF inhibe la replicación vírica y estimula la respuesta inmune a fin de eliminar el virus. Pero, a diferencia del IFN, que elimina el virus pero deja intacto el hepatocito, el TNF lo hace produciendo necrosis celular. Hay un equilibrio estrecho entre ambas citocinas (de mecanismo no muy bien conocido) que cuando se pierde empeora el aclaramiento vírico. Al inhibir el TNF con fármacos se estimula la replicación vírica pero, a la vez, se inhibe la respuesta inmune. Con esto cada vez hay mayor carga vírica, más hepatocitos infectados pero sin oposición inmune. Al suspender el tratamiento, en cuanto se restaura la respuesta inmune se produce la hepatitis, a menudo fulminante debido a la alta concentración de hepatocitos infectados.
En la HC, a diferencia de lo que ocurre en la HB, la infección se vuelve crónica en la mayoría de los casos (más del 80%). Ahí la principal citocina implicada en el aclaramiento vírico es el IFN. El TNF no parece afectar la replicación vírica, pero sí tiene acción sobre el IFN, lo inhibe y, como consecuencia, disminuye el aclaramiento vírico. Se ha visto que cifras elevadas de TNF en sangre se asocian a peor respuesta al IFN y a mayores recidivas de la HC, mientras que aquellos pacientes que responden mejor al IFN son aquellos que tienen cifras de TNF más bajas en sangre. Se ha demostrado que la inhibición del TNF estimula la producción del IFN y se consiguen respuestas más sostenidas al IFN como tratamiento. Por tanto, cuando se da un tratamiento anti-TNF probablemente se favorezca la eliminación del virus.
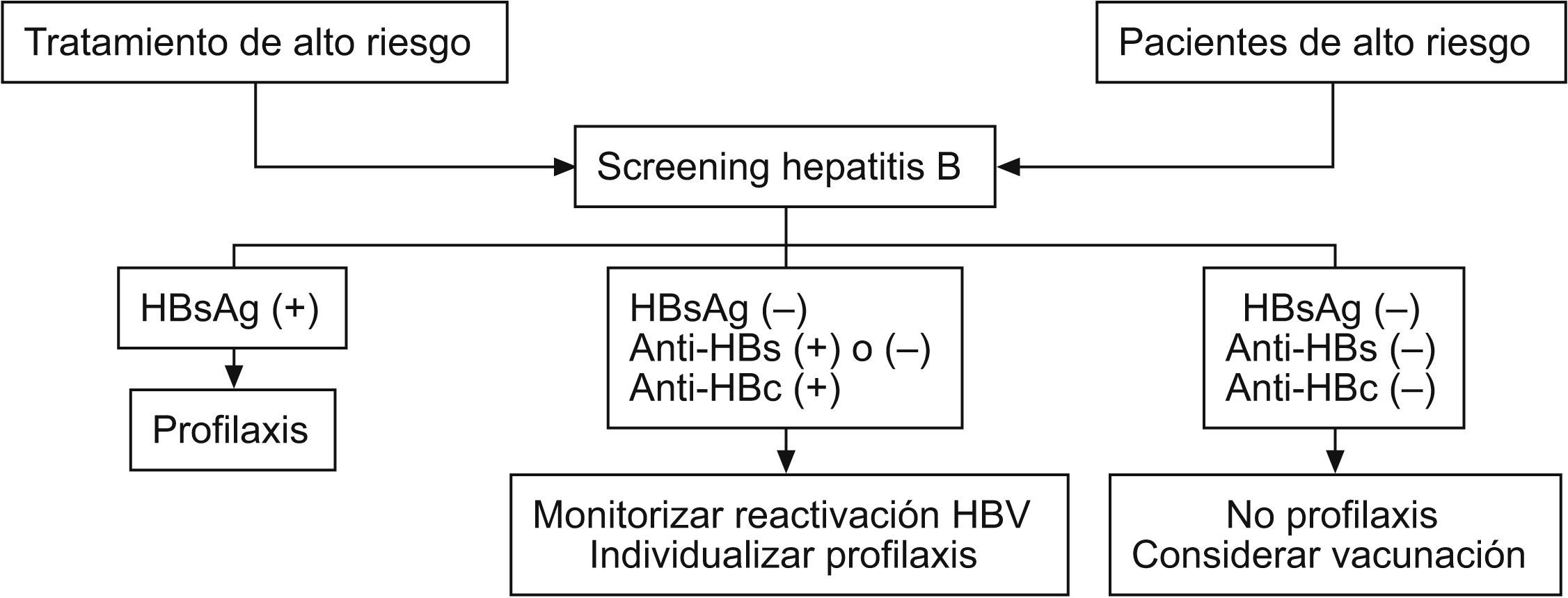
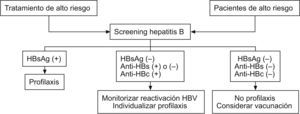
Estrategias de prevención de la hepatitisCalabrese et al publicaron en 200610 unas estrategias de prevención de reactivación de HB en pacientes con enfermedades reumáticas. No es una guía de práctica clínica, sino estrategias de prevención. Consideran la existencia de pacientes de alto riesgo y fármacos de alto riesgo de reactivación de la HB. Son pacientes de alto riesgo los siguientes: los nacidos en áreas endémicas, los adictos a drogas intravenosas, los que realizan hemodiálisis, los que mantienen relaciones homosexuales masculinas, los infectados por el VIH, y los que tienen contacto familiar o sexual con infectados por el VHB. Consideran como fármacos de alto riesgo a todos los inmunosupresores en general y, en concreto, mencionan los anti-TNF, el MTX y la leflunomida. Recomiendan hacer detección sistemática de HB a todo paciente de alto riesgo y a todo el que vaya a recibir un tratamiento de alto riesgo.
En caso de detectar serología positiva de HB, los autores proponen realizar profilaxis antivírica a todos los pacientes con HBsAg (+). Si el HBsAg era negativo, pero con anti-HBs o anti-HBc (hepatitis B core antigen 'antígeno core del virus de la hepatitis B') positivos proponen monitorizar serologías por si se trata de una infección oculta, e individualizar profilaxis. En caso de que antígeno y anticuerpos fueran negativos, proponen considerar la vacunación (fig. 2).
Teniendo en cuenta la cronicidad de las enfermedades reumáticas y que es muy factible que en un momento u otro de la enfermedad el paciente reciba uno de los fármacos de alto riesgo, puede plantearse la vacunación contra la HB en el momento del diagnóstico en todos los pacientes si la serología es negativa. Sin embargo, habría que tener en cuenta que la probabilidad de infección de HB en un paciente que no sea de alto riesgo y en edad adulta, es muy baja. Tal vez se podría considerar la propuesta de Calabrese en aquellos pacientes de alto riesgo de infección (adicción a drogas por vía parenteral, hemodiálisis, contactos familiares o sexuales con infectados, homosexualidad masculina, etc.). Para el resto de la población no haría falta vacunación en la edad adulta. Además, las políticas de vacunación contra HB al nacimiento y en la adolescencia (edades de mayor riesgo) se realizan desde hace más de 15 años, por lo que en el futuro toda la población adulta estará vacunada.
En el año 2006, Nathan et al41 publicaron unas recomendaciones para el uso de anti-TNF en pacientes con HB y con HC. Son parecidas a las estrategias de Calabrese para la prevención de HB en enfermedades reumáticas, pero aquí se centran en los anti-TNF y se concretan pautas para seguir (guía de práctica clínica). Consideran de primordial importancia realizar detección sistemática de HB y de HC a todo paciente que fuera a recibir anti-TNF. Recomiendan realizar carga vírica y determinación de alanina-aminotransferasa en aquellos pacientes con serologías positivas para el virus B. Como profilaxis proponen 2 opciones: la primera consiste en tratar con 100 mg/día de lamivudina a todos los pacientes con HBsAg (+). El tratamiento debe comenzar una o 2 semanas antes de iniciar el anti-TNF y mantenerse durante todo el tiempo que éste dure y hasta 3 meses después de su suspensión. La segunda opción consiste en no tratar a todos los pacientes con HBsAg (+) y en su lugar monitorizar las enzimas hepáticas y la carga vírica. Si éstas aumentan, entonces se debe iniciar la profilaxis con lamivudina. En los pacientes con HBsAg (−) pero con anti-HBs (+) o anti-HBc (+), proponen monitorizar la serología por si se positiviza el HBsAg y, si esto ocurre, se debe iniciar tratamiento con lamivudina. Se detectaría una infección oculta en reactivación. El esquema de monitorización que proponen es de enzimas mensuales, hasta 3 meses después de finalizar el tratamiento y ADN vírico en los HBsAg (+) que no realicen profilaxis.
Ante un paciente con serología positiva para HC, Nathan et al recomiendan determinar carga vírica y enzimas, pero ahí no hay profilaxis posible. Proponen monitorización de enzimas hepáticas mensualmente durante todo el tiempo que dure el tratamiento anti-TNF y hasta 3 meses después.
Probablemente la monitorización mensual de enzimas hepáticas que proponen Nathan et al sea un poco exagerada, sobre todo en el caso de la HC. Es posible que pasados los primeros meses de tratamiento estos controles se puedan distanciar a cada 2 o 3 meses. Al suspender el fármaco, sería conveniente realizar una monitorización más estrecha, mensual, hasta 3 meses después, debido al riesgo incrementado de reactivación de la hepatitis en este momento.
La lamivudina ha demostrado ser eficaz en la reducción de la frecuencia de reactivación de la HB en los pacientes que reciben inmunosupresores6-9,42. Es segura, bien tolerada y su efecto es rápido. El principal problema que plantea la profilaxis con lamivudina es que si se administra durante largos períodos de tiempo se crean resistencias y, a diferencia de los pacientes neoplásicos que reciben quimioterapia durante períodos limitados de tiempo, el tratamiento de los pacientes con AR es de larga duración. El virus sufre una mutación, YMDD, que le confiere resistencia a la lamivudina. Esto ocurre en más del 50% de los pacientes a los 4 años de tratamiento y en más del 70% de los pacientes a los 5 años de tratamiento. Cuando esto ocurre (se detecta porque aparece elevación de enzimas hepáticas) hay que cambiar de antivírico. Actualmente se administra adefovir dipivoxil, con menores resistencias pero que tiene el inconveniente de ser más lento (tarda meses en hacer efecto), por lo que hay que asociarlo un tiempo y posteriormente suspender la lamivudina. Otra preocupación con respecto a la profilaxis antivírica con lamivudina es la posibilidad de reactivación de la hepatitis al suspenderla, por lo que también se deben monitorizar las enzimas hepáticas del paciente varios meses tras la suspensión9.
En poco tiempo han surgido diversos antivíricos para tratar la HB, pero de momento no han demostrado su eficacia como profilaxis. La telbivudina, el tenofovir y el entecovir son los nuevos antivíricos que probablemente sustituirán a la lamivudina y el adefovir. El mundo de los antivíricos es muy amplio y cambia rápidamente, por lo que es aconsejable contactar con el hepatólogo en cuanto a la decisión del mejor tratamiento antivírico para la profilaxis de reactivación de HB en estos pacientes.
ConclusionesEn los pacientes con serologías de HB o HC no se recomiendan el MTX ni la leflunomida debido a hepatotoxicidad y riesgo de reactivación de HB. La sulfasalazina, los antipalúdicos, la ciclosporina y la azatioprina son opciones más seguras, pero no siempre puede controlarse la enfermedad con ellos. Por sus propiedades antivíricas, la ciclosporina es además una buena opción en los pacientes con HC. Con respecto a los fármacos biológicos, la experiencia con los anti-TNF demuestra que hay riesgo de reactivación de la HB crónica, riesgo que parece disminuir o desaparecer si se realiza profilaxis con antivíricos como la lamivudina. Dadas la gravedad y las potencialmente graves consecuencias de la reactivación de la HB, se debe ser prudentes en la indicación de estos fármacos en pacientes con HBsAg (+) y, en caso de ser necesarios, usarlos con las medidas de profilaxis y monitorización recomendadas. La infección crónica por el VHC no parece contraindicar el tratamiento con anti-TNF. Con todo, haría falta series más amplias y ensayos clínicos aleatorizados que también incluyeran datos histológicos para poder hacer esta aseveración con seguridad. Con respecto al resto de los fármacos biológicos, la experiencia en pacientes con hepatitis víricas es prácticamente nula, por lo que habrá que ser muy cautos antes de usarlos en estas situaciones y, en caso de ser necesario, mantener las mismas precauciones que con los anti-TNF.