El tratamiento de las vasculitis sistémicas ha experimentado cambios sustanciales en los últimos años. La ciclofosfamida sigue teniendo un papel crucial en la inducción de remisión en formas severas, reduciendo considerablemente la mortalidad. Sin embargo, su empleo conlleva una importante toxicidad a largo plazo y el acúmulo de morbilidad derivada de un control subóptimo del proceso. Se han desarrollado estrategias para limitar la exposición al fármaco y minimizar su toxicidad, como son el uso de pulsos endovenosos como alternativa a la vía oral y la estrategia secuencial. Tanto para inducir remisión en casos no severos como para el mantenimiento de remisión se preconiza el empleo de inmunosupresores alternativos, como son el metotrexate, la azatioprina o la leflunomide. En determinadas situaciones con compromiso vital puede recurrirse a opciones como la plasmaféresis o las inmunoglobulinas endovenosas. Las terapias biológicas suponen una alternativa prometedora, si bien su empleo actual debe restringirse a los casos refractarios.
The treatment of systemic vasculitis has undergone important changes in recent years. Cyclophosphamide still plays a crucial role in the induction of remission in severe forms, reducing the mortality. However, its use entails a significant long-term toxicity and the accumulation of damage resulting from a sub-optimal control of the process. Strategies has been developed to limit exposure to the drug and minimize its toxicity, such as using intravenous pulses as an alternative to oral administration and a sequential strategy. Both induce remission in less severe cases and work also for the maintenance of remission; the use of alternative immunosuppressants, such as methotrexate, azathioprine or leflunomide has been advocated. In life-threatening situations, options such as plasmapheresis or intravenous inmunoglobulins are available. Biologic therapies are a promising alternative, but their use must be limited for now to refractory cases.
Las vasculitis necrotizantes sistémicas constituyen un grupo heterogéneo de procesos que se definen por inflamación y necrosis de la pared vascular acompañada o no de infiltrados inflamatorios en los tejidos circundantes. Las vasculitis anticuerpos anticitoplasma de neutrófilo (ANCA)-asociadas (VAA) suponen el subgrupo cuantitativamente más importante, caracterizado por la afectación de pequeño vaso y la presencia de autoanticuerpos dirigidos contra antígenos del citoplasma de los neutrófilos (los llamados ANCA), con especificidad frente a mieloperoxidasa (MPO) o proteinasa 3 (PR3)1.
Aunque no son enfermedades frecuentes, tampoco deben considerarse como excepcionales2. Así, en un área bien definida del noroeste de nuestro país, la incidencia anual resultó de 2,95/106 para la granulomatosis de Wegener (GW) y 7,91/106 para la poliangeítis microscópica (PAM)3. A pesar de que la mortalidad ha mejorado sustancialmente, aún supera la de la población general4, variando del 0 al 27,4% en los distintos ensayos clínicos aleatorizados realizados hasta la fecha.
En este artículo, que no pretende ser una revisión sistemática, nos centraremos sobre todo en las VAA, por ser las vasculitis necrotizantes sistémicas más frecuentes y por constituir el grupo donde se han concentrado la mayoría de los ensayos clínicos recientes. Si bien es cierto que casi todos ellos se han realizado en la GW, también lo es que la mayoría de los principios terapéuticos son aplicables a todas las VAA, particularmente en el escenario de enfermedad multisistémica severa.
Tratamiento clásicoEl tratamiento convencional de estas patologías, consistente en el uso conjunto de ciclofosfamida (CFM) y glucocorticoides (GC), lleva en vigor más de treinta años. Se trata de un tratamiento remarcablemente eficaz cuya introducción, en los años 70 por Wolfe y Fauci, supuso la transformación de estas enfermedades, antes uniformemente letales, en procesos crónicos recidivantes5.
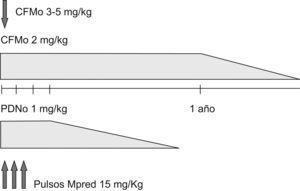
El régimen, al que nos referiremos aquí como régimen clásico, consiste en la administración de CFM por vía oral (CFMo) en dosis de 2mg/kg (pudiendo usarse de 3 a 5mg/kg los primeros días en casos particularmente severos), dosis que se mantiene un año una vez lograda la remisión, procediéndose entonces al «tapering» (reducción progresiva de dosis) hasta su retirada en unos 6 meses (fig. 1). La respuesta inicial suele producirse a las 2-4 semanas y la remisión en 2-3 meses, aunque puede demorarse hasta 6 meses. Si la respuesta se juzga insatisfactoria, la dosis de CFM se puede incrementar de 25 en 25mg hasta un máximo de 200mg, siendo el factor limitante la leucopenia (un evento que se debe evitar, más que un objetivo). La CFM se acompaña de GC (prednisona 1mg/kg o su equivalente), que se mantienen durante un mes (el llamado período «ventana» de la CFM), procediéndose al tapering en aproximadamente 6-12 meses, aplicando la conversión precoz a días alternos. Con esta terapia se alcanza la remisión en más del 80% de los casos.
Tratamiento clásico. Tras un año de inducción con ciclofosfamida por vía oral (CFMo) se procede al tapering (disminución progresiva de dosis). La prednisona se administra durante 4 semanas a dosis plena y se procede al tapering. En casos muy severos, se intensifica el régimen al inicio: CFMo (3–5/mg/día) 2–5 días y tres pulsos de metilprednisolona (15mg/kg). CFMo: ciclofosfamida por vía oral; Mpred: metilprednisolona; PDN: prednisona.
La auténtica contribución de Wolfe y Fauci en los NIH (National Institutes of Health) norteamericanos fue el empleo de una quimioterapia para una enfermedad no neoplásica, inicialmente en la GW y posteriormente en el resto de las vasculitis sistémicas. A pesar de tratarse de la terapia estándar, el nivel de evidencia que sustenta la eficacia de la CFM en estos procesos es limitado y viene establecido por estudios observacionales. Los trabajos iniciales de los NIH mostraron que si se añadía CFM, la mortalidad de los pacientes con GW descendía, comparando con cohortes históricas, del 50 al 20%. Estos resultados son extensibles a la PAM y a otras vasculitis sistémicas severas. Así, en un estudio realizado con PAM, el riesgo relativo (RR) de muerte resultó de 5 si solamente se habían empleado GC6. Este mismo grupo concluye, en otro estudio, que el RR de resistencia al tratamiento es menor (0,43 según sus datos) cuando se emplea CFM además de GC7. Por otra parte, el uso de CFM para inducir remisión reduce sustancialmente la probabilidad de daño orgánico, de tal forma que cuanto más tiempo esté el paciente con CFM en los primeros seis meses de tratamiento, menor es la probabilidad de que se ocasione daño irreversible8.
De manera que podemos concluir que el uso de un agente alquilante de alta toxicidad parece plenamente justificado en una proporción sustancial de pacientes con vasculitis sistémicas necrotizantes severas, para las que la CFM es aún el tratamiento estándar, como así se recomienda en las recientes directrices de European League Against Rheumatism (EULAR)9.
Limitaciones del tratamiento clásicoSin embargo, pronto se hizo evidente que el uso conjunto a largo plazo de CFM y GC conllevaba un importante acúmulo de morbilidad, derivado tanto de la toxicidad de los fármacos como del daño asociado a un control subóptimo de la enfermedad. A pesar del tratamiento, el daño acumulado es frecuente y se presenta precozmente, pudiendo llegar a afectar a entre un 66 y un 89% de los pacientes al año del diagnóstico10–12. La toxicidad asociada al tratamiento clásico queda patente si analizamos los resultados de dos cohortes monocéntricas de GW, más o menos coetáneas y de similar severidad, que han publicado sus seguimientos a largo plazo. La cohorte del grupo de los NIH, paradigma del régimen terapeútico clásico (al menos un año de CFM tras remisión), con un proporción de uso de CFM del 92%, comunica un porcentaje de morbilidad atribuible al tratamiento del 42%13. Por otro lado, el grupo de Wolfgaang Gross, el German Vasculitis Center, ha llevado a cabo un protocolo de tratamiento adaptado al grado de actividad y extensión, con cambio a mantenimiento con otro inmunosupresor una vez obtenida la remisión con CFMo. En total, un 89% de los pacientes fueron sometidos a tratamiento con CFMo14. Ambas cohortes coinciden en un porcentaje alto de infección así como de neoplasias que se producen de forma tardía (tabla 1). Es claro que en los pacientes tratados con CFMo se duplica el riego de neoplasia, la complicación tardía más temible de esta terapia. Particularmente acusado resulta el incremento del RR de carcinoma de vejiga (entre 9 y 45) y de linfoma (11), con evidente relación dosis-respuesta. En este sentido, una dosis acumulada de CFM inferior a 35g parece segura15–17.
Toxicidad de la ciclofosfamida vía oral*
| Groos 2000 | NIH 1992 | |
| Pacientes | 155 | 158 |
| Seguimiento | 7 años | 8 años |
| Mielodisplasia | 8% | 2% |
| Neoplasia sólida | 4,5% | 2,8% |
| Infección severa | 26% | 46% |
| Mortalidad | 14% | 20% |
NIH: National Institutes of Health.
Hoffman se preguntaba en un editorial de Arthritis and Rheumatism18, hace ya más de una década, si era el momento de cambiar el tratamiento estándar; quizá ahora ya lo es. Y es que desde entonces se han ido desarrollando diferentes estrategias encaminadas a perfeccionar el protocolo clásico, mejoras que han permitido optimizar el control de la actividad minimizando al mismo tiempo la toxicidad derivada del tratamiento. Paralelamente, se han llevado a cabo un número considerable de ensayos clínicos aleatorizados, muchos de ellos promovidos por el EUVAS (European Vasculitis Study Group) que, como grupo multinacional cooperativo, ha puesto en marcha un plan sistemático de diseño de estudios dirigido a responder los grandes interrogantes planteados en la terapia de las vasculitis sistémicas, varios de ellos completados ya con éxito, otros aún en curso19,20. Las mejoras que han ido imponiéndose en los últimos años incluyen la optimización de la dosis de la CFM, la adecuación del tratamiento a la severidad, el empleo con éxito de medidas profilácticas de efectos adversos y el desarrollo de la estrategia secuencial. La discusión crítica de estos aspectos ocupará el grueso de esta revisión.
Optimizando las dosis de ciclofosfamidaPulsos de CFM versus CFM por vía oralEl uso de pulsos de CFM (CFMp) persigue básicamente el conseguir una inducción de remisión acumulando menos cantidad de citotóxico, siempre en comparación con la CFMo diaria. Un régimen de inducción con CFMp rara vez superará los 20g y supone un 50% de la dosis habitualmente necesaria si se usa CFMo con el mismo propósito. Esto significa una cantidad total de CFM muy por debajo de los «umbrales» de riesgo de neoplasias definidos hasta la fecha. Pero ¿cuál es la evidencia que sustenta esta modalidad terapéutica? En los estudios controlados que han comparado ambas modalidades no se han apreciado diferencias entre CFMp y CFMo en cuanto al porcentaje de remisiones, si bien en varios de ellos se constató un menor número de recidivas con CFMo21–24. Estos estudios, llevados a cabo durante la pasada década, adolecen de importantes limitaciones metodológicas, bien a causa de la heterogenicidad de las vasculitis o bien por el número pequeño de pacientes que fueron incluidos en cada uno de ellos (tabla 2). A pesar de la variabilidad en el régimen de administración de CFMp y del insuficiente tamaño muestral, De Groot et al realizan un intento de metaanálisis y concluyen que los CFMp constituyen un tratamiento igual o mejor que la CFMo y es consistentemente menos tóxico25.
Ciclofosfamida por vía oral versus pulsos: estudios controlados
| n | Dosis | Remisión (%) | Recidiva (%) | ||
| Pulsos/oral | CFMp | Vasculitis | CFMp/CFMo | CFMp/CFMo | |
| Hautbitz | 22/25 | 0,75/m2/4 sem | GW/PAM | 100/84 | 40/28 |
| Adu | 24/30 | 15mg/kg/3 sem | GW/PAM/cPAN | 83/86,6 | 29,6/26,6 |
| Garayaud | 12/13 | 0,6g/m2/mes | cPAN/Churg-Strauss | 76/75 | 15/16 |
| Guillevin | 27/23 | 0,75/m2/3 sem | GW | 78,3/88,9 | 59,2/13 |
CFMo: ciclofosfamida por vía oral; CFMp: pulsos de ciclofosfamida; cPAN; panarteritis nodosa clásica; GW: granulomatosis deWegener; PAM: poliangeítis microscópica.
No es claro que estos resultados sean trasladables a las vasculitis severas, ya que éstas han sido excluidas en varios de los estudios citados. Algunos centros, altamente especializados en el manejo de este tipo de pacientes, no han obtenido con CFMp resultados tan favorables, particularmente en GW extensa26,27. En un intento de dar una respuesta más definitiva a este interrogante, el EUVAS pone en marcha el estudio CYCLOPS. Este ensayo ha sido diseñado con el propósito de comparar CFMp frente a CFMo como tratamiento de inducción en vasculitis sistémicas con afectación de un órgano vital. Se excluyen, eso sí, enfermos críticos, esto es, con hemorragia alveolar o con creatinina >500μm/l. El cálculo del tamaño muestral ya es adecuado aquí, con 140 pacientes incluidos en total. En los resultados preliminares a un año (comunicados en forma de abstract al último workshop internacional de VAA) no se aprecian diferencias en tiempo medio en remisión ni tampoco en los efectos adversos, aunque con una fuerte tendencia a menor mortalidad del grupo tratado con CFMp28. En cualquier caso, y al menos hasta la publicación de resultados más definitivos, estamos ante una cuestión aún no zanjada.
Se dispone de pocos datos comparativos entre CFMp y CFMo a largo plazo. Los mejores proceden de un estudio de Guillevin publicado muy recientemente, donde se completó una media de 6 años de seguimiento a un grupo de pacientes que habían participado en un estudio comparativo de CFMo frente a CFMp. A diferencia de los datos preliminares de CYCLOPS, se constató que la modalidad de administración de CFM no tenía influencia en la mortalidad, si bien hay que enfatizar que el tamaño del estudio era pequeño y se produjeron cambios a la vía oral en caso de respuesta insatisfactoria29.
En cuanto a la pauta por seguir, existen fundamentalmente dos protocolos sobre los que se tiene amplia información (fig. 2). El protocolo más utilizado por el grupo multicéntrico francés emplea CFM ajustada a la superficie corporal a razón de 0,6g/m2, con administración inicial de 3 pulsos quincenales y posteriormente mensuales. El régimen propuesto en las directrices de la Sociedad Británica de Reumatología sugiere ajustar la dosis al peso corporal, a razón de 15mg/kg, pasando a administrar pulsos cada tres semanas tras las 3 dosis quincenales30. Que sepamos, no hay estudios que comparen las dos pautas de administración, pautas que se nos antojan bastante similares.
Ajuste para edad y sexoPara el correcto ajuste de dosis, es necesario considerar binomio edad/insuficiencia renal30. Contrariamente a lo que se suele pensar, hay más evidencia del ajuste de dosis por edad que por función renal (tabla 3).
Adecuando el tratamiento a la severidadOtra de las estrategias encaminadas a ahorrar CFM es adecuar el tratamiento a la severidad, usando inmunosupresores alternativos en enfermedad menos severa o localizada.
Parece claro que la mortalidad de una vasculitis necrotizante sistémica depende más de la extensión y la severidad de la enfermedad que del tipo de vasculitis. Los estudios llevados a cabo por el grupo multicéntrico francés así lo demuestran. Así, por ejemplo, un estudio observacional prospectivo con seguimiento a muy largo plazo (88 meses de media), que incluyó a 278 pacientes con panarteritis nodosa clásica (cPAN), PAM y Churg-Strauss, concluye que son el nivel de actividad y el score de afectación visceral los factores que determinan la mortalidad31.
Estratificar de forma fiable a los pacientes de acuerdo a la severidad y/o la extensión de la enfermedad es, obviamente, un paso ineludible para adaptar el tratamiento a la gravedad del caso concreto. El EUVAS propuso en su día una clasificación de severidad32, que ha sido usada en los diferentes ensayos clínicos del grupo, aunque no de un modo uniforme (tabla 4). Por otro lado, el grupo de trabajo francés ha desarrollado un instrumento validado, el FFS (five factor score ‘puntaje de cinco factores’), una escala derivada del estudio prospectivo de un gran número de casos, que se ha mostrado capaz de predecir mortalidad (fig. 3)33.
Subclasificación EULAR en función de la severidad
| Subgrupo clínico | Síntomas constitucionales | ANCA | Órgano vital | Creatinina sérica (μmol/l) |
| Localizada | No | +/- | No | <120 |
| Sistémica de inicio | Sí | +/- | No | <120 |
| Generalizada | Sí | + | Sí | <500 |
| Renal severa | Sí | + | Sí | >500 |
| Refractaria | Sí | +/- | Sí | Cualquiera |
ANCA: anticuerpos anticitoplasma de neutrófilo.
La estrategia de adecuar el tratamiento a la severidad ha resultado con frecuencia exitosa, según se desprende de diferentes estudios retrospectivos. La experiencia de la Clínica de Vasculitis de Cleveland es particularmente informativa en este sentido34. En un amplio estudio reciente de este grupo, realizado en 82 pacientes con GW, no encontraron diferencias en inducción de remisión al comparar CFMo con metotrexate (MTX), utilizando este último sólo en casos no severos. La supervivencia global del grupo resultó llamativa: el 96,3% de los pacientes estaban vivos a los 4 años de seguimiento medio. La incidencia de infección fue inferior a la comunicada en la cohorte de los NIH (0,076/pacientes-año frente a 0,11/pacientes-año)13. Sin embargo, las dos cohortes no son muy comparables, ya que en el estudio de Cleveland se excluyó a los pacientes que tenían creatinina >2mg/dl tras la inducción de remisión. El porcentaje de recidivas, el 66% a los dos años, resultó bastante alto en ese estudio, si bien no difiere sustancialmente del observado en ensayos controlados donde se ha usado MTX en mantenimiento de remisión.
Los datos procedentes de NORAM, un estudio controlado promovido por el EUVAS, también sustentan esta estrategia. En este ensayo se comparó MTX con CFMo como inductores de remisión en GW limitada, sin apreciarse diferencias en eficacia. Curiosamente, probablemente debido al limitado seguimiento (18 meses), no hubo tampoco diferencias en la incidencia de infecciones, a pesar de detectarse un mayor porcentaje de leucopenias en el grupo que recibió CFMo35.
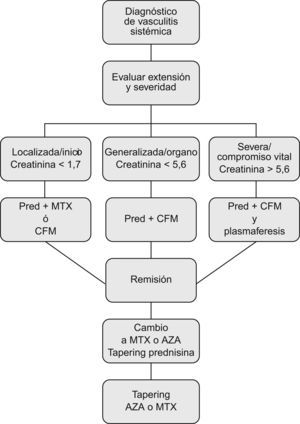
En un análisis retrospectivo reciente de 595 pacientes, realizado por el grupo multicéntrico francés, se concluye que la mortalidad durante el primer año de enfermedad resulta mayor en aquellos pacientes tratados únicamente con GC sólo en el caso de FFS mayor o igual a 236. En base a éste y otros estudios previos del propio grupo, proponen usar el FFS para adecuar el tratamiento a la severidad, de manera que los pacientes con FFS de 0 podrían ser tratados solamente con GC, añadiendo un inmunosupresor de no obtenerse una respuesta satisfactoria37. La Sociedad Británica de Reumatología sugiere un algoritmo de manejo basado también en una estrategia de adaptación a la extensión y severidad del proceso (fig. 4)38.
Alternativas a la CFM en casos severosEl mycofenolato de mofetilo (MFM) constituye la única alternativa que ha sido comparada de forma directa con la CFM en inducción de remisión para casos severos. Se trata de un potente inmunosupresor que inhibe la inosina monofosfato deshidrogenasa, limitando la síntesis de nucleótidos de guanosina. Más allá de su carácter inmunosupresor, el MFM exhibe diversos efectos, potencialmente beneficiosos, sobre la célula endotelial38. Estas características, junto con los buenos resultados obtenidos en otras patologías autoinmunes sistémicas, posicionan al MFM como una alternativa prometedora. De hecho, el MFM ha sido ya utilizado con éxito en vasculitis refractarias o en pacientes intolerantes a la CFM39,40. En un ensayo controlado reciente, no ciego, Hu et al encuentran al MFM superior a CFMp como inductor de remisión en un pequeño grupo pacientes con VAA, todos ellos con afectación renal (creatinina <500μmol/l). Sorprende en este estudio el escaso número de pacientes en los que se logró obtener una remisión completa con CFM (el 47,1 frente al 77,8% con MFM), cifra por debajo de lo descrito habitualmente en la literatura médica41.
Es obvio que hacen falta ensayos de apropiado diseño y a más largo plazo que permitan definir el papel del MFM como inductor de remisión en las VAA.
Opciones en enfermedad severa con compromiso vitalAdemás de las medidas antes apuntadas, que incluyen el uso de megadosis de GC en pulsos, existen dos recursos terapéuticos que pueden contribuir a conseguir un control más rápido y completo de la enfermedad en situaciones de particular gravedad: la plasmaféresis (PF) y la infusión de dosis elevadas de inmunoglobulinas intravenosas (IGIV). Hasta el momento, ninguno de las dos modalidades ha demostrado modificar favorablemente el pronóstico vital, pero se dispone de ciertas evidencias que fundamentan su utilización.
PlasmaféresisLa polémica acerca del posible papel de la PF en las vasculitis sistémicas se arrastra ya desde hace más de 20 años. Patogénicamente, la PF aparece como un procedimiento terapéutico tentador para las VAA. Mediante PF no sólo retiramos del torrente circulatorio los ANCA y las citoquinas proinflamatorias, como TNF-α e IL-6, capaces de cebar a los neutrófilos haciéndolos susceptibles a la activación por los ANCA, sino también proteínas del complemento y proteasas lesivas para el endotelio vascular42.
En un metaanálisis de Guillevin, realizado sobre dos estudios aleatorizados, se concluyó que la PF no aportaba nada al tratamiento inmunosupresor convencional en presencia de glomerulonefritis43. Sin embargo, ya dos décadas antes, Pusey et al sugirieron, en pequeño estudio controlado, que la PF resultaba eficaz sólo en situación de diálisis44. Estos resultados han sido confirmados recientemente por un estudio multicéntrico controlado, llevado acabo por el EUVAS: el estudio MEPEX. En este estudio se compararó el uso de pulsos de metilprednisolona (pMP) con PF, practicada precozmente (en las dos semanas tras el inicio de la diálisis). En el análisis realizado al año de seguimiento, la PF resultó superior a los pMP en cuanto a la supervivencia libre de diálisis, si bien no se detectaron diferencias en mortalidad. Tampoco había diferencias en efectos adversos. Quizá el limitado tiempo de seguimiento explique en parte estos resultados. En cualquier caso, el objetivo primario del estudio era la independencia de la diálisis a los 3 meses45. Un análisis post hoc demuestra que, aun con signos histopatológicos ominosos, como las lesiones glomerulares extensas y la atrofia tubular, la probabilidad de recuperación renal excede el riesgo de muerte cuando el paciente recibe PF como adyuvante46. Respecto a la capilaritis con hemorragia alveolar, no se ha llevado a cabo ningún ensayo controlado, pero merece comentarse el estudio observacional de Klemmer et al47. En este estudio, la supervivencia de 20 de los 20 pacientes tratados con PF (varios de ellos con cuadros severos, que precisaron ventilación mecánica) es impactante, dada la alta mortalidad de este proceso, habitualmente superior al 50%. Pensamos que estos resultados fundamentan, hasta mejor evidencia, el recurso a la PF en el manejo de las glomerulonefritis rápidamente progresivas y las capilaritis pulmonares que tengan su origen en una VAA. Esta misma conclusión se extrae de la reciente revisión sistemática de la evidencia de la colaboración Cochrane48.
InmunoglobulinasLas IGIV se han mostrado eficaces como tratamiento adyuvante en series pequeñas de pacientes con vasculitis severas y también en un estudio controlado49–52. En este último, se añadieron IGIV al tratamiento inmunosupresor convencional52. A pesar del número pequeño de pacientes que incluyó, el estudio tenía potencia estadística suficiente para detectar diferencias con placebo. Los efectos beneficiosos tuvieron una duración limitada (3 meses de media) y algunos pacientes sufrieron un deterioro transitorio de función renal. Por lo demás, el recurso a IGIV constituye un tratamiento con un buen perfil de seguridad53, que puede beneficiar a los pacientes con vasculitis severas, particularmente en situación de glomerulonefritis rápidamente progresiva50,51. Y puede, además, constituir una opción recomendable en el caso de sospecha de infección sobreañadida. Su mecanismo de acción no se conoce bien. Posiblemente la restauración de la red antiidiotipo frente a los ANCA sea el más importante, pero no el único. También parecen ser relevantes la modulación del repertorio de células B y la regulación a la baja de las citoquinas proinflamatorias, entre otros54.
Reduciendo riesgos inherentes a la inmunosupresión de alta intensidadDada la innegable toxicidad del tratamiento convencional de las vasculitis sistémicas, se plantea la utilización de medidas preventivas que contribuyan a minimizarla. Aunque las evidencias disponibles son limitadas (tabla 5) y algunas de estas medidas se han trasladado de situaciones de inmunodepresión no superponibles, su uso se ha ido generalizando y son recomendadas por la mayoría de los expertos9.
Inmunosupresión de alta intensidad: medidas profilácticas
| Problema | Medida | NE |
| Cistitis hemorrágica | Mesna e hidratación | C |
| Infertilidad | Análogos de LH-RH (leuprorelina) | A Ib (C?) |
| Cáncer | Screening (vejiga, cérvix, etc.), fotoprotección, tabaco | C |
| Osteoporosis | Bifosfonatos, vitamina D, teriparatide | A |
| Pneumocistis jiroveci | Profilaxis Cotrimoxazol/pentamidina | B |
| Neumonía | Vacuna antineumocócica y cotrimoxazol | C |
| Tuberculosis | Quimioprofilaxis si hay tuberculosis latente | C |
LH-RH: hormona liberadora de hormona luteinizante; NE: nivel de evidencia.
El cotrimoxazol (CTX) añade a su capacidad de prevenir la infección por Pneumocistis jiroveci la posibilidad de disminuir la incidencia de neumonías, según estudios realizados en pacientes infectados por el VIH. Existen datos retrospectivos que son muy sugestivos de su eficacia como profilaxis de P. jiroveci en vasculitis sistémicas, como los aportados por los estudios observacionales publicados por el Centro de Vasculitis de la Clínica Cleveland. La incidencia de neumonía por P. jiroveci desaparece en las cohortes actuales de este centro tras la introducción del CTX (pasa a ser de 11 casos en 180 pacientes en 1992 a 0 casos de 82 pacientes en 2007)34. Además, a diferencia de la pentamidina, es una terapia con un buen cociente coste/efectividad en este contexto, aumentando la expectativa de vida de los pacientes con GW sometidos a terapia inmunosupresora55. Su uso es aconsejable en caso de linfopenia global por debajo de 400cél/μl. Aunque la dosis recomendada en prevención de infecciones es baja, no se descarta un efecto inmunomodulador sobre la enfermedad de base.
La vacunación antineumocócica polivalente está indicada en todo paciente que vaya a ser sometido a inmunosupresión, reduciendo el riesgo de bacteriemia y muerte asociada a la infección por Streptococcus pneumoniae56.
Para la quimioprofilaxis de la infección por Mycobacterium tuberculosis, rigen las medidas aplicables a todo paciente que se prevé va a recibir dosis de corticoides altas de GC57.
Tratamiento de mantenimientoEl principal desafio actual del manejo de las VAA es no tanto el inducir remisión como el mantenerla, minimizando la toxicidad del tratamiento. Hasta un 50% de las vasculitis (el 60–80% en el caso de la GW) recidivan y suelen hacerlo al disminuir o retirar el tratamiento inmunosupresor. Este panorama no parece haber variado sustancialmente en la última década. Aunque pocos estudios han abordado las consecuencias de los brotes repetidos, la información disponible sugiere que las recidivas conllevan acumulación de daño, que puede ser severo. Así, en un amplio estudio reciente del grupo de Chapel Hill, las recidivas renales supusieron un RR de insuficiencia renal terminal de 4,77.
Estrategias para mantener la remisiónEn los últimos años, remedando las estrategias oncológicas, se preconiza un tratamiento en dos fases: una primera fase de inducción de remisión y, dado el carácter recurrente de las VAA, una segunda de mantenimiento. El concepto de mantenimiento debería englobar no sólo el eludir brotes de enfermedad y minimizar daño acumulado, si no también medidas encaminadas a controlar procesos concomitantes, como el riesgo de arteriosclerosis y de trombosis venosa profunda, la progresión a insuficiencia renal terminal, etc. Como viene sucediendo en otras enfermedades inflamatorias crónicas mediadas por mecanismos inmunes, se acumulan datos que sugieren un incremento del riesgo cardiovascular para los pacientes con vasculitis sistémicas58. Asimismo, al menos en lo que se refiere a la GW, también parece existir un incremento del riesgo de trombosis venosa59. De manera que, hasta que se disponga de más estudios, parece razonable plantear el control agresivo de los factores de riesgo cardiovascular clásicos en estos pacientes. Además, se ha sugerido recientemente que las estatinas pueden tener un efecto favorable sobre la actividad de las vasculitis60.
Definir el estatus de enfermedadLa adecuada discriminación entre un brote de enfermedad y la presencia de daño irreversible, un aspecto fundamental en el manejo a largo plazo de estos procesos, no es siempre tarea fácil. En ocasiones hay que recurrir a las biopsias con el fin de descartar la presencia de vasculitis activa en el tejido afectado, ya que los biomarcadores de inflamación o actividad no son todo lo fiables que deberían en este cometido. Pueden ser de utilidad, orientando al clínico, las definiciones recomendadas por EULAR para su empleo en ensayos clínicos (tabla 6)61.
Definiciones EULAR del estatus de la enfermedad
| Estatus | Definición |
| Remisión | Ausencia de actividad que precise mantener tratamiento IS |
| Respuesta | 50% de reducción de un score de actividad y ausencia de manifestaciones nuevas |
Recidiva
| Recurrencia o debut de una manifestación atribuible a enfermedad activa
|
Refractariedad
| Actividad estable o en aumento a pesar de 4 semanas de tratamiento estándar |
| <50% de reducción de un score de actividad después de 6 semanas de terapia | |
| Presencia de ≥ un ítem mayor o 3 menores (BVAS o BVAS/WG) tras 12 semanas de tratamiento | |
| Baja actividad | Persistencia de síntomas menores, responden a aumentos discretos de GC |
BVAS: Birmingham Vasculitis Activity Score; BVAS/WG: Birmingham Vasculitis Activity Score for Wegener Granulomatosis; GC: glucocorticoides; IS: inmunosupresor.
El único estudio a la fecha que sustenta la estrategia secuencial es el CYCAZAREM62. Este estudio fue promovido por el EUVAS con el propósito de comparar el tratamiento clásico: inducción y mantenimiento con CFMo, con el secuencial: inducción con CFMo y mantenimiento con azatioprina (AZA). Se incluyeron un número adecuado de pacientes con VAA severas, con un claro predominio de PAM. Se consiguió demostrar que la terapia secuencial resultaba equivalente en eficacia a la monoterapia con CFMo. Tanto el índice de daño acumulado como la mortalidad resultaron similares a los 18 meses. El porcentaje de recidivas también fue similar, llamativamente bajo, eso sí, en ambos grupos (el 15,5 en el grupo de AZA frente al 13,7% en el de CFM). Desconocemos si estos resultados se reproducirían de usarse CFMp en vez de CFMo para inducir remisión. Por otro lado, el estudio adolece de suficiente seguimiento como para concluir si existen o no diferencias, tanto en daño acumulado como en incidencia de neoplasias entre las dos modalidades de tratamiento. En cualquier caso, el impacto que este estudio ha tenido en la clínica diaria parece haber sido alto, propiciando un amplio uso de la estrategia secuencial desde su publicación.
El estudio retrospectivo de la Clínica de Vasculitis de Cleveland, ya citado previamente, permite matizar esta estrategia34. En ese estudio, que incluyó solamente a pacientes con GW, la asignación a monoterapia con MTX frente a CMFo seguida de MTX no fue aleatoria, usándose sólo MTX en los casos más leves (sin insuficiencia renal relevante). En un seguimiento medio de 4,5 años, el porcentaje de recidivas resultó elevado (un 66% a los dos años) e igual para ambos brazos. Es de resaltar que los pacientes con linfopenia sufrieron menos brotes a lo largo del estudio. Este dato es interesante ya que, de confirmarse en estudios prospectivos, el mantenimiento de linfopenia por debajo de 500cél/μl podría convertirse en un objetivo terapéutico. En definitiva, parece que la monoterapia con MTX puede resultar suficiente en casos de GW localizada.
Elección del inmunosupresorSi nos inclinamos por usar una terapia secuencial, debemos salvar un nuevo escollo: la elección del inmunosupresor más idóneo en orden a mantener la remisión. Idealmente, la elección debería ser individualizada. Disponemos de datos comparativos, provenientes de estudios controlados (tabla 7) que, aunque no definitivos, pueden facilitarnos la tarea. Ya se ha comentado la eficacia de la AZA como alternativa a la CFMo en el mantenimiento de remisión de los pacientes con vasculitis severas, patente en el ensayo CYCAZAREM. El CTX ha recibido atención durante un tiempo en la literatura médica, pero el alto porcentaje de recidivas, hasta el 100% en un estudio comparativo con MTX, ha relegado a este agente a un uso marginal. El MTX constituye una buena alternativa, si bien, exceptuando el caso del CTX63, su uso se ha asociado a un porcentaje de recidivas superior al de todos los fármacos con los que se ha comparado. En un estudio reciente, Metzler et al enfrentan leflunomide (LFN) con MTX y concluyen que el LFN es superior como mantenedor de remisión, con ninguna recidiva renal en su haber64. El estudio no está exento de debilidades, como son el alto porcentaje de abandonos por efectos adversos para LFN y el que la estrategia llevada a cabo con MTX fue excesivamente conservadora, tanto en la escalada de dosis como en la vía utilizada, que fue la oral. Un estudio en curso, el IMPROVE, se ha propuesto comparar MFM con AZA pero, que sepamos, aún no se ha hecho público resultado alguno.
Terapia de mantenimiento: estudios controlados
| Estudio | Año | Dosis | Recidivas (%) | Toxicidad | Sugerido en | |
| AZA | CYCAZAREM | 2003 | 2mg/kg | AZA vs. CFM | ≈ | Enfermedad severa |
| 13,7 vs. 15,5 | ||||||
| 18m | ||||||
| CTX | De Groot et al | 1996 | 800/160mg/12h | CTX vs. MTX | 20% retiradas | ¿Localizada? |
| 100 vs. 9 | con CTX | |||||
| 14m | ||||||
| MTX | NORAM | 2005 | 20–25mg | MTX vs. CFM | ≈ | Enfermedad no severa, sin IR |
| 69 vs. 45 | ||||||
| 18m | ||||||
| MFM | IMPROVE | 2007 | 2g | MFM vs. AZA | ? | ? |
| LFN | Metzler et al | 2007 | 30mg | LFN vs. MTX | > % retiradas LFN | ¿IR? |
| 23 vs. 46 | ||||||
| 21m | ||||||
AZA: azatioprina; CFM: ciclofosfamida; CTX: cotrimoxazol; IR; insuficiencia renal; LFN: leflunomide; m: meses; MFM: mycofenolato mofetil; MTX: metotrexate.
Desafortunadamente, no se dispone de ensayos controlados a largo plazo, aspecto cardinal a la hora de plantearnos una terapia de mantenimiento. Estudios retrospectivos sugieren una mayor frecuencia de recidivas con AZA frente a CFM tras años de seguimiento, especialmente en pacientes ANCA PR3 positivos, pero a su vez apuntan a mayor mortalidad con CFM65,66. Estos estudios no proporcionan datos concluyentes ya que, además de los sesgos propios de los estudios retrospectivos, los tratamientos que se comparan se realizaron en distintos momentos históricos.
Como cabría esperar, los estudios de seguimiento a largo plazo con MTX arrojan altos porcentajes de recidiva, recidiva que con frecuencia es renal67,68. En el estudio prospectivo del grupo alemán de Lübeck, que empleó MTX intravenoso tras inducción con CFM, un tercio de los pacientes habían recidivado tras un seguimiento medio de 25 meses. De los 26 brotes que se contabilizaron, 15 fueron renales68. En este estudio, el nivel de remisión obtenida medida mediante DEI (un índice de extensión de enfermedad específico de la GW) resultó un poderoso factor de riesgo de recidiva.
Se han publicado muy recientemente los resultados del estudio WEGENT. En este ensayo se comparó directamente AZA y MTX en mantenimiento de remisión, tras una inducción con CFMp. A los 29 meses, no se apreciaron diferencias en supervivencia entre los dos brazos. Aunque no alcanzó significación estadística, se constató una fuerte tendencia a mayores efectos adversos en el grupo tratado con MTX69. Esta circunstancia se podría explicar por el alto porcentaje de pacientes con insuficiencia renal, un conocido factor de riesgo de toxicidad asociada al uso de MTX.
Papel de los GC en el mantenimiento de la remisiónParte de la variabilidad en los resultados entre los diferentes ensayos clínicos de terapia de mantenimiento puede atribuirse a la heterogenicidad en el uso de los GC. Walsh et al realizan un metaanálisis de todos aquellos estudios donde la pauta de GC estaba suficientemente especificada, concluyendo que su uso continuado parece asociarse a menor riesgo de recidiva70. Si bien es cierto que no existe ningún ensayo clínico diseñado con este propósito en las VAA, también lo es que el uso a largo plazo de GC a dosis bajas, habitual en muchas de las enfermedades reumáticas inflamatorias, goza de un aceptable perfil de seguridad y, hasta mejor evidencia, representa una medida razonable. Está por establecerse si la prevención del daño acumulado que se deriva de los brotes repetidos compensa los efectos deletéreos del uso continuado de GC.
Duración del tratamientoUna vez elegido el inmunosupresor, corresponde establecer la duración del tratamiento. De nuevo topamos con incertidumbres, destacando la falta de existencia de una definición uniforme y estandarizada de recidiva. Las recidivas, sea cual sea la definición que se use, son más frecuentes en los primeros dos años, particularmente en los seis meses tras la retirada del tratamiento inmunosupresor inicial, de manera que no parece aconsejable su suspensión precoz.
En vasculitis con afectación de órgano vital, sabemos que mantener el tratamiento 10 meses es mejor que 4 meses, al menos usando CFMp. Lo sabemos gracias a dos estudios controlados del grupo multicéntrico francés: uno realizado en cPAN y PAM, y otro en Churg-Strauss. En el primero de ellos, la tasa de recidivas fue del 66% con 6 pulsos mensuales frente al 22% cuando se utilizaron un total de 12 pulsos (tras inducción con pulsos semanales). Además, la diferencia en brotes se incrementa con el tiempo, al menos hasta los 36 meses de seguimiento, una vez suspendido el tratamiento inmunosupresor. No se apreciaron diferencias en la supervivencia ni tampoco en incidencia de neoplasias, que resultó baja. A los 3 años, el porcentaje de sobrevivientes sin brote fue mayor al 70%, dato que sugiere que sería suficiente con mantener la CFMp 10 meses71. En el estudio realizado en Churg-Strauss, de análogo diseño, los resultados fueron muy similares: la tasa de supervivencia libre de enfermedad fue claramente favorable al brazo que recibió 12 pulsos. De nuevo aquí tampoco había diferencias en los efectos adversos graves72. Un estudio retrospectivo a 18–24 meses apuntala estos resultados, ya que encuentra un bajo porcentaje de recidivas (21%) usando CFMp a largo plazo. La CFM fue bien tolerada, con una tasa acumulada de infección del 18,9%73.
Pero ¿resulta suficiente un año de tratamiento? Si confrontamos, tal y como propone Hoffman en un reciente editorial74, las conclusiones del estudio NORAM y las del CYCAZAREM, ambos ya comentados, es patente que la suspensión del tratamiento a los 12 meses en NORAM conduce a un aumento notable del número de recidivas que no se aprecia en CYCAZAREM, donde el tratamiento se mantuvo hasta el final del estudio. Sin embargo, es conveniente considerar que en NORAM los pacientes eran menos severos, con predominio de formas limitadas de GW, que tienden a ser más recidivantes.
Con el propósito de aportar evidencias sobre esta cuestión, el EUVAS ha puesto en marcha el estudio REMAIN, que comparará dos plazos de tratamiento tras remisión con CFM: inmunosupresión con AZA y dosis bajas de prednisona durante 2 años versus 4 años.
¿Tratamiento de mantenimiento para todos los pacientes?Se sabe que un subgrupo considerable de pacientes consigue períodos prolongados de remisión después de un único curso de inducción con CFMo y GC, llegando hasta un tercio de los casos según datos de la cohorte de los NIH75. El problema es que no disponemos de ninguna herramienta fiable para identificarlos con antelación. Aunque se han descrito un buen número de factores asociados a recidiva7,66,76, al no disponerse de un índice ponderado que los integre, con frecuencia resulta difícil e inexacto clasificar de este modo a los pacientes. En cualquier caso, los factores más refrendados en la literatura médica se exponen en la tabla 8. La reducción o retirada de la terapia inmunosupresora es, sin duda, el más robusto.
Factores de riesgo de recidiva
| Reducción o retirada de la terapia inmunosupresora |
| Retirada precoz de esteroides |
| Uso de dosis bajas de CFM en inducción |
| Afectación de tracto respiratorio |
| Brotes previos |
| Infecciones del TRS (Staphylococcus aureus) |
| ANCA positivo en el momento del cambio de IS |
Wegener o anti-PR3 positivo persistente
|
ANCA: anticuerpos anticitoplasma de neutrófilo; CFM: ciclofosfamida; IS: inmunosupresor; PR3: proteinasa 3; TRS; tracto respiratorio superior.
A la hora de la toma de decisiones, se debería considerar que son escasos los datos que sustentan una adaptación de la duración del tratamiento al riesgo de recidiva. Los partidarios de un tratamiento de mantenimiento prolongado para todos los pacientes, que es la postura que parece gozar de mayor predicamento entre los expertos, aducen que el número de brotes tras suspenderlo es alto, que las recidivas son imprevisibles e independientes de la severidad y que las terapias de mantenimiento actuales no son ya tan tóxicas. En otras palabras, que los riesgos de toxicidad se compensan evitando brotes, con la consiguiente reducción del daño acumulado.
MonitorizaciónEULAR recomienda una evaluación clínica estructurada, utilizando instrumentos validados, tanto para establecer la extensión como el grado de actividad, si bien el nivel de evidencia de esta aproximación no pasa de grado C9. Son necesarios estudios prospectivos que ayuden a definir las estrategias de monitorización más costo-efectivas.
El BVAS (Birmingham Vasculitis Activity Score), con su versión para la GW, es una herramienta multiítem que mide actividad, ampliamente validada y de uso muy extendido77, pero no ha sido diseñada para su aplicación en el paciente individual.
En las directrices de la Sociedad Británica de Reumatología, particularmente minuciosas, se recoge un consenso de autoridades europeas de peso en este ámbito. La monitorización estrecha del hemograma es una característica destacable, ya que se sugiere sea semanal durante el primer mes y quincenal durante los dos siguientes30.
Respecto a la utilidad de los ANCA, sabemos que su positividad, tanto al debut como en el momento de la remisión, aumenta el riesgo de recidiva y lo hace exponencialmente con incrementos de 4 o más veces, en MPO o PR3, sobre el valor basal. Sin embargo, los ANCA muestran una asociación débil con la actividad. Sólo la mitad de las elevaciones de los ANCA acaban en recidiva y las recidivas son precedidas de elevación de los ANCA en aproximadamente la misma proporción78,79. En una revisión sistemática de la evidencia, que contempla 22 estudios, se concluye que los datos son suficientemente heterogéneos como para impedir llevar a cabo un metaanálisis, y que no puede afirmarse que la medición seriada de los ANCA sea útil con el propósito de monitorizar actividad80. Por todas estas razones, no parece sensato tomar decisiones terapéuticas en base exclusivamente al nivel de MPO o PR3 en el paciente individual. Ello no excusa de una vigilancia clínica estrecha a todo paciente que presente un aumento significativo de los ANCA.
Vasculitis refractaria: terapias biológicas y otras opcionesEn torno al 15–20% de los pacientes con VAA son refractarios al tratamiento convencional con GC y CFM, cifras que varían en función de los criterios que se empleen para definir refractariedad, la mayor o menor selección de pacientes graves en una determinada cohorte81. Antes de calificar a un paciente como refractario, una situación ciertamente inhabitual en la clínica diaria, es preciso asegurarse de que realmente lo es y de que no estamos ante una respuesta tardía, una infección, una toxicidad de la terapia o simplemente un daño irreversible sin franca actividad. También es ineludible el cerciorarse de si el tratamiento convencional llevado a cabo ha sido optimizado o no. Si se han ensayado CFMp y no se ha obtenido remisión, puede que ésta se consiga con la vía oral, como recomienda Guillevin82, estrategia para la que existe cierta evidencia que se ha clasificado como de grado B30. Existen otras opciones, todas ellas previa autorización vía compasiva en la actualidad en nuestro país, que podrían resultar beneficiosas, entre las que se destacan las terapias biológicas.
Terapias biológicasEl conocimiento creciente de los mecanismos inmunopatogénicos que operan en las VAA está facilitando el rápido desarrollo de alternativas terapéuticas dirigidas a dianas más específicas: las llamadas terapias biológicas83.
RituximabLas células B constituyen una de las dianas potenciales en varias enfermedades inflamatorias mediadas por autoanticuerpos, incluyendo las VAA, ya que, además de producir ANCA y citoquinas, estas células interactúan con los linfocitos T y pueden comportarse como eficientes presentadoras de antígenos. La terapia ablativa con rituximab (RTX), el anti-CD20 más ampliamente disponible, ha mostrado resultados prometedores en pequeñas series de pacientes con VAA refractaria o recurrente, con porcentajes de respondedores superiores al 90%84,85. Aunque las recurrencias son comunes, el retratamiento suele tener éxito86. Casi invariablemente, el RTX se ha empleado junto con inmunosupresores convencionales y su eficacia parece independiente del estatus de los ANCA. Sin embargo, la escasa información de que se dispone revela que la eficacia no es homogénea, siendo más previsible en presencia de vasculitis generalizada que en formas localizadas, donde se han comunicado bastantes fracasos. Una posible explicación de su inconstante eficacia en las GW limitadas, formas por lo general más «granulomatosas», es la formación de órganos seudolinfoides en el seno del granuloma, donde los linfocitos B, alojados en nichos protegidos, podrían escapar de los efectos del anti-CD20. Sin embargo, pequeñas series de casos comunican un beneficio tardío en este subgrupo de pacientes; en otras palabras, el criterio temporal que definiría el fallo del RTX no se ha establecido y probablemente difiera dependiendo del tipo de manifestación87,88.
Se han hecho necesarios estudios aleatorizados para clarificar tanto la posible eficacia de la terapia ablativa B con este monoclonal como su lugar en la secuencia de tratamiento, así como el fármaco idóneo con el que se debería combinar. Esperamos que el estudio RAVE (Rituximab for ANCA-Associated Vasculitis), aún en curso, pueda brindarnos algunas respuestas.
Terapia anti-TNFLa información de que se dispone no parece justificar el recurso habitual a la terapia anti-TNF para los pacientes con VAA refractaria. A pesar de los resultados de estudios in vitro que muestran la producción in situ de TNF en las glomerulonefritis asociadas a ANCA y el beneficio del bloqueo del TNF en varios modelos experimentales, su utilización clínica no parece haber satisfecho las expectativas creadas. Algunos estudios piloto han sugerido la posible eficacia del infliximab (IFX), incluyendo seguimientos a largo plazo89–91. Por otra parte, un estudio multicéntrico francés, que no ha sido publicado en forma completa, ha comparado directamente RTX e IFX en un pequeño número de pacientes, sin apreciar diferencias entre ambas terapias biológicas92. Sin embargo, también se han publicado estudios con resultados negativos y con efectos adversos de consideración. En la cohorte más numerosa hasta la fecha93, que incluyó 32 casos de VAA tratados con IFX, un 21% de los pacientes sufrieron una infección severa que precisó ingreso hospitalario, porcentajes que son elevados y que serían achacables, en parte, al uso concomitante de inmunosupresores convencionales.
Peor suerte parece haber corrido el receptor soluble anti-TNF de uso más extendido, el etanercept (ETZ). En el estudio WEGET, un estudio controlado en el que se añadía ETZ al tratamiento inmunosupresor convencional, éste no consiguió aventajar al placebo en porcentaje de recidivas. Además se observó un mayor número de neoplasias en el grupo que recibió ETZ, asociadas al uso concomitante de CFM94. Con estos datos en mente y dado el fracaso del ETZ en otros procesos granulomatosos, como es el caso de la enfermedad de Crohn, podemos concluir que tal vez no sea el bloqueador de TNF más idóneo, al menos en la GW. Es preciso señalar, con todo, que la aleatorización del estudio WEGET no fue óptima, ya que había diferencias significativas, en cuanto a afectación visceral, desfavorables para el grupo tratado con ETZ. Para complicar aún más las cosas, existen casos descritos de VAA en relación con el uso de anti-TNF en pacientes con artritis reumatoide, aunque probablemente el mecanismo patogénico sea distinto95.
Terapias de rescateEn caso de vasculitis auténticamente refractaria o con actividad persistente de suficiente entidad, sobre todo si compromete órgano vital, existen algunas opciones de carácter experimental, cuyo posible beneficio se sustenta en casos anecdóticos o pequeñas series de pacientes. El uso de terapias biológicas experimentales, de alto coste y potencial toxicidad, debería presuponer una cierta experiencia con el fármaco que se empleará y, obviamente, pericia en la valoración de la respuesta en este complejo grupo de patologías. De lo contrario, no estaría de más plantearse el traslado del paciente a un servicio o centro de referencia. Además, al menos idealmente, también se debería plantear la participación en protocolos o registros multicéntricos, dado lo infrecuente de estas enfermedades, con la consiguiente dificultad para atesorar experiencia en el uso de nuevas terapias. Comentaremos en este apartado terapias de eficacia potencial con las que se tiene menos experiencia en enfermedades inflamatorias autoinmunes.
Entre ellas se cuenta el alentuzumab (previamente campath-1H), un anticuerpo monoclonal Ig-1k, humanizado, anti-CD52, capaz de provocar una marcada depleción panlinfocitaria, que se usa como terapia de tercera línea en la leucemia linfoide crónica. De considerable toxicidad hematológica, se han comunicado resultados muy favorables en una serie monocéntrica de 71 pacientes con vasculitis severa refractaria a CFM. Se consiguió remisión en nada menos que el 85% de los casos, si bien las recidivas fueron frecuentes96.
Algo similar ha sucedido con la globulina antitimocito, un agente «biológico» más rudimentario, que actúa también como terapia ablativa, en este caso con diana en los linfocitos T activados. En un pequeño estudio abierto se consigue un alto porcentaje de remisiones en GW refractaria. De nuevo aparece aquí la toxicidad como factor limitante de consideración97.
Gusperimos, o deoxipergualina, es un inmunosupresor derivado de la spergualina que tiene efectos antiproliferativos predominantemente sobre las células T CD4+ naive. El mecanismo de acción aún no se conoce en detalle, pero los datos disponibles sugieren que actúa bloqueando el factor nuclear de transcripción kB. Se han descrito casos de respuesta espectacular tras fracaso de la terapia estándar98. Además se ha concluido recientemente un estudio multicéntrico europeo que ha mostrado un porcentaje de respuesta superior al 90% en pacientes refractarios a CFM o MTX. Los efectos adversos fueron frecuentes, pero rara vez condujeron a la suspensión de la medicación99. Sobre la base de estos datos, la Unión Europea ha asignado al gusperimos la condición de droga huérfana para el tratamiento de la GW.
Transplante autólogo de médula óseaComo ha sucedido con otras enfermedades autoinmunes, el transplante autólogo de médula ósea (TMO) ha sido intentado en pacientes aislados, con resultados variables100. El grupo mixto cooperativo European League Against Rheumatism and European Group for Blood and Marrow Transplantation (EULAR/EBMT) ha revisado recientemente la experiencia acumulada con este procedimiento en un grupo heterogéneo de vasculitis sistémicas, concluyendo que el TMO constituye un tratamiento factible, con mortalidad asumible, para las VAA, considerando pertinente la realización de ensayos controlados101.
Directrices EULAREn una patología grave y poco prevalente, que precisa con frecuencia de inmunosupresión agresiva, las directrices confeccionadas por grupos de expertos son particularmente bienvenidas. Recientemente, EULAR ha promovido la elaboración de dos importantes documentos en esta área. El primero de ellos, las recomendaciones para el manejo de las vasculitis primarias de pequeño y mediano vaso, ha sido elaborado por un grupo multidisciplinario de expertos europeos y americanos, usando un método Delphi modificado y de acuerdo con los procedimientos normalizados EULAR, llevando a cabo una revisión sistemática de la literatura médica9. Se emiten un conjunto de 15 recomendaciones, clasificando la evidencia de cada una de ellas, así como el «voto» de los expertos, recomendaciones que mostramos en la tabla 9. El segundo documento EULAR, las directrices para ensayos clínicos en vasculitis, confeccionadas siguiendo una metodología similar, incluyen una revisión de los sistemas de evaluación y de los biomarcadores, así como recomendaciones para definir los estatus de actividad, que pueden resultar muy útiles también para la clínica diaria61.
Recomendaciones EULAR para el manejo de las vasculitis sistémicas de pequeño vaso
| Recomendación | NE | Voto |
| 1. Manejo en, o en colaboración con, centros expertos | 3 | D |
| 2. Los ANCA deberían testarse en un contexto clínico adecuado. | 1A | A |
| 3. Soporte patológico del diagnóstico | 3 | C |
| 4. Evaluación clínica estructurada | 3 | C |
| 5. Categorización por severidad | 2B | B |
| 6. CFM + GC para inducir remisión en vasculitis generalizadas | 1A/1B | A |
| 7. MTX + GC en formas sin compromiso de órgano vital | 1B | B |
| 8. Altas dosis de GC para inducir remisión | 3 | C |
| 9. Plamaféresis si la GN es rápidamente progresiva. | 1B | B |
| 10. Mantener remisión con dosis bajas de GC y AZA, MTX o LFN | 1B/2B | A/B |
| 11. Inmunomodulación alternativa si hay fracaso en conseguir remisión o recidiva en dosis máximas de terapia estándar | 3 | C |
| 12. Inmunosupresión en vasculitis crioglobulinémica esencial | 4 | D |
| 13. Antivirales en vasculitis crioglobulinémica asociada a hepatitis C | 1B | B |
| 14. Antivirales + plasmaféresis + GC en vasculitis asociada a hepatitis B | 3 | C |
| 15. Investigar hematuria inexplicada persistente en todo paciente sometido a CFM | 2B | C |
ANCA: anticuerpos anticitoplasma de neutrófilo; AZA: azatioprina; CFM: ciclofosfamida; GC: glucocorticoides; GN: glomerulonefritis; LFN: leflunomide; NE: nivel de evidencia; MTX: metotrexate.