Actualizar el consenso de la Sociedad Española de Reumatología (SER) sobre el uso de terapias biológicas y sintéticas dirigidas en la artritis reumatoide (AR) como medio de apoyo al clínico en sus decisiones terapéuticas.
MétodosSe constituyó un panel de 13 expertos a través de convocatoria abierta en la SER. Se empleó una metodología mixta de adaptación-elaboración-actualización a partir del Documento de Consenso de la Sociedad Española de Reumatología sobre el uso de terapias biológicas en la AR publicado en 2015. Se partió de las revisiones sistemáticas (RS) de las recomendaciones de EULAR 2019, American College of Rheumatology 2021 y GUIPCAR 2017 y se actualizaron las estrategias de búsqueda de las preguntas PICO de GUIPCAR, elaborándose una RS adicional sobre enfermedad desmielinizante en relación con tratamientos biológicos y sintéticos dirigidos. Tras el análisis de la evidencia por los diferentes panelistas se consensuó en reunión presencial la redacción y el grado de acuerdo de cada una de las recomendaciones.
ResultadosEl panel acordó 5 principios generales y 15 recomendaciones sobre el manejo de la AR. Estas incluyen aspectos como la importancia del tratamiento precoz, el objetivo terapéutico en la AR, la frecuencia de monitorización, el uso de glucocorticoides, la utilización de fármacos antirreumáticos modificadores de la enfermedad (FAME) sintéticos convencionales (FAMEsc), FAME biológicos (FAMEb) y FAME sintéticos dirigidos, así como la reducción de dosis de estos fármacos en pacientes estables. Además, en esta actualización se incluyen recomendaciones sobre el uso de FAMEb e inhibidores de Janus-kinasas en algunas situaciones clínicas especiales, como pacientes con enfermedad pulmonar, antecedente de cáncer, insuficiencia cardiaca o enfermedad desmielinizante.
ConclusionesEsta actualización aporta recomendaciones sobre aspectos clave en el manejo de la AR con terapias biológicas y sintéticas dirigidas.
To update the consensus document of the Spanish Society of Rheumatology (SER) regarding the use of targeted biological and synthetic therapies in rheumatoid arthritis (RA) with the aim of assisting clinicians in their therapeutic decisions.
MethodsA panel of 13 experts was assembled through an open call by SER. We employed a mixed adaptation-elaboration-update methodology starting from the 2015 Consensus Document of the Spanish Society of Rheumatology on the use of biological therapies in RA. Starting with systematic reviews (SR) of recommendations from EULAR 2019, American College of Rheumatology 2021, and GUIPCAR 2017, we updated the search strategies for the PICO questions of GUIPCAR. An additional SR was conducted on demyelinating disease in relation to targeted biological and synthetic therapies. Following the analysis of evidence by different panelists, consensus on the wording and level of agreement for each recommendation was reached in a face-to-face meeting.
ResultsThe panel established 5 general principles and 15 recommendations on the management of RA. These encompassed crucial aspects such as the importance of early treatment, therapeutic goals in RA, monitoring frequency, the use of glucocorticoids, the application of conventional synthetic disease-modifying antirheumatic drugs (csDMARDs), biological DMARDs (bDMARDs), and targeted synthetic DMARDs. Additionally, recommendations on dose reduction of these drugs in stable patients were included. This update also features recommendations on the use of bDMARDs and Janus Kinase inhibitors in some specific clinical situations, such as patients with lung disease, a history of cancer, heart failure, or demyelinating disease.
ConclusionsThis update provides recommendations on key aspects in the management of RA using targeted biological and synthetic therapies.
La existencia de múltiples fármacos para el tratamiento de la artritis reumatoide (AR), junto con el gran desarrollo del conocimiento sobre las estrategias terapéuticas más idóneas para su manejo, hacen necesario el establecimiento de recomendaciones terapéuticas que ayuden a los clínicos a seleccionar las opciones más adecuadas para cada situación. La Sociedad Española de Reumatología (SER), en su afán de contribuir a la mejora de la calidad de vida de los pacientes con enfermedades reumáticas y musculoesqueléticas, ha realizado desde el año 2000 varios documentos de consenso y actualizaciones sobre el tratamiento de la AR con terapias biológicas y sintéticas dirigidas.
El último consenso se publicó en 20151; el presente documento representa la actualización del mismo. Desde entonces se han aprobado nuevos fármacos y se ha generado evidencia adicional sobre las estrategias terapéuticas más adecuadas para la AR. Un hito fundamental ha sido el desarrollo de un gran número de fármacos biosimilares que está contribuyendo a la reducción del coste de estas terapias, incidiendo sobre una de las barreras previas para su utilización. Un nuevo inhibidor del receptor de la interleucina6 (IL-6R) está disponible desde hace años, se han aprobado nuevas terapias sintéticas dirigidas que incrementan las opciones existentes y se han publicado importantes estudios que analizan el perfil de seguridad de estos tratamientos.
Esta actualización parte de la estructura del documento anterior, a su vez alineado con el esquema de las recomendaciones EULAR correspondientes. Tras comenzar con unas recomendaciones generales, se analizan aspectos como la importancia del tratamiento precoz, el objetivo terapéutico en la AR, el uso de glucocorticoides (GC) y la utilización de fármacos antirreumáticos modificadores de la enfermedad (FAME) sintéticos convencionales (FAMEsc), FAME biológicos (FAMEb) y FAME sintéticos dirigidos, de los que, en el caso de la AR, solo disponemos de los inhibidores de Janus-kinasas (iJAK). Además, en esta actualización se incluyen recomendaciones sobre el uso de FAMEb e iJAK en algunas situaciones clínicas especiales.
Este documento trata de ayudar en la toma de decisiones terapéuticas a los profesionales de la salud implicados en el cuidado de pacientes con AR, especialmente a los reumatólogos, los especialistas habitualmente implicados en el tratamiento de esta enfermedad. Cada una de las recomendaciones se ha realizado tras un detallado análisis de la evidencia disponible por el grupo de panelistas elegidos competitivamente desde la SER en base a su experiencia en el tema. No obstante, el nivel de evidencia para varias de ellas es limitado, por lo que la experiencia de los miembros que conforman el panel ha resultado clave para la interpretación de los escenarios más inciertos o complejos.
MetodologíaFases del procesoEn la actualización del documento de consenso se han seguido una serie de pasos que se describen a continuación (tabla 1, fig. 1).
- 1.
Creación del grupo de trabajo. La elaboración del documento se inició con la constitución de un panel de expertos formado por 13 reumatólogos miembros de la SER. Fueron elegidos mediante una convocatoria abierta a todos los socios de la SER. La Comisión de Guías de Práctica Clínica (GPC) y Recomendaciones de la SER valoró el currículum vitae de todos los solicitantes de acuerdo a criterios objetivos de aportación al conocimiento de la AR. La coordinación de los aspectos clínicos y metodológicos se realizó, respectivamente, por uno de estos reumatólogos, como investigador principal (IP), y una especialista en metodología, técnico de la Unidad de Investigación (UI) de la SER.
- 2.
Identificación de las áreas clavespara la actualización del consenso anterior. En la primera reunión de trabajo todos los panelistas participaron en las tareas de dar estructura al documento, así como de establecer los contenidos y los aspectos clave.
- 3.
Definición de la metodología a seguir en el proceso de elaboración del consenso. Se decidió emplear una metodología mixta de adaptación-elaboración-actualización. Para ello se tomó como punto de partida el documento elaborado en 2014 (Actualización 2014 del Documento de Consenso de la Sociedad Española de Reumatología sobre el uso de terapias biológicas en la artritis reumatoide)1. Además, se decidió tener en cuenta las revisiones y recomendaciones ya incluidas en otros tres documentos más: a)2021 American College of Rheumatology Guideline for the Treatment of Rheumatoid Arthritis2; b)EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2019 update3, y c)GUIPCAR 20174. Se completó el proceso valorando también el artículo EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2022 update.
- 4.
Búsqueda bibliográfica. Se actualizaron las estrategias de búsqueda de las preguntas PICO provenientes de la GUIPCAR. Se decidió fijar la fecha de comienzo de la búsqueda desde el año 2019, fecha de la actualización de la ACR, o 2016 para las que no había datos de ACR. La base de datos utilizada ha sido Pubmed (Medline). Se elaboró una RS adicional para dar respuesta a una nueva pregunta clínica planteada por el panel de expertos: «En pacientes con AR ¿cuál es el riesgo de desarrollo de enfermedad desmielinizante de los tratamientos con FAME biológicos o FAME sintéticos dirigidos?».
- 5.
Análisis de la evidencia. Los reumatólogos del grupo de trabajo se encargaron de revisar los estudios identificados y seleccionar los más relevantes. Después se sintetizó la información disponible en la materia y elaboraron un resumen narrativo con los resultados relevantes.
- 6.
Formulación de recomendaciones. En una segunda reunión se presentaron las propuestas de redacción para cada una de las recomendaciones y así poder establecer una propuesta final de redacción. Con la reunión presencial la interacción entre los expertos permitió profundizar en todas las cuestiones más relevantes. Mediante la técnica de consenso nominal modificado, se consensuó el grado de acuerdo de los expertos con la redacción de cada una de las recomendaciones. El acuerdo se valoró con la respuesta a la escala Likert. La puntuación «1» indica completo desacuerdo con lo expresado en el texto y la puntuación «5» indica completo acuerdo con este enunciado. Se definió alto grado de consenso en la redacción cuando el porcentaje de panelistas que otorgaron valores ≥4 en la escala de Likert fue igual o superior al 75%. Las recomendaciones finales se incluyeron en una tabla que, además de recoger la información estadística sobre el grado de acuerdo alcanzado por los panelistas en cada recomendación, muestra también los niveles de evidencia y los grados de recomendación de acuerdo con la clasificación del Centre for Evidence Based Medicine (CEBM) de Oxford5.
Consenso SER sobre el uso de FAMEb y FAMEsd en AR
| Estadísticos | NE | GR | ||
|---|---|---|---|---|
| Recomendaciones | ||||
| Recomendaciones generales | ||||
| Recomendación A. El tratamiento de la AR debe basarse en una decisión compartida entre el paciente y el reumatólogo | GA=100% | DE=0,49 | NA | NA |
| Recomendación B. Las decisiones terapéuticas se deben basar en la actividad de la enfermedad, la seguridad de los tratamientos y otros factores de los pacientes, tales como comorbilidades, la progresión del daño estructural o sus preferencias de administración | GA=100% | DE=0,52 | NA | NA |
| Recomendación C. Los reumatólogos son los especialistas responsables de la atención de los pacientes con AR | GA=92% | DE=0,67 | NA | NA |
| Recomendación D. La heterogeneidad y el curso crónico de la AR hacen necesario el acceso de los pacientes a múltiples fármacos con diferentes mecanismos de acción | GA=100% | DE=0,29 | NA | NA |
| Recomendación E. En el manejo de la AR el reumatólogo debe tener en cuenta el alto coste individual y sociosanitario que conlleva la enfermedad | GA=100% | DE=0,49 | NA | NA |
| Recomendaciones manejo AR | ||||
| Recomendación 1. Se recomienda el inicio de tratamiento con FAME sintéticos convencionales en cuanto se realice el diagnóstico de AR | GA=83% | DE=0,98 | 1a | A |
| Recomendación 2. Se recomienda alcanzar y mantener la remisión o, en su defecto, la baja actividad de la enfermedad como objetivo terapéutico en la AR | GA=100% | DE=0,29 | 1a | A |
| Recomendación 3a. En pacientes con AR y enfermedad activa o cambios recientes de tratamiento se recomienda monitorizar cada 1-3 meses | GA=100% | DE=0,39 | 2b | B |
| Recomendación 3b. En pacientes con AR con enfermedad estable, en los que se ha conseguido el objetivo terapéutico, se recomienda monitorizar cada 3-6 meses | GA=100% | DE=0,49 | 2b | B |
| Recomendación 4a. En pacientes con AR se recomienda el metotrexato en monoterapia como FAME de primera elección | GA=100% | DE=0,00 | 1a | A |
| Recomendación 4b. En caso de intolerancia y/o efectos adversos a metrotexato, se puede utilizar leflunomida o sulfasalazina | GA=100% | DE=0,00 | 1a | A |
| Recomendación 5a. En pacientes con AR se recomienda considerar la utilización de glucocorticoides como terapia puente en el tratamiento inicial o ante cambios de FAMEsc | GA=100% | DE=0,51 | 1a | A |
| Recomendación 5b. En aquellos pacientes en tratamiento con FAME y glucocorticoides en los no se consiga una reducción gradual o retirada de los glucocorticoides, se recomienda considerar la intensificación o cambio del FAME | GA=92% | DE=1,08 | 5 | D |
| Recomendación 6a. Cuando el objetivo terapéutico no se ha alcanzado con la primera estrategia de uso de FAMEsc, se recomienda añadir un FAMEb o un iJAK. En determinadas situaciones se podría cambiar a otro FAMEsc en monoterapia o combinación | GA=100% | DE=0,51 | 1a | A |
| Recomendación 6b. En caso de decidir utilizar un FAMEb, este se elegirá tras considerar las características del paciente, comorbilidades, posibilidad de uso concomitante de metotrexato, experiencia de uso y coste | GA=100% | DE=0,51 | 5 | D |
| Recomendación 7. En la artritis reumatoide que precisa terapia combinada de un FAMEb/sd con un FAMEsc se recomienda usar metrotexato; cuando metrotexato está contraindicado o produce intolerancia, se recomienda leflunomida | GA=100% | DE=0,39 | 1a | A |
| Recomendación 8. Cuando se inicia una terapia combinada de FAMEb/sd con metrotexato, se recomienda mantener la misma dosis de metrotexato | GA=92% | DE=0,90 | 1a | A |
| Recomendación 9. En caso de usar un FAMEb/sd en monoterapia, se recomienda un anti-IL-6R o un iJAK | GA=100% | DE=0,29 | 1a | A |
| Recomendación 10a. En pacientes con AR y fallo previo a un primer anti-TNF, se puede emplear un biológico con distinto mecanismo de acción, un iJAK o, incluso, un segundo anti-TNF | GA=100% | DE=0,39 | 1b | A |
| Recomendación 10b. En pacientes con AR y fallo previo a dos o más fármacos anti-TNF, se recomienda el empleo de un fármaco biológico con distinto mecanismo de acción o un iJAK | GA=100% | DE=0,29 | 1b | A |
| Recomendación 10c. En pacientes con AR y fallo a un biológico no anti-TNF o un iJAK, se puede utilizar cualquier otro FAMEb o iJAK | GA=100% | DE=0,39 | 4 | C |
| Recomendación 11. En pacientes con AR tratados con FAMEb/sd, en remisión o baja actividad durante al menos 6 meses, se recomienda valorar la reducción de dosis | GA=100% | DE=0,29 | 1b | A |
| Recomendaciones especiales | ||||
| Recomendación 12. En pacientes con artritis reumatoide con indicación de FAMEb/sd y enfermedad pulmonar intersticial difusa se recomienda, preferentemente, abatacept o rituximab o, como alternativa, anti-IL-6R o iJAK | GA=77% | DE=0,74 | 4 | C |
| Recomendación 13. En pacientes con AR y antecedente de cáncer que vayan a iniciar tratamiento biológico o dirigido, se recomienda tomar una decisión individualizada, consensuada con el paciente y su oncólogo | GA=92% | DE=0,58 | 4 | C |
| Recomendación 14. En pacientes con AR e insuficiencia cardiaca moderada o grave que precisen FAMEb/sd se recomienda evitar anti-TNF (clase III o IV de la NYHA) y rituximab (clase IV de la NYHA) | GA=100% | DE=0,39 | 4 | C |
| Recomendación 15. En pacientes con AR y enfermedad desmielinizante se recomienda evitar la utilización de anti-TNF | GA=100% | DE=0,29 | 4 | C |
DE: desviación estándar; GA: grado de acuerdo; GR: grado de recomendación procedente de los documentos Consenso SER, ACR, EULAR y GUIPCAR1-4; NE: nivel de evidencia procedente de los documentos Consenso SER, ACR, EULAR y GUIPCAR1-4.
Clasificación según el sistema el sistema del Centre for Evidence-Based Medicine (CEBM) de Oxford5.
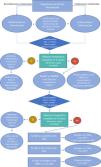
Algoritmo de tratamiento de la artritis reumatoide.
FAME: fármaco modificador de la enfermedad. B: biológico. sc: sintético convencional. OMA: Otro mecanismo de acción.
iJAK: Inhibidor de Janus kinasas. *: limitar el uso de iJAK en pacientes de 65 años o más, aquellos con factores de riesgo de enfermedad cardiovascular o tromboembólica, fumadores o con factores de riesgo adicionales de cáncer.
- A)
El tratamiento de la AR debe basarse en una decisión compartida entre el paciente y el reumatólogo. GA 100%; DE=0,49.
- B)
Las decisiones terapéuticas se deben basar en la actividad de la enfermedad, la seguridad de los tratamientos y otros factores de los pacientes, tales como comorbilidades, la progresión del daño estructural o sus preferencias de administración. GA 100%; DE=0,52.
- C)
Los reumatólogos son los especialistas responsables de la atención de los pacientes con AR. GA 92; DE=0,67.
- D)
La heterogeneidad y el curso crónico de la AR hacen necesario el acceso de los pacientes a múltiples fármacos con diferentes mecanismos de acción. GA 100%; DE=0,29.
- E)
En el manejo de la AR el reumatólogo debe tener en cuenta el alto coste individual y sociosanitario que conlleva la enfermedad. GA 100%; DE=0,49.
Por primera vez se incluyen en este documento de consenso una serie de principios generales, para los que no existe una evidencia contrastable, que establecen un marco para el manejo de la AR basado fundamentalmente en la opinión de los panelistas.
El primer principio enfatiza el papel decisivo que el paciente debe tener a la hora de participar en la elección del tratamiento más adecuado para su enfermedad, un principio fundamental en la concepción actual de la práctica médica. El principioB enumera los elementos clave que deben ser considerados a la hora de elegir un tratamiento, incluyendo aspectos como la preferencia en la vía de administración por el paciente, su frecuencia, etc. El principioC incide en el papel central del reumatólogo en el manejo de la AR; esto no cuestiona el hecho de que, en áreas en las que no exista acceso a un reumatólogo, algún otro especialista pudiera asumir el tratamiento de estos pacientes. Gran importancia tiene también el principio generalD, en el sentido de que, dada la complejidad de la AR y su curso crónico, con necesidad frecuente de cambiar de tratamiento a lo largo de la vida del paciente, no se debe limitar la disponibilidad de diferentes FAMEb o iJAK bajo el argumento de que ya existen otros fármacos accesibles. El último principio general incide en la necesidad de incorporar el factor económico entre los elementos para elegir un tratamiento. Esto tiene una doble perspectiva: por una parte, en el alto coste de algunas terapias debe considerarse el ahorro que suponen a largo plazo en discapacidad y pérdidas laborales; por otra, el coste de los medicamentos debe ser tenido en cuenta a la hora de elegir entre dos fármacos con el mismo perfil de eficacia y seguridad, priorizando el de menor coste.
RecomendacionesRecomendación 1. Se recomienda el inicio de tratamiento con FAME sintéticos convencionales en cuanto se realice el diagnóstico de AR. GA 83%; DE=0,98.
En la revisión sistemática para la actualización del tratamiento de la AR de la SER 2014, ACR 20212 y EULAR 20226 se muestra que el tratamiento con FAMEsc mejora los síntomas y signos de la AR, y que debe iniciarse tan pronto que se establezca el diagnóstico de la misma. Además, se enfatiza la importancia del diagnóstico y tratamiento precoces de la enfermedad, dado que numerosos estudios, ensayos clínicos y metaanálisis7,8 muestran que la duración de la enfermedad antes del inicio del tratamiento se asocia con la progresión radiográfica y con menor probabilidad de alcanzar la remisión.
Aunque los anti-TNF, tocilizumab (TCZ) y abatacept (ABA) estarían indicados en ficha técnica en pacientes con AR de inicio no tratados previamente con FAMEsc, y algunos estudios y metaanálisis muestran que el tratamiento inicial con FAMEb podría tener mejores resultados clínicos9-11, la estrategia de iniciar terapia con FAMEb no se contempla en las recomendaciones actuales. Son varios los motivos por los que el panel propone el inicio de tratamiento con FAMEsc. Además de los aspectos relacionados con la seguridad y el coste, un número alto de pacientes pueden alcanzar la remisión clínica con metotrexato (MTX), sin necesidad de un FAMEb o iJAK12,13.
Dos panelistas mostraron su disconformidad con esta recomendación alegando que habría que incluir a los pacientes con preartritis o artritis indiferenciada. Esta alternativa se basa en las recomendaciones EULAR 2016 para el manejo de la artritis precoz14, que recogen la posibilidad de ampliarse la prescripción de FAMEsc a pacientes con artritis indiferenciada, si el reumatólogo tiene una alta sospecha de que pueda evolucionar a una AR15-18. Finalmente, se decidió que la preartritis o artritis indiferenciada estaba fuera del objetivo del documento, lo cual no quiere decir que el panel estuviera en contra del posible uso precoz de FAMEsc en este perfil de pacientes.
Recomendación 2. Se recomienda alcanzar y mantener la remisión o, en su defecto, la baja actividad de la enfermedad como objetivo terapéutico en la AR. GA 100%; DE=0,29.
La remisión es el objetivo terapéutico más importante según las recomendaciones treat to target (T2T), así como las guías publicadas por distintas organizaciones4,19,20. Se ha demostrado que los pacientes que alcanzan la remisión muestran una mejor función física, mejor calidad de vida, mejor productividad, menor progresión del daño estructural, menor número de cirugías ortopédicas y menor coste por paciente, incluso cuando se compara con otro buen estado, como es la baja actividad21-23.
Sin embargo, la remisión o la baja actividad de la AR como objetivos son fuente de discusión. En las recomendaciones del ACR se prefiere como objetivo la baja actividad y luego considerar la remisión, ya que cuantos más tratamientos han fallado, más difícil es lograr el objetivo terapéutico. La remisión como objetivo no se recomienda porque, según los criterios establecidos, puede no ser alcanzable, y si no se alcanza, puede ser desalentador2. En el estudio TITRATE, en pacientes con AR establecida en actividad moderada a los que se aleatoriza a recibir tratamiento intensivo frente al tratamiento usual se demuestra que, aunque la remisión se consigue en un número mayor de pacientes en el brazo de intervención (32% vs. 18%), lo hace a expensas de aumentar de manera significativa el gasto. La gran discapacidad previa al tratamiento o el sobrepeso dificultaron lograr la remisión24. A pesar de estas consideraciones, el panel considera la remisión como el objetivo más deseable, especialmente en pacientes con una duración de la enfermedad relativamente corta.
El DAS28, el SDAI, el CDAI o los criterios booleanos se utilizan para describir la remisión19. Sin embargo, los pacientes con AR en quienes la sinovitis ha sido suprimida aún pueden tener dolor o fatiga significativa que no se explica por la actividad de la enfermedad. Se debe tener esto en cuenta al interpretar los índices de actividad de la AR.
Recomendación 3a. En pacientes con AR y enfermedad activa o cambios recientes de tratamiento se recomienda monitorizar cada 1-3 meses. GA 100%; DE=0,39.
Recomendación 3b. En pacientes con AR con enfermedad estable, en los que se ha conseguido el objetivo terapéutico, se recomienda monitorizar cada 3-6 meses. GA 100%; DE=0,49.
La actividad inflamatoria mantenida en pacientes con AR puede tener consecuencias irreversibles, por lo que es fundamental realizar una estrategia treat to target con monitorización adecuada25. Esta ha demostrado los beneficios a largo y a medio plazo en la evolución global de la enfermedad, independientemente del fármaco utilizado26-28.
No existen datos concretos sobre cuál es la periodicidad más adecuada para monitorizar la actividad clínica en pacientes con AR, dado que la mayor parte de los estudios no están diseñados para evaluar esto29,30. La mayoría de las publicaciones plantean periodos de monitorización que oscilan entre las 4 semanas y los 4 meses31-43.
El panel de expertos propone que, en inicios o cambios recientes de FAME, el rango óptimo de monitorización clínica debería oscilar entre 1 y 3 meses. En situación clínica estable, estas monitorizaciones se recomiendan espaciar a cada 3-6 meses. Por otra parte, el panel considera que, en situaciones especiales donde la enfermedad está controlada de manera sostenida y se cuenta con el apoyo de un profesional (médico de atención primaria) que realice controles analíticos intermedios, las monitorizaciones podrían alargarse a un máximo de 9 meses.
Por otro lado, el desarrollo creciente de las tecnologías de la información y comunicación (TIC) está permitiendo una revolución en el manejo de los pacientes en distintos ámbitos de la medicina44. El panel de expertos reconoce que existen determinadas circunstancias donde los pacientes con enfermedades crónicas podrían beneficiarse de un seguimiento telemático, apoyados por el uso de TIC, evitando visitas presenciales. Recientemente en EULAR se han publicado unas recomendaciones de cómo se debe hacer el seguimiento remoto en pacientes con enfermedades reumáticas45. En dicho documento se resalta la importancia de disponer de equipamiento necesario y de profesionales adecuadamente formados para llevar a cabo un control remoto de la enfermedad. La evidencia actual sobre modelos de implementación de estas herramientas en el ámbito hospitalario es aún escasa, aunque existen datos muy prometedores46,47. Sin embargo, el éxito de la implementación de estas técnicas requiere el desarrollo de soluciones digitales de alta calidad que hayan sido rigurosamente evaluadas en un marco clínico48.
Recomendación 4a. En pacientes con AR se recomienda el metotrexato en monoterapia como FAME de primera elección. GA 100%; DE=0,0.
Recomendación 4b. En caso de intolerancia y/o efectos adversos a metotrexato, se puede utilizar leflunomida o sulfasalazina. GA 100%; DE=0,0.
El panel consideró que los datos actuales refuerzan claramente el uso de MTX por delante de otros FAMEsc, teniendo en cuenta su probada efectividad, mucho más contrastada que la de hidroxicloroquina (HCQ), sulfasalazina (SSZ) o leflunomida (LEF), así como la flexibilidad de dosis y la experiencia en diferentes escenarios clínicos de la enfermedad2,49,50. La administración oral es preferible, gracias a su facilidad de uso, el buen perfil de seguridad y su biodisponibilidad a dosis iniciales del fármaco. Sin embargo, existen otros estudios que sugieren que la eficacia de la administración subcutánea es superior, aunque el coste de esta es un factor a considerar51-54. No se discutió en detalle la dosis de MTX, refiriendo para ello a versiones anteriores55; brevemente, se considera adecuado usarlo en escalada rápida de dosis, comenzando por 10-15mg y subiendo hasta alrededor de 25mg semanales.
La monoterapia con MTX se considera de elección porque la mayor carga de la terapia combinada (p. ej., múltiples medicamentos, mayor coste, más efectos adversos) supera la evidencia de calidad moderada que sugiere mejoras en la actividad de la enfermedad asociada a la combinación de FAMEsc. No obstante, el panel considera aceptable elegir FAMEsc en combinación, en algunas situaciones, con el fin de obtener una mayor respuesta a pesar de la carga adicional que representa tomar múltiples comprimidos56.
Algunos panelistas consideraron aceptable el uso de HCQ, por delante de MTX, en una AR de baja carga inflamatoria y sin factores de mal pronóstico, debido a su buen perfil de seguridad57,58, existiendo, no obstante, diferencias de criterio sobre este punto.
En caso de no poder usar MTX, la LEF ha demostrado su eficacia en la AR, a una dosis de 20mg diarios en monoterapia, tanto desde el punto de vista clínico como de progresión radiológica. Esta eficacia es similar a la de MTX, aunque se ha discutido si las dosis de MTX empleadas en estudios comparativos eran las óptimas para este fármaco59,60. LEF es también eficaz en combinación con agentes biológicos61,62 y con iJAK63, aunque con una evidencia menor a la disponible con MTX. Por estas razones, LEF puede considerarse como la primera alternativa al MTX en caso de intolerancia o contraindicación a MTX64.
La SSZ con cubierta entérica a dosis de 2g al día, escalada según tolerancia hasta los 3-4g, ha demostrado una eficacia similar al MTX, desde el punto de vista clínico y radiológico65-70. Además, es segura durante el embarazo. Sin embargo, al no existir en España SSZ con cubierta entérica, la mala tolerabilidad de las dosis de 3-4g limita el uso de este fármaco64,71.
Por último, la cloroquina (CQ) y, fundamentalmente, la HCQ son fármacos cuyo uso en monoterapia en la AR está prácticamente desechado, sin perjuicio de lo comentado anteriormente en pacientes leves. Su utilización en AR ha quedado prácticamente limitada a la terapia combinada con SSZ y MTX. La HCQ, al igual que la SSZ, es un fármaco seguro en el embarazo72.
En pacientes con nodulosis inducida por MTX se debe considerar cambio de FAME, aunque la información sobre la eficacia de LEF o SSZ en esta situación es limitada73.
Recomendación 5a. En pacientes con AR se recomienda considerar la utilización de glucocorticoides como terapia puente en el tratamiento inicial o ante cambios de FAMEsc. GA 100%; DE=0,51.
Recomendación 5b. En aquellos pacientes en tratamiento con FAME y glucocorticoides en los no se consiga una reducción gradual o retirada de los glucocorticoides, se recomienda considerar la intensificación o cambio del FAME. GA 92%; DE=1,08.
Existen evidencias de que los GC a dosis bajas son frecuentemente necesarios como tratamiento inicial para aliviar los síntomas antes del inicio de la acción de los FAMEsc.
Aunque no se conoce la duración óptima del tratamiento, las últimas recomendaciones ACR 2021 y EULAR 2019 sugieren, basándose en opinión de expertos, que, si son necesarios, no se debe prolongar más de 3 meses por su toxicidad significativa2,3. Así, el tratamiento con GC debería limitarse a la mínima dosis efectiva con la menor duración posible.
Según las últimas recomendaciones EULAR 2019, hubo unanimidad en que deberían usarse principalmente como terapia puente hasta que los FARMEsc muestren su eficacia y con una reducción gradual rápida3.
El fracaso para mantener el objetivo terapéutico en la reducción gradual o la retirada de GC después de la fase de terapia puente debe considerarse como un fracaso de esta fase terapéutica y, por lo tanto, se debe plantear el inicio de un FAMEb o un iJAK añadido al FAMEsc.
En cuanto al debate sobre la preferencia de tratamiento con FAMEb o iJAK al tratamiento con FAMEsc más GC, al menos tres ensayos clínicos han mostrado respuestas similares cuando se comparó MTX más GC con MTX más FAMEb38,74,75. Sin embargo, se ha objetivado que el uso prolongado de GC después del período puente (menos de 3 meses) conlleva al impacto negativo de los GC con efectos indeseables en los pacientes a largo plazo, incluido el riesgo para infecciones, osteoporosis y enfermedades cardiovasculares, en AR y en otras enfermedades reumáticas, lo cual apoya la creciente evidencia76-81.
Recomendación 6a. Cuando el objetivo terapéutico no se ha alcanzado con la primera estrategia de uso de FAMEsc, se recomienda añadir un FAMEb o un iJAK. En determinadas situaciones se podría cambiar a otro FAMEsc en monoterapia o combinación. GA 100%; DE=0,51.
Recomendación 6b. En caso de decidir utilizar un FAMEb, este se elegirá tras considerar las características del paciente, comorbilidades, posibilidad de uso concomitante de metotrexato, experiencia de uso y coste. GA 100%; DE=0,51.
El panel considera que la estratificación del riesgo es un aspecto de la máxima relevancia en el manejo de la AR. Un estado de alta actividad, positividad del factor reumatoide y/o de los anticuerpos anti-proteínas citrulinadas (ACPA), el fracaso a dos o más FAMEsc y la presencia de erosiones son factores de mal pronóstico en la AR82,83. Además, los panelistas consideran que una respuesta inadecuada (RI) al MTX representa de por sí un factor de mal pronóstico en la AR.
En los pacientes con algún factor de mal pronóstico se recomienda añadir un FAMEb o un iJAK, tras una adecuada evaluación de los factores de riesgo del paciente (véase más adelante). El término «añadir» refleja el consenso de que se recomienda que el FAMEb/sd se use en combinación con FAMEsc, salvo intolerancia o contraindicación, dada la demostrada superioridad de la terapia combinada frente a la monoterapia con FAMEb/sd, particularmente para los anti-TNF84,85.
Todos los FAMEb muestran una eficacia comparable en el tratamiento de la AR con RI a MTX30.
Es costumbre iniciar el tratamiento biológico con un agente anti-TNF combinado con MTX por razones diversas, entre las que se encuentran la experiencia de los clínicos, más información de seguridad a largo plazo y la existencia de biosimilares de un coste inferior. La elección de ABA, rituximab (RTX) o inhibidores de IL-6R depende de diferentes factores: preferencias del paciente, coste del fármaco, comorbilidades, vía de administración, experiencia del clínico e indicaciones (RTX no tiene aprobación para su indicación en primera línea tras el fallo de MTX).
En AR, cuatro iJAK (tofacitinib, baricitinib, upadacitinib y filgotinib) han demostrado eficacia y seguridad en ECA de alta calidad metodológica en diferentes situaciones clínicas86-106. Recientemente se han publicado los resultados del ECA Oral-Surveillance107, no logrando demostrar la no inferioridad de tofacitinib frente a etanercept o adalimumab (ADA) respecto a la aparición de cáncer y eventos cardiovasculares relevantes en pacientes mayores de 50años con algún factor de riesgo cardiovascular. Otro estudio observacional sobre práctica clínica ha identificado un mayor riesgo de tromboembolismo venoso en los pacientes tratados con baricitinib frente a anti-TNF108. A raíz de estos resultados, el Comité para la Evaluación de Riesgos europeo (PRAC) de la Agencia Europea de Medicamentos (EMA) ha concluido que el aumento de riesgo de eventos cardiovasculares mayores, enfermedad tromboembólica, cáncer, infecciones graves y mortalidad por todas las causas identificado en estos estudios, debe ser considerado un efecto de clase para todos los iJAK, dada la similitud de todos estos medicamentos en su mecanismo de acción. Por todo ello, la EMA recomienda que, en los pacientes de 65años o más, aquellos con antecedentes o factores de riesgo de enfermedad cardiovascular, fumadores o exfumadores que fumaron durante un tiempo prolongado o con factores de riesgo adicionales de cáncer, se utilicen los iJAK únicamente cuando no se disponga de alternativas terapéuticas adecuadas. Así mismo, la EMA recomienda que, en pacientes con riesgo de enfermedad tromboembólica, los iJAK deben utilizarse con cautela51. Este panel considera que los iJAK son una alternativa razonable a los FAMEb en AR y que pueden ser utilizados tras una cuidadosa evaluación de la existencia de los factores de riesgo descritos.
En los pacientes sin factores de mal pronóstico con respuesta inadecuada a una primera estrategia con FAMEsc (que prácticamente siempre incluye MTX) se podría considerar otra estrategia con FAMEsc en monoterapia (LEF o SSZ) o en combinación (MTX +HCQ +SSZ —triple terapia— o MTX +LEF)12,30,51,52,109. No existen datos procedentes de ECA sobre el uso de MTX+LEF comparado con la adición de un FAMEb o un iJAK en este contexto, por lo que este panel no puede recomendar, en base a la evidencia científica existente, su utilización. No obstante, el panel es consciente de la frecuente intolerancia a la triple terapia, así como del uso extendido en nuestro medio de la combinación de MTX+LEF, por lo que, en casos seleccionados, esta combinación podría ser una alternativa razonable.
Recomendación 7. En la artritis reumatoide que precisa terapia combinada de un FAMEb/sd con un FAMEsc se recomienda usar metotrexato; cuando metotrexato está contraindicado o produce intolerancia, se recomienda leflunomida. GA 92%; DE=0,39.
Un ensayo clínico110 y diferentes estudios de cohortes62,111-113 han analizado diversas combinaciones de tratamiento de FAMEsc (incluyendo MTX, LEF y otros) con agentes anti-TNF, concluyendo que la mayoría que LEF y potencialmente otros FAMEsc son tan eficaces y seguros como MTX en combinación con distintos anti-TNF.
En un amplio estudio de cohortes114, colaborativo entre registros europeos, el porcentaje de pacientes que alcanzaron una buena respuesta EULAR a los 6 meses en el grupo de RTX+LEF (29,1%) fue estadísticamente superior al de RTX+MTX (21,1%) y al de RTX en monoterapia (19,3%). Resultados similares se observaron a los 12 meses, con una frecuencia de efectos adversos (EA) similar entre los grupos. Un análisis del registro RABBIT115 en pacientes con AR que no habían recibido previamente MTX concluyó que, para los pacientes intolerantes a MTX, la combinación RTX+LEF es una buena opción también a largo plazo. Un estudio de cohortes español116 mostró que la eficacia y la seguridad de TCZ combinado con MTX es similar a la combinación con LEF.
Una RS+metaanálisis117 comunicada recientemente ha analizado cuál es el mejor FAMEsc (MTX o LEF/otro) para combinar con un FAME biológico/iJAK. Para RTX, se observa una significativa mejor respuesta EULAR (RR=1,46, p<0,001) y mejor seguridad —no significativa— con LEF que con MTX. Con respecto a los sujetos que recibieron anti-TNF, la probabilidad de conseguir una respuesta EULAR buena o moderada es algo mayor cuando se combinan con MTX que con otros FAME sintéticos.
Los datos con ABA, TCZ o iJAK4,63 son insuficientes para establecer conclusiones.
Recomendación 8. Cuando se inicia una terapia combinada de FAMEb/sd con metotrexato, se recomienda mantener la misma dosis de metotrexato. GA 100%; DE=0,90.
Una RS118 ha establecido que en múltiples ECA y estudios observacionales de los FAMEb (muchos de ellos en pacientes con RI-MTX) la dosis máxima de MTX que se combina con el agente biológico al inicio de la terapia era de 25mg semanales para la administración oral y de 15mg para la parenteral, siendo las dosis medias de 12,5-15mg semanales.
El estudio CONCERTO119 investigó la eficacia y la seguridad de dosis crecientes semanales de MTX en combinación con ADA en AR. Sus resultados sugieren que las dosis de 10 y 20mg semanales de MTX al combinarse con ADA son similares, mostrando menor eficacia las de 2,5 y 5mg semanales. El estudio MUSICA120 investigó la utilidad de reducir la dosificación de MTX (7,5mg semanales frente a 20mg semanales) cuando se inicia, en pacientes con fracaso previo a este fármaco, su combinación con ADA. Sus resultados no apoyan la reducción rutinaria de la dosis de MTX cuando se inicia la terapia combinada con ADA. La interpretación y aplicación a la práctica de estos estudios originó un interesante debate dentro del grupo elaborador de estas recomendaciones; algún miembro consideró que la evidencia podría avalar la reducción de dosis de MTX a 10mg cuando se inicia la combinación con un anti-TNF. De cualquier manera, el grupo acordó que, cuando se combina MTX con anti-TNF, la dosis de partida de MTX debe ser de, al menos, 10mg semanales.
No hay estudios que comparen diferentes dosis de MTX cuando se combina con iJAK. Por lo tanto, el panel recomienda continuar con la misma dosis de MTX que previamente recibía el paciente. En los ECA pivotales de tofacitinib (así como en los estudios de práctica real) la dosis combinada de MTX osciló entre 7,5 y 25mg semanales87,90,91,121, y en los de baricitinib, entre 10-25mg cada 7días93.
Se ha sugerido también que repartir la dosis semanal total de MTX en 2-3 tomas orales cada 2-3 días puede ser mejor que darla toda junta y similar al empleo de la vía parenteral, en términos de eficacia y tolerabilidad122.
Recomendación 9. En caso de usar un FAMEb/sd en monoterapia, se recomienda un anti-IL-6R o un iJAK. GA 100%; DE=0,29.
Todos los FAMEb/sd tienen más eficacia cuando se combinan con MTX u otro FAMEsc comparado con su prescripción individual123. Sin embargo, a diferencia de la monoterapia con anti-TNF, ABA y RTX, el uso aislado de anticuerpos contra el receptor de la IL-6 (sarilumab, tocilizumab [TCZ]) y de los iJAK puede lograr un adecuado efecto terapéutico, parecido al que se consigue cuando se combinan con MTX y superior a la monoterapia con otros agentes biológicos124-129.
Diferentes estudios han comparado la terapia combinada TCZ+MTX frente a la monoterapia con TCZ, demostrando que no existen diferencias significativas entre los dos grupos en la eficacia, especialmente a corto plazo130,131. Sin embargo, en otros estudios la terapia combinada TCZ+MTX parece significativamente superior a medio/largo plazo en la tasa de remisión booleana y en la progresión radiológica132. La monoterapia con TCZ o sarilumab es superior a la monoterapia con ADA128,129.
Respecto a los iJAK, todos ellos han demostrado su eficacia en monoterapia95,97,106,127,133,134. La comparación del tratamiento combinado de tofacitinib y MTX con tofacitinib en monoterapia demuestra la eficacia de esta última intervención, aunque levemente inferior a la de la terapia combinada127. Baricitinib ha demostrado eficacia en monoterapia similar a la del tratamiento combinado con MTX en pacientes con AR de inicio95,133. Upadacitinib y filgotinib han demostrado también su eficacia en monoterapia, aunque se carece de estudios comparativos directos con su uso en combinación con MTX97,134.
Recomendación 10a. En pacientes con AR y fallo previo a un primer anti-TNF, se puede emplear un biológico con distinto mecanismo de acción, un iJAK o, incluso, un segundo anti-TNF. GA 100%; DE=0,39.
Recomendación 10b. En pacientes con AR y fallo previo a dos o más fármacos anti-TNF, se recomienda el empleo de un fármaco biológico con distinto mecanismo de acción o un iJAK. GA 100%; DE=0,29.
Recomendación 10c. En pacientes con AR y fallo a un biológico no anti-TNF o un iJAK, se puede utilizar cualquier otro FAMEb o iJAK. GA 100%; DE=0,39.
En la práctica clínica se plantea, con mucha frecuencia, la necesidad de cambiar de fármaco biológico o iJAK debido, en la mayoría de los casos, a ineficacia135-137. Además, se conoce que la supervivencia de los distintos fármacos es menor a medida que aumentan las líneas de tratamiento empleadas138. Dentro de esta situación general, el panel valoró tres posibles escenarios distintos. Los dos primeros se centraron en evaluar la respuesta, la persistencia y/o los costes de FAMEb (incluyendo otro anti-TNF) o iJAK tras fracaso a terapia anti-TNF136-175. Con respecto al cambio a un segundo fármaco biológico tras fracaso a un primer anti-TNF, distintos estudios, tanto ensayos clínicos como estudios de cohortes142,143,146,148,149,153,156-158,160,164,165,168,170,172, demuestran la eficacia de un fármaco biológico con otro mecanismo de acción (OMA), un iJAK o, incluso, un segundo anti-TNF. Este respaldo de la evidencia facilitó un buen grado de acuerdo entre los panelistas a la hora de emitir la recomendación. Aunque varios de estos estudios muestran algunas diferencias entre las distintas opciones de tratamiento, la evidencia disponible no permite recomendar la elección de un fármaco concreto sobre otro, por lo que el panel decidió establecer una cierta prioridad entre los fármacos en la redacción de la recomendación, dando preferencia al cambio de diana terapéutica, pero sin establecer una jerarquía clara y dejar abierta la elección de uno u otro fármaco en función de la valoración individualizada de cada paciente. Algo más clara es la evidencia disponible acerca del tratamiento a elegir tras el fracaso a dos o más fármacos anti-TNF136-141,145,147,150-152,154,155,159,161-163,166,167,169,171,173-176. Dicha evidencia demuestra mayor eficacia tras el cambio a un fármaco con OMA frente a un tercer o sucesivo anti-TNF. El panel recomienda este cambio de mecanismo de acción tras el fracaso a dos o más anti-TNF con un elevado grado de acuerdo aunque, de la misma manera que en el escenario anterior, la evidencia existente no permite recomendar un mecanismo de acción sobre otro, por lo que la elección del mismo queda abierta a la evaluación individualizada de cada caso. La tercera parte de la recomendación incluye aquellos pacientes en los que ha fracasado, al menos, un tratamiento previo con fármacos biológicos no anti-TNF o iJAK. Estudios de distinta calidad desde el punto de vista de la evidencia científica analizan el tratamiento de pacientes en los que ha fallado un tratamiento con OMA177-185 y demuestran ventajas, sobre todo desde el punto de vista de la supervivencia, del tratamiento con otro fármaco con OMA o iJAK frente a un fármaco anti-TNF. Sin embargo, la variabilidad en los fármacos empleados en los distintos estudios impide, nuevamente, recomendar una jerarquía en la elección del fármaco. Finalmente, en el escenario de pacientes con fracaso al tratamiento con un iJAK, distintos estudios, en general con baja calidad desde el punto de vista de la medicina basada en la evidencia177,181,183,184, muestran la eficacia de un segundo iJAK, similar a la de fármacos anti-TNF o con OMA, aunque con ciertas ventajas en la persistencia del tratamiento para los primeros. La evidencia disponible, que no permite estratificar el tratamiento con fármacos anti-TNF, con OMA o iJAK tras el fracaso a los dos últimos, llevó al panel a emitir una única recomendación para este escenario, con un menor grado de acuerdo que otras, sin jerarquizar la elección entre ellos, que quedará supeditada a la valoración individual del paciente en cada caso.
En todos estos escenarios se debe tener presente la recomendación comentada previamente de limitar el uso de iJAK en los pacientes mayores de 65años con antecedentes o factores de riesgo de enfermedad cardiovascular o cáncer.
Recomendación 11. En pacientes con AR tratados con FAMEb/sd, en remisión o baja actividad durante al menos 6 meses, se recomienda valorar la reducción de dosis. GA 77%; DE=0,29.
Desde hace tiempo se ha planteado la suspensión o reducción progresiva de la dosis en aquellos pacientes que están en remisión o en baja actividad de la enfermedad, lo que supondría para el paciente un menor riesgo, además de una reducción del gasto.
La suspensión del tratamiento biológico conlleva, en una alta proporción de pacientes, una reactivación de la enfermedad y un mayor daño irreversible, por lo que no es aconsejable186-196. Sin embargo, hay evidencia de que los pacientes con AR en remisión o baja actividad de la enfermedad durante al menos 6 meses pueden reducir la dosis de los FAMEb/sd. Estos estudios se han realizado tanto con los anti-TNF como con otras terapias dirigidas. La mayoría de los resultados son coincidentes en que la reducción de dosis en pacientes que han conseguido el objetivo terapéutico de forma sostenida mantiene la remisión o la baja actividad en la mayoría de los casos, recuperándose el control de la enfermedad con la intensificación del tratamiento en caso de reactivación192,196-209.
En cuanto a las diferentes estrategias de reducción de dosis o espaciamiento de esta, no hay diferencias en los resultados210.
Varios estudios identifican perfiles y marcadores asociados a mayor éxito en la reducción del tratamiento: AR de corta evolución, varones, remisión o baja actividad conseguida de forma precoz, títulos bajos o negativos del factor reumatoide y combinación con MTX, otros FAMEsc o GC6,50,211-213.
En la situación de pacientes con AR en remisión o baja actividad que reciban tratamiento combinado de MTX con FAMEb o FAMEsd no hay diferencia en cuál de las dos estrategias reducir primero, por lo que se deberá tener en cuenta para tomar esta decisión el coste y otros factores como comorbilidades, la formación de anticuerpos antifármacos y la opinión del paciente214-218.
Algunas incertidumbres sobre esta recomendación resaltan la importancia de que la decisión sobre reducir o espaciar un FAMEb/sd sea compartida entre reumatólogos y pacientes.
Recomendaciones especialesRecomendación 12. En pacientes con AR con indicación de FAMEb/sd y enfermedad pulmonar intersticial difusa se recomienda, preferentemente, abatacept o rituximab o, como alternativa, anti-IL-6R o iJAK. GA 77%; DE=0,74.
La enfermedad pulmonar intersticial difusa asociada a la AR (EPID-AR) es la manifestación pulmonar más frecuente en los pacientes con AR, y ocasiona una elevada morbimortalidad219,220. Tanto las nuevas recomendaciones de la SER-SEPAR para el manejo de la EPID-AR221, como la guía de práctica clínica para el manejo de pacientes con AR de la SER (GUIPCAR), y la guía de la Sociedad Británica de Reumatología222, coinciden en señalar en sus RS que ABA y RTX son los agentes biológicos con más evidencia de seguridad en estos pacientes223-225, mientras que los fármacos anti-TNF podrían asociarse a un riesgo de empeoramiento de una EPID-AR preexistente (con bajo nivel de evidencia)226. La experiencia española de uso de ABA en práctica clínica avala la seguridad de su utilización en la EPID-AR223-225. Además, en un estudio que analizó datos de seguridad de 3.173 pacientes incluidos en los estudios pivotales con ABA, la incidencia de EPID fue de 1,1/1.000 pacientes-año, cifra similar a la estimada en AR227. Asimismo, existen trabajos observacionales con RTX que confirman su seguridad y su posible utilidad para estabilizar o mejorar la función pulmonar en estos pacientes224,228,229.
Por otro lado, la evidencia publicada con inhibidores de la IL-6 en pacientes con AR-EPID se limita a TCZ y, a pesar de que algunos estudios han sido contradictorios230,231, otros muestran un adecuado perfil de seguridad232. En cuanto a los iJAK, si bien en los ECA de desarrollo de tofacitinib se notificaron casos de EPID, en un análisis post hoc la incidencia de EPID fue similar a la estimada en AR233. De manera similar, la información existente con baricitinib no ha detectado un incremento de riesgo de desarrollo o exacerbación de EPID en los ensayos clínicos234.
En este contexto, el panel considera que, con la información disponible, resulta razonable priorizar el uso de ABA o RTX en estos pacientes, pero manteniendo TCZ o los iJAK como alternativas adecuadas.
Recomendación 13. En pacientes con AR y antecedente de cáncer que vayan a iniciar tratamiento biológico o dirigido, se recomienda tomar una decisión individualizada, consensuada con el paciente y su oncólogo. GA 92%; DE=0,58.
El panel considera que la literatura existente no permite contestar a esta pregunta de forma más concreta. Algunos estudios observacionales en pacientes con AR y cáncer que han recibido FAMEb aportan, no obstante información de interés.
Varias publicaciones de registros europeos no han encontrado diferencias en cuanto a la recurrencia de cáncer entre pacientes con AR tratados con anti-TNF, RTX o FAMEsc235-238, o incluso con otras patologías como psoriasis y enfermedad inflamatoria intestinal239. Un metaanálisis publicado en 2020240 confirmó que los pacientes con AR y una neoplasia previa tratados con FAMEb no tenían un riesgo aumentado de desarrollar cáncer en comparación con los pacientes tratados con FAMEsc. Otros estudios que han evaluado a pacientes con cáncer de cabeza y cuello241 y de mama242,243 tratados con anti-TNF tampoco han encontrado una mayor tasa de recurrencia.
No existen estudios observacionales longitudinales que analicen el riesgo de recurrencia de cáncer en pacientes tratados con FAMEb no anti-TNF (aparte de RTX y anakinra) o iJAK. Los estudios sobre incidencia de cáncer en pacientes con AR sin antecedentes de cáncer no muestran un riesgo aumentado con FAMEb no anti-TNF, salvo con ABA. En un estudio post-comercialización244 se observó un ligero aumento de melanoma en pacientes tratados con ABA en comparación con otros FAMEb, y una RS245 halló un aumento del riesgo de cáncer en general en comparación con anti-TNF y de cáncer de piel no melanoma en comparación con FAMEsc, al igual que ocurre con los anti-TNF17,245-247. Con respecto a los iJAK, dos metaanálisis previos17,248 no habían detectado un aumento de la incidencia de cáncer. Sin embargo, en el ensayo clínico aleatorizado ORAL Surveillance107,249, tofacitinib no alcanzó criterios de no inferioridad en cuanto a la incidencia de cáncer con respecto a los anti-TNF.
Ante estos hallazgos, el grupo elaborador consideró que es razonable usar FAMEb/sd en pacientes con antecedente de cáncer. Los datos de seguridad sobre ABA e iJAK plantean la conveniencia de reservar estos fármacos para aquellos pacientes que no puedan recibir un fármaco anti-citoquina (TNF o IL-6) o RTX. No obstante, dado que estos hallazgos no han sido obtenidos en poblaciones de pacientes con una neoplasia previa —el objeto de esta recomendación—, finalmente no se estableció tal recomendación, dejando la decisión como fruto del consenso entre el reumatólogo, el oncólogo y el paciente. Se deben tener en cuenta factores como la naturaleza y el estadio del cáncer previo (no todos los cánceres tienen el mismo riesgo de recidiva ni el mismo horizonte temporal), el tratamiento recibido o la actividad de la AR250.
Recomendación 14. En pacientes con AR e insuficiencia cardiaca moderada o grave que precisen FAMEb/sd se recomienda evitar anti-TNF (clase III o IV de la New York Heart Association [NYHA]) y rituximab (clase IV de la NYHA). GA 100%; DE=0,39.
Hasta la fecha no hay demasiada evidencia apoyando esta pregunta de investigación diferente a la aportada en las últimas guías ACR 20212.
Diferentes ECA con terapia anti-TNF en pacientes con insuficiencia cardíaca (IC) crónica moderada-grave han mostrado un mayor riesgo de eventos clínicos adversos. Hay tres ensayos con etanercept: RENAISSANCE, RECOVER y RENEWAL, en IC moderada a grave, sin AR, los cuales no demostraron ningún beneficio clínico en pacientes con IC y sugirieron que etanercept puede afectar negativamente el curso de la IC251-253. Otro ECA con infliximab, el ATTACH, concluyó que el anti-TNF con infliximab no mejoró la IC y afectó de forma negativa el estado clínico de los pacientes con IC moderada a grave254. Con ADA también se han notificado casos de empeoramiento de la IC congestiva255.
En este sentido, se recomienda que los anti-TNF deben usarse con precaución en pacientes con IC congestiva leve (clase I/II de la NYHA), y estos pacientes deben ser monitorizados de cerca y se recomienda evitar anti-TNF en pacientes con IC moderada-grave (clase III/IV de la NYHA)251-256. En estudios con RTX en pacientes con IC crónica grave se ha observado un mayor riesgo de eventos clínicos adversos y está contraindicado en pacientes con AR e IC grave (clase IV de la NYHA) o enfermedades cardiacas graves no controladas257.
Por otro lado, en línea con esta recomendación, para pacientes con AR que ya están en tratamiento con un anti-TNF o RTX que desarrollan una IC moderada/grave o grave, en el caso del RTX, el panel considera adecuado el cambio a FAMEb no anti-TNF o FAMEsd252,255-257.
Recomendación 15. En pacientes con AR y enfermedad desmielinizante se recomienda evitar la utilización de anti-TNF. GA 100%; DE=0,29.
Esta recomendación se deriva de una actitud cautelosa en un entorno de evidencia limitada y considerando las múltiples opciones terapéuticas en pacientes con AR.
La AR no se asocia a un mayor riesgo de esclerosis múltiple (EM)258; sin embargo, el tratamiento con anti-TNF puede aumentar los brotes en pacientes con EM. Se han publicado múltiples series de casos de enfermedad desmielinizante en pacientes con AR y tratamiento con anti-TNF; sin embargo, no está claro si estos inducen la aparición de EM o desenmascaran una enfermedad desmielinizante previa. Varios estudios epidemiológicos más recientes han intentado aclarar esta asociación. En los datos del registro británico de 2021 no se observó un aumento de riesgo, tan solo marginal en hombres, y posiblemente asociado a mayor tabaquismo en este grupo259. Se han obtenido resultados similares en un estudio con pacientes de los registros de Dinamarca (DANBIO) y Suecia (ARTIS) publicado en 2020 con un total de 111.455 pacientes. En este estudio se observó un aumento de riesgo de enfermedad desmielinizante en pacientes en tratamiento con anti-TNF y espondiloartritis y artritis psoriásica, pero no en AR259. Este estudio se planteó después de un mayor riesgo observado en hombres en un estudio de DANBIO de 2016 sin suficiente poder estadístico260. Por otra parte, hay dos estudios de casos y controles, uno de Canadá de 2022, con 296.918 pacientes, y otro de la Clínica Mayo (EE.UU.) de 2020, con 212 pacientes, en los que se observa un aumento de riesgo de EM261 y eventos desmielinizantes262 con el uso de anti-TNF en una población mixta de enfermedades reumáticas sin análisis específico para AR.
En conclusión, los eventos desmielinizantes con anti-TNF en AR son muy poco frecuentes y no queda claro si existe un mayor riesgo asociado a su uso, salvo quizá en hombres y relacionado con tabaquismo. No hay datos disponibles respecto a otras dianas terapéuticas distintas a los anti-TNF. Por otra parte, no se dispone de suficiente evidencia para saber si es seguro reiniciar el anti-TNF en pacientes que desarrollan enfermedad desmielinizante. En este contexto de evidencia limitada, y dado que en AR se dispone de dianas terapéuticas alternativas, el panel recomienda no reiniciar el anti-TNF en este escenario.
Por último, el panel considera que, dado que las enfermedades desmielinizantes tienen un inicio de síntomas insidioso y con una progresión lenta, es importante estar alerta ante posibles síntomas de alarma en pacientes que inician tratamiento con anti-TNF, ya que la suspensión rápida del fármaco mejora el pronóstico.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónFundación Española de Reumatología.
Contribución de los autoresLos autores han hecho contribuciones sustanciales según el análisis de los datos, el borrador del artículo y la aprobación definitiva de la versión que se presenta.
Conflicto de interesesJosé María Álvaro-Gracia Álvaro ha recibido financiación de Abbvie, Lilly, MSD, Novartis, Pfizer y Roche para la asistencia a cursos/congresos; honorarios de Abbvie, BMS, Lilly MSD, Novartis, Pfizer, Sanofi, Roche y UCB en concepto de ponencias; financiación de Abbvie, BMS, Galápagos, Gilead, Janssen-Cilag, Lilly, MSD, Novartis, Pfizer, Sanofi, Tigenix, Roche y UCB en concepto de consultorías para compañías farmacéuticas u otras tecnologías; ayuda económica de Abbvie, BMS, Lilly, MSD, Novartis, Pfizer, Roche y UCB para la dotación de material a la unidad o servicio, y ayuda económica de Abbvie, BMS, Lilly, MSD, Novartis, Pfizer, Roche y UCB para la financiación de una investigación.
José Luis Andreu Sánchez ha recibido financiación de Abbvie, Janssen, Pfizer y UCB para la asistencia a cursos/congresos; honorarios de Abbvie, AstraZeneca, Biogen, GSK, Janssen y Lilly en concepto de ponencias; financiación de Abbvie, AstraZeneca y Pfizer para programas educativos o cursos; financiación de BMS por participar en una investigación, y financiación de Abbvie, Biogen, Galápagos, GSK, MSD, Roche y UCB en concepto de consultorías para compañías farmacéuticas u otras tecnologías.
Alejandro Balsa ha recibido financiación de Abbvie, Galápagos, Lilly, Pfizer y UCB para la asistencia a cursos/congresos; honorarios de Abbvie, BMS, Fresenius, Galápagos, Lilly, Nordic, Novartis, Pfizer, Rubio, Sandoz y UCB en concepto de ponencias; financiación de Abbvie, BMS, Novartis y UCB para programas educativos o cursos; financiación de Abbvie, Nordic, Novartis, Pfizer y UCB por participar en una investigación; honorarios de Abbvie, BMS, Fresenius, Galápagos, Lilly, Nordic, Novartis, Pfizer, Sandoz, Sanofi y UCB en concepto de consultorías para compañías farmacéuticas u otras tecnologías; ayuda económica de UCB para la financiación de una investigación y financiación de Novartis, para programas educativos o cursos para la unidad.
Rafael Cáliz ha recibido financiación de GSK, MSD y Novartis para la asistencia a cursos/congresos; honorarios de Abbvie, GSK, Lilly y Novartis en concepto de ponencias; financiación de Janssen para programas educativos o cursos; ayuda económica de GSK y Janssen para la financiación de una investigación y financiación de Abbvie, GSK y Novartis para programas educativos o cursos para la unidad.
Isabel Castrejón Fernández ha recibido financiación de Janssen, Lilly y Pfizer para la asistencia a cursos/congresos, y honorarios de BMS, Galápagos, Gilead, GSK, Janssen, Lilly, MSD, Novartis, y Pfizer en concepto de ponencias.
Héctor Corominas ha recibido financiación de Abbvie, Lilly y Pfizer para la asistencia a cursos/congresos; honorarios de Abbvie, Lilly, Gebro y Pfizer en concepto de ponencias; financiación de Amgen, Jansen, Lilly y Sandoz para programas educativos o cursos; financiación de Gebro, MSD y Sanofi por participar en una investigación; honorarios de Abbvie, Amgen, MSD y Sanofi en concepto de consultorías para compañías farmacéuticas u otras tecnologías, y financiación o ayudas económicas de Abbvie, Amgen, BMS, Galápagos, Gebro, GSK, Jansen, Kern, Lilly, MSD, Nordic, Pfizer, Roche y UCB para la creación de la unidad o servicio.
Petra Díaz del Campo Fontecha ha declarado ausencia de intereses en relación con este documento de recomendaciones.
José A. Gómez Puerta ha recibido financiación de Abbvie, BMS, Galápagos, Lilly, Pfizer y Roche para la asistencia a cursos/congresos; honorarios de Abbvie, BMS, Galápagos, GSK, Janssen, Lilly, MSD, Novartis, Otsuka, Pfizer y Roche en concepto de ponencias; financiación de Amgen, Galápagos, Lilly y Pfizer para programas educativos o cursos; honorarios de Galápagos, GSK, Roche y Sanofi en concepto de consultorías para compañías farmacéuticas u otras tecnologías, y financiación de Abbvie para dotación de material a la unidad o servicio.
Sara Manrique Arija ha recibido financiación de Abbvie, Johnson & J, Lilly, Novartis, Pfizer y UCB para la asistencia a cursos/congresos; honorarios de Abbvie, Gedeon, Johnson & Johnson, Lilly, Menarini, MSD, Novartis, Pfizer y UCB en concepto de ponencias; honorarios de Abbvie, Lilly, Novartis y UCB en concepto de consultorías para compañías farmacéuticas u otras tecnologías; financiación de la Sociedad Andaluza de Reumatología para dotación de material a la unidad o servicio y para contratación o ayudas económicas para contratar personal en la unidad o servicio.
Natalia Mena Vázquez ha recibido financiación de Abbvie, Novartis, Pfizer y Roche para la asistencia a cursos/congresos; honorarios de Abbvie, MSD, Pfizer y Roche en concepto de ponencias, y financiación de Abbvie y MSD para programas educativos o cursos.
Ana Ortiz García ha recibido financiación de Abbvie, AsacPharma, Lilly, Pfizer y UCB para la asistencia a cursos/congresos; honorarios de Lilly y Sanofi en concepto de ponencias; ayuda económica de Abbvie y Pfizer para la financiación de una investigación, y honorarios de Abbvie en concepto de consultorías para compañías farmacéuticas u otras tecnologías.
Chamaida Plasencia Rodríguez ha recibido financiación de Theramex y UCB para la asistencia a cursos/congresos; honorarios de Biogen, Lilly, Novartis, Pfizer, Sandoz, Sanofi y UCB en concepto de ponencias, y ayuda económica de Abbvie para la financiación de una investigación.
Lucía Silva Fernández ha recibido financiación de Gebro, Lilly, Novartis y Pfizer para la asistencia a cursos/congresos; honorarios de Abbvie, Amgen, BMS, FAES, GSK, Janssen Lilly, Novartis y Pfizer en concepto de ponencias, y honorarios de Janssen, MSD, Novartis, Pfizer y Sanofi en concepto de consultorías para compañías farmacéuticas u otras tecnologías.
Jesús Tornero Molina ha recibido financiación de Fresenius, Gebro y Sanofi para la asistencia a cursos/congresos o en concepto de ponencias.
AgradecimientosEl grupo de expertos del presente trabajo quiere manifestar su agradecimiento a Mercedes Guerra Rodríguez, documentalista de la SER, por su colaboración en las estrategias de búsqueda de la evidencia. También quieren agradecer al Dr. Federico Díaz González, director de la Unidad de Investigación de la SER, por contribuir a preservar la independencia de este documento.