Evaluar la influencia del peso de los pacientes en el coste de tratamiento de la artritis reumatoide con fármacos biológicos indicados en primera línea tras respuesta inadecuada a metotrexato.
Pacientes y métodoSe incluyeron costes farmacológicos y de administración considerando no optimización y optimización de viales de los fármacos intravenosos. Los datos de posologías y peso de pacientes se obtuvieron de forma retrospectiva de 66 pacientes atendidos en un servicio de Reumatología Clínica de un hospital terciario en España. El horizonte temporal del estudio fue de 2 años. Los costes se expresaron en euros de 2013.
ResultadosEn un paciente promedio de 69kg de peso, abatacept subcutáneo (ABA SC) fue el fármaco de menor coste (21.028,09 €) sin optimización de viales, e infliximab (IFX) (20.779,29 €) con optimización de viales. Considerando el peso de los pacientes, sin optimización de viales, IFX fue menos costoso en pacientes de 45-49kg, ABA intravenoso en pacientes de 50-60kg y ABA SC en pacientes ≥ 60kg. Con optimización de viales IFX sería menos costoso en pacientes < 70kg y ABA SC pacientes ≥ 70kg.
ConclusionesSuponiendo efectividad comparable de fármacos biológicos, el peso de los pacientes es una variable relevante, pudiendo alcanzarse ahorros potenciales superiores a 20.000 € en pacientes de más de 100kg de peso en 2 años de tratamiento.
The objective was to assess the influence of patients’ weight in the cost of rheumatoid arthritis treatment with biologic drugs used in first line after non-adequate response to methotrexate.
Patients and methodPharmaceutical and administration costs were calculated in two scenarios: non-optimization and optimization of intravenous (IV) vials. The retrospective analysis of 66 patients from a Spanish 1,000 beds-hospital Rheumatology Clinic Service was used to obtain posology and weight data. The study time horizon was two years. Costs were expressed in 2013 euros.
ResultsFor an average 69kg-weighted patient the lowest cost corresponded to abatacept subcutaneous (SC ABA) (€21,028.09) in the scenario without IV vials optimization and infliximab (IFX) (€20,779.29) with optimization. Considering patients’ weight in the scenario without IV vials optimization infliximab (IFX) was the least expensive drug in patients ranged 45-49kg, IV ABA in 50-59kg and SC ABA in patients over 60kg. With IV vials optimization IFX was the least expensive drug in patients under 69kg and SC ABA over 70kg.
ConclusionsAssuming comparable effectiveness of biological drugs, patient's weight is a variable to consider, potentials savings could reach €20,000 in two years.
La artritis reumatoide (AR) tiene un gran impacto en la calidad de vida del paciente y origina un coste social y económico elevado1. Tiene un efecto negativo sobre la morbilidad y discapacidad de los pacientes2, que ven reducida su esperanza de vida en 5-10 años3, además de afectar a sus actividades diarias4,5.
Su tratamiento ha experimentado importantes avances debido en parte a los fármacos antirreumáticos moduladores de la enfermedad (FAME), que suponen el tratamiento de elección en AR6. Tras una primera línea de tratamiento con FAME tradicionales como metotrexato (MTX), la siguiente opción terapéutica la constituyen los llamados FAME biológicos, producidos en cultivos celulares mediante ingeniería genética7.
En España presentan indicación en primera línea de tratamiento, tras respuesta inadecuada a MTX: abatacept subcutáneo (ABA SC), abatacept intravenoso (ABA IV), adalimumab (ADA), certolizumab (CZP), etanercept (ETN), golimumab (GLM), infliximab (IFX), tocilizumab (TCZ) y anakinra (ANA). Si bien existen algunos estudios de comparación directa, como el estudio AMPLE8 o ADACTA9, gran parte de la información disponible procede de comparaciones indirectas, en las que se detectan pequeñas diferencias en cuanto a seguridad o eficacia10.
En los fármacos biológicos que se administran por vía IV (IFX, ABA y TCZ), la dosis se ajusta por peso del paciente. El resto, incluyendo ABA SC, se administran por vía subcutánea a una dosis fija independiente del peso. El objetivo principal del estudio fue evaluar la influencia del peso en el coste de tratamiento de AR con fármacos biológicos indicados en primera línea tras respuesta inadecuada a MTX.
Pacientes y métodosDiseñoSe diseñó un modelo en Microsoft® Excel® para calcular los costes farmacológicos y de administración. Los FAME incluidos fueron ABA SC, ABA IV, ADA, CZP, ETN, GLM, IFX y TCZ, excluyéndose ANA por su reducido uso en la práctica clínica. El horizonte temporal fue de 2 años, considerando siempre en el primer año las posologías de inducción y el posible escalado de dosis.
Para determinar las características demográficas de los pacientes con AR en España, se recogieron de forma retrospectiva datos de género, edad y peso de una serie consecutiva de 66 pacientes tratados en un hospital terciario de 1.000 camas de la Comunidad Valenciana.
Cálculo de costesSe estimó el coste total por FAME de un paciente promedio, con el peso medio observado en la muestra seleccionada, así como la diferencia de costes respecto al menos costoso, considerando un escenario sin optimización de viales y un escenario de optimización de viales, desechando o no el remanente en los viales no acabados respectivamente.
Se realizaron estimaciones de coste por intervalos de peso de 5kg, incluyendo el peso mínimo y máximo de los pacientes de la muestra. Adicionalmente, se calculó el coste por FAME biológico en una cohorte hipotética de 100 pacientes, que reflejara la distribución de pesos observada en la muestra, considerando que el peso sigue una distribución normal con media ± desviación estándar muestrales.
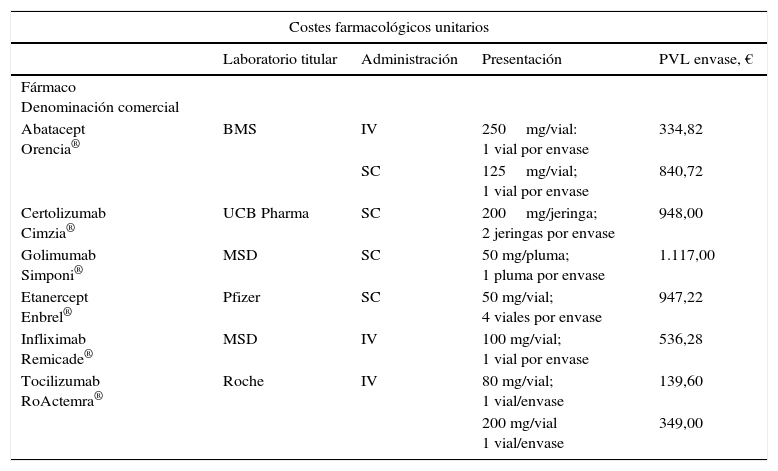
Recursos y costesSe empleó la perspectiva hospitalaria, considerándose costes directos sanitarios farmacológicos y asociados a administración. No se incluyeron otros por asumirse similares entre todas las alternativas. Los costes farmacológicos se calcularon en función de las posologías de uso en el hospital siguiendo información proporcionada por especialistas en Reumatología (tabla 1), valorados a precio de venta del laboratorio11, aplicándose la deducción estipulada en el Real Decreto-Ley 8/201012 (7,5%) e incrementando el IVA (4%).
Posologías incluidas en el estudio
| Alternativa | Año 1 | Año 2 |
|---|---|---|
| ABA IV | Fase de inducción en las semanas 0, 2 y 4 del año 1 2 viales en pacientes de peso < 60kg; 3 viales en pacientes de peso ≥ 60kg y ≤ 100kg; 4 viales en peso>100kg 10mg/kg en el supuesto de optimización de viales Administraciones de mantenimiento cada 4 semanas 14 administraciones en total | 10mg/kg en el supuesto de optimización de viales 2 viales en pacientes de peso < 60kg; 3 viales en pacientes de peso ≥ 60kg y ≤ 100kg; 4 viales en peso>100kg Administraciones de mantenimiento cada 4 semanas 13 administraciones en total |
| ABA SC | 52 administraciones semanales de 125mg No se realiza dosis de carga intravenosa | 52 administraciones semanales de 125mg |
| ADA | 26 administraciones cada 2 semanas de 40mg | 26 administraciones cada 2 semanas de 40mg |
| CZP | Dosis inicial de 400mg en las semanas 0, 2 y 4 Tras las dosis de 400mg se administran 200mg cada 2 semanas 3 administraciones de 400mg y 23 de 200mg | 26 administraciones de 200mg |
| ETN | 52 administraciones de 50mg | 52 administraciones de 50mg |
| GLM | 12 administraciones mensuales de 50mg | 12 administraciones mensuales de 50mg |
| IFX | 3 dosis de inducción de 3mg/kg en las primeras 6 semanas Tras la semana 6, dosis de 3mg/kg cada 8 semanas, 5 administraciones | 7 administraciones de 4mg/kg |
| TCZ | Dosis de 8mg/kg cada 4 semanas 13 administraciones | 13 administraciones de 8mg/kg cada 4 semanas |
ABA IV: abatacept intravenoso; ABA SC: abatacept subcutáneo; ADA: adalimumab; CZP: certolizumab pegol; ETN: etanercept; GLM: golimumab; IFX: infliximab; TCZ: tocilizumab.
El coste de administración de FAME IV se calculó a partir de las fichas técnicas (ABA IV 30 min, TCZ 60 min, IFX 60-120 min)13-15. Los costes unitarios asociados a la administración se obtuvieron a partir de una base de datos de costes sanitarios nacionales16. Los costes se expresaron en euros del 2013, sin considerar tasa de descuento temporal (tabla 2).
Costes unitarios empleados en la estimación de costes
| Costes farmacológicos unitarios | ||||
|---|---|---|---|---|
| Laboratorio titular | Administración | Presentación | PVL envase, € | |
| Fármaco Denominación comercial | ||||
| Abatacept Orencia® | BMS | IV | 250mg/vial: 1 vial por envase | 334,82 |
| SC | 125mg/vial; 1 vial por envase | 840,72 | ||
| Certolizumab Cimzia® | UCB Pharma | SC | 200mg/jeringa; 2 jeringas por envase | 948,00 |
| Golimumab Simponi® | MSD | SC | 50 mg/pluma; 1 pluma por envase | 1.117,00 |
| Etanercept Enbrel® | Pfizer | SC | 50 mg/vial; 4 viales por envase | 947,22 |
| Infliximab Remicade® | MSD | IV | 100 mg/vial; 1 vial por envase | 536,28 |
| Tocilizumab RoActemra® | Roche | IV | 80 mg/vial; 1 vial/envase | 139,60 |
| 200 mg/vial 1 vial/envase | 349,00 | |||
| Costes de administración de fármacos intravenosos | ||
|---|---|---|
| Fármaco | Coste empleado | Coste unitario, € |
| Abatacept | Perfusión fármacos menor de 1/2h | 123,76 |
| Infliximab | Perfusión fármacos entre 1/2h y 2h | 151,25 |
| Tocilizumab | Perfusión fármacos entre 1/2h y 2h | |
Se realizaron 2 análisis de sensibilidad: 1) utilización de administraciones de 3mg/kg en vez de los 4mg/kg del caso base, en el año 2 en pacientes tratados con IFX, y 2) utilización de administraciones de 6mg/kg en el año 2, en vez de las administraciones de 8mg/kg del caso base, en pacientes tratados con TCZ.
ResultadosSe analizaron datos de una serie consecutiva de 66 pacientes (24% varones), de media de edad 56,8±11,7 años y media de peso 69,0±13,1kg (rango 44-103kg); un 30% de los pacientes se situaron entre 65-74kg y un 77% de pacientes se situaron entre 55-84kg.
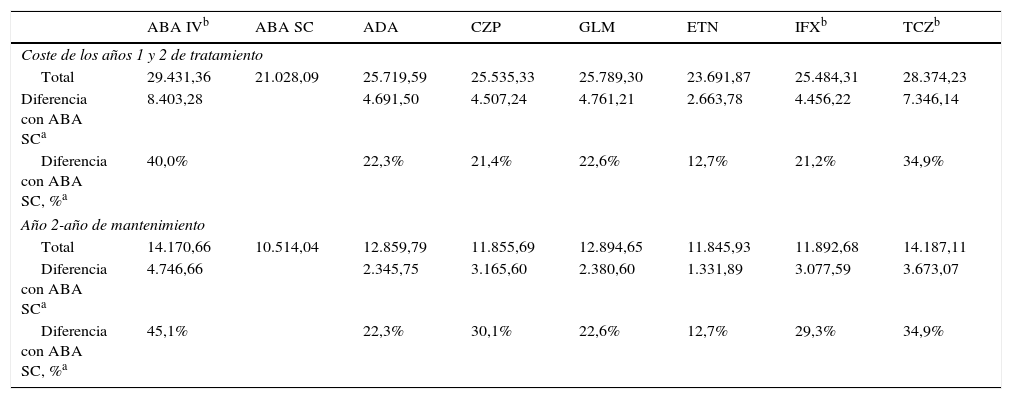
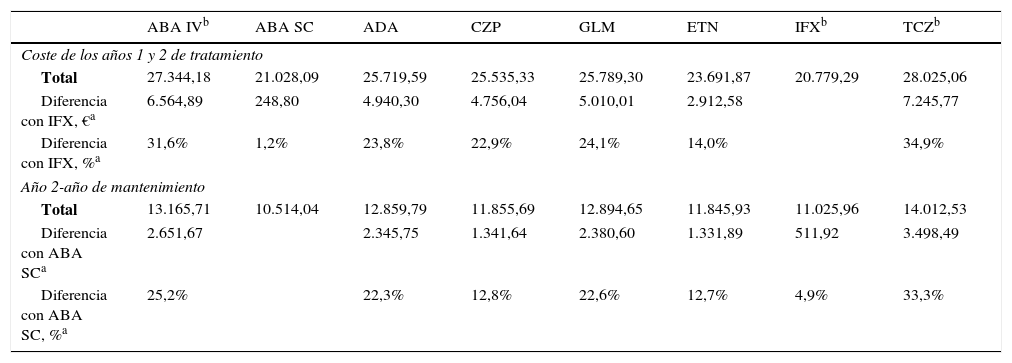
Análisis de costes del paciente promedioEn el caso de un paciente promedio, en el escenario sin optimización de viales, ABA SC fue el fármaco de menor coste, 21.028,09 € en 2 años (tabla 3). Con optimización de viales, el fármaco de menor coste fue IFX, 20.779,29 €. ABA SC fue el menos costoso durante el segundo año (10.514,04€) (tabla 4).
Costes para un paciente de 69kg en el supuesto de no optimización de viales, €
| ABA IVb | ABA SC | ADA | CZP | GLM | ETN | IFXb | TCZb | |
|---|---|---|---|---|---|---|---|---|
| Coste de los años 1 y 2 de tratamiento | ||||||||
| Total | 29.431,36 | 21.028,09 | 25.719,59 | 25.535,33 | 25.789,30 | 23.691,87 | 25.484,31 | 28.374,23 |
| Diferencia con ABA SCa | 8.403,28 | 4.691,50 | 4.507,24 | 4.761,21 | 2.663,78 | 4.456,22 | 7.346,14 | |
| Diferencia con ABA SC, %a | 40,0% | 22,3% | 21,4% | 22,6% | 12,7% | 21,2% | 34,9% | |
| Año 2-año de mantenimiento | ||||||||
| Total | 14.170,66 | 10.514,04 | 12.859,79 | 11.855,69 | 12.894,65 | 11.845,93 | 11.892,68 | 14.187,11 |
| Diferencia con ABA SCa | 4.746,66 | 2.345,75 | 3.165,60 | 2.380,60 | 1.331,89 | 3.077,59 | 3.673,07 | |
| Diferencia con ABA SC, %a | 45,1% | 22,3% | 30,1% | 22,6% | 12,7% | 29,3% | 34,9% | |
ABA IV: abatacept intravenoso; ABA SC: abatacept subcutáneo; ADA: adalimumab; CZP: certolizumab pegol; ETN: etanercept; GLM: golimumab; IFX: infliximab; TCZ: tocilizumab.
Costes para un paciente de 69kg en el supuesto de optimización de viales, €
| ABA IVb | ABA SC | ADA | CZP | GLM | ETN | IFXb | TCZb | |
|---|---|---|---|---|---|---|---|---|
| Coste de los años 1 y 2 de tratamiento | ||||||||
| Total | 27.344,18 | 21.028,09 | 25.719,59 | 25.535,33 | 25.789,30 | 23.691,87 | 20.779,29 | 28.025,06 |
| Diferencia con IFX, €a | 6.564,89 | 248,80 | 4.940,30 | 4.756,04 | 5.010,01 | 2.912,58 | 7.245,77 | |
| Diferencia con IFX, %a | 31,6% | 1,2% | 23,8% | 22,9% | 24,1% | 14,0% | 34,9% | |
| Año 2-año de mantenimiento | ||||||||
| Total | 13.165,71 | 10.514,04 | 12.859,79 | 11.855,69 | 12.894,65 | 11.845,93 | 11.025,96 | 14.012,53 |
| Diferencia con ABA SCa | 2.651,67 | 2.345,75 | 1.341,64 | 2.380,60 | 1.331,89 | 511,92 | 3.498,49 | |
| Diferencia con ABA SC, %a | 25,2% | 22,3% | 12,8% | 22,6% | 12,7% | 4,9% | 33,3% | |
ABA IV: abatacept intravenoso; ABA SC: abatacept subcutáneo; ADA: adalimumab; CZP: certolizumab pegol; ETN: etanercept; GLM: golimumab; IFX: infliximab; TCZ: tocilizumab.
El coste total bianual por paciente para cada una de las alternativas en función del peso presentaba los siguientes resultados. Sin optimización, IFX presentaba menor coste en pacientes con peso comprendido entre 44-49kg, ABA IV en pacientes de 50-59kg y ABA SC a partir de 60kg. Con optimización, IFX presentaba menor coste en pacientes con peso inferior a 69kg, y ABA SC en pacientes > 70kg.
Estos resultados fueron ligeramente sensibles al mantenimiento de dosis de IFX de 3mg/kg durante el segundo año. Sin optimización IFX fue el fármaco menos costoso en pesos inferiores a 64kg, mientras que con optimización IFX fue el menos costoso en pacientes de peso inferior a 84kg. Reducir la dosis de TCZ hasta 6mg/kg no modificaba los resultados.
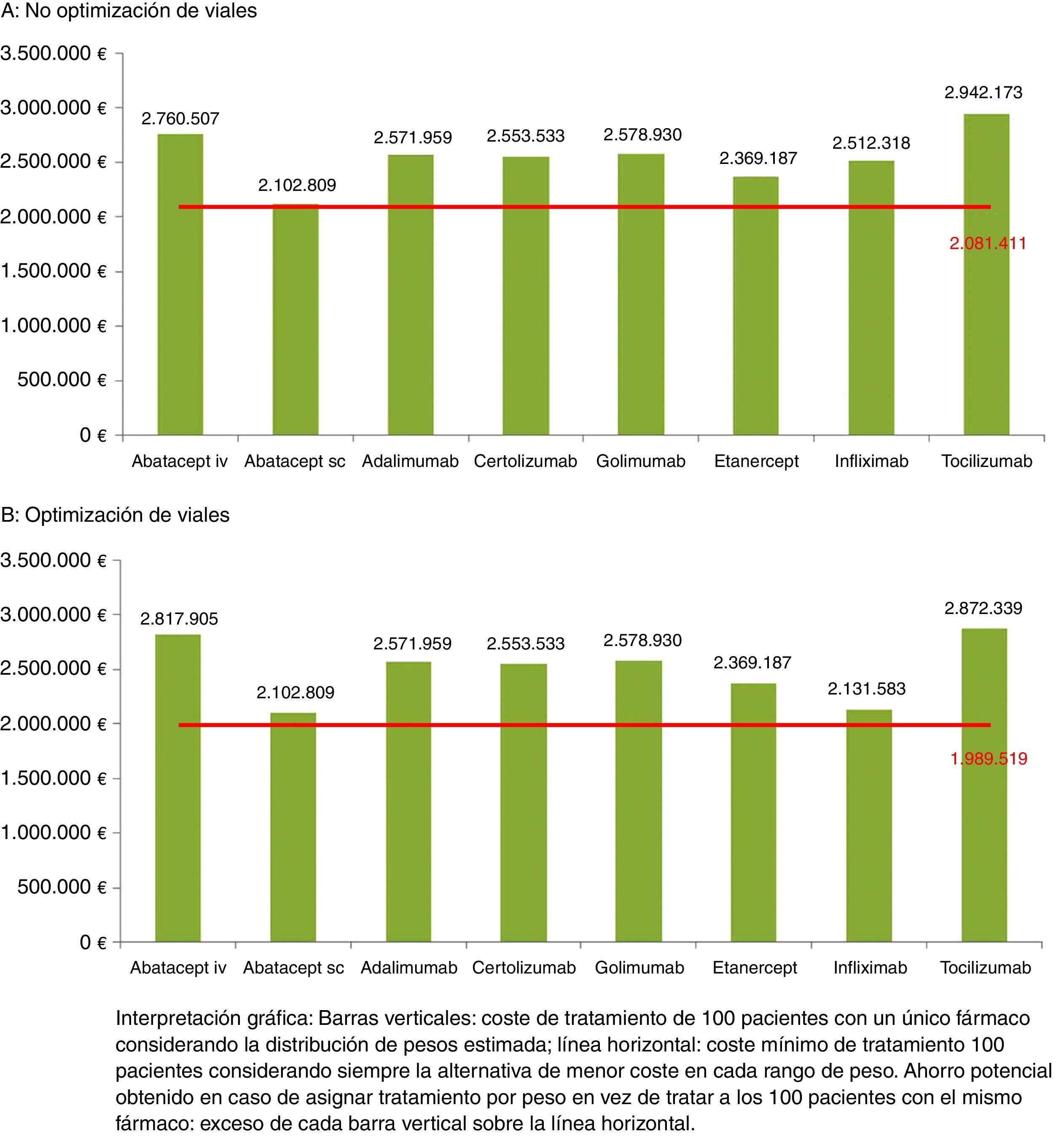
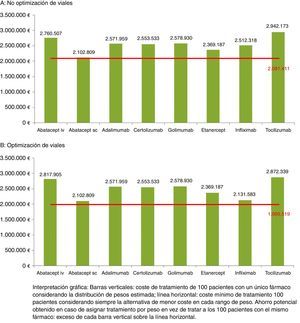
Estimación del ahorro al tratar en función del peso del pacienteConsiderando que el peso sigue una distribución normal, en una muestra hipotética de 100 pacientes se estimaba una mayor frecuencia de pacientes a partir de los 60kg. En la figura 1 se presenta el coste de tratamiento de dicha cohorte en función de la distribución de pesos tanto sin optimización de viales, 1A, como con optimización, 1B.
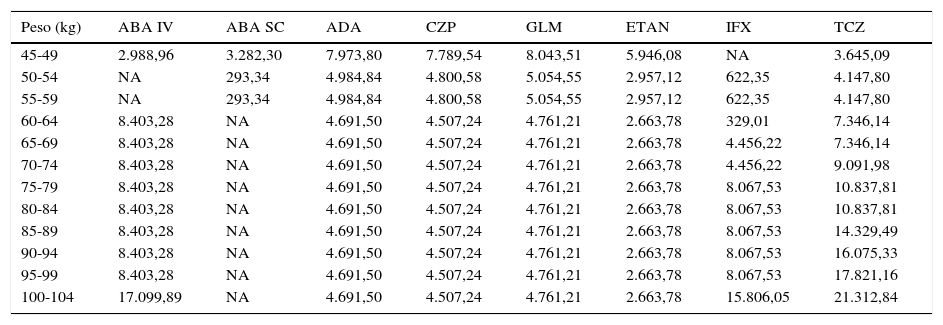
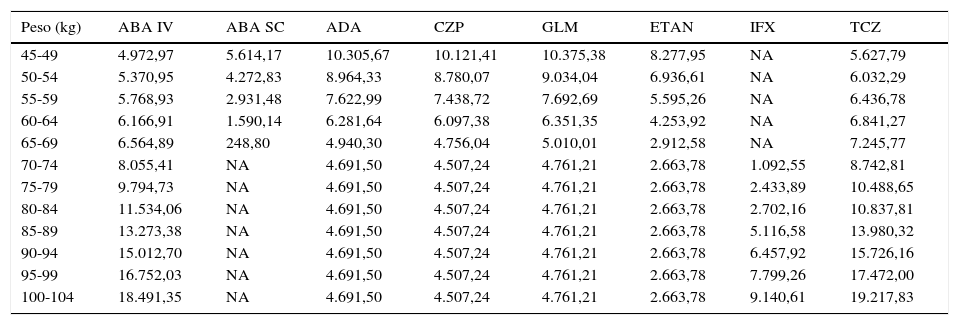
Tanto en el caso de no optimización (21.398€ [2.102.809 €-2.081.411 €] en 100 pacientes) como en el caso de optimización (113.290 € [2.102.809-1.989.519] en 100 pacientes) los ahorros mínimos corresponden a ABA SC, que es la alternativa que presenta un menor coste y más se aproxima al coste mínimo. Sin optimización, los ahorros máximos alcanzados pueden llegar a superar los 21.000 € por cada paciente de 100-104kg de peso tratado con ABA SC en vez de TCZ (tabla 5). Con optimización, el ahorro máximo alcanzado superaba los 19.000 € tratando a un paciente de 100-104kg con ABA SC en vez de TCZ (tabla 6).
Ahorro estimado por paciente en 2 años de tratamiento al tratar con la alternativa menos costosa en función del coste de los pacientes en el escenario de no optimización de viales
| Peso (kg) | ABA IV | ABA SC | ADA | CZP | GLM | ETAN | IFX | TCZ |
|---|---|---|---|---|---|---|---|---|
| 45-49 | 2.988,96 | 3.282,30 | 7.973,80 | 7.789,54 | 8.043,51 | 5.946,08 | NA | 3.645,09 |
| 50-54 | NA | 293,34 | 4.984,84 | 4.800,58 | 5.054,55 | 2.957,12 | 622,35 | 4.147,80 |
| 55-59 | NA | 293,34 | 4.984,84 | 4.800,58 | 5.054,55 | 2.957,12 | 622,35 | 4.147,80 |
| 60-64 | 8.403,28 | NA | 4.691,50 | 4.507,24 | 4.761,21 | 2.663,78 | 329,01 | 7.346,14 |
| 65-69 | 8.403,28 | NA | 4.691,50 | 4.507,24 | 4.761,21 | 2.663,78 | 4.456,22 | 7.346,14 |
| 70-74 | 8.403,28 | NA | 4.691,50 | 4.507,24 | 4.761,21 | 2.663,78 | 4.456,22 | 9.091,98 |
| 75-79 | 8.403,28 | NA | 4.691,50 | 4.507,24 | 4.761,21 | 2.663,78 | 8.067,53 | 10.837,81 |
| 80-84 | 8.403,28 | NA | 4.691,50 | 4.507,24 | 4.761,21 | 2.663,78 | 8.067,53 | 10.837,81 |
| 85-89 | 8.403,28 | NA | 4.691,50 | 4.507,24 | 4.761,21 | 2.663,78 | 8.067,53 | 14.329,49 |
| 90-94 | 8.403,28 | NA | 4.691,50 | 4.507,24 | 4.761,21 | 2.663,78 | 8.067,53 | 16.075,33 |
| 95-99 | 8.403,28 | NA | 4.691,50 | 4.507,24 | 4.761,21 | 2.663,78 | 8.067,53 | 17.821,16 |
| 100-104 | 17.099,89 | NA | 4.691,50 | 4.507,24 | 4.761,21 | 2.663,78 | 15.806,05 | 21.312,84 |
ABA IV: abatacept intravenoso; ABA SC: abatacept subcutáneo; ADA: adalimumab; CZP: certolizumab pegol; ETN: etanercept; GLM: golimumab; IFX: infliximab; NA: no aplicable; TCZ: tocilizumab.
Ahorro estimado por paciente en 2 años de tratamiento al tratar con la alternativa menos costosa en función del coste de los pacientes en el escenario de optimización de viales
| Peso (kg) | ABA IV | ABA SC | ADA | CZP | GLM | ETAN | IFX | TCZ |
|---|---|---|---|---|---|---|---|---|
| 45-49 | 4.972,97 | 5.614,17 | 10.305,67 | 10.121,41 | 10.375,38 | 8.277,95 | NA | 5.627,79 |
| 50-54 | 5.370,95 | 4.272,83 | 8.964,33 | 8.780,07 | 9.034,04 | 6.936,61 | NA | 6.032,29 |
| 55-59 | 5.768,93 | 2.931,48 | 7.622,99 | 7.438,72 | 7.692,69 | 5.595,26 | NA | 6.436,78 |
| 60-64 | 6.166,91 | 1.590,14 | 6.281,64 | 6.097,38 | 6.351,35 | 4.253,92 | NA | 6.841,27 |
| 65-69 | 6.564,89 | 248,80 | 4.940,30 | 4.756,04 | 5.010,01 | 2.912,58 | NA | 7.245,77 |
| 70-74 | 8.055,41 | NA | 4.691,50 | 4.507,24 | 4.761,21 | 2.663,78 | 1.092,55 | 8.742,81 |
| 75-79 | 9.794,73 | NA | 4.691,50 | 4.507,24 | 4.761,21 | 2.663,78 | 2.433,89 | 10.488,65 |
| 80-84 | 11.534,06 | NA | 4.691,50 | 4.507,24 | 4.761,21 | 2.663,78 | 2.702,16 | 10.837,81 |
| 85-89 | 13.273,38 | NA | 4.691,50 | 4.507,24 | 4.761,21 | 2.663,78 | 5.116,58 | 13.980,32 |
| 90-94 | 15.012,70 | NA | 4.691,50 | 4.507,24 | 4.761,21 | 2.663,78 | 6.457,92 | 15.726,16 |
| 95-99 | 16.752,03 | NA | 4.691,50 | 4.507,24 | 4.761,21 | 2.663,78 | 7.799,26 | 17.472,00 |
| 100-104 | 18.491,35 | NA | 4.691,50 | 4.507,24 | 4.761,21 | 2.663,78 | 9.140,61 | 19.217,83 |
ABA IV: abatacept intravenoso; ABA SC: abatacept subcutáneo; ADA: adalimumab; CZP: certolizumab pegol; ETN: etanercept; GLM: golimumab; IFX: infliximab; NA: no aplicable; TCZ: tocilizumab.
La metodología del estudio corresponde a una estimación de costes de diferentes alternativas sin analizar eficacia, asumiendo que las alternativas de tratamiento comparadas en el estudio presentan eficacia elevada y similar demostrada17-22. El análisis incluyó todos los FAME biológicos empleados en primera línea tras respuesta inadecuada a MTX, excluyendo ANA por su uso reducido en la práctica clínica diaria.
En la estimación de coste total bianual para un paciente promedio, ABA SC resultó el biológico de menor coste en el escenario sin optimización de viales IV (21.028 €) e IFX lo fue en el escenario alternativo (20.779 €). En ambos escenarios, ABA SC fue menos costoso que IFX en el segundo año de terapia, debido al escalado de dosis de IFX de 3mg/kg a 4mg/kg. Este escalado es frecuente en la práctica clínica23,24, lo que hace pensar que en un horizonte temporal superior al considerado, ABA SC sería la alternativa menos costosa. Este resultado es consistente con un estudio reciente en el que se analizaba el coste de tratamiento siendo más reducido en ABA SC frente a ABA IV, ADA, CZP, ETN, GLM, IFX y TCZ en pacientes con AR que inician tratamiento con FAME biológicos25.
El análisis por rangos de peso indicaba que es un factor determinante del coste, ya que la consideración de fármaco menos costoso presenta variaciones en función del peso del paciente y por ello no coincide con el caso inicial de 69kg. La consideración del peso del paciente puede suponer ahorros en pacientes de 60-70kg tratados con ABA SC de 2.600-9.000 € en función de la alternativa considerada.
En el análisis se decidió evaluar 2 escenarios en función del aprovechamiento de los viales IV por ser una práctica cada vez más frecuente26. Esta práctica solo es aplicable en situaciones de patologías de alta prevalencia y/o en centros que tengan asignado un número crítico de pacientes para citación simultánea. Es una situación óptima que debería entenderse como una premisa conservadora, ya que en la práctica clínica no parece probable que se lograra reunir al número exacto de pacientes para no desechar ningún remanente.
Entre las limitaciones del estudio cabe mencionar la representatividad de la distribución de peso empleada de la población de pacientes con AR. Al analizar la muestra de 66 pacientes disponibles, se asumió una distribución normal del peso definida por la media ± desviación típica de la muestra, lo cual puede no ser reflejo exacto de la población nacional con AR. Igualmente, en esta muestra no se han considerado variables que pueden tener relevancia en el peso como la pérdida de masa muscular experimentada por pacientes con AR en función del tiempo de evolución de la enfermedad. No obstante, se ha considerado que con la muestra analizada se puede conseguir el objetivo del estudio que es analizar la influencia del peso de los pacientes en el coste de tratamiento.
Por otra parte, el análisis realizado asumía que los fármacos SC no precisan consumo de recursos sanitarios para su inyección, aunque es probable que un porcentaje de pacientes con determinadas características (edad avanzada, fobia a agujas) acuda a un centro sanitario para solicitar la administración del fármaco. Los autores consideran que el porcentaje de pacientes de este tipo sería bajo y los resultados no se modificarían de forma relevante.
Otra limitación es la consideración del resto de costes como iguales entre las alternativas. En el estudio AMPLE8 se demostraba que ABA SC presenta un menor porcentaje de reacciones en el lugar de inyección que ADA, lo que repercutiría en diferencias de costes no consideradas. Por otro lado, no considerar tasa de descuento temporal puede infravalorar los costes del segundo año con respecto a los del primero, lo que puede favorecer a fármacos de mayor coste de mantenimiento.
Igualmente, no se incluye el coste de MTX o ácido fólico por considerar que se aplican en todos los FAME biológicos, tal y como sugiere la Guía clínica europea más reciente6. Por último, se debe señalar que no se han incluido costes de monitorización que pueden ser diferentes entre fármacos; la razón de la no inclusión de este costes radica en que las diferencias entre los procesos de monitorización suponen un coste marginal en comparación con el coste farmacológico o de administración.
Otra posible limitación es la elevada variabilidad en el empleo de fármacos en AR. Esta variabilidad puede suponer que hasta el 45,7% de los pacientes reduzcan su dosis27 y su relevancia se ha notificado en un documento de Consenso del año 201428. Esta limitación se ha intentado paliar con el análisis de sensibilidad, en el que se pone de manifiesto la relevancia de la dosis en el coste demostrada en estudios sobre estrategias de reducción de dosis o espaciado terapéutico23,29. Este análisis solo se ha aplicado con fármacos IV por focalizarse el estudio en cambios en el coste en función del peso del paciente.
En este estudio se demuestra que el peso del paciente es un factor que podría ser tomado en consideración a la hora de prescribir FAME biológicos y puede permitir una asignación de recursos racional y más eficiente. Sobre la base de los resultados obtenidos, la elección respecto al peso del paciente asociada a un uso más racional sería la utilización de IFX en pacientes de 45-49kg, ABA IV en pacientes de 50-60kg y ABA SC en pacientes ≥ 60kg sin optimización de viales IV. Con optimización, las opciones serían IFX en pacientes < 70kg y ABA SC pacientes ≥ 70kg.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interés/FinanciaciónEste trabajo ha sido financiado por Bristol-Myers Squibb (BMS). Cristina Canal es empleada de BMS en el momento en el que se desarrolló el estudio. Itziar Oyagüez y Manuel Gómez Barrera son empleados de PORIB, consultora especializada en el área de evaluación económica de tecnologías sanitarias, que ha recibido una financiación de BMS para este artículo. José Andrés Román Ivorra, Jefe del Servicio de Reumatología, y Emilio Monte-Boquet, farmacéutico, del Hospital Universitario y Politécnico La Fe de Valencia, han recibido honorarios de BMS por su asesoría en el desarrollo de este proyecto. José Ivorra, reumatólogo del Hospital Universitario y Politécnico La Fe de Valencia, declara no tener ningún conflicto de interés. El soporte económico de este proyecto no ha interferido en su desarrollo.
Los autores agradecen a los revisores de Reumatología Clínica los comentarios aportados durante la revisión del manuscrito.