En el contexto de la pandemia por SARS-CoV-2 el desarrollo de nuevas vacunas y su eficacia en pacientes con enfermedades reumáticas inmunomediadas ha sido motivo de estudio. El objetivo de este trabajo es evaluar la tasa de respuesta vacunal en pacientes con enfermedades reumáticas inmunomediadas en tratamiento con inmunomoduladores, incluyendo el rituximab (RTX), así como la influencia de posibles factores implicados en la respuesta vacunal en estos pacientes.
Material y métodosSe realizó un estudio de cohortes prospectivo, unicéntrico, en 130 pacientes con enfermedad reumática inmunomediada en tratamiento con inmunomoduladores, incluyendo RTX, que recibieron la pauta completa de vacunación frente a SARS-CoV-2 con BioNTech/Pfizer, Moderna/Lonza, AstraZeneca o Janssen entre abril y octubre de 2021. Se analizaron factores demográficos como la edad, el sexo, el tipo de enfermedad inmunomediada, el tratamiento inmunomodulador y el tipo de vacuna, así como marcadores serológicos incluyendo los niveles de anticuerpos anti-SARS-CoV-2 IgG al mes y a los 6 meses desde la vacunación, niveles de linfocitos CD19+ y la presencia o no de hipogammaglobulinemia. Se realizó un análisis estadístico para evaluar la influencia en los títulos de anticuerpos de las diferentes variables recogidas en el estudio.
ResultadosSe obtuvo una muestra de 130 pacientes, 41 en tratamiento con RTX y 89 con otros inmunomoduladores. Se observó una menor tasa de respuesta vacunal en los pacientes con RTX (12/34, 36,7%) al mes de la primovacunación con respecto al 96,5% (82/85) de pacientes que no recibieron este fármaco y sí alcanzaron respuesta. En el análisis de variables secundarias la hipogammaglobulinemia se asoció de forma significativa a la ausencia de desarrollo de respuesta vacunal. La administración del último RTX en los 6 meses previos a la vacunación y niveles bajos de CD19+ (<20mg/dl) también influyeron de forma negativa en el desarrollo de respuesta vacunal. En el grupo de pacientes que no estaban en tratamiento con RTX la respuesta vacunal fue similar a la observada en la población general. No observamos diferencias estadísticamente significativas en la respuesta vacunal en función del tratamiento inmunomodulador diferente al RTX, el tratamiento corticoideo concomitante, el tipo de enfermedad inmunomediada, la edad o el sexo.
Discusión y conclusionesEn los pacientes con enfermedades reumáticas en tratamiento inmunomodulador la respuesta a la vacunación frente al SARS-CoV-2 es superponible a la de la población general, salvo en el caso de pacientes en tratamiento con RTX, que es alrededor de un tercio (36,7%), los cuales tienen una tasa de respuesta menor asociada a factores como la hipogammaglobulinemia, los niveles de linfocitos CD19+ previos a la vacunación y el tiempo entre la vacunación y la última dosis de RTX inferior a 6 meses. Es importante tener en consideración dichos factores para optimizar la vacunación en estos pacientes.
In the context of the SARS-CoV-2 pandemic, the development of new vaccines and their efficacy in patients with immune-mediated rheumatic diseases has been a target to investigate. The objective of this study is to evaluate the vaccine response rate in patients with immune-mediated rheumatic diseases under treatment with immunomodulators, including rituximab (RTX), as well as the influence of possible factors involved in the vaccination response in these patients.
Material and methodsA single-centre, prospective cohort study was conducted in 130 patients with immune-mediated rheumatic disease on treatment with immunomodulators, including RTX, who received the full course of vaccination against SARS-CoV-2 with BioNTech/Pfizer, Moderna/Lonza, AstraZeneca, or Janssen between April and October 2021. Demographic factors such as age, sex, type of immune-mediated disease, immunomodulatory treatment and type of vaccine were analysed, as well as serological markers including anti-SARS-CoV-2 IgG antibody levels measured one and six months after vaccination, CD19+ lymphocyte levels and the presence or absence of hypogammaglobulinemia. A statistical analysis was performed to assess the influence of the different variables collected in the study on the antibody titres.
ResultsA sample of 130 patients was studied, 41 under treatment with RTX and 89 with other immunomodulators. A lower vaccination response rate was observed in patients with RTX (12/34, 36.7%) one month after the primary vaccination compared to 96.5% (82/85) of patients who did not receive this drug and did respond. In the analysis of secondary variables, hypogammaglobulinemia was significantly associated with lack of development of a vaccine response. The administration of the last RTX cycle in the 6 months prior to vaccination and low CD19+ levels (<20mg/dL) also had a negative influence on the development of a vaccine response. In the group of patients who were not receiving RTX treatment, the vaccination response was like that observed in the general population. We did not observe statistically significant differences in the vaccine response based on immunomodulatory treatment other than RTX, concomitant corticosteroid treatment, type of immune-mediated pathology, age, or sex.
Discussion and conclusionsIn patients with rheumatic diseases receiving immunomodulatory treatment, the response to vaccination against SARS-CoV-2 is comparable to the general population, except in the case of patients receiving RTX, who have a lower response rate (around 36.7%) which is associated with factors such as hypogammaglobulinemia, pre-vaccination CD19+ lymphocyte levels, and a period between vaccination and the last dose of RTX of less than 6 months. It is important to take these factors into consideration to optimize vaccination in these patients.
La infección por SARS-CoV-2ha supuesto un gran problema de salud pública con una repercusión muy importante en la gestión de los recursos sanitarios y un alto impacto en la morbimortalidad de la población general y, en particular, de las personas con compromiso inmunitario1,2.
Existen numerosas publicaciones al respecto de la eficacia y la seguridad de distintas vacunas en pacientes con enfermedades reumáticas inmunomediadas (ERIM)3,4. En la mayoría se describe un buen nivel de seguridad de estas, así como una eficacia similar a la que se observa en los controles sanos de los mismos estudios. Del Porto el al.3 recogieron datos sobre la vacuna de la influenza en pacientes con lupus eritematoso sistémico (LES), artritis reumatoide (AR) y controles sanos sin observar diferencias en significativas en los títulos de anticuerpos que alcanzaban tras la vacunación. Sin embargo, en otros trabajos se ha reportado una eficacia inferior, especialmente en pacientes tratados con rituximab (RTX). Oren et al.5 estudiaron la respuesta a la vacuna de influenza en 43 pacientes con AR, 14 en tratamiento con RTX y 21 controles sanos, observando que a las 4 semanas la proporción de respondedores a uno de los antígenos de la vacuna fue significativamente menor en el grupo de RTX que en el grupo no-RTX (21% vs. 67%, p=0,006).
En cuanto a la vacuna frente al SARS-CoV-2 se han publicado hasta la fecha varios trabajos en los que se analiza la respuesta vacunal en individuos sanos, pero en los primeros meses de la pandemia había poca información; así fue como Lusting et al.6, en Israel, evidenciaron que con la vacuna BNT162b2 (Pfizer/BioNTech) se conseguían títulos adecuados de anticuerpos en el 96,5% de los 2.607 trabajadores sanitarios, sanos la mayoría de ellos, que se incluyeron en el estudio. Sin embargo, en los ensayos clínicos de estas vacunas se excluyeron a pacientes con ERIM, por lo que no se tuvieron datos hasta la poscomercialización de las mismas. En un estudio multicéntrico se evaluó la eficacia y seguridad de la misma vacuna en población con ERIM (n=686), comparándola con población sana (n=121), objetivándose una adecuada respuesta serológica en estos pacientes, excepto en aquellos en tratamiento con RTX, glucocorticoides, abatacept y micofenolato de mofetilo (MMF), los cuales se relacionaron con una menor tasa de respuesta vacunal7.
El objetivo primario de este estudio es determinar la tasa de respuesta humoral a la vacuna frente a SARS-CoV-2 en pacientes con enfermedad reumática inmunomediada en tratamiento inmunomodulador, incluyendo pacientes con RTX en nuestro centro. Los objetivos secundarios del trabajo son determinar la persistencia de la respuesta serológica a la vacuna a los 6 meses e identificar factores que puedan influenciar en dicha respuesta.
Material y métodosSe realizó un estudio observacional prospectivo con 2 cohortes de pacientes en seguimiento en el Servicio de Reumatología del Hospital Universitario Doctor Peset diagnosticados de ERIM y tratados con inmunomoduladores, sin inmunidad natural frente a SARS-CoV-2. Las 2 cohortes se diferenciaban en el tipo de tratamiento inmunomodulador: en la primera se incluyeron pacientes tratados con RTX y en la segunda tratados con inmunomoduladores sintéticos (clásicos o dirigidos) y/o biológicos, excluyendo RTX.
Se incluyeron pacientes en proceso de primovacunación frente al SARS-CoV-2 que hubieran recibido la pauta completa (una o 2 dosis de la vacuna) según los protocolos vigentes del Ministerio de Sanidad del Gobierno de España en el momento del estudio con las vacunas de BioNTech/Pfizer (2 dosis separadas 4-8 semanas), Moderna/Lonza (2 dosis separadas 8 semanas), AstraZeneca (2 dosis separadas 4-12 semanas) o Janssen (dosis única). Se registró también la administración de una dosis de refuerzo para aquellos pacientes que no habían desarrollado respuesta humoral con la pauta previa.
Como variable principal se estudió la tasa de respuesta humoral determinada en función de los niveles de anticuerpos anti-SARS-CoV-2 IgG (considerando respuesta si presentaban niveles superiores a 50UA/Ml)a al mes y a los 6 meses de completar la pauta de vacunación. Se analizaron variables secundarias como el tipo de vacuna (BioNTech/Pfizer, Moderna/Lonza, AstraZeneca, Janssen), la tasa de pacientes que mantienen niveles protectores de anticuerpos anti-SARS-CoV-2 IgG II a los 6 meses de haber recibido la vacuna, el tipo de tratamiento recibido, así como el número de ciclos en caso de RTX, el tipo de enfermedad inmunomediada, el tratamiento concomitante con inmunomoduladores sintéticos clásicos (FAME) o corticoides y variables analíticas como los niveles de linfocitos CD19+ (células/mm2) y proteinograma previos a la vacunación en caso de la cohorte con RTX, considerando la presencia de hipogammaglobulinemia como niveles de globulina gamma inferiores a 0,71g/dl, según el laboratorio de referencia.
Se calcularon proporciones para las variables cualitativas y la media con la desviación estándar y la mediana con el rango intercuartílico (IQR) para las variables cuantitativas continuas. Las variables cualitativas se compararon mediante el test Chi-cuadrado de Pearson, aplicando la corrección por continuidad en caso necesario. Para comparar promedios se utilizó el estadístico «t» de Student (o el de Kruskal-Wallis en caso de ser más apropiado). En todos los análisis realizados se asumió la significación estadística con valores de p<0,05.
ResultadosSe reclutaron pacientes entre los meses de abril y octubre de 2021. En total se analizaron datos de 130 pacientes, 41 en el grupo RTX y 89 en el grupo sin RTX.
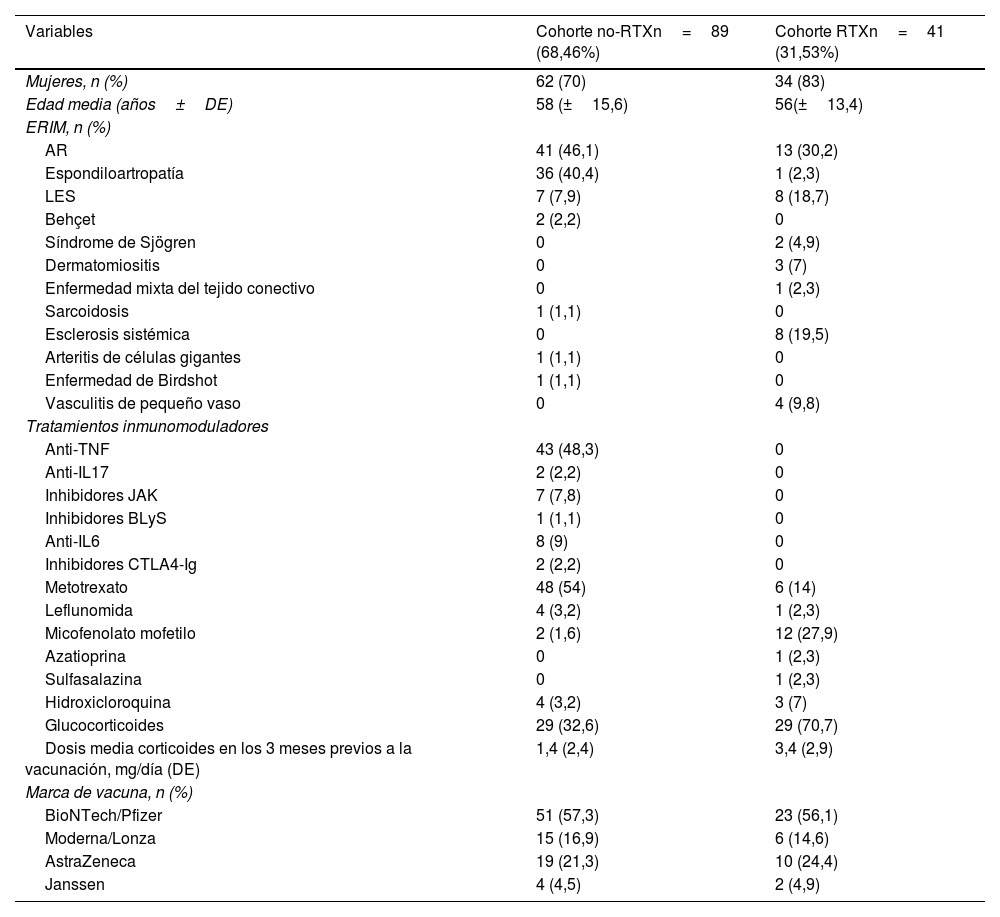
En la tabla 1 se recogen datos demográficos y la distribución de enfermedades y tratamientos en ambas cohortes analizadas.
Datos demográficos y distribución de enfermedades y tratamientos en las cohortes analizadas
| Variables | Cohorte no-RTXn=89 (68,46%) | Cohorte RTXn=41 (31,53%) |
|---|---|---|
| Mujeres, n (%) | 62 (70) | 34 (83) |
| Edad media (años±DE) | 58 (±15,6) | 56(±13,4) |
| ERIM, n (%) | ||
| AR | 41 (46,1) | 13 (30,2) |
| Espondiloartropatía | 36 (40,4) | 1 (2,3) |
| LES | 7 (7,9) | 8 (18,7) |
| Behçet | 2 (2,2) | 0 |
| Síndrome de Sjögren | 0 | 2 (4,9) |
| Dermatomiositis | 0 | 3 (7) |
| Enfermedad mixta del tejido conectivo | 0 | 1 (2,3) |
| Sarcoidosis | 1 (1,1) | 0 |
| Esclerosis sistémica | 0 | 8 (19,5) |
| Arteritis de células gigantes | 1 (1,1) | 0 |
| Enfermedad de Birdshot | 1 (1,1) | 0 |
| Vasculitis de pequeño vaso | 0 | 4 (9,8) |
| Tratamientos inmunomoduladores | ||
| Anti-TNF | 43 (48,3) | 0 |
| Anti-IL17 | 2 (2,2) | 0 |
| Inhibidores JAK | 7 (7,8) | 0 |
| Inhibidores BLyS | 1 (1,1) | 0 |
| Anti-IL6 | 8 (9) | 0 |
| Inhibidores CTLA4-Ig | 2 (2,2) | 0 |
| Metotrexato | 48 (54) | 6 (14) |
| Leflunomida | 4 (3,2) | 1 (2,3) |
| Micofenolato mofetilo | 2 (1,6) | 12 (27,9) |
| Azatioprina | 0 | 1 (2,3) |
| Sulfasalazina | 0 | 1 (2,3) |
| Hidroxicloroquina | 4 (3,2) | 3 (7) |
| Glucocorticoides | 29 (32,6) | 29 (70,7) |
| Dosis media corticoides en los 3 meses previos a la vacunación, mg/día (DE) | 1,4 (2,4) | 3,4 (2,9) |
| Marca de vacuna, n (%) | ||
| BioNTech/Pfizer | 51 (57,3) | 23 (56,1) |
| Moderna/Lonza | 15 (16,9) | 6 (14,6) |
| AstraZeneca | 19 (21,3) | 10 (24,4) |
| Janssen | 4 (4,5) | 2 (4,9) |
DE: desviación estándar; ERIM: enfermedad reumática inmunomediada; n: tamaño muestral.
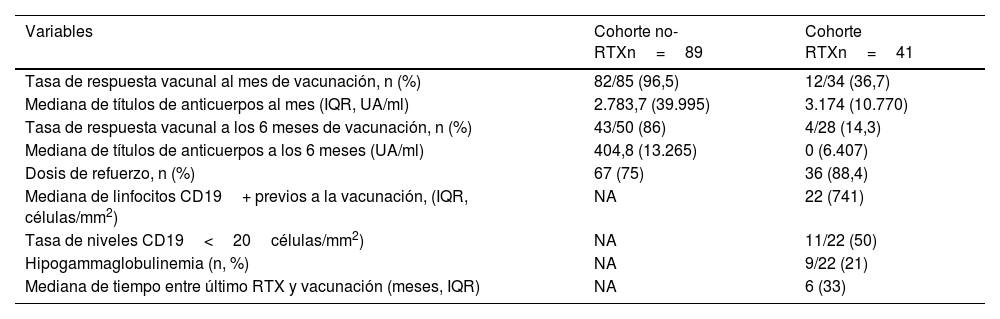
En la cohorte de RTX, de los pacientes que tuvieron serología al mes de la vacunación, un 36,7% (12/34) consiguió desarrollar títulos por encima del punto de corte considerados como respuesta vacunal con una mediana de 3.174UA/ml (IQR 10770) (tabla 2). De los 19 pacientes (46,3%) de que se disponía de datos al mes y a los 6 meses el 10,6% (2/19) mantuvo la respuesta vacunal a los 6 meses, un paciente (5,2%) la perdió y el 84,2% restante (16/19) no desarrollaron respuesta en ninguna de las 2 determinaciones. Hubo 9 pacientes con datos solo a los 6 meses, con una tasa de respuesta del 22% (2/9). La mediana global de anticuerpos a los 6 meses fue de 0UA/ml (IQR 6407). El 88,4% (36/41) recibió una dosis de refuerzo un mes después de la última dosis de la pauta habitual de vacunación, pero no consiguió producir respuesta en ningún paciente que no la hubiera desarrollado con las anteriores (tabla 2). El 88,8% de los pacientes con hipogammaglobulinemia (8/9) presentó ausencia de respuesta vacunal de forma estadísticamente significativa (p=0,04). La media de tiempo entre la administración del último RTX y la pauta completa de vacunación fue de 8,1 meses (DE 6,34), y se observó que la tasa de respuesta vacunal en los pacientes que habían recibido el último ciclo de RTX en los 6 meses previos a la vacuna tendió a ser inferior (4/19, 21%) con respecto a aquellos que recibieron RTX más allá de los 6 meses previos a la vacuna (9/22, 41%), pero no se alcanzó la significación estadística (p=0,058). Los títulos de anticuerpos desarrollados un mes después de la vacunación se correlacionaron positivamente y de forma estadísticamente significativa con el tiempo entre el último ciclo de RTX y la vacunación (r=0,423; p=0,014) y con los niveles absolutos de linfocitos CD19+ previos a la vacunación (mediana 22 células/mm3; IQR 741) (r=0,514; p=0,029), pero estas diferencias no se mantuvieron a los 6 meses. No se encontraron diferencias significativas con relación al número de ciclos previos de RTX, el tipo de enfermedad inmunomediada, el tratamiento concomitante con inmunomoduladores sintéticos clásicos o corticoides o el tipo de vacuna recibida.
Resumen de tasas de respuesta vacunal y niveles de anticuerpos al mes y a los 6 meses tras la vacunación
| Variables | Cohorte no-RTXn=89 | Cohorte RTXn=41 |
|---|---|---|
| Tasa de respuesta vacunal al mes de vacunación, n (%) | 82/85 (96,5) | 12/34 (36,7) |
| Mediana de títulos de anticuerpos al mes (IQR, UA/ml) | 2.783,7 (39.995) | 3.174 (10.770) |
| Tasa de respuesta vacunal a los 6 meses de vacunación, n (%) | 43/50 (86) | 4/28 (14,3) |
| Mediana de títulos de anticuerpos a los 6 meses (UA/ml) | 404,8 (13.265) | 0 (6.407) |
| Dosis de refuerzo, n (%) | 67 (75) | 36 (88,4) |
| Mediana de linfocitos CD19+ previos a la vacunación, (IQR, células/mm2) | NA | 22 (741) |
| Tasa de niveles CD19<20células/mm2) | NA | 11/22 (50) |
| Hipogammaglobulinemia (n, %) | NA | 9/22 (21) |
| Mediana de tiempo entre último RTX y vacunación (meses, IQR) | NA | 6 (33) |
NA: no afecta.
En la cohorte no-RTX el 96,5% (82/85) de los pacientes con serología al mes alcanzó la respuesta vacunal con una mediana de niveles de anticuerpos de 2783,7 UA/ml (IQR 39995). El porcentaje de respondedores disminuyó a los 6 meses (43/50, 86%) y la mediana de niveles se redujo un 85% (404,8 UA/ml; IQR 13265) (tabla 2).
Todos los pacientes tratados con anti-TNF, anti-IL17, inhibidores JAK e inhibidores BLyS (belimumab) mostraron respuesta al mes de la vacunación. El porcentaje decayó en el caso de anti-IL6 (7/8, 87.5%) e inhibidores de CTLA4-Ig (abatacept) (1/2, 50%). El 96,5% (56/58) de los pacientes con FAME clásicos alcanzó la respuesta al mes. El porcentaje de respondedores disminuyó a los 6 meses (43/50, 86%) y la mediana de niveles de Ac se redujo un 85% (404,8UA/ml). No se encontró asociación entre el desarrollo de respuesta vacunal y la enfermedad de base, la corticoterapia o la edad en este grupo de pacientes. Sin embargo, en el grupo RTX se observó que de los 21 pacientes mayores de 50 años solo uno (4,7%), mantuvo anticuerpos a títulos protectores (p=0,008).
DiscusiónLa tasa de respuesta humoral a la vacuna frente al SARS-CoV-2 en pacientes que reciben un tratamiento inmunomodulador distinto del RTX en nuestra cohorte (82/85 [96,5%]) es superponible a la respuesta esperable en población general, que se sitúa por encima del 95% en los diferentes estudios en los que se ha medido esta respuesta en población sana y pacientes con ERIM y la mayoría de los tratamientos inmunomoduladores1,6,7. Por tanto, podemos asumir que en este colectivo de pacientes la pauta de vacunación estándar frente a SARS-CoV-2 es adecuada. Sin embargo, en los estudios que se han realizado en pacientes con ERIM y tratamiento inmunosupresor, se ha detectado que determinados fármacos se relacionan con una menor tasa de respuesta vacunal, como es el caso del RTX, pero también del abatacept, MMF y los glucocorticoides6-8. En nuestro trabajo hemos observado que los pacientes en tratamiento con RTX tenían una tasa de respuesta vacunal menor (12/34 [36,7%]) que los pacientes sin RTX (82/85 [96,5%]) al mes de la vacunación, lo cual es consistente con lo observado en otros estudios, como el de Furer et al.7, donde la tasa de respuesta de los pacientes con RTX fue del 41% (36/87) al mes de la vacunación. En el análisis de variables que pudieron influir en la menor respuesta de los pacientes en el grupo de RTX encontramos que existen 3 factores que se relacionaron de forma significativa con este hecho.
Primeramente, la hipogammaglobulinemia previa a recibir las vacunas (p=0,044) que ya se había descrito en estudios de la eficacia de estas vacunas en pacientes con neoplasias hematológicas, donde la hipogammaglobulinemia era uno de los factores asociados de forma negativa al desarrollo de respuesta vacunal9. Con relación a este hecho, y a pesar de que serían necesarios más estudios al respecto, se podría plantear que la presencia de hipogammaglobulinemia en los pacientes en tratamiento con RTX puede ser un predictor de baja respuesta a la vacuna.
En segundo lugar, el tiempo entre la última dosis de RTX y la vacunación influye de forma determinante en el desarrollo de respuesta vacunal. Así, Furer et al. en su cohorte de pacientes con RTX describen una tasa de seropositividad del 20% en aquellos pacientes que recibieron el último ciclo de RTX en los 6 meses previos a la vacuna y del 50% en aquellos que se vacunaron al menos un año después de haberse administrado el fármaco, siendo similar en nuestro estudio (21% y 41% respectivamente). En este sentido, las recomendaciones más recientes de EULAR/ACR10,11 recomiendan vacunar antes de las 4 semanas previas al siguiente ciclo de RTX y esperar entre 2 y 4 semanas desde la vacuna para administrar el fármaco si la actividad de la enfermedad lo permite. Sin embargo, no especifican si en caso de falta de respuesta a las dosis de la vacuna conviene posponer el RTX y revacunar con una tercera o cuarta dosis. Posiblemente en aquellos pacientes con enfermedades graves y con pocas opciones de tratamiento, teniendo en cuenta el riesgo-beneficio, convendría priorizar la administración de RTX a pesar de obtener una pobre respuesta humoral a la vacuna y del riesgo de infección que conlleva12. Por los datos que extraemos de nuestro estudio ningún paciente con RTX que recibió dosis de refuerzo desarrolló respuesta vacunal, pero son necesarios estudios a más largo plazo y con un mayor tamaño muestral para poder establecer unas recomendaciones sólidas al respecto de esta cuestión.
Y, por último, los pacientes con depleción de linfocitos CD19+ previamente a la vacunación tuvieron menor respuesta vacunal que los pacientes con niveles>20células/mm3 al momento de recibir la vacuna. En el estudio de Stefansky et al.8 fijan el mínimo de CD19 en al menos 10 células/mm3 para poder desarrollar respuesta inmune y lo proponen como posible biomarcador de predicción de respuesta. Algunos autores señalan que en los pacientes que reciben RTX se puede desarrollar inmunidad celular frente al SARS-CoV-2 a partir de una segunda y tercera dosis de la vacuna, aunque no se detecte inmunidad humoral, lo cual confiere cierto grado de protección frente a la infección13. Pese a que no existe una recomendación específica en este sentido en las guías, medir la respuesta celular en determinados pacientes podría ser de ayuda para la toma de decisiones más individualizadas.
En cuanto a la influencia de otros inmunomoduladores en el desarrollo de respuesta vacunal no hemos observado diferencias significativas en ninguna de las 2 cohortes analizadas. Se ha reportado que el uso de MMF, abatacept y los glucocorticoides reducen las tasas de seroconversión7, aunque no de forma tan significativa como el RTX. En nuestro estudio, con respecto al MMF, el 50% (6/6) no obtuvo respuesta vacunal en el grupo de RTX (tratamiento concomitante) de forma no significativa, mientras que en el grupo no-RTX, los 2 pacientes en tratamiento con MMF (combinado con adalimumab y belimumab respectivamente) desarrollaron respuesta vacunal al mes (100%). Con respecto al abatacept solo uno de los 2 pacientes desarrolló respuesta vacunal (50%), pero debido al pequeño tamaño muestral no se puede establecer una significación estadística. En cuanto al tratamiento corticoideo no encontramos diferencias significativas en las tasas de respuesta vacunal, como sí que reportan en algunos estudios7,8; no obstante, en estos estudios la media de dosis fue de 6,7 y 6,5mg/día, mientras que en nuestro estudio fue 1,5 y 3,4mg/día. En estudios en pacientes con AR o espondiloartropatías con dosis bajas de corticoides no se ha visto influencia en la seroconversión frente a la vacuna de influenza4. Sin embargo, no está claro por qué mecanismo los glucocorticoides pueden reducir la respuesta vacunal frente al SARS-CoV-2, pero el uso concomitante de otros inmunosupresores y la actividad de la enfermedad de base que obliga a utilizar dosis más altas de corticoides es posible que influyan negativamente8,14,15, aunque son necesarios más estudios al respecto. Con respecto a otras variables como el sexo o la edad, se han reportado datos negativos sobre la respuesta vacunal en pacientes varones y mayores de 66 años6, pero en nuestras cohortes no hemos observado diferencias estadísticamente significativas en función del sexo o la edad.
Como limitaciones de este estudio cabe destacar el bajo tamaño muestral, debido al carácter unicéntrico del estudio y a las limitaciones logísticas por las restricciones sanitarias que dificultaron el acceso a las consultas médicas, a la realización de analíticas y a la vacunación en el tiempo adecuado. Igualmente, hay que mencionar que no se ha podido analizar la influencia de la actividad de la enfermedad o las comorbilidades en la respuesta vacunal de estos pacientes.
Este estudio ha sido aprobado por el CEIC del Hospital Doctor Peset.
ConclusionesEn nuestro estudio, las vacunas frente a SARS-CoV-2 han demostrado una tasa de efectividad en pacientes con ERIM similar a la de la población general (82/85 [96,5%])1,6,7. El tratamiento con RTX disminuye la tasa de respuesta a la vacunación, incluso tras la administración de dosis de refuerzo (12/34 [36,7%]) y que es similar a la tasa de respuesta observada en otros estudios6-8. La presencia de hipogammaglobulinemia y los niveles de CD19 inferiores a 20células/mm3 previas a la vacunación, así como el tiempo entre el último ciclo de RTX y la vacunación menor de 6 meses influyeron de forma negativa en el desarrollo de anticuerpos. No se encontraron diferencias en cuanto al tratamiento con otros inmunomoduladores (incluyendo abatacept y MMF) ni corticoides. Tampoco encontramos relación con la edad ni el género, probablemente debido al tamaño muestral del estudio.
En los pacientes con ERIM en tratamiento con RTX que no han desarrollado respuesta a la vacuna frente a SARS-CoV-2, y requieran revacunación por alto riesgo de contraer la infección, habría que tener en cuenta que, para optimizar la posibilidad de generar anticuerpos, conviene esperar 6 meses desde la aplicación de la última dosis de RTX y administrar la vacuna antes de las 4 semanas previas a la infusión, si la actividad de la enfermedad lo permite, siguiendo las recomendaciones EULAR/ACR10,11. Como factores adicionales que se podrían tener en cuenta para predecir la respuesta a la vacuna se proponen los niveles de linfocitos CD19+ superiores a 20 células/mm3 y la ausencia de hipogammaglobulinemia.
FinanciaciónEl presente trabajo ha sido financiado por la beca 2022 de la Fundación Valenciana de Reumatología.
Conflicto de interesesNinguno.
A José Miguel Nogueira Coito (Servicio de Microbiología del Hospital Universitari Doctor Peset).