La artritis reumatoide es una enfermedad que tiene una alta prevalencia en mujeres en edad fértil. Se realiza una revisión de las características de la barrera placentaria, el paso de medicamentos a través de ella y del uso de fármacos durante el embarazo: los que son potencialmente seguros, los fármacos que sólo pueden ser usados si la vida materna se ve comprometida, los fármacos que están contraindicados y aquéllos con información insuficiente sobre seguridad y que por tanto deben ser evitados, en este último grupo se ubican los fármacos biológicos. También se realiza una revisión acerca del uso de fármacos durante la lactancia, periodo en el cual es frecuente un rebrote de la artritis reumatoide.
Rheumatoid arthritis is a disease that is highly prevalent in women of childbearing age. A review is done about the characteristics of the placental barrier, the passage of drugs through it and the use of drugs during pregnancy: those which are potentially safe drugs, those drugs that can only be used if there is a life threatening condition for the mother, drugs that are contraindicated and those with insufficient data on safety and therefore should be avoided, the latter group comprises biological drugs. Also a review is done about the use of drugs during lactation, a period that a flare of rheumatoid arthritis can occur.
La artritis reumatoide (AR) es una enfermedad que afecta aproximadamente al 1% de la población general, de ellos la mayoría son mujeres y una gran parte de éstas se encuentran en edad reproductora1, por tanto la coincidencia de AR y embarazo no resulta un hallazgo infrecuente. El manejo de la AR durante este periodo es complicado; no obstante la actividad de la enfermedad mejora sustancialmente durante el embarazo1-3, pero la remisión completa se producirá en alrededor del 16% de las pacientes2; en aquellas que presenten una actividad de su enfermedad leve o moderada al iniciar la gestación se producirá mejoría en más del 48% de los casos3. Sin embargo, el 39% puede sufrir un brote de la enfermedad durante el posparto3 y la artritis aguda estará presente en el 10-20% de las pacientes en algún momento del embarazo4. El pronóstico del embarazo en gestantes con AR bien controladas es comparable al de la población general1.
La AR es una enfermedad patogénicamente más ligada a la inmunidad celular (Th1) que a la humoral (Th2). La reducción de la actividad inflamatoria en la AR durante la gestación parece relacionada con el incremento en la actividad Th2 que tiene lugar durante el embarazo, con aumento de citoquinas como la IL-4 e IL-10, que podrían ser inmunosupresoras en la AR. Otros mecanismos pueden ser la disminución de la función de polimorfonucleares en el líquido sinovial por la alfafetoproteína5, el incremento del número de receptores del TNF-α y el incremento de los niveles plasmáticos del antagonista del receptor de IL-16.
Algunos datos sugieren que la mejoría de la actividad de la AR durante el embarazo depende de la disparidad HLA entre la madre y el feto, a mayor disparidad mayor posibilidad de remisión de la enfermedad7.
Por otra parte, la lactancia parece favorecer la aparición de brotes de AR3: la mayoría de las mujeres con AR tiene un brote de la enfermedad durante el posparto, generalmente en los 3 primeros meses1. La causa de este comportamiento no se conoce, pero puede estar relacionada con el efecto proinflamatorio de la prolactina7.
EmbarazoPlacenta y barrera placentariaLa función de la placenta es la nutrición fetal (aunque durante las primeras semanas es de origen trofoblástica), el intercambio de gases, la excreción de productos de desecho fetales y otras funciones tipo hormonal e inmunológica8,9.
En la placenta madura, la sangre fetal llega a través de dos arterias umbilicales, avanza por los capilares de las vellosidades y regresa al feto por la vena umbilical. Por otro lado, el flujo sanguíneo materno procede de las arterias uterinas, penetra en los senos maternos que rodean las vellosidades y retorna a ella por las venas uterinas maternas9.
La barrera placentaria está compuesta por las vellosidades coriónicas (sangre fetal) y las lagunas trofoblásticas (sangre materna) y entre ambos sistemas vasculares una capa de células trofoblásticas y tejido conjuntivo, este último se irá adelgazando en la medida que progrese el embarazo y envejezca la placenta9.
La transferencia placentaria está regulada por factores anatómicos, fisiológicos y bioquímicos como por ejemplo, grosor de la barrera, presión hidrostática, flujo sanguíneo a ambos lados de la barrera y metabolismo placentario8,10.
Mecanismos de transferencia placentaria10:
- 1.
Difusión simple y facilitada.
- 2.
Transporte activo.
- 3.
Pinocitosis y fagocitosis.
La mayoría de los fármacos atraviesan la barrera placentaria por difusión simple y algunos como los corticoides lo hacen por difusión facilitada8,10.
Clasificación y revisión de los fármacos usados en el embarazoLa Food and Drug Administration (FDA, por sus siglas en inglés) de los Estados Unidos clasifica los fármacos según el riesgo que comporta para su uso en el embarazo, basado en estudios animales y en humanos, en 5 grupos: A, B, C, D y X. En esta revisión clasificaremos los fármacos para su uso en el embarazo según una valoración de riesgo-beneficio con relación al embarazo-artritis reumatoide (tabla 1)11.
Clasificación de los fármacos útiles en la artritis reumatoide según riesgo/beneficio durante el embarazo.
| Categorías de riesgo | Fármacos | Clasificación FDA |
| Potencialmente seguros durante el embarazo. | AINE*, corticoides, azatioprina y 6-mercaptopurina, sulfasalazina, antipalúdicos, inmunoglobulinas IV, ciclosporina y tracrólimus | B, C, D |
| Pueden ser usados si la vida materna se ve comprometida | Ciclofosfamida, clorambucilo y sales de oro | C, D |
| Información insuficiente sobre seguridad, deben ser evitados | Fármacos biológicos | B, C |
| Contraindicados | Metotrexato, leflunomida y micofenolato | D, X |
AINE: fármacos antiinflamatorios no esteroideos; FDA: Food and drug administration.
Los fármacos que a continuación mencionaremos pueden utilizarse durante el embarazo con cierto nivel de seguridad. No obstante, hay reportes de casos en los cuales se asocian con algunas malformaciones congénitas, se irán exponiendo separadamente.
- •
Fármacos antiinflamatorios no esteroideos (AINE): en principio son fármacos seguros pero la administración de AINE durante el embarazo se ha asociado a gastrosquisis (ibuprofeno)12, malformaciones cardiacas y paladar hendido, esto último ligado al uso de naproxeno13. No deben administrarse después de las 32 semanas de embarazo por la posibilidad de cierre temprano del ductus arterioso con hipertensión pulmonar, además de otras malformaciones como disgenesia renal, enterocolitis necrotizante y lesiones quísticas cerebrales con hemorragias intraventriculares14, en esta etapa del embarazo la FDA los clasifica en el grupo D.
Recientemente se ha publicado un posible efecto negativo del meloxicam sobre el cierre del tubo neural; este estudio se ha realizado en embriones de pollo, con dosis supraterapéuticas del fármaco y los autores concluyen que se requieren estudios adicionales con dosis más bajas15.
- •
Corticoides: los más comúnmente usados son la prednisona, la prednisolona y la metilprednisolona dentro de los corticoides de acción corta y la dexametasona y la betametasona dentro de los corticoides fluorados de acción prolongada. Los segundos alcanzan grandes concentraciones en el feto, por lo que se utilizan para acelerar la maduración fetal y en caso de administrar a embarazadas con AR para el control de su enfermedad es preferible la betametasona; no obstante, en pacientes con AR se utilizan más frecuentemente la prednisona, la prednisolona y la metilprednisolona que, aunque atraviesan la barrera placentaria, no alcanzan grandes concentraciones en el feto16.
Con la exposición intraútero a corticoides flourados debe considerarse administrar tratamiento esteroideo posnatal4.
El consumo de corticoides se ha asociado en el niño a paladar hendido (si se usa en el primer trimestre y sobre todo a dosis mayores de 15 mg/kg de peso corporal por día), rotura prematura de membranas, retardo del crecimiento intrauterino y parto pretérmino y en la madre: hipertensión, diabetes gestacional, infección y osteoporosis4,17.
- •
Sulfasalazina: pertenece a un grupo de sustancias antagonistas del ácido fólico y puede producir paladar fisurado, anomalías cardiacas (defectos septales) y también alteraciones de la hematopoyesis18,19. En caso de utilizar este fármaco debe administrarse suplementos de ácido fólico18.
En el sexo masculino puede producir esterilidad reversible20 y hay muy poca información sobre teratogenicidad.
- •
Antipalúdicos: el uso de hidroxicloroquina no ha demostrado diferencias con respecto a las embarazadas normales en cuanto a pronóstico y complicaciones del embarazo21. Se ha descrito relación con malformaciones en el borde libre de las orejas en pacientes que han usado cloroquina4. La hidroxicloroquina sería preferible a la cloroquina.
- •
Azatioprina y 6-mercaptopurina: estas drogas no son de primera línea en el tratamiento de la AR, la combinación de: «Azathioprine»[Mesh] AND «Arthritis, Rheumatoid»[Mesh]) AND «Pregnancy»[Mesh] en pubmed no genera ningún artículo en pacientes con AR; sin embargo, en otras situaciones patológicas como el trasplante de órganos, la enfermedad de Crohn y pacientes con lupus eritematoso sistémico, el uso de estos fármacos se ha relacionado con bajo peso al nacer, prematuridad, ictericia, distrés respiratorio y alteraciones cromosómicas19,22. Clasificado como D por la FDA.
- •
Ciclosporina: la prevalencia de malformaciones congénitas no difiere de lo esperado en la población gestante normal, pero se ha asociado a bajo peso al nacer, malformaciones congénitas sin patrón definido, así como HTA y diabetes gestacional16,23.
- •
Tacrólimus: las evidencias de sus efectos sobre el embarazo no provienen de pacientes con AR, sino sobre todo de pacientes trasplantados y el artículo más recurrido corresponde a Kainz et al (2000), en el cual no encuentran efectos negativos de esta droga sobre el embarazo24.
- •
Inmunoglobulinas IV: atraviesa la barrera placentaria a partir de 2.° trimestre y sobre todo en el 3.er trimestre (32 semanas). Es posible la transmisión de hepatitis C y la producción de anemia hemolítica en el neonato16,19.
- •
Ciclofosfamida: la embriopatía por ciclofosfamida varía según el momento del embarazo en el cual se utilice el fármaco y el riesgo de teratogenicidad es mayor en el primer trimestre15. La embriopatía consiste en alteraciones en la calota craneal, estructuras craneofaciales, oídos, extremidades y órganos viscerales, además de retardo del crecimiento19,25.
- •
Clorambucilo: la exposición a este fármaco puede producir agenesia/hipoplasia renal y defectos en la formación ósea16.
- •
Sales de oro: fármaco en desuso para el tratamiento de la AR. Toxicidad fetal poco probable. Un reciente estudio considera estos fármacos como una posible opción para mujeres con AR que planifican embarazo26.
- •
Metotrexato: este fármaco se distribuye ampliamente en los tejidos maternos y persiste en el hígado cerca de 4 meses después de la exposición16. El periodo más vulnerable para el uso del metotrexato se encuentra entre la semanas 5 y 8 de gestación, pero también se han producido malformaciones fetales después de la 11 semana4. Este fármaco es abortivo, puede producir retardo del crecimiento fetal, alteraciones en la osificación del cráneo, arcos superciliares hipoplásicos, implantación baja de las orejas, micrognatia y alteraciones en las extremidades4,19. La probabilidad de malformaciones fetales es dependiente de la dosis14.
- •
Leflunomida: su metabolito activo (teriflunomida) permanece detectable hasta 2 años16. Los datos de malformaciones congénitas en humanos son escasos y un reciente estudio evaluó las consecuencias del uso de leflunomida en 64 mujeres embarazadas y no encontró alteraciones significativas que sugieran un incremento del riesgo de efectos adversos en aquellas embarazadas que se sometieron al procedimiento de «lavado» del metabolito activo de la leflunomida con colestiramina27. Este procedimiento se lleva a cabo después de la suspensión del fármaco y consiste, tanto en mujeres como en varones, en la administración de 8 g de colestiramina 3 veces al día durante 11 días, como alternativa se puede utilizar 50 g de carbón activo en polvo, 4 veces al día, durante 11 días. Adicionalmente deben medirse los niveles plasmáticos del metabolito activo de la leflunomida (A771726) a través de un programa para la detección de estos niveles plasmáticos, para cuyo procedimiento debemos ponernos en contacto con el representante de la casa comercial del fármaco, quien nos aportará instrucciones para el procesado y envío de las muestras. En cualquier caso, para permitir la gestación es necesario que se demuestren unas concentraciones del metabolito inferiores a 0,02 mg/l mediante la realización de dos análisis separados por 14 días.
- •
Micofenolato: probablemente produce un fenotipo característico con labio y paladar fisurado, microtia y alteraciones en el conducto auditivo externo28, además de otras malformaciones congénitas19.
En este grupo ubicamos los fármacos biológicos. Las evidencias del uso de fármacos biológicos durante el embarazo son escasas y dispersas y los estudios realizados carecen de grupo control. La FDA clasifica, de forma general, a los anti-TNF en la categoría B.
Los reportes de uso de anti-TNF, especialmente infliximab, durante la gestación sugieren que en caso necesario y consensuado con la paciente podrían utilizarse estos fármacos, pues parece que el beneficio supera al riesgo y por otro lado no sería una condición suficiente para la interrupción del embarazo29,30.
- •
Etanercept: se ha relacionado con un conjunto específico de malformaciones congénitas conocidas por el recurso mnemotécnico de VACTERL: V-anomalías vertebrales; A-atresia anal; C-defectos cardiacos (septo ventricular); TE- fístula traqueoesofágica; R-anomalías renales; L-alteraciones en extremidades (displasia radial)16. Las evidencias no son consistentes en cuanto a la producción de estas malformaciones congénitas31, recientemente se ha reportado una gestante con AR que recibió etanercept durante todo el embarazo sin presentar complicaciones32.
- •
Infliximab: el estudio más importante involucra 131 embarazadas con exposición directa. Los resultados no difieren de los esperados en las gestantes no expuestas33.
- •
Adalimumab: algunas series reportan abortos, partos pretérmino, displasia de cadera o ausencia de malformaciones estructurales y problemas durante el embarazo34.
- •
Golimumab: no hay datos disponibles.
- •
Certolizumab: realizando una búsqueda en pubmed con palabras clave para la búsqueda «MESH: certolizumab and pregnancy», aparece un único artículo en una paciente con enfermedad de Crohn que utilizó el fármaco durante el 1.er y el 3.er trimestre, la descendencia fue normal35.
- •
Anakinra: no hay datos en humanos.
- •
Rituximab: en madres que han usado este fármaco se reduce la concentración de linfocitos B en el niño con recuperación rápida y sin aparentes consecuencias. Los reportes de complicaciones hematológicas, partos pretérmino o infecciones severas no son concluyentes en cuanto a su relación con este fármaco36.
- •
Abatacept: No hay estudios en humanos de exposición al fármaco.
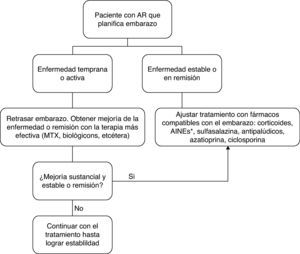
En una situación ideal en pacientes con AR que planifican su embarazo nos encontraremos con dos opciones (fig. 1): enfermedad temprana o activa y enfermedad estable o en remisión. En el primer caso debemos posponer el embarazo hasta conseguir la remisión o estabilidad de la enfermedad con los fármacos disponibles sin distinción, con excepción de la leflunomida. Una vez que se alcance la remisión, se suspenden los fármacos incompatibles con el embarazo, se espera el tiempo recomendable para cada uno de ellos (tabla 2) y se ajusta el tratamiento con fármacos compatibles con el embarazo4.
Tiempo de espera para algunos fármacos antes de la concepción.
| Fármaco | Recomendación |
| Metotrexato | Suspender 3 meses antes de la concepción |
| Leflunomida | Suspender cuando se planifique el embarazo y realizar lavado con colestiramina o carbón activo, después de lo cual y cuando el metabolito activo sea<0,02 mg/dl: esperar 1,5 meses para las mujeres y 3 meses para los varones |
| Abatacept | Suspender 10 semanas antes de la concepción |
| Rituximab | Suspender 12 meses antes de la concepción |
| Infliximab | Suspender a la primera falta o después del test positivo |
| Etanercept | Suspender a la primera falta o después del test positivo |
| Adalimumab | Suspender a la primera falta o después del test positivo |
Fuente: tomado y con permiso de: ∅stensen y Förger4.
En caso de reagudizaciones de la enfermedad, el tratamiento dependerá del tipo de reagudización (tabla 3): artritis aguda en una o más articulaciones: infiltración con corticoides y/o AINE; dolor: paracetamol que a dosis de hasta 4 g/día es seguro durante el embarazo; reagudización sistémica: corticoides (dosis<15 mg/día en el 1.er trimestre), antipalúdicos (preferible hidroxicloroquina), azatioprina (dosis<2mg/día), ciclosporina (monitorizar/controlar la tensión arterial materna), sulfasalazina (suplementar con ácido fólico)4.
Tratamiento de las reagudizaciones
| Tipo de reagudización | Fármacos compatibles | Precaución |
| Artritis aguda en 1 o más articulaciones | Corticoides intraarticular, AINE (diclofenaco, ibuprofeno, ketoprofeno, naproxeno) | Suspender AINE antes de las 32 semanas de embarazo |
| Dolor | Paracetamol | 1-4 g son seguros durante todo el embarazo |
| Reagudización sistémica | Corticoides orales | Usar≤15 mg diarios en el primer trimestre |
| Antipalúdicos | Preferible hidroxicloroquina | |
| Azatioprina | Usar≤2 mg por kg de peso corporal al día | |
| Ciclosporina | Monitorizar/controlar la tensión arterial materna | |
| Sulfasalazina | Suplementar con ácido fólico |
AINE: fármacos antiinflamatorios no esteroideos.
Fuente: tomado y con permiso de: ∅stensen y Förger4.
En pacientes con exposición inadvertida a algunos de los fármacos potencialmente nocivos durante el embarazo, debemos conocer el fármaco en cuestión, la dosis utilizada, la edad gestacional al momento del consumo del fármaco y solicitar ecografías por personal entrenado entre las 11-12 semanas y entre las 18-20 semanas con búsqueda del patrón de malformaciones esperadas según el fármaco empleado, así como amniocentesis o biopsia de vellosidades coriónicas en caso necesario. Con la normalidad de estos estudios, es poco probable que se produzca una patología mayor en el feto4.
LactanciaDurante el embarazo, los estrógenos secretados por la placenta hacen que el sistema ductal de las mamas crezca y se ramifique. Al mismo tiempo el estroma glandular aumenta y se deposita grasa en él. Pero es indispensable el estímulo de la prolactina para que se produzca una lactancia con normalidad9.
El paso de fármacos a la leche materna depende de varios factores como, por ejemplo: la unión de éstos a las proteínas plasmáticas (efecto negativo), la liposolubilidad (efecto positivo), el carácter básico del fármaco (efecto positivo), el momento de producción de la leche (ayuno, posprandial) y la farmacocinética, pues los medicamentos que se absorben poco o que tienen un fuerte metabolismo del primer paso son menos problemáticos durante la lactancia10.
Habitualmente se considera que la «dosis relativa del fármaco» que recibirá el niño no debe exceder el 10% de la relación: dosis que recibirá el niño en la leche (mg) /dosis materna (mg) ×100%, para considerarse seguro. Por ejemplo, los AINE tienen una «dosis relativa» del 1% y por tanto son considerados seguros. La dosis del niño en la leche materna depende de la concentración del fármaco en la leche y del volumen de leche ingerida (estimado en 0,15 l/kg de peso diario).
Casi todos los fármacos llegan a la leche materna, con excepción de insulinas y heparinas por su peso molecular, generalmente el paso es por difusión pasiva y el uso de cualquier medicación tópica como cremas, spray nasal o inhaladores aportan menor riesgo al lactante que los fármacos administrados por vía sistémica10,37. El aclaramiento de los fármacos en el recién nacido puede estar significativamente reducido con respecto al adulto, especialmente en prematuros37.
Los AINE, azatioprina, 6-mercaptopurina, sulfasalazina, antipalúdicos (evitar en prematuros y recién nacidos de menos de 1 mes) e inmunoglobulinas IV son fármacos compatibles con la lactancia. La lactancia no está contraindicada con el uso de corticoides, pero si la dosis es mayor de 40 mg diarios hay que considerar la lactancia 4 h después del consumo del fármaco. La ciclosporina, tacrólimus, ciclofosfamida, metotrexato, leflunomida, micofenolato, clorambucilo, sales de oro y biológicos no son fármacos compatibles con la lactancia16,19.
ConclusionesCon frecuencia el embarazo mejora la evolución de la AR, pero una gran parte de las pacientes requerirán algún tipo de tratamiento y en algunas se producirá un brote de la enfermedad, por tanto la decisión de embarazo en una paciente con AR debe retrasarse hasta conseguir un adecuado control de la enfermedad y una vez conseguido utilizar los fármacos inocuos para el feto. Por su parte, la lactancia es un periodo que favorece la aparición de brotes de AR y muy frecuentemente modificaciones del tratamiento.
Conflictos de interesesLos autores declaran no tener conflictos de intereses.
Nota: Sección acreditada por el SEAFORMEC con 1,7créditos.Consultar preguntas de cada artículo en: URL: http://www.reumatologiaclinica.org.