Se presenta el caso de artropatía destructiva de caderas y hombros con calcinosis tumoral asociada a depósitos de oxalato de calcio en un paciente con oxalosis primaria e insuficiencia renal terminal en hemodiálisis.
A case of destructive arthropathy of hips and shoulders with tumoral calcinosis associated with calcium oxalate deposits in a patient with primary oxalosis and end stage renal disease on hemodialysis.
La enfermedad por depósito de cristales de oxalato es una afección rara vista principalmente en pacientes con hiperoxaluria primaria (HOP) y nefropatía por oxalato; se observan formas de oxalosis secundaria en pacientes con insuficiencia renal terminal en diálisis crónica, ingesta de oxalato, deficiencia de tiamina y piridoxina o formación de oxalato por Aspergillus niger. Las manifestaciones musculoesqueléticas de la enfermedad por depósito de oxalato de calcio son similares a las presentadas por artropatías por cristales de pirofosfato de calcio. Se presenta el caso de un paciente con artropatía y calcinosis tumoral asociada a depósitos de oxalato de calcio.
Descripción del casoHombre de 22 años, de origen mestizo latinoamericano, hemotipo O positivo, sin hábitos tóxicos. Sin antecedentes heredofamiliares de litiasis renal. Con diagnóstico de talla baja a los 6 años. A los 8 años inició episodios de litiasis renal repetidos y a los 10 años se realizó el diagnóstico de HOP, con progresión a insuficiencia renal terminal. A los 12 años inició terapia de sustitución renal con diálisis peritoneal y a los 13 se realizó trasplante de donador vivo relacionado con pérdida del injerto a los 5 meses, por lo que inició hemodiálisis, 3 sesiones a la semana, mantenida hasta la actualidad. A los 2 años de inclusión en hemodiálisis inició manifestaciones articulares, con dolor óseo, artritis de carpos, metacarpofalángicas y de rodillas, de forma simétrica y patrón aditivo. A los 16 años presentó fractura patológica del fémur derecho, que requirió reducción abierta y fijación interna. El dolor óseo y la poliartritis siguieron un curso progresivo, sin respuesta al tratamiento con antiinflamatorios, y se inició la aparición de tumoraciones localizadas en los tejidos blandos, que llegaron a impedir la marcha a los 19 años. Los síntomas persistieron a pesar del empleo de infiltración con glucocorticoides, dosis bajas de glucocorticoides por vía oral, analgésicos opioides y antiinflamatorios. En su última valoración se encontró talla baja, pectus carinatum, extremidades cortas, subluxación de carpos y tobillos, y tumoración periarticular localizada en hombros, caderas y rodillas, a expensas de tejidos blandos.
Los estudios de laboratorio mostraron: vitamina D 7,1 ng/ml (deficiencia < 10), ferritina 1 342 ng/ml (30-400), cortisol 7,87 μg/dl (5-25), hormona paratiroidea (PTH) 4,08 pg/ml (10-65), porcentaje de saturación de hierro 101% (15-55), capacidad de fijación de hierro sin saturar 63 μg/dl (250-450), hierro 64 μg/dl (50-170 μg/dl), creatinina 3,4mg/dl (0,4-1,2), nitrógeno ureico 36,45mg/dl (5-23), glucosa 83mg/dl, calcio 9,7mg/dl (8,4-10,2), fósforo 5,1mg/dl (2,7-4,5), magnesio 2,4mg/dl (1,6-2,6), fosfatasa alcalina 296 U/l (40-129), deshidrogenasa láctica 507 U/l (240-480), gammaglutamil transferasa 640 U/l (10-71), alanina-aminotranferasa 23 U/l (2-41), aspartato-transaminasa 50 U/l (2-38), albúmina 2,3g/dl (3,4-4,8) y ácido úrico 6,5mg/dl (2,4-7).
La ecografía abdominal evidenció ambos riñones hipoplásicos, ecogenicidad aumentada y presencia de calcificaciones renales, hepatoesplenomegalia y páncreas sin alteraciones. La tomografía axial computarizada abdominopélvica mostró nefrocalcinosis, hepatomegalia, esplenomegalia y arteriosclerosis, así como osteoesclerosis vertebral y de huesos de la pelvis.
La ecografía cardíaca transtorácica evidenció una presión sistólica de la arteria pulmonar de 61mmHg, ventrículo izquierdo de diámetros normales, grosor de la pared engrosado, movilidad normal, cavidades derechas con dilatación leve, esclerosis valvulares, insuficiencia mitral leve e insuficiencia tricuspídea moderada.
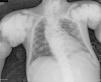
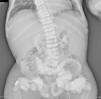
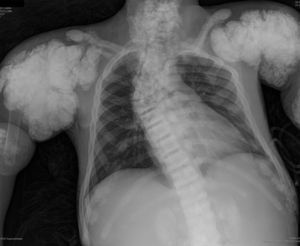
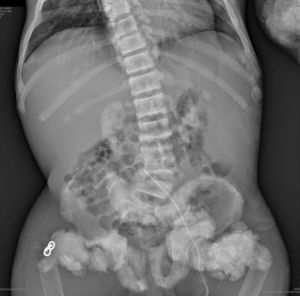
En la radiografía de tórax (fig. 1) se observaron calcificaciones periarticulares en los hombros de aspecto nodular, osteoesclerosis vertebral y colapsos vertebrales dorsales 5 y 6, secuelas de fracturas costales y fractura del húmero derecho. En la radiografía de abdomen (fig. 2) se apreciaron nefrocalcinosis bilateral, osteoesclerosis vertebral y en huesos de la pelvis, calcificaciones periarticulares de aspecto nodular y fractura subtrocantérica bilateral.
Calcificaciones periarticulares de aspecto nodular en hombros. Osteoesclerosis platillovertebrales superior e inferior (columna en jersey de rugby) y colapsos vertebrales dorsales 5 y 6. Crecimiento en forma de bulbo de los extremos de las costillas y clavículas. Osteoesclerosis de clavículas y secuelas de fracturas costales. Fractura del húmero derecho.
Nefrocalcinosis bilateral, osteoesclerosis vertebral (columna en jersey de rugby) y osteosclerosis Paget-like en huesos de la pelvis. Datos de osteomalacia. Calcificaciones periarticulares de aspecto nodular. Fractura subtrocantérica bilateral. Material quirúrgico en el extremo proximal del fémur derecho.
La HOP es un error congénito del metabolismo que conlleva un déficit enzimático de alanina-glioxalato aminotransferasa en el peroxisoma hepático, de herencia autosómica recesiva. El déficit enzimático origina una sobreproducción de oxalato que se elimina por el riñón y precipita formando cristales que se depositan en diversos tejidos. El diagnóstico de HOP se realiza antes de la edad de 5 años en el 65% de los casos. La principal causa de muerte es la uremia, en el 80% de los casos ocurre antes de los 20 años1.
Dado que el oxalato se elimina por vía renal, el riñón es el primer y principal órgano afectado, dando lugar a la aparición de la litiasis de repetición en las primeras décadas de la vida, nefrocalcinosis e insuficiencia renal precoz2. Cuando ocurre la insuficiencia renal terminal y no se puede excretar el ácido oxálico, los depósitos tisulares evolucionan rápidamente, en particular en los riñones y el esqueleto2,3. El hueso es uno de los principales órganos afectados, habiéndose descrito lesiones de inusitada gravedad, especialmente en pacientes con insuficiencia renal en diálisis crónica4. Los depósitos de oxalato y la reacción granulomatosa circundante inducen lesiones semejantes a las del hiperparatiroidismo secundario, particularmente graves4.
El patrón de afectación articular más común es una poliartritis u oligoartritis simétrica, aguda o crónica, con compromiso de las articulaciones metacarpofalángicas e interfalángicas proximales, con o sin tenosinovitis, junto con calcificaciones miliares o algodonosas de la piel y de las arterias de los dedos5,6 (fig. 3); sin embargo, se puede presentar en otras articulaciones, como rodillas, codos, tobillos y las primeras articulaciones metatarsofalángicas. En estudios de autopsia se han descrito depósitos de oxalato de calcio en tejido articular y la oxalosis ósea ocurre en aproximadamente el 90% de los pacientes con insuficiencia renal en tratamiento con hemodiálisis crónica6.
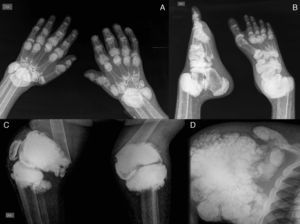
A) Radiografía de manos con calcinosis periarticular en interfalángicas, metacarpofalángicas y carpos, disminución de la densidad ósea, resorción de las epífisis distales del cúbito y radio. B) Radiografía de pies con calcinosis periarticular en interfalángicas, metatarsofalángicas y articulación tibioastragalina, osteoesclerosis en falanges y metatarsianos, luxación de las articulaciones tibioastragalinas, resorción ósea de la epífisis distal de la tibia y peroné. C) Radiografía de rodillas con calcinosis tumoral periarticular, fractura supracondílea bilateral, con desviación medial de la diáfisis femoral. D) Radiografía de hombro con calcinosis tumoral periarticular, resorción de la cabeza y cuello humerales, resorción ósea de la clavícula.
El Hage et al. realizaron una revisión de 12 pacientes consecutivos con HOP tipo 1, todos con afectación renal, 4 de ellos con enfermedad renal terminal en diálisis7. El principal síntoma fue el dolor óseo y solo estuvo presente en los 4 pacientes gravemente implicados y apareció en el segundo año de la diálisis. Los 2 pacientes más gravemente afectados tenían evidencia de fracturas patológicas7.
El daño renal, por lo general, es el resultado de una combinación de nefrolitiasis, nefrocalcinosis y fibrosis intersticial secundaria. La insuficiencia renal se asocia al rápido depósito de los cristales en el riñón, el miocardio, los vasos de la piel, los huesos y la sangre; cuando la tasa de filtración glomerular disminuye por debajo de 30 a 40ml/min/1,73 m2, el oxalato ya no puede ser eficientemente excretado por los riñones y alcanza niveles de sobresaturación8. La saturación de oxalato depende fundamentalmente de los niveles séricos y estos están inversamente relacionados con el filtrado glomerular9. Esta sobresaturación, que ocurre casi universalmente en el suero de los enfermos urémicos terminales con HOP, es la causa de oxalosis sistémica que afecta a estos pacientes en diálisis2. En el trabajo de Worcester et al., se encontró que el umbral de saturación del oxalato en suero es de 40-50μUmol/l, umbral que se alcanza con niveles séricos de creatinina de aproximadamente 9mg/dl2. El estudio y el seguimiento de los pacientes con oxalosis e insuficiencia renal de forma seriada reportan que los pacientes con insuficiencia renal prediálisis no presentan manifestaciones clínicas ni radiológicas de enfermedad ósea.
Las localizaciones típicas de los depósitos de cristales en el esqueleto son los segmentos de las metáfisis de los huesos tubulares10. La distribución de los cristales en el hueso en los sitios de osificación endocondral o intramembranosa sugiere la precipitación en áreas vasculares cuando los niveles son altos. La oxalosis ósea puede ser debida a la combinación del hiperparatiroidismo, la osteodistrofia renal y la respuesta inflamatoria inducida por los cristales de oxalato de calcio11,12.
A medida que el tratamiento regular de diálisis puede prolongar la supervivencia de los pacientes, un nuevo síndrome, caracterizado por el depósito intenso y continuo de cristales de oxalato de calcio en los tejidos blandos y los huesos, se puede desarrollar13. La aparición de problemas óseos en pacientes sometidos a diálisis da testimonio de que la diálisis es menos eficaz en la eliminación de los oxalatos que el riñón sano. Así mismo se han reportado casos de oxalosis secundaria a diálisis; la insuficiencia renal crónica puede conducir a niveles de oxalato séricos de 4 a 8 veces mayores que los niveles normales, que resulta de la eliminación ineficiente de oxalato por hemodiálisis y diálisis peritoneal8. El tipo de diálisis también afecta a la velocidad de depósito de los cristales: el aclaramiento de ácido oxálico por hemodiálisis se ha informado de 80 ml/min, y por diálisis peritoneal solo 6ml/min14. Marangella et al. estudiaron el balance de oxalato en pacientes con HOP en hemodiálisis; la tasa de generación diaria en su estudio fue de 360-630mg y la extracción durante la diálisis no alcanzó al 30% de la cantidad generada, resultando en un depósito diario de oxalato cálcico de 180-360mg; para conseguir el balance de oxalato en diálisis, las sesiones deberían prolongarse de 13-15 h, lo que resulta impracticable2,15.
La exploración radiológica puede poner de manifiesto unos riñones pequeños, contraídos, con calcificaciones parenquimatosas. El espectro de alteraciones radiológicas en el esqueleto es el resultado de los cambios causados por el depósito de oxalato en el hueso y la osteodistrofia renal en pacientes con insuficiencia renal crónica3.
Los signos radiológicos pueden dividirse en más específicos y menos específicos. Los más específicos de oxalosis se encuentran principalmente en las personas gravemente afectadas e incluyen las bandas esclerosas trasversales irregulares en los segmentos metafisarios de los huesos tubulares (fémur, húmero, tibia, peroné, metacarpianos, metatarsianos y falanges), bandas metafisarias radiolúcidas y osteoesclerosis de los cuerpos vertebrales que implican en un primer momento los platillos vertebrales superior e inferior, creando una apariencia de la columna en jersey de rugby, antes de que se extiendan al resto del cuerpo vertebral, así como la aparición de la típica imagen de «hueso dentro de hueso»7. Las bandas metafisarias y las zonas escleróticas en los cuerpos vertebrales no son específicas para oxalosis y el diagnóstico diferencial incluye, entre otros, la intoxicación por plomo, leucemia tratada y la talasemia1. Los menos específicos incluyen: configuración en palillo de tambor de los huesos metacarpianos, esclerosis en forma de placas en las clavículas, borde radiolúcido o radiodenso alrededor de las epífisis, carpo y huesos del tarso, cambios quísticos óseos, invaginación epifisaria, el crecimiento bulboso de los extremos de las costillas y las clavículas, osteoesclerosis en parches (Paget-like), la resorción subperióstica y fracturas patológicas. Day et al. encontraron que las anormalidades radiográficas óseas dependen de la edad del paciente en el momento en que se produjo la insuficiencia renal y el grado de éxito del trasplante renal; los cambios esqueléticos más característicos se presentaron en 6 de 7 pacientes que desarrollaron insuficiencia renal a una edad menor o igual a los 7 años12.
Las calcificaciones de tejidos blandos son una complicación frecuente en el paciente con insuficiencia renal crónica. El término calcinosis tumoral se refiere al depósito masivo de sales de calcio que forman tumoraciones multiloculadas alrededor de las articulaciones. La patogenia de las alteraciones óseas y de partes blandas asociadas a la insuficiencia renal crónica es multifactorial y, aunque no está del todo claro, 2 son los principales factores que actúan en conjunto: el hiperparatiroidismo secundario y alteración del metabolismo de la vitamina D.
La calcificación de los tejidos blandos se ve en un 79% de los pacientes en diálisis. La insuficiencia renal crónica lleva a un hiperparatiroidismo secundario que origina liberación de calcio de los huesos e inhibición de la reabsorción tubular de fosfato. Cuando el producto calcio-fósforo está elevado, del orden de 65-70 (normalmente es de 40), se produce el depósito subcutáneo de fosfato de calcio16.
La calcinosis tumoral idiopática se caracteriza por el desarrollo de grandes masas de fosfato cálcico amorfo alrededor de grandes articulaciones, niveles elevados de fósforo sérico y niveles normales de PTH. La causa más probable es un incremento de la reabsorción tubular de fosfato17. Usualmente, esta lesión es asintomática y rara vez puede dar síntomas producto de compresión de estructuras vecinas.
La calcinosis tumoral asociada al paciente urémico es una complicación poco frecuente entre los pacientes sometidos a diálisis de larga evolución, de etiología multifactorial; se caracteriza por depósitos de sales cálcicas en áreas periarticulares, en ocasiones de forma masiva. El factor etiopatogénico más importante lo constituye la alteración del producto de las concentraciones séricas de calcio y fósforo, y el hiperparatiroidismo, las tumoraciones son frecuentemente periarticulares, sin existir afectación articular ni proceso invasivo18,19. Clínicamente, se presenta como tumoraciones periarticulares no dolorosas, de consistencia firme y crecimiento progresivo. Este crecimiento es expansivo y no produce invasión visceral, muscular ni ósea. Los factores predisponentes son el hiperparatiroidismo grave y el producto-calcio fósforo mayor de 7018. En ausencia de un hiperparatiroidismo secundario, la elevación del producto calcio-fósforo está originada por una hipercalcemia iatrogénica y/o una hiperfosforemia multifactorial: administración prolongada y excesiva de carbonato calcio y calcitriol, ingesta inadecuada de quelantes del fósforo y diálisis insuficiente18.
La ingesta crónica de dosis elevadas de vitamina D puede originar hipervitaminosis D; sus síntomas y signos son debidos a hipercalcemia e incluyen debilidad, cefalea, náuseas, poliuria y nefrolitiasis16.
En nuestro caso, descartamos estos factores descritos como inductores de calcificaciones. Los niveles de vitamina D se encontraron por debajo del rango de referencia, lo que descarta hipervitaminosis D. No se documentó hiperparatiroidismo secundario, por el contrario, los niveles de PTH se encontraron suprimidos, ni se encontraron niveles elevados de la relación calcio-fósforo (aproximadamente 50) que justificara la calcinosis tumoral. Así mismo la manifestación esquelética más común del hipoparatiroidismo es la osteoesclerosis, con bandas de radiodensidad en las metáfisis de los huesos largos y, aunque pueden apreciarse calcificaciones subcutáneas, especialmente en las caderas y los hombros, estas son asintomáticas; así mismo el paciente no presentó hipocalcemia o signos neuromusculares que apoyaran el diagnóstico de hipoparatiroidismo. Por razones técnicas al momento del ingreso, y por la posterior pérdida del seguimiento del paciente, no fue posible la realización de una biopsia ósea ni el estudio de cristales en el líquido sinovial, que ayudarían a aclarar la patogenia de la enfermedad.
Nuestro paciente presentó un cuadro clínicamente compatible con HOP al presentar nefrolitiasis recurrente, nefrocalcinosis en edad pediátrica que evolucionó a insuficiencia renal terminal; la clave diagnóstica es la hiperoxaluria, pero este dato solo es útil en ausencia de insuficiencia renal, por lo cual no se determinó. La ausencia de síntomas musculoesqueléticos antes de la diálisis concuerda con los reportes de que los pacientes con HOP en la etapa prediálisis se encuentran asintomáticos, sin signos radiológicos de oxalosis ósea; en un periodo de 1-2 años posterior a la diálisis, la mayoría evoluciona con dolores óseos progresivos, que puede llegar a producir afección ósea grave con deformidades esqueléticas, fracturas espontáneas e invalidez 4. La mayor sobrevida de nuestro paciente por los cuidados de la terapia de sustitución de la función renal, con un mayor tiempo de exposición y precipitación de los cristales de oxalato a nivel osteoarticular, se considera el principal factor para los cambios tardíos de la oxalosis ósea, la presencia de fracturas patológicas y la calcinosis tumoral. En una serie de más de 200 pacientes en tratamiento con diálisis y niveles séricos de PTH superiores a los del paciente no se encontró osteoesclerosis vertebral y en la pelvis, por lo cual este patrón es difícilmente atribuible únicamente a la osteodistrofia renal 13. De los datos bioquímicos, se encontró fosfatasa alcalina moderadamente elevada, lo cual ha sido descrito en la evolución de los pacientes con oxalosis, principalmente en pacientes en hemodiálisis4.
Brancaccio et al. reportaron que el depósito de oxalato y el hiperparatiroidismo están implicados en la génesis de las lesiones óseas, pero lo primero es mucho más importante; en un paciente con HOP e hiperparatiroidismo al que se realizó una paratiroidectomía, las lesiones óseas progresaron a pesar de los valores de PTH en suero normales y niveles de calcio sérico limítrofes, indicativos de una resorción ósea independiente de la PTH13.
Como resultado, la oxalosis secundaria a hemodiálisis combinada con la HOP podría haber agravado los cambios esqueléticos de nuestro paciente. Además, la mayoría de los cambios esqueléticos vistos en el paciente podrían ser el resultado de los efectos combinados del depósito de cristales de oxalato y el desarrollo progresivo de la osteodistrofia renal. Sin embargo, los cambios esqueléticos son más propensos a ser concordante con oxalosis. Parece lógico considerar los depósitos de oxalato como los principales causantes de las graves lesiones óseas y la calcinosis tumoral observada en este paciente.
El objetivo de este artículo fue describir el espectro radiológico de la oxalosis ósea de grandes articulaciones. Hasta donde sabemos, ningún otro artículo menciona una artropatía destructiva asociada a esta compleja afección, lo cual puede ser debido a la mayor sobrevida del paciente en hemodiálisis. Una búsqueda exhaustiva de la literatura no ha podido recuperar ningún artículo que describa una asociación entre oxalosis y artropatía destructiva de los hombros, caderas y rodillas.
ConclusiónEl espectro radiográfico de los cambios óseos en la HOP y la oxalosis se debe a muchos factores que influyen en el metabolismo óseo en esta enfermedad compleja, que incluye altos niveles de oxalato de calcio, hiperparatiroidismo secundario y osteodistrofia renal. Se describe el caso de un paciente con artropatía destructiva de grandes articulaciones, en que se descartaron razonablemente el hiperparatiroidismo, el hipoparatiroidismo y las alteraciones en relación fosfocálcica, sugiriendo el depósito de oxalato como causa de esta artropatía.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.