Evaluar la asociación del epítopo compartido, el tabaquismo y la interacción entre ambos sobre la presencia de autoanticuerpos (antipéptidos cíclicos citrulinados [anti-PCC] y factor reumatoide) en pacientes con artritis reumatoide en nuestra área geográfica.
MétodosEstudio descriptivo y transversal realizado en una cohorte de 106 pacientes diagnosticados de artritis reumatoide. Análisis estadístico univariante y multivariante mediante regresión logística ordinal. Se calcularon odds ratios (OR) con un intervalo de confianza del 95% [IC95%] y se considero significativo un valor de p<0,05.
ResultadosEn el análisis univariante, el epítopo compartido (OR=2,68; IC95% 1,11-6,46), el hábito tabáquico (OR=2,79; IC95% 1,12-6,97) y un índice de tabaquismo en paquetes-año alto (>20 paquetes/año) (OR=8,93; IC95% 1,95-40,82) se asociaron con la presencia de anti-PCC positivos. Para el factor reumatoide, la asociación solo fue significativa con el hábito tabáquico (OR=3,89; IC95% 1,06-14,28) y el índice de tabaquismo (OR=8,33; IC95% 1,05-66,22). Mediante análisis de regresión logística ordinal se identificó asociación con títulos elevados de anti-PCC (>200 U/mL) en mestizos latinoamericanos, ser homocigoto para el epítopo compartido, tener factor reumatoide positivo y ser gran fumador.
ConclusionesEl ser mestizo latinoamericano, tener epítopo compartido, factor reumatoide y un índice de tabaquismo>20 paquetes/año son factores de riesgo independientes para el desarrollo de artritis reumatoide con anti-PCC positivos a títulos elevados (>200U/mL). En los pacientes portadores del epítopo compartido, la intensidad del consumo de tabaco se asocia más fuertemente que el hábito de fumar con un riesgo incrementado de anti-PCC positivos, observándose una interacción entre ambos factores.
To evaluate the association of shared epitope, smoking and their interaction on the presence of autoantibodies (anti-cyclic citrullinated peptide [CCP] antibodies and rheumatoid factor) in patients with rheumatoid arthritis in our geographical area.
MethodsA descriptive and cross-sectional study was carried out in a cohort of 106 patients diagnosed with RA. Odds ratios (OR) for antibody development were calculated for shared epitope, tobacco exposure and smoking dose. Statistical analysis was performed with univariate and multivariate statistics using ordinal logistic regression. Odds ratios were calculated with 95% confidence interval (95% CI) and a value of P<.05 was considered significant.
ResultsIn univariate analysis, shared epitope (OR=2.68; 95% CI: 1.11-6.46), tobacco exposure (OR=2.79; 95% CI: 1.12-6.97) and heavy smoker (>20 packs/year) (OR=8.93; 95% CI: 1.95-40.82) were associated with the presence of anti-CCP antibodies. For rheumatoid factor, the association was only significant for tobacco exposure (OR=3.89; 95% CI: 1.06-14.28) and smoking dose (OR=8.33; 95% CI: 1.05-66.22). By ordinal logistic regression analysis, an association with high titers of anti-CCP (>200U/mL) was identified with South American mestizos, patients with homozygous shared epitope, positive FR and heavy smokers.
ConclusionsBeing a South American mestizo, having a shared epitope, rheumatoid factor positivity and a smoking dose>20 packs/year are independent risk factors for the development of rheumatoid arthritis with a high titer of anti-CCP (>200U/mL). In shared epitope-positive rheumatoid arthritis patients, the intensity of smoking is more strongly associated than tobacco exposure with an increased risk of positive anti-CCP.
La artritis reumatoide (AR) es una enfermedad autoinmune sistémica caracterizada por inflamación crónica de las articulaciones. Presenta un origen multifactorial donde intervienen factores genéticos y ambientales y cuya interacción es determinante en el desarrollo de la enfermedad1. El factor genético más importante para su desarrollo es una secuencia de alelos HLA denominados «epítopo compartido» (EC)2. Además, una gran variedad de factores ambientales inciden sobre la base genética para iniciar el proceso autoinmune de la enfermedad. El tabaquismo es el factor ambiental más importante asociado a un mayor riesgo de padecer AR, particularmente en individuos portadores de los alelos del EC3.
El descubrimiento de los anticuerpos contra proteínas y/o péptidos cíclicos citrulinados (anti-PCC) ha modificado la hipótesis del papel del EC como factor de susceptibilidad. Se ha propuesto que los alelos del EC predisponen exclusivamente al desarrollo de AR con anti-PCC positivos. Además, el factor reumatoide (FR) y los anti-PCC con frecuencia suelen ocurrir simultáneamente pero la asociación entre EC y FR es secundaria a la asociación entre EC y anti-PCC. En los últimos años se ha formulado un nuevo modelo para la patogénesis de la AR donde el EC y los anti-PCC tienen un rol fundamental y donde intervienen factores genéticos y ambientales denominado «modelo del EC citrulinado»4.
El objetivo de nuestro estudio fue evaluar la asociación del EC, el tabaquismo y la interacción entre ambos sobre la presencia de autoanticuerpos específicos asociados a la AR.
Materiales y métodosPacientesEstudio realizado sobre una cohorte de 106 pacientes diagnosticados de AR en las Consultas de Artritis Precoz del Hospital Universitario Virgen Macarena de acuerdo a los criterios del American College of Rheumatology (ACR, 1987)5. De cada paciente se obtuvo una muestra de suero al diagnóstico para la determinación de los anticuerpos anti-PCC y FR mientras que el EC se determinó en una muestra de sangre total.
Determinación de autoanticuerpos y del epítopo compartidoLos anti-PCC se cuantificaron por un ensayo ELISA (QUANTA LiteTM CCP3 IgG, INNOVA Diagnostics, San Diego, EE. UU.) y un punto de corte >40 U/mL fue considerado positivo. El FR se cuantificó mediante un método inmunoturbidimétrico potenciado con látex en el analizador ADVIA 2400 (Siemens Healthcare Diagnostics) y una concentración >20 UI/mL se empleó como punto de corte. Para la determinación del EC se empleó una técnica de hibridación reversa (Kit «HLA-DRB1 Shared Epitope QKRAA/QRRAA/RRRAA» de GenID GmbH, Strassberg, Alemania) y se expresó como negativo, positivo heterocigoto y positivo homocigoto.
Exposición al tabaco de los pacientesLa exposición al tabaco de los pacientes se definió con 2 variables: hábito tabáquico (HT) e índice tabáquico (IT). El HT se definió como «fumador» (incluye «fumadores activos» y «ex fumadores») o «no fumador». El IT es una variable epidemiológica cuantitativa empleada para conocer el consumo de tabaco del paciente y se define como el producto entre el «número de cigarros fumados al día» por «años que lleva fumando» dividido por el valor numérico de 20. Se expresa en paquetes/año y clasifica a los pacientes en 3 grupos: IT alto (>20 paquetes/año), IT bajo (1-20 paquetes/año) e IT negativo (no fumadores). Se ha establecido un punto de corte superior a 20 paquetes/año para definir a grandes fumadores6.
Aspectos éticosEl proyecto de investigación fue aprobado por el Comité de Ética e Investigación Sanitaria del Área Hospitalaria Virgen Macarena de Sevilla y el consentimiento informado fue obtenido de los pacientes. En todo momento se respetaron los principios de equidad, confidencialidad, respeto, no maleficencia y demás requisitos anotados en las Guías de Buena Práctica Clínica. El estudio está basado en práctica clínica habitual por lo que en ningún momento este proyecto significó una modificación en la conducta clínica habitual ni en los tratamientos a seguir de los pacientes.
Análisis estadístico de datosLas variables cuantitativas se expresaron como mediana (rango intercuartílico) y las variables cualitativas como número y porcentajes. Para estudiar la contribución del EC y del tabaquismo sobre la presencia de autoanticuerpos en los pacientes con AR se calcularon los odds ratio (OR) con intervalos de confianza al 95% (IC95%). Se construyeron diferentes modelos de regresión logística binaria y de regresión logística ordinal, en donde la variable dependiente fue tener anti-PCC positivo/negativo empleando diferentes puntos de corte: los del fabricante de la técnica (negativo 0-40U/mL, positivo débil 40-60U/mL y positivo fuerte>60U/mL); y los de la mediana de la muestra (negativo 0-40U/mL, positivo bajo 40-200U/mL y positivo alto>200U/mL; mediana de pacientes con anti-PCC positivos: 200 (63-309)U/mL). Las variables independientes en los modelos realizados fueron las que con sentido biológico en el análisis univariante mostraron una p<0,2.
ResultadosCaracterísticas de los pacientesLa cohorte de 106 pacientes se caracterizó por un predominio del sexo femenino (72%) y una mediana de edad de 53 (45-62) años (tabla 1). Sesenta y ocho pacientes (64%) eran no fumadores y los 38 pacientes restantes (36%) eran fumadores: 25 fumadores activos (24%) y 13 exfumadores (12%). Del grupo de 38 pacientes fumadores; el 25% (26 pacientes) eran grandes fumadores con un IT>20 paquetes/año mientras que el 11% (12 pacientes) tenían un IT bajo (1-20 paquetes/año). Se observó que el IT fue superior en los «exfumadores» frente a «fumadores activos» con valores de 45 (36-56) y 26 (18-31) paquetes/año, respectivamente (p=0,008). Los anti-PCC fueron positivos en el 65% de los pacientes y para el FR este porcentaje ascendió al 81% mientras que ambos anticuerpos fueron positivos simultáneamente en el 64% de los pacientes. La positividad para el EC fue del 73% (77 pacientes). De los 77 pacientes con el EC positivo en el grupo AR, 60 (57%) de ellos fueron heterocigotos y los 17 (16%) restantes fueron homocigotos.
Características de los pacientes en la visita basal
| Parámetros | AR(n=106) | AR-EC positivo(n=77) | AR-EC negativo(n=29) | Valor p |
|---|---|---|---|---|
| Edad (años) | 53 (45-62) | 55 (46-63) | 52 (39-58) | 0,2 NSc |
| Género femenino | 76 (72) | 56 (72) | 20 (69) | 0,7 NSb |
| Grupo étnico | 0,04b | |||
| Caucásicos europeos | 99 (91) | 68 (88) | 29 (100) | |
| Mestizos latinoamericanos | 9 (9) | 9 (12) | 0 (0) | |
| Antecedentes familiares de AR | 22 (21) | 17 (22) | 5 (17) | 0,5 NSb |
| Hábito tabáquico | 0,2 NSb | |||
| No fumador | 68 (64) | 48 (62) | 20 (69) | |
| Fumadora | 38 (36) | 29 (38) | 9 (31) | |
| Exfumador | 13 (12) | 12 (16) | 1 (3) | |
| Fumador activo | 25 (24) | 17 (22) | 8 (28) | |
| Índice tabáquico (paquetes/año) | 30 (18-45) | 30 (18-50) | 30 (5-31) | 0,2 NSc |
| Índice tabáquico | 0,5 NSb | |||
| Negativo | 68 (64) | 48 (62) | 20 (69) | |
| Bajo (1-20 paquetes/año) | 12 (11) | 8 (10) | 4 (14) | |
| Alto (>20 paquetes/año) | 26 (25) | 21 (27) | 5 (17) | |
| Forma de inicio de síntomas | 0,3 NSb | |||
| Poliarticular | 70 (69) | 53 (71) | 17 (65) | |
| Oligoarticular | 21 (21) | 13 (17) | 8 (31) | |
| Monoarticular | 8 (8) | 7 (9) | 1 (4) | |
| Poliartralgias | 2 (2) | 2 (3) | 0 (0) | |
| Diagnóstico precoz (<2 años) | 83 (83) | 61(82) | 22 (85) | 0,7 NSb |
| Erosiones articulares | 64 (60) | 45 (58) | 19 (65) | 0,5 NSb |
| DAS28 | 5,7 (3,9-6,5) | 5,7 (4,1-6,4) | 5,6 (3,5-6,5) | 0,8 NSc |
| HAQ | 1,3 (0,5-2,0) | 1,4 (0,6-2,0) | 1,0 (0,5-2,1) | 0,8 NSc |
| Anti-PCC (U/mL) | 116 (11-280) | 177(16-301) | 16 (6-33) | <0,0001c |
| Anti-PCC positivo | 69 (65) | 55 (71) | 14 (48) | 0,03b |
| FR (UI/mL) | 62 (31-178) | 83 (39-224) | 33 (20-59) | <0,0001c |
| FR positivo | 86 (81) | 65 (84) | 21 (72) | 0,1 NSb |
| Anti-PCC y FR positivo | 60 (64) | 50 (65) | 14 (48) | 0,1 NSb |
AR: artritis reumatoide; Anti-PCC: anticuerpos antipéptido cíclico citrulinado; DAS28: disease activity score based on 28 joints; EC: epítopo compartido; FR: factor reumatoide; HAQ: Health Assessment Questionnaire.
Datos cualitativos expresados como n (%) y datos cuantitativos expresados como mediana (rango intercuartílico).
El EC estuvo asociado con la presencia de anti-PCC con un OR de 2,68 (IC95%: 1,11-6,46): el 71% de los pacientes con EC positivo tuvieron los anti-PCC positivos en contraste con los pacientes con EC negativo donde este porcentaje fue del 48% (tabla 2). Se observó una asociación significativa con el EC positivo heterocigoto con un OR de 2,50 (IC95%: 1-6,24) y una significación estadística marginal con el EC positivo homocigoto con un OR de 3,48 (IC95%: 0,92-13,25). Sin embargo, para el FR no se encontró asociación significativa con el EC (tabla 3).
Factores asociados con los anticuerpos anti-PCC en los pacientes con artritis reumatoide
| Parámetro | Anti-PCC negativo (n=37) | Anti-PCC positivo (n=69) | OR (IC95%) | Valor pb |
|---|---|---|---|---|
| Epítopo compartido | ||||
| Negativo | 15 (52) | 14 (48) | 1 | - |
| Positivo | 22 (29) | 55 (71) | 2,68 (1,11-6,46) | 0,03 |
| Positivo heterocigoto | 18 (30) | 42 (70) | 2,50 (1-6,24) | 0,04 |
| Positivo homocigoto | 4 (23) | 13 (77) | 3,48 (0,92-13,25) | 0,05 |
| Hábito tabáquico | ||||
| No fumador | 29 (43) | 39 (57) | 1 | - |
| Fumadora | 8 (21) | 30 (79) | 2,79 (1,12-6,97) | 0,03 |
| Exfumador | 2 (15) | 11 (85) | 4,09 (0,84-19,88) | 0,06 |
| Fumador activo | 6 (24) | 19 (76) | 2,36 (0,84-6,64) | 0,1 |
| Índice tabáquico | ||||
| IT negativo (no fumador) | 29 (43) | 39 (57) | 1 | - |
| IT bajo (1-20 paq./año) | 6 (50) | 6 (50) | 0,90 (0,20-2,54) | 0,7 |
| IT alto (>20 paq./año) | 2 (8) | 24 (92) | 8,93 (1,95-40,82) | 0,005 |
| Género | ||||
| Masculino | 7 (23) | 23 (77) | 1 | - |
| Femenino | 30 (40) | 46 (60) | 0,47 (0,17-1,22) | 0,1 |
| Edadc | ||||
| Edad<53 años | 21 (40) | 32 (60) | 1 | - |
| Edad>53 años | 16 (30) | 37 (70) | 1,52 (0,68-3,39) | 0,3 |
| Etnia | ||||
| Caucásico europeo | 36 (37) | 61 (63) | 1 | |
| Mestizo latinoamericano | 1 (11) | 8 (89) | 4,72 (0,57-39,31) | 0,1 |
| Antecedentes familiares de AR | ||||
| Sin antecedentes | 30 (36) | 54 (64) | 1 | |
| Con antecedentes | 7 (32) | 15 (68) | 1,19 (0,44-3,24) | 0,7 |
| Tiempo de diagnóstico de la enfermedad | ||||
| Tiempo<2 años | 28 (34) | 55 (66) | 1 | |
| Tiempo>2 años | 5 (29) | 12 (71) | 1,22 (0,39-3,81) | 0,7 |
| Factor reumatoide | ||||
| Negativo (<20UI/mL) | 15 (75) | 5 (25) | 1 | |
| Positivo (>20UI/mL) | 22 (26) | 64 (74) | 8,73 (2,84-26,80) | <0,0001 |
AR: artritis reumatoide; Anti-PCC: anticuerpos antipéptido cíclico citrulinado; IT: índice tabáquico; OR: odds ratio.
Datos expresados como n (%).
Factores asociados con el factor reumatoide positivo en los pacientes con artritis reumatoide
| Epítopo compartido | FR negativo (n=20) | FR positivo (n=86) | OR (IC95%) | Valor pb |
|---|---|---|---|---|
| Epítopo compartido | ||||
| Negativo | 8 (28) | 21 (72) | 1 | - |
| Positivo | 12 (16) | 65 (84) | 2,06 (0,74-5,73) | 0,1 |
| Positivo heterocigoto | 10 (17) | 50 (83) | 1,91 (0,66-5,50) | 0,2 |
| Positivo homocigoto | 2 (12) | 15 (88) | 2,86 (0,53-15,41) | 0,2 |
| Hábito tabáquico | ||||
| No fumador | 17 (25) | 51 (75) | 1 | - |
| Fumadora | 3 (8) | 35 (92) | 3,89 (1,06-14,28) | 0,04 |
| Exfumador | 1 (8) | 12 (92) | 4 (0,48-33,08) | 0,2 |
| Fumador activo | 2 (8) | 23 (92) | 3,83 (0,82-17,98) | 0,1 |
| Índice tabáquico | ||||
| IT negativo (no fumador) | 17 (25) | 51 (75) | 1 | - |
| IT bajo (1-20 paq./año) | 2 (17) | 10 (83) | 1,67 (0,33-8,37) | 0,5 |
| IT alto (>20 paq./año) | 1 (4) | 25 (96) | 8,33 (1,05-66,22) | 0,04 |
| Género | ||||
| Masculino | 3 (10) | 27 (90) | 1 | - |
| Femenino | 17 (22) | 79 (78) | 0,39 (0,10-1,43) | 0,1 |
| Edadc | ||||
| Edad<53 años | 10 (19) | 43 (81) | 1 | - |
| Edad>53 años | 10 (19) | 43 (81) | 1 (0,38-2,65) | 1,0 |
| Etnia | ||||
| Caucásico europeo | 20 (21) | 77 (79) | 1 | - |
| Mestizo latinoamericano | 0 (0) | 9 (100) | 0,79 (0,72-0,88) | 0,1 |
| Antecedentes familiares de AR | ||||
| Sin antecedentes | 15 (18) | 69 (82) | 1 | - |
| Con antecedentes | 5 (23) | 17 (77) | 0,74 (0,24-2,32) | 0,6 |
| Tiempo de diagnóstico de la enfermedad | ||||
| Tiempo<2 años | 10 (12) | 73 (88) | 1 | - |
| Tiempo>2 años | 6 (35) | 11 (65) | 0,25 (0,08-0,83) | 0,02 |
AR: artritis reumatoide; FR: factor reumatoide; IT: índice tabáquico; OR: odds ratio.
Datos expresados como n (%).
El HT estuvo asociado con la presencia de anti-PCC positivos con un OR de 2,79 (IC95%: 1,12-6,97). En los pacientes fumadores, el 79% de ellos presentaron los anti-PCC positivos en contraste con los pacientes no fumadores donde este porcentaje fue del 57% (tabla 2). Para el FR se obtuvo un OR de 3,89 (IC95%: 1,06-14,28) siendo el FR positivo en el 92 y 75% de los pacientes con HT positivo y negativo, respectivamente (tabla 3). Al separar a los pacientes fumadores en los 2 grupos «exfumador» y «fumador activo»; no se observaron diferencias estadísticamente significativas con la presencia de anti-PCC y FR, respectivamente.
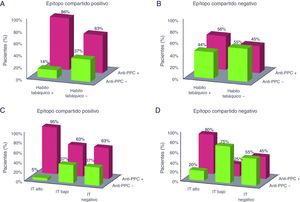
Del mismo modo, en los pacientes se estudió si la cantidad de tabaco consumido influía sobre los anticuerpos anti-PCC y FR. Un IT alto (>20 paquetes/año) estuvo asociado con la presencia de anti-PCC positivos con un OR de 8,93 (IC95%: 1,95-40,82). En ellos, el 92% presentaron los anti-PCC positivos en contraste con los pacientes con un IT bajo y negativo donde los porcentajes descendieron al 50 y 57%, respectivamente (tabla 2). Para el FR se obtuvo un OR de 8,33 (IC95%: 1,05-66,22) siendo el FR positivo en el 96 y 83% de los pacientes con IT alto y bajo, respectivamente (tabla 3). En la figura 1 se representa el porcentaje de pacientes con anti-PCC positivos y negativos según el HT y el IT en los pacientes diagnosticados de AR y estratificados según el EC.
Porcentaje de pacientes con anti-PCC positivos y negativos según el hábito tabáquico y el índice tabáquico en los pacientes diagnosticados de artritis reumatoide y estratificados según el epítopo compartido. El porcentaje hace referencia a los pacientes con anti-PCC positivos y negativos dentro de cada categoría de tabaquismo. Anti-PCC: anticuerpos antipéptido cíclico citrulinado; IT: índice tabáquico. A: epítopo compartido positivo y hábito tabáquico; B: epítopo compartido negativo y hábito tabáquico; C: epítopo compartido positivo e índice tabáquico; D: epítopo compartido negativo e índice tabáquico.
Mediante un modelo de regresión logística ordenada se analizó la asociación entre variables de riesgo y títulos de anti-PCC. El mejor modelo que explicó la asociación entre presencia de anti-PCC positivos a título negativo (0-40U/mL), positivo bajo (40-200U/mL) y positivo alto (>200U/mL) incluyó la raza, el EC, el FR y el IT. El modelo fue consistente con un OR de 95,94; likelihood ratio de 40,89 y p<0,00001. Estos datos se muestran en la tabla 4. La tabla muestra que los mestizos latinoamericanos tienen un OR proporcional en el modelo ordenado de tener anti-PCC>200 U/mL 14,63 veces mayor (1,52-141,21) cuando el resto de variables se mantiene constante. Tener un EC homocigoto incrementa el OR de tener anti-PCC>200 U/mL 6,63 (1,88-23,31) veces; mientras que tener un EC heterocigoto incrementa el OR de tener anti-PCC a la mitad 3,01 (1,22-7,41) si el resto de variables se mantienen constantes en el modelo. De modo interesante, tener un FR positivo incrementa la probabilidad de tener anti-PCC 5,23 veces (1,62-16,85). Respecto al IT, ser fumador leve-moderado, es decir aquellos con IT<20 paquetes/año no se asoció con tener títulos elevados de anti-PCC, asociación que sí se vio incrementada en los grandes fumadores con IT>20 paquetes/año (OR: 2,64; IC95%: 1,04-6,69).
Modelo multivariante mediante regresión logística ordenada de las variables que influyen independientemente en la presencia de anticuerpos anti-PCC positivos en los pacientes con artritis reumatoide
| Variables | Modelo multivariante | |
|---|---|---|
| OR (IC95%) | Valor pa | |
| Etnia mestizo latinoamericano | 14,62 (1,52-141,21) | 0,02 |
| EC heterocigoto | 3,01 (1,22-7,41) | 0,02 |
| EC homocigoto | 6,63 (1,88-23,31) | 0,003 |
| FR positivo | 5,23 (1,62-16,85) | 0,006 |
| IT bajo | 0,55 (0,14-2,21) | 0,4 |
| IT alto | 2,64 (1,04-6,69) | 0,04 |
| Anti-PCC punto de corte 40U/mL | 1,78 (0,56-2,99) | - |
| Anti-PCC punto de corte 200U/mL | 3,58 (2,21-4,94) | - |
| Iteraciones realizadas para obtener el modelo: | ||
| Iteración 0: log likelihood=−116,387 | ||
| Iteración 1: log likelihood=−96,467 | ||
| Iteración 2: log likelihood=−95,949 | ||
| Iteración 3: log likelihood=−95,941 | ||
| Iteración 4: log likelihood=−95,941 | ||
| Características del modelo multivariante: | ||
| Número de observaciones: 106 | ||
| LR Chi2=40,89 | ||
| p<0,00001 | ||
| Seudo R2=0,1757 | ||
| Log likelihood=−95,94 | ||
| Variables incluidas en el modelo multivariante: | ||
| Anti-PCC (variable dependiente): negativo (0-40U/mL), positivo bajo (40-200U/mL), positivo alto (>200U/mL) | ||
| Etnia: caucásico, mestizo latinoamericano | ||
| Epítopo compartido: negativo, positivo y heterocigoto | ||
| Factor reumatoide: negativo (<20UI/mL), positivo (>20UI/mL) | ||
| Índice tabáquico: negativo (0 paquetes/año), bajo (1-20 paquetes/año), alto (>20 paquetes/año) | ||
Anti-PCC: anticuerpos anti-péptido cíclico citrulinadoEC: epítopo compartido; FR: factor reumatoide; IT
índice tabáquico; OR: odds ratio.
El modelo con regresión logística ordenada fue más consistente que el de regresión logística binaria (OR: 95,94 vs. 53,44, respectivamente). Los modelos que incluyeron los anti-PCC con punto de corte negativo (0-40U/mL), positivo débil (40-60U/mL) y positivo fuerte (>60U/mL) fueron menos consistentes. Datos no mostrados.
DiscusiónEste estudio ha evaluado la asociación del EC y del tabaquismo sobre la presencia de autoanticuerpos asociados a la AR en nuestra población del sur de España. La mayoría de los estudios en AR se han realizado en el continente europeo, sobre todo en los países de la zona norte, demostrando una consistencia en sus resultados3,7,8. Los resultados obtenidos han validado los resultados anteriores en nuestra población e indican que la presencia del EC confiere un mayor riesgo de desarrollar AR con anticuerpos anti-PCC positivos (OR=2,68). Además, el aumento de la dosis génica tuvo asociado un incremento del riesgo coincidiendo con estudios previos. Los pacientes con el EC heterocigoto presentaron un riesgo de 2,50 mientras que dicho riesgo ascendió a 3,48 para los pacientes con el EC homocigoto (tabla 2). Por el contrario, no se observó una asociación significativa entre el EC y la presencia del FR. Estos datos obtenidos muestran que el EC se asocia principalmente a la presencia de anticuerpos anti-PCC y no a la presencia de FR en nuestra área geográfica.
El tabaquismo representa, sin lugar a dudas, el factor ambiental de riesgo más destacado y argumentado para el desarrollo de AR. Desde la primera observación a finales de los años 80 de la asociación del tabaquismo con la AR en un conjunto de mujeres9, consecutivos estudios tanto de casos y controles como de cohortes han identificado el tabaquismo como un importante factor de riesgo en la AR1,10,11. Heliövaara et al.12 encontraron que la exposición al humo de tabaco puede desencadenar la producción del FR y contribuir al desarrollo de la AR mientras que Uhlig et al.13 identificaron el HT como un factor de riesgo independiente para el desarrollo de AR en hombres, especialmente en la AR seropositiva para el FR. Igualmente, en un estudio realizado en mujeres encontraron que la duración pero no la intensidad del HT estuvo asociada con un riesgo incrementado de AR, tanto seropositiva como seronegativa para el FR1. Sin embargo, en un estudio realizado por Costenbader et al.11 encontraron que tanto la duración como la intensidad del HT estaban directamente relacionadas con el desarrollo de AR, en particular con la AR seropositiva. En dicho estudio la asociación se dio tanto en fumadores activos como en exfumadores.
Por ello, en nuestros pacientes también se estudió la asociación del tabaquismo con la presencia de anticuerpos (tablas 2 y 3). De los resultados obtenidos se extrajo que el HT se asoció tanto con la presencia de anticuerpos anti-PCC como con el FR. Por el contrario, al estratificar a los fumadores como exfumadores y fumadores activos, los resultados no llegaron a ser significativos. Apoyaría el hallazgo de Costenbader et al.11 quienes señalan que la asociación se da independientemente del estado actual de exposición al tabaco, afectando tanto a fumadores activos como exfumadores. En los pacientes fumadores un parámetro que se emplea habitualmente es el IT que mide la cantidad de tabaco consumido en paquetes/año y que tiene en cuenta los años que lleva fumando el paciente. Por ello, en los pacientes con AR estudiamos la relación entre el IT y la presencia de los distintos anticuerpos. Se obtuvo que un IT alto (>20 paquetes/año) estuvo asociado con la presencia de anti-PCC y de FR (tablas 2 y 3). Sin embargo, para un IT bajo, con un consumo comprendido entre 1 y 20 paquetes/año, no se obtuvo una asociación significativa con la presencia de los anticuerpos.
Aunque la etiología de la AR no se conoce en su totalidad, los hallazgos de los últimos años indican que el HT actúa como un desencadenante ambiental para la AR induciendo una inmunidad contra residuos de citrulina en sujetos portadores de los alelos del EC. Como describieron Klareskog et al.8; el EC y el tabaquismo no influyen por separado en la producción de autoanticuerpos sino que interaccionan entre ellos y dicha interacción confiere un riesgo de desarrollar AR pero restringida solo a lo que se conoce como enfermedad seropositiva, es decir, al subgrupo de pacientes con AR positiva para el FR y/o los anti-PCC pero no para la AR seronegativa a dichos autoanticuerpos. El modelo multivariante obtenido en el presente estudio mediante regresión logística ordenada (tabla 4) recalca la importancia que tiene el aumento de la dosis génica y la intensidad del consumo de tabaco sobre la presencia de anti-PCC en los pacientes, apoyando hipótesis previas. Es interesante señalar que, junto a estos factores, otros variables independientes que influyen son la etnia del paciente y la presencia de FR positivo. Por el contrario, en los pacientes con AR seronegativa no se ha descrito una asociación significativa entre el tabaquismo y el EC sobre la presencia de anti-PCC3,8,14–16.
Un hallazgo interesante del estudio fue que la intensidad del consumo de tabaco cuantificada por el IT estuvo más fuertemente asociada que el HT con un riesgo incrementado de anti-PCC positivos (tabla 2). De hecho, el modelo de regresión multivariante obtenido confirmó este hallazgo incluyendo dentro de los factores independientes asociados a la presencia de anti-PCC positivos al IT pero no al HT (tabla 4). En los pacientes con EC positivo y un IT alto se observó un mayor porcentaje de pacientes con anti-PCC positivos (95%) en comparación con el resto de los grupos (fig. 1C). No obstante, el alto porcentaje de pacientes con los anti-PCC positivos que se observa en el grupo de pacientes con EC negativo e IT alto (fig. 1D) se debe al efecto individual que ejerce un alto consumo acumulado de tabaco. Aunque muchos de los estudios realizados solo evalúan la interacción entre el EC y el HT encontrándose una interacción significativa entre ambos factores, el número de estudios que tienen en cuenta tanto el HT como el IT es menor. En uno de ellos, Karlson et al.1 encontraron una fuerte interacción genético-ambiental entre el EC y el tabaquismo cuando se estratifico según el IT más que al estratificar según el HT para el desarrollo de AR seropositiva. Recientemente, en un estudio realizado en varias cohortes de pacientes con AR se ha encontrado que el tabaquismo no está asociado solo a la presencia de anti-PCC sino a la presencia concurrente de varios autoanticuerpos en AR17.
Los anti-PCC tienen un rol fundamental en la patogénesis de la AR8,18,19. En una primera fase de este proceso tiene lugar una inducción de anti-PCC por generación de neoepítopos citrulinados ya sea por un evento inflamatorio local o por acción de agentes ambientales. Estas proteínas y péptidos citrulinados constituirían el sustrato para la activación de una respuesta inmune local con producción de anti-PCC. Esta primera fase puede tener lugar varios años antes del desarrollo de la AR. Posteriormente, en una segunda fase y ante la presencia de un proceso inflamatorio articular se produciría la citrulinización de péptidos y proteínas en las articulaciones inflamadas que serían reconocidos por los anti-PCC generados previamente dando lugar a una respuesta inmune con liberación de mediadores de inflamación como interleucinas y TNF-alfa. No obstante, la respuesta inmune articular entraría en un círculo vicioso donde la inflamación produciría más antígenos para ser procesados con una posible perpetuación de la respuesta como resultado18,19. Para el diagnóstico de la AR, los anti-PCC son anticuerpos que presentan una excelente especificidad (90-100%) con una muy buena sensibilidad (41-88%)20. Además, los anti-PCC pueden preceder a la aparición de la AR durante varios años, antes del comienzo de los primeros síntomas de la enfermedad21. Aunque varias enfermedades pueden ser confundidas con la AR en sus etapas iniciales, sobre todo en aquellos casos donde el FR no es discriminante, la determinación de los anti-PCC es útil en esos pacientes. No obstante, los anti-PCC pueden ser positivos en una pequeña proporción de pacientes con artritis psoriásica que presentan artritis erosiva22,23.
Dentro de las limitaciones de este estudio observacional encontramos que el número de pacientes estudiado es reducido al ser realizado en un único centro hospitalario. Consecuencia de ello sería la falta de significación observada entre la presencia de los anti-PCC positivos con la dosis génica (tabla 2, significación marginal para EC homocigoto). Además, uno de los factores ambientales que ha tomado relevancia en los últimos años y que parece presentar un rol importante en la etiología de la AR es la periodontitis producida por la infección por la bacteria P. gingivalis24. Podemos considerar una limitación el hecho de que este dato no estaba recopilado en todos los pacientes con AR incluidos en nuestro estudio, siendo imposible evaluar dicha variable. Otra limitación que tenemos en nuestros resultados es que no hemos incluido en el estudio otros genes relacionados con la enfermedad y que no se determinan en nuestro hospital en la práctica clínica diaria.
En conclusión, la etnia mestizo latinoamericano, el EC positivo, el FR positivo y un IT superior a 20 paquetes/años que caracteriza a grandes fumadores son factores de riesgo independientes para el desarrollo de AR con anti-PCC positivos a títulos elevados (>200U/mL). En los pacientes portadores de EC, la intensidad del consumo de tabaco se asocia más fuertemente que el HT con un riesgo incrementado de anti-PCC positivos observándose una interacción entre ambos factores.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónNo se ha recibido financiación para la realización de este estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.