Emitir recomendaciones sobre aspectos prácticos de la monitorización de los niveles de fármacos biológicos que puedan ser de utilidad para reumatólogos.
MétodosSe realizó una revisión sistemática de la literatura de estudios en los que se determinaron niveles de fármaco y de anticuerpos antifármaco en pacientes con artritis reumatoide o espondiloartritis para estudiar si podían predecir diferentes desenlaces. Con los resultados de la revisión un grupo de expertos discutió bajo qué circunstancias podría ser útil la solicitud de niveles de fármacos biológicos y sus anticuerpos, lo que se concretó en una serie de preguntas clínicas que fueron respondidas con la evidencia científica disponible y creándose algoritmos para facilitar la toma de decisiones.
ResultadosSe establece que la determinación de los niveles de fármaco puede ser especialmente útil en 2 situaciones clínicas, cuando hay fallo al tratamiento (primario o secundario) y en remisión mantenida. Se revisa también qué técnica de laboratorio y momento para tomar la muestra son los más adecuados para la medición, y se establecen recomendaciones sobre la interpretación de los niveles de fármaco y sobre factores a tener en cuenta (por ejemplo, índice de masa corporal y fármacos modificadores de la enfermedad).
ConclusionesSe han elaborado algoritmos y establecido posibles pautas y directrices para solicitar niveles de fármaco y de anticuerpos antifármaco en pacientes con artritis reumatoide y espondiloartritis, basados en la evidencia, que pueden ayudar a la toma de decisiones clínicas.
Issue recommendations on practical aspects of the monitoring of levels of biological drugs that may be useful for rheumatologists.
MethodsWe conducted a systematic review of studies in which drug and anti-drug antibody levels were determined in patients with rheumatoid arthritis (RA) or spondyloarthritis (SpA) to study whether they could predict different outcomes. In light of the results of the review, a group of experts discussed under what circumstances testing biological drug levels and their antibodies could be useful. The discussion resulted in a series of clinical questions that were answered with the scientific evidence collected, and in algorithms that facilitate decision making.
ResultsIt was established that the determination of drug levels can be especially useful in two clinical situations, on treatment failure (primary or secondary) and on sustained remission. It is also reviewed which laboratory technique and timing for sample drawing are the most suitable for the measurement. Recommendations are issued on the interpretation of drug levels and on factors to be taken into account (for example, body mass index and disease modifying drugs).
ConclusionsEvidence-based algorithms and guidelines have been established to test drug levels and anti-drug antibodies in patients with RA and SpA, which can help clinical decision making.
Los fármacos biológicos son macromoléculas proteicas con un gran peso molecular y propiedades farmacocinéticas y farmacodinámicas complejas. Estas dependen de varios factores como la carga neta, la unión al receptor Fc neonatal, el receptor Fcgamma, la glucosilación, PEGilación o agregación1. Aunque los principios de la farmacocinética son consistentes, los mecanismos que determinan los procesos de absorción, distribución, metabolismo y excreción de los fármacos biológicos son muy diferentes de los fármacos de molécula pequeña y necesitan para estudiarse ensayos bioanalíticos complejos1.
Son muchos los factores que influyen en la farmacocinética de los anti-TNF, alterando la eliminación de los anticuerpos monoclonales y, por lo tanto, la vida media: albúmina sérica, peso molecular, comorbilidades, la propia actividad de la enfermedad de base o la administración concomitante de inmunosupresores (por ejemplo, metotrexato), así como la formación de anticuerpos anti-fármaco (AcAF)2. A la inmunogenicidad de los anti-TNF contribuyen múltiples factores3; algunos dependientes del propio fármaco: la secuencia de la proteína, la estructura tridimensional o las modificaciones postraduccionales. Otros dependen del proceso de fabricación, que puede afectar tanto a la agregación como a las modificaciones postraduccionales. La vía de administración, las características del paciente y el uso de medicación concomitante4 desempeñarían un papel en la inmunogenicidad. Es por ello que desde que se introdujeron las terapias biológicas, especialmente los anti-TNF, se ha observado una gran variabilidad interindividual en los niveles de fármaco y de AcAF5.
El objetivo debe ser alcanzar y mantener un nivel en rango terapéutico del fármaco, con objeto de lograr la remisión clínica o una baja actividad de la enfermedad. Son diversas las técnicas utilizadas para la medición de los niveles de fármacos biológicos y AcAF4 (tabla 1).
Tipo de análisis
| Tipos de análisis | Fundamento | Ventajas | Inconvenientes | Uso principal |
|---|---|---|---|---|
| ELISA captura | Análisis en fase sólida: placa recubierta con fármaco capturado o con fragmentos Fab de un monoclonal antifármaco | CómodoRápidoBaratoBuena sensibilidad y especificidad | Posible interferencia de FR (no cuando se emplean fragmentos Fab) | Detección de niveles de fármaco |
| ELISA «puente» | Análisis en fase sólida: placa recubierta con fármaco | CómodoBaratoRápidoAlta sensibilidad y especificidad | Falsos negativos para AcAF por interferencia del fármacoFalsos positivos para AcAF por FRNo detecta AcAF IgG4 | Detección de niveles de AcAF |
| RIA | Análisis en fase líquida con fármaco o TNFα marcados con 131I | Más sensible que ELISA para nivel de fármaco y detección de AcAFMenor interferencia del fármaco en la detección de AcAF | Necesidad de instalación radioactiva | Detección de niveles de fármacoDetección de AcAF |
| High mobility shift assay (HMSA) | Cromatografía de alta resolución en fase líquida | Muy sensibleNo interferencia del fármaco en la detección de AcAF | Muy caroLento | Detección de niveles de fármacoDetección de AcAF |
| Funcionales | Análisis bioluminiscente con células que responden a TNF-α transfectadas con el gen de luciferasa | Detecta fármaco biológicamente activo in vivo y AcAF relevantes funcionalmente | Necesidad de manejar clones de células vivas almacenadas a –70°C | Detección de fármaco activoDetección de AcAF relevantes |
| Electroquimioluminiscencia | Utiliza un electrodo recubierto de TNF para capturar el TNF α y un anticuerpo anti-PEG como reactivo de detección | Más sensible y específico que ELISA para medir niveles de fármaco y AcAF. Menor interferencia con el fármaco | Poco accesible, se está usando actualmente, sobre todo, en ensayos clínicos | Detección de niveles de fármaco y AcAF |
AcAF: anticuerpo antifármaco; ELISA: enzimoinmunoanálisis; Fab: fragmento de la molécula del anticuerpo monoclonal que se une al antígeno; FR: factor reumatoide; RIA: radioinmunoanálisis; TNF-α: tumor necrosis factor α.
Aunque en la práctica clínica, en gastroenterología existe una disposición clara al uso de niveles de fármacos, en reumatología no es una práctica extendida ya que, además, en muchos centros su determinación no está disponible. Muchos reumatólogos se preguntan si es realmente útil la monitorización de los niveles séricos de fármacos biológicos, a quién hay que monitorizar, cuándo, cada cuánto tiempo, con qué técnica, cuál es el nivel sérico óptimo del fármaco y si es una determinación coste-efectiva. Una revisión sistemática reciente6 analizó los distintos niveles de AcAF que se han encontrado frente a los distintos agentes biológicos utilizados en enfermedades reumáticas e intestinales inflamatorias (tabla 2). La prevalencia encontrada oscila mucho entre estudios, si bien puede extrapolarse que las más altas aparecen en los estudios de infliximab o su biosimilar.
Frecuencia de formación de anticuerpos antifármaco de los fármacos con autorización para artritis reumatoide y espondiloartritis
| Prevalencia de anticuerpos anti-fármaco | |||
|---|---|---|---|
| Rango de % (número de estudios) | |||
| Biológico | Artritis reumatoide | Espondiloartritis | Rango |
| Abatacepta | 2-20 (7) | 2-20 (9) | |
| Adalimumaba,b | 0-51 (33) | 8-39 (9) | 0-54 (56) |
| Certolizumab-Pegola,b | 2,8-37 (7) | 3-37 (7) | |
| Etanercepta,b | 0-13 (25) | 0 (4) | 0-13 (34) |
| Golimumaba,b | 2-10 (11) | 0-6,4 (2) | 0-10 (14) |
| Infliximaba,b | 8-62 (48) | 6,1-69 (10) | 6-62 (63) |
| Rituximaba | 0-21 (8) | 0-21 (8) | |
| Secukinumabc | 0-0,3 (3) | 0-0,5 (6) | |
| Tocilizumaba | 0-16 (14) | 0-16 (17) | |
| CT-P13a,b,d | 26-52 (2) | 27 (1) | 21-52 (3) |
Por todo ello, nos planteamos el objetivo de emitir consejos prácticos, basados en la mejor evidencia disponible, sobre aspectos prácticos de la monitorización de los niveles de fármacos biológicos que puedan ser de utilidad en el campo de la reumatología. Estas indicaciones se refieren a los niveles de fármacos en los que en la actualidad se realiza la medición de los niveles de fármaco y de anticuerpos (inhibidores del TNF —anti-TNF o TNFi— y tocilizumab), tanto en su pauta estandarizada como optimizada, y que afectan a pacientes con artritis reumatoide (AR) y espondiloartritis (EspA), incluida la psoriásica.
MétodosUn grupo de expertos, con posiciones diferentes a priori sobre la utilidad de la medición de niveles, concretó el contenido del documento mediante un listado de preguntas clínicas para ser respondidas basándose en la evidencia científica. Con este «mapa de preguntas» se elaboró el esqueleto del contenido con las preguntas clínicas útiles, que debían ser respondidas mediante los artículos seleccionados por la revisión sistemática.
El panel de expertos definió como «útil» aquella intervención que modificara o ayudara a la toma de una decisión coste-efectiva.
Búsqueda sistemática de la literaturaSe cribaron las siguientes bases de datos bibliográficas: Medline, Embase y Cochrane Library desde su inicio hasta noviembre de 2016, utilizando estrategias que permitieran identificar estudios que respondieran a las siguientes preguntas PICO:
- a)
Si en pacientes con AR y EspA en tratamiento con terapia biológica y en remisión mantenida (P) los niveles de fármaco (I) sirven como predictores de recaída (O).
- b)
Si en pacientes con AR y EspA en tratamiento con terapia biológica y fallo primario o secundario (P) la información sobre los niveles de fármaco (I) modifica la actitud terapéutica según niveles de fármaco: cambio de fármaco o de diana, o intensificación de dosis (O).
- c)
Si en pacientes con AR y EspA en tratamiento con terapia biológica en combinación o no con metotrexato (MTX) (P) los niveles de fármaco biológico (I) se asocian a la respuesta (O).
Para todas las preguntas se incluyeron cualquier tipo de diseño, experimental u observacional, siempre y cuando el estudio incluyese al menos 10 pacientes, y se excluyeron estudios en animales y de ciencia básica.
Tras la búsqueda sistemática se realizó una selección por pares (MML y LC) y se recuperaron los artículos relacionados. Posteriormente, se realizó una búsqueda manual secundaria de la bibliografía de los artículos que finalmente se incluyeron.
Discusión de aspectos prácticos en función de la evidenciaEn una reunión del panel con las revisoras se analizaron los resultados de las revisiones sistemáticas y se discutió la respuesta a cada pregunta, buscándose el consenso entre todos los expertos, para su redacción, y anotándose el nivel de evidencia que apoyaba la recomendación resultante. Durante la reunión y posterior interacción por correo electrónico se incluyó la opinión de los expertos en aspectos prácticos para los que no se encontró evidencia científica que la apoyara. No se consultó a más expertos ni usuarios.
Con la evidencia y la opinión se elaboraron una serie de consejos prácticos a modo de vías de decisión clínica, sobre la utilidad de la determinación de los niveles de fármaco y de los AcAF y sobre su interpretación. Todas las indicaciones se redactaron bajo el consenso de los expertos.
Para cada sugerencia las revisoras redactaron el resumen de la evidencia y recabaron la opinión de los panelistas, que estuviera en consonancia con la evidencia, y los panelistas añadieron el aspecto práctico que pudiera derivarse de ella. La discusión fue abierta y cada apartado se redactó por consenso hasta que todos los panelistas refirieron estar cómodos con la redacción.
ResultadosLas revisiones sistemáticas que suponen la primera parte de este trabajo han sido publicadas7. A continuación se presentan los resultados de la discusión y consejos prácticos, con el resumen de la evidencia de apoyo resultante de la revisión sistemática de la literatura.
¿En qué situaciones clínicas es útil la medición de niveles de fármaco?La medición de niveles de fármaco puede considerarse de utilidad en la toma de decisiones ante fallo primario o secundario a biológico; en pacientes en remisión, antes de optimizar o retirar el biológico, y parece poco útil en la suspensión temporal o de forma basal o rutinaria.
Mulleman et al. mostraron en 24 pacientes que la medición de los niveles de infliximab puede modificar la decisión de los médicos en el 50% de los casos y mejorar el control de la actividad de la enfermedad8. Méric et al., usando el mismo algoritmo que Mulleman, observaron una relación inversa entre las concentraciones séricas de infliximab y BASDAI en EspA9. Garcês et al. estudiaron 105 pacientes con AR y fallo a tratamiento a los que aleatorizaron a seguir con la estrategia estándar, o un algoritmo que incluía el nivel sérico del fármaco10. El grupo que siguió el algoritmo terapéutico basado en niveles de fármaco y AcAF cada 3 meses tenía más probabilidades de responder (OR=7,91, p<0,001, IC del 95%: 3,27-19,13) y alcanzar la baja actividad de la enfermedad (OR=9,77, p<0,001, IC del 95%: 4,69-20,37) que los que no se siguieron por algoritmo.
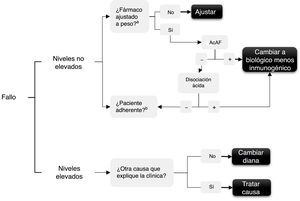
Ante un fallo de tratamiento la determinación de niveles permite entender la posible causa y tomar una decisión al respecto. Varios autores han realizado distintas interpretaciones para su uso10–13, que se resumen en el algoritmo de la figura 1. En síntesis, si los niveles de fármaco son indetectables o en rango infraterapéutico esto puede ser por: 1) inmunogenicidad, que habría que comprobar con la determinación de niveles de anticuerpos antifármaco —y valorar en este caso usar la técnica de disociación ácida si hay AcAF negativos, ya que demostrará AcAF si estaban presentes pero unidos al fármaco14— o 2) por falta de adherencia al tratamiento, tanto del biológico como del posible tratamiento concomitante con fármacos modificadores de la enfermedad sintéticos (FAMEs), cuya causa habría que revisar con el paciente.
Por el contrario, si los niveles de fármaco son elevados o en rango terapéutico, y aun así el fármaco no es eficaz, pueden estar ocurriendo 2 situaciones: 1) que realmente la diana no es la adecuada, con lo que debemos cambiar a otro fármaco con otro mecanismo y no incidir en la misma familia (fallo primario); o 2) que la causa de la sintomatología actual puede no tener relación con la actividad inflamatoria de la enfermedad para la que se indicó el biológico y deberse a otras causas (por ejemplo, el dolor producido por una estenosis de canal en un paciente para el que el anti-TNF se indicó por la EspA).
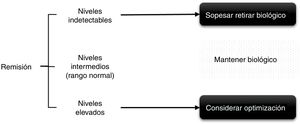
En el caso de pacientes en remisión duradera (definida como remisión durante al menos 6 meses a un año) o baja actividad, los niveles de fármaco se podrían utilizar para la toma de decisiones, tanto a la hora de espaciar o disminuir la dosis (fig. 2), aunque esto se sustentaba hasta hace poco en un estudio de adalimumab en el que se comprobaba que predicen el mantenimiento de la respuesta11. Más recientemente, en un ensayo clínico, se ha podido ver que los pacientes con niveles de adalimumab>8μg/ml pueden mantener respuesta tras la reducción sin rebrote de actividad15.
No hay datos que sustenten la monitorización rutinaria en todos los pacientes en seguimiento, tratados con un fármaco biológico, excepto si se aprecia pérdida de eficacia clínica o aparece una reacción infusional.
¿Cuál es la utilidad de la determinación de los niveles de fármaco, al poco tiempo de iniciar el tratamiento biológico?La realización de los niveles de fármaco en pacientes que lleven poco tiempo en tratamiento (por ejemplo, con la segunda dosis de los fármacos intravenosos y al mes16 con subcutáneos, o a los 6 meses de iniciar tratamiento, una vez que ya se haya evaluado que no hay fallo primario), pueden tener cierta utilidad predictora en la toma de decisiones en pacientes con factores de mal pronóstico y que precisen intervenciones más rápidas. Sin embargo, no hay evidencia todavía suficiente en este tipo de pacientes para poder hacer unas recomendaciones generales.
Si se alcanzan niveles de fármaco elevados o en rango supraterapéutico en los primeros meses, los pacientes tienen mayor probabilidad de respuesta y de alcanzar la remisión. Por el contrario, los pacientes que no alcanzan un nivel en rango terapéutico en los primeros meses de tratamiento tienen menor probabilidad de alcanzar la remisión. En estos casos, se debe vigilar especialmente la adherencia al tratamiento.
¿Qué factores se deben tener en cuenta a la hora de interpretar los niveles de fármaco?La interpretación de los niveles de fármaco dependerá de múltiples factores. Además de considerar la actividad de la enfermedad de base, para evaluar el rango terapéutico de los niveles de fármaco se deben tener en cuenta otros factores, como la evaluación de la adherencia al mismo (niveles bajos de fármaco «obligan» a investigar sobre el cumplimiento de la pauta prescrita y su adherencia), el uso de fármacos concomitantes y también su adherencia y dosis adecuada, la conveniencia de un ajuste de dosis o la necesidad de un cambio en la diana terapéutica.
Índice de masa corporalLa obesidad puede afectar la farmacocinética de fármacos como los anti-TNF, ya que las adipoquinas del tejido adiposo pueden aumentar el nivel de citocinas proinflamatorias. Se ha descrito en trabajos con etanercept17, adalimumab18 y certolizumab19 la relación inversa entre niveles de fármaco y el índice de masa corporal (IMC). Los obesos alcanzan menores niveles de fármaco, pudiendo afectar a la eficacia del tratamiento sin un incremento en la inmunogenicidad18. Sin embargo, en el trabajo de Sigaux et al.20, no se encontró relación entre los niveles de tocilizumab y el IMC. Por lo tanto, parece necesario individualizar según el fármaco, el IMC del paciente e incluso la situación clínica en ese momento.
Fármacos modificadores de la enfermedad sintéticosEl uso de FAMEs minimiza la aparición de AcAF21,22, si bien los datos sobre la relación entre el uso de FAMEs y los niveles de fármacos depende más del fármaco biológico y de la enfermedad de base. Por ejemplo, en EspA, el infliximab se usa a dosis más altas que en AR, y no se suele combinar a MTX. En cambio, en pacientes con AR tratados con infliximab y, especialmente con adalimumab, el tratamiento con MTX disminuye la inmunogenicidad y aumenta la supervivencia del fármaco, existiendo incluso una relación inversa entre la dosis de MTX y los niveles de AcAF en pacientes tratados con adalimumab23. Aunque hay más controversia en EspA, los estudios publicados apuntan a una mayor supervivencia del fármaco y menor inmunogenicidad entre los pacientes con tratamiento concomitante con FAMEs. En el caso del tocilizumab los niveles de fármaco no se ven influenciados por el uso concomitante de MTX20.
¿Cuál es la técnica recomendada para su determinación?La mayoría de los trabajos sobre el tema utilizan la técnica ELISA captura para estudiar los niveles de fármaco y ELISA «puente» para los autoanticuerpos. El ELISA «puente» es una técnica barata, de acceso en cualquier centro hospitalario y con la que es fácil automatizar la medición; por el contrario, es menos sensible, no detecta anticuerpos IgG4, que están unidos al fármaco. Por otro lado, la técnica RIA (radioinmunoensayo) es más específica, presenta menos interferencias por artefactos inducidos, pudiendo detectar IgG1, IgG2 y especialmente IgG4 unidos al fármaco. Sin embargo, se trata de una técnica más compleja, más cara y al manejar isótopos sería preciso un servicio de medicina nuclear. La concordancia entre ambas técnicas es mayor cuando los niveles de AcAF son altos24.
La estandarización de las técnicas actuales para la determinación de los niveles de fármaco biológico es una de las cuestiones que no están totalmente resueltas. En nuestro país normalmente los kits utilizan método de ELISA (kit español de Grifols). En este campo se han realizado varios estudios interlaboratorio (con la misma muestra) y de comparación con otros kits/técnicas con excelente correlación25–28.
¿Cuál es el mejor momento para tomar la muestra?La mayoría de los trabajos miden los niveles en valle, que correspondería a las concentraciones mínimas, esto es, las recogidas el día de la administración de la dosis de tratamiento, previo a su administración, ya que se suelen correlacionar estos niveles con la respuesta clínica4. Los niveles de autoanticuerpos también se miden en el momento valle, cuando los niveles plasmáticos del fármaco son mínimos (evitando de esta manera posibles interferencias), con lo que se tendrá en cuenta la vida media de los fármacos a estudio (tabla 3).
Vida media de los fármacos en los que se realiza medición de niveles de fármacos y anticuerpos
| Fármaco | Estructura | Tiempo de vida media (días) |
|---|---|---|
| Adalimumab | Anticuerpo monoclonal humano IgG1 | 10-14 |
| Golimumab | Anticuerpo monoclonal humano IgG1 | 12 |
| Certolizumab pegol | Fracción Fab de anticuerpo monoclonal humanizado IgG1 conjugado con polietilenglicol | 14 |
| Infliximab | Anticuerpo monoclonal quimérico (humano-murino) IgG1 | 9-11,5 |
| Etanercept | Proteína de fusión humana: fracción FC de IgG1 y receptor soluble p75 del TNF | 3-4,8 |
| Tocilizumab | Anticuerpo monoclonal IgG1 recombinante humanizado antirreceptor de interleucina-6 | 11-21 |
Fab: fragmento de unión al antígeno; FC: fragmento cristalizable; IgG1: inmunoglobulina G1; TNF: factor de necrosis tumoral.
Este es un aspecto relevante, y sobre el que existe mucha confusión en la literatura publicada, debido especialmente a la población utilizada en los estudios, el tipo de respuesta terapéutica estudiada, las técnicas de medición y a las distintas unidades de medidas utilizadas. De hecho, no se está seguro de que los rangos en una enfermedad activa sean los mismos que en remisión.
Estudios en adalimumab, donde se determinaba el nivel terapéutico, y en los que realizaron el análisis mediante curva ROC23, se habla de niveles de 5μg/ml (equivalente a 5mg/l)13 o incluso más bajos25,29. Kneepkens et al.17 no encontraron una dosis óptima en 162 pacientes con EspA en tratamiento con etanercept. Un trabajo recientemente publicado indicó en pacientes con EspA axial que los niveles de golimumab en suero de 0,7 a 1,4mg/l eran adecuados para controlar la actividad de la enfermedad, y que aumentos en la dosis de fármaco circulante no daba como resultado mayor beneficio30. En el caso del infliximab el análisis de 66 pacientes con AR que iniciaron tratamiento con infliximab proponen una dosis de 4,4μg/ml en la semana 616. Por último, Jani et al. describieron en 115 pacientes con AR tratados con certolizumab tendencia en pacientes con niveles más altos de certolizumab (>23-24μg/ml) de mejoría del DAS28 respecto al basal19. En un modelo de farmacocinética y farmacodinamia poblacional con tocilizumab se establecieron unos niveles terapéuticos de 3,7μg/ml, aunque con gran variabilidad individual. No obstante, solo la presencia de niveles detectables (>1μg/ml) es suficiente para suprimir la respuesta de fase aguda (PCR)31.
¿Cuándo se debe realizar la medición de anticuerpos anti-fármaco?La medición de los AcAF se considera que solo tiene relevancia clínica en los siguientes supuestos:
- a)
Cuando los niveles de fármaco son bajos o indetectables. Los niveles indetectables de fármaco pueden relacionarse con la aparición de AcAF neutralizantes, que bloqueen la acción del fármaco. Si hay nivel de fármaco detectable, con la técnica ELISA no se detectará AcAF, pues estará unido al fármaco. En pacientes con niveles de adalimumab<2mg/l un estudio muestra que la disociación ácida puede separar esta unión haciendo el AcAF detectable en cerca del 50% de los casos14, aunque en la práctica no se suele utilizar con niveles detectables. En los pacientes con AcAF estos se pueden detectar incluso meses más tarde de haber retirado el fármaco.
- b)
Fallo terapéutico. La evaluación de los AcAF permite ayudar a seleccionar la opción terapéutica potencialmente más eficaz (cambio de anti-TNF u otra diana terapéutica o evaluar adherencia) (fig. 1). Solo un tercio de los fracasos secundarios en pacientes tratados con anti-TNF monoclonal son por formación de AcAF4,32.
- c)
Reacciones infusionales. Ante una reacción infusional se debe evitar el mismo anti-TNF, pero en aquellos pacientes que hayan presentado reacciones leves o hayan interrumpido el tratamiento la detección de AcAF puede ser útil para valorar la posibilidad de reintroducir el mismo fármaco. La mayor parte de las reacciones infusionales no son debidas a AcAF, sino a la velocidad de infusión4,33.
La llegada de los fármacos biológicos, además de suponer un cambio radical en el manejo de las enfermedades inmunomediadas, ha supuesto también un gran aumento del gasto farmacéutico. Teniendo en cuenta el gran impacto que estos tratamientos han tenido en el presupuesto de farmacia, el mejorar la coste-efectividad debe ser un objetivo prioritario34.
Hay diversas publicaciones, tanto en el ámbito de la reumatología como en el de la gastroenterología, sobre enfermedades inflamatorias crónicas en tratamiento con terapia biológica, que respaldan la asociación entre la respuesta clínica y los niveles séricos de fármaco biológico25,35,36. Sin embargo, no parece adecuado el uso sistemático de la medición de los niveles, las decisiones terapéuticas deben basarse fundamentalmente en la clínica y, en todo caso, la determinación de los niveles de fármaco y AcAF sí puede ser de utilidad en determinadas situaciones clínicas mencionadas: fallo secundario, sobre todo; pacientes en remisión mantenida, candidatos a optimización o suspensión de terapia; valoración de adherencia y ante reacciones infusionales, aunque la decisión terapéutica siempre se tomará en combinación con los datos clínicos.
Este trabajo pretende elaborar, tras haber realizado una revisión de la literatura, unos algoritmos preliminares de posibles pautas para solicitar y evaluar los posibles escenarios en los que puede ser útil la determinación de los niveles, y facilitar así su implantación como una herramienta en la práctica clínica. Se sugiere extraer los niveles de fármaco en valle, y estos se suelen clasificar en bajos, medios o altos según un rango terapéutico definido en cada estudio para el agente biológico empleado y según la situación clínica del paciente (remisión o actividad tras fallo terapéutico). El principal inconveniente que encontramos es que no se dispone de rangos terapéuticos de niveles de fármaco validados universalmente para cada uno de los agentes biológicos y para cada situación clínica, así como también existe todavía falta de estandarización en cuanto a qué técnicas usar para la medición de niveles. En España la técnica que más se recomienda emplear es ELISA, y en pacientes con niveles de fármaco bajos o infraterapéuticos y ausencia de AcAF realizar además disociación ácida14,37.
Se sugiere, por tanto, plantear optimización del fármaco biológico en pacientes con actividad de la enfermedad controlada y niveles de fármaco altos15,38–41, mantener el tratamiento igual si los niveles son intermedios y valorar discontinuación de la terapia si los niveles de fármaco son bajos o indetectables. En pacientes con fracaso terapéutico, si los niveles de fármaco son altos, se habrá de cambiar a otro fármaco con distinto mecanismo de acción y/o valorar otras causas responsables de la sintomatología distintas a la actividad de la enfermedad. Y, por el contrario, si los niveles son bajos habrá de comprobarse la presencia de AcAF y/o la adherencia al biológico y al FAMEs concomitante si lo hubiese. En los casos en los que el paciente pudiera presentar fallo terapéutico con niveles de fármaco y AcAF indetectables se aconseja comprobar la adherencia, ya que el ajuste de dosis del fármaco biológico según el peso del paciente (si el fármaco lo permite), no está avalado por la literatura en reumatología. De este modo, en el estudio PREMIER42 no se conseguían mejores resultados reduciendo el intervalo de adalimumab en pacientes con AR y en el estudio Loadet43, por ejemplo, no se encontraba ningún beneficio clínico con más dosis de etanercept en pacientes con EspA axial, por lo que no se recomienda en la práctica habitual, además, por el aumento de costes y de efectos secundarios que puede suponer44.
Se han descrito también algunos factores a tener en cuenta que pueden influir en los niveles de fármaco, la relación inversa que existe con el IMC (excepto en un estudio con tocilizumab20 y la asociación del uso de FAME concomitante (el más usado MTX) con mayores niveles de fármaco y menos inmunogenicidad, aunque en EspA hay más controversia45,46, y en el caso del tocilizumab no hay diferencias entre asociar o no FAMEs concomitante20. La mayoría de los algoritmos publicados señalan la optimización de dosis en pacientes con niveles séricos elevados del fármaco, puesto que al reducir la dosis es muy probable que se llegue a un nivel dentro de la normalidad o intermedio. En niveles intermedios o de rango normal es los que el paciente debería mantenerse para obtener el máximo beneficio, y en esta situación no parece razonable la reducción de dosis, al menos con la misma intensidad que suele realizarse en pacientes en remisión, pues si pensamos en la farmacocinética de estos fármacos sería muy probable que el paciente entrara en niveles infraterapéuticos y poder perder eficacia clínica. Estas pautas, pueden ser también de interés en aquellos pacientes en los que ya se ha iniciado una pauta de optimización, para explorar si se puede continuar el ajuste de dosis, siempre en función de la situación clínica del paciente.
En los últimos años han aparecido fármacos biosimilares de los anti-TNF. Para su autorización estos fármacos han tenido que realizar ensayos clínicos en los que los datos de immunogenidad debían ser similares a los productos originales. Así, la inmunogenicidad de cada uno de los biosimilares, tanto de infliximab47,48 como de adalimumab49,50, aprobados fue similar a la del fármaco «original». Con el etanercept, como es menos inmunogénico que los anticuerpos monoclonales anti-TNF, se obtuvo también una prevalencia más baja y se detectó una prevalencia mucho más baja de AcAF, tal y como pasa con el etanercept no biosimilar51–53. De este modo, los comentarios realizados sirven para los fármacos biológicos, tanto para los originales como para los biosimilares.
Por lo tanto, la monitorización de los niveles de fármaco y AcAF es un tema a debate todavía; para que se pueda realizar de forma generalizada en la práctica clínica serían necesarios, en primer lugar, más estudios y mayor evidencia que permitiese definir de forma universal los rangos terapéuticos de los niveles de fármaco. Basándonos en ellos se podrían tomar decisiones terapéuticas individualizadas por paciente en aquellas situaciones clínicas que permitiesen un mayor ahorro de costes y una disminución de los efectos secundarios asociados a la terapia biológica.
FinanciaciónEste estudio ha sido financiado por Grifols a través de la Asociación para la Investigación en Reumatología de la Marina Baixa (AIRE-MB). El contenido es responsabilidad exclusiva de los autores y no representa necesariamente los puntos de vista oficiales de Grifols.
Conflicto de interesesMML, TO, JC y LC refieren no tener conflictos de intereses respecto al tema de investigación.
JR ha participado en asesorías, conferencias o proyectos de formación/investigación financiados por Abbvie, BMS, Grifols, Lilly, MSD, Novartis, Pfizer, Roche y UCB.
AB ha participado en asesorías, conferencias o proyectos de formación/investigación financiados por Pfizer, Abbvie, UCB, Roche, Novartis, BMS, Sandoz, Celltrion y Nordic.
RS ha participado en asesorías, conferencias o proyectos de formación/investigación financiados por BMS, MSD, Pfizer, Abbvie, UCB y Roche.
JT ha recibido fondos para la formación y/o para proyectos de investigación de Gebro, Jansen, Pfizer, Roche y Sanofi.