El éxito de las terapias dirigidas a las células B en la artritis reumatoide (AR) sugiere que pueden ser eficaces en otras enfermedades autoinmunes mediadas por autoanticuerpos. Actualmente existen diferentes agentes en desarrollo dirigidos a diferentes dianas específicas de células B. Algunas tienen efectos funcionales y otras son citolíticas como anti-CD20 o anti-CD19 aunque la mejor estrategia está por definir. El mecanismo de acción de rituximab (anti-CD20) sugerido por los estudios en la AR es una reducción secundaria de las células plasmáticas de vida corta, productoras de autoanticuerpos localmente (sinovial), o sistémicamente.
Con estas premisas es esperable que estas terapias sean eficaces en el LES, donde la hiperfunción B y los autoanticuerpos desempeñan un papel importante en su patogenia. Los ensayos clínicos han confirmado los efectos sobre las células B, algunos signos tardíos de actividad sobre la síntesis de autoanticuerpos, y sobre todo la viabilidad de estas terapias en el LES. Sin embargo, no han generado aún datos suficientes que confirmen su utilidad cuando se añaden a la terapia convencional. Aunque múltiples estudios abiertos sugieren que rituximab puede ser útil en manifestaciones refractarias, son necesarios más estudios controlados para establecer mejor sus indicaciones y estrategias de utilización el el LES.
Recent success of B-cell targeted therapies in rheumatoid arthritis suggests their potential efficacy for other auntoantibody-mediated autoimmune diseases. Currently, multiple agents directed toward different B-cell specific targets are under development. Although the best strategy is yet to be defined, multiple functional inhibitors or cytolitic agents such as anti-CD20 or anti-CD19 are available. According to studies in RA, the most likely mechanism of action of rituximab (anti-CD20) consists of a secondary reduction in local (synovial) or systemic autoantibody producing short-lived plasma cells.
According to this data, it is expected that these therapies will be efficacious in SLE, were B-cell enhanced function and autoantibodies play relevant pathogenetic roles. Clinical trials confirm B-cell effects, delayed activity on autoantibody synthesis, and most importantly, the feasibility of these therapies to treat SLE. However, there are no sufficient data confirming their therapeutic value when added to convencional therapy. Although multiple open trials suggest that rituximab might be useful for refractory manifestations of SLE, more controlled trials are needed in order to establish the indications and strategies of its use in SLE.
Las terapias inmunosupresoras habitualmente utilizadas en el LES, como los esteroides o la ciclofosfamida, ejercen efectos importantes sobre las células B tales como la inhibición de la síntesis de autoanticuerpos por las células plasmáticas y de la proliferación de las células B1,2. Sin embargo, el amplio espectro de acciones de estos fármacos impide atribuir sus efectos terapéuticos a sus acciones sobre los linfocitos B (LB). La primera terapia con efectos específicos sobre los LB ensayada en el LES ha sido el anticuerpo anti-CD20 rituximab (RTX), del que no se conocen otras dianas celulares3. RTX ejerce un efecto citolítico muy potente, eliminando casi por completo los LB maduros circulantes por periodos prolongados de tiempo. Estos se recuperan posteriormente desde precursores medulares B inmaduros, CD20-negativos, denominados pro-B o pre-B, que son respetados.
La mayor experiencia con RTX en el tratamiento de enfermedades autoinmunes ha sido adquirida en la artritis reumatoide (AR). En la AR se ha obtenido una valiosa información acerca de los efectos de RTX sobre las respuestas B normales y autoinmunes. Recientemente, RTX y otras nuevas terapias específicas de células B han sido utilizadas en pacientes con LES, síndrome de Sjögren, vasculitis y otras enfermedades autoinmunes caracterizadas por la presencia de autoanticuerpos, tanto de forma no controlada como en ensayos clínicos controlados. Estos estudios no proporcionan una respuesta concluyente sobre su eficacia, ni sobre otras cuestiones muy importantes como son sus indicaciones o estrategias de utilización clínica en el LES. Sin embargo, sí proporcionan elementos importantes de referencia para comprender mejor los mecanismos de acción de RTX y mejorar el diseño de futuros ensayos que establezcan futuras pautas de aplicación clínica en la terapia del LES.
Dianas terapéuticas específicas de las células BExisten dos estrategias dirigidas a modular específicamente poblaciones celulares B o sus funciones. La primera consiste en utilizar anticuerpos completos, citolíticos, que actúan bien por activación del complemento o bien por citotoxicidad celular anticuerpo-dependiente, específicamente dirigidos a moléculas de superficie de LB como CD19 o CD20. La segunda, bloquear mediante anticuerpos o receptores solubles, la función de ligandos o receptores con funciones importantes en el desarrollo o función de los linfocitos B, entre los que los más importantes son los ligandos BLyS y APRIL y sus receptores TACI, BR3 y BCMA4. Un caso intermedio son los anticuerpos anti-CD22, de cuya interacción con la molécula de membrana CD22 podría resultar la lisis celular, pero que fundamentalmente inducen efectos funcionales antiproliferativos, reduciendo la población B madura en menor medida que las terapias citolíticas5. En la tabla 1 se resumen las principales moléculas anticélula B en diferentes fases de desarrollo clínico para la terapia del LES.
Agentes biológicos dirigidos a dianas específicas de células B en diferentes fases de desarrollo
| Anti-CD20 | |
| • Rituximab (AC quimérico) | Depleción de células B |
| • Ocrelizumab (AC humanizado) | Depleción de células B |
| • Veltuzumab (AC humanizado) | Depleción de células B |
| • Ofatumumab (AC humano) | Depleción de células B |
| • TrU015 (AC humano) | Depleción de células B |
| Anti-CD19 | |
| • MDX1342 (AC humano) | Depleción de células B |
| Anti-CD22 | |
| • Epratuzumab (AC Humanizado) | Bloqueo funcional, Depleción parcial de células B |
| Anti-BAFF (BLyS) o -APRIL | |
| • BAFF Belimumab (AC anti-BLys) | Bloqueo funcional, Depleción parcial de células B |
| • BAFF Briobacept (Br3-IgFc) | Bloqueo funcional, Depleción parcial de células B |
| • BAFF AMG623 | Bloqueo funcional, Depleción parcial de células B |
| • BAFF y APRIL Atacicept (TACI-IgFc) | Bloqueo funcional, Depleción parcial de células B |
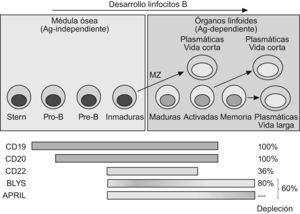
Los ligandos del sistema BLyS/APRIL pertenecen a la superfamilia del TNF y ejercen efectos activadores de señales intracelulares superponibles en parte a las activadas por TNF, pero sus receptores se expresan de forma casi exclusiva por los LB6. Sus funciones son promotoras del crecimiento y la supervivencia de las células B, pero también participan en su maduración en respuesta a antígenos T-dependientes. Debe señalarse que el bloqueo de estos ligandos, particularmente APRIL, afecta parcialmente a las células plasmáticas, al contrario que la eliminación o bloqueo de las otras dianas (CD19, CD20, CD22) presentes en LB pero no en células plasmáticas, y que por tanto no modifican directamente la producción de anticuerpos. Este aspecto se resume en la figura 1, señalándose la diferente representación o importancia funcional de estas moléculas en las diferentes poblaciones B. Una consecuencia directa es que las terapias dirigidas a unas u otras dianas reducen directa o indirectamente en diferente medida la población de LB en sangre periférica como se indica en la figura 1.
Las terapias citolíticas de más amplio espectro (CD19 o CD20) carecen de efectos sobre las células plasmáticas y sobre los precursores B medulares. De esta forma la síntesis de anticuerpos protectores se mantiene inicialmente intacta, aunque también en parte la producción de autoanticuerpos patogénicos. La capacidad de regeneración y futura respuesta también se conservan, permitiendo la posterior recuperación del repertorio B tras un periodo prolongado. Las terapias B persiguen una interferencia máxima con el desarrollo de células productoras de autoanticuerpos y mínima de las productoras de anticuerpos protectores, conservando a la vez la capacidad regenerativa del repertorio B. Este difícil equilibrio solo podría explicarse por la diferente longevidad y dependencia de precursores de las células plasmáticas autoinmunes y de las protectoras, de las que depende el balance de eficacia/seguridad de estas terapias. Los datos clínicos post-RTX sugieren que las células plasmáticas de vida larga protectoras (antitoxoide tetánico o antipolisacárido neumocócico), y las productoras de autoanticuerpos tienen una vida media diferente7. Incluso, las plasmáticas productoras de diferentes autoanticuerpos (i.e. anti-DNA, anti-ENA, FR o anti-CPA) podrían tener una variable longevidad, aunque los datos disponibles del efecto de las diferentes terapias sobre estos anticuerpos no aclaran suficientemente este punto.
Estos factores temporales también explicarían la cinética de los efectos de estas terapias, de inicio lento pero duración prolongada, y sin un paralelismo claro en ninguno de estos dos aspectos con la cinética de depleción/recuperación de LB en sangre periférica. Los datos obtenidos de pacientes con AR tratados con RTX aportan una valiosa información al respecto.
Dinámica de las células B post-RTXEl éxito de la depleción terapéutica de células CD20 con RTX en la AR ha permitido contestar numerosas preguntas sobre su seguridad y mecanismos de acción. RTX produce una desaparición completa e inmediata de las células B circulantes en la práctica totalidad de los pacientes con AR que se prolonga durante un periodo muy variable, con una media de unos 8 meses, tras el cual se produce una progresiva recuperación8. De manera similar, también se produce una depleción rápida, aunque más variable y generalmente incompleta de los LB maduros en compartimentos tisulares, como la médula ósea o el tejido sinovial reumatoide9,10. Estos efectos no tienen una buena correlación con la mejoría clínica: no todos los pacientes deplecionados responden, la respuesta clínica es bastante más tardía que la depleción B, y las recidivas clínicas pueden producirse tanto antes como después de la recuperación celular B.
Numerosos estudios han aprovechado esta discordancia para investigar qué otros parámetros se asocian a la respuesta y recidiva clínica en los diferentes tiempos, o diferenciar a los pacientes respondedores de los no respondedores. Casi todos estos estudios apuntan a que una reducción secundaria de las células plasmáticas o sus precursoras inmediatas (preplasmáticas), que se produce de una forma más variable, es la que verdaderamente correlaciona con las respuestas clínicas10–12. Estos datos son muy importantes porque subrayan la relevancia de la función B productora de autoanticuerpos sobre otras potenciales funciones de las células B en la patogenia de la inflamación. La limitada eficacia de RTX en la AR seronegativa también apoya este concepto.
Estudios secuenciales de membrana sinovial de pacientes tratados con RTX indican que el grado de reducción tardía (al 4.° mes) del infiltrado de células plasmáticas correlaciona la respuesta clínica, mientras que el grado de reducción precoz (a la 4.a semana) del infiltrado de células B no predice la respuesta clínica10. El tratamiento con RTX produce una reducción del título medio de autoanticuerpos (factor reumatoide o antipéptido citrulinado) pero esta no predice bien la respuesta clínica. La gran variabilidad individual en los títulos puede explicar esta dificultad predictiva, aunque es interesante señalar que la variación de las plasmáticas sinoviales si correlaciona con la variación en los niveles de autoanticuerpos circulantes.
Las células B tienen otras funciones importantes sobre otros elementos del sistema inmune, particularmente las relacionadas con las respuestas T (tabla 2)13. La inhibición de estas funciones tras la depleción B podría también contribuir a la mejoría clínica como apuntan algunos datos indirectos14–16. Sin embargo no existen pruebas directas de que la modificación de alguna de estas funciones explique las respuestas terapéuticas a RTX en la AR.
Funciones de las células B
|
Por último, existen numerosos datos sobre el comportamiento de las respuestas B implicadas en la defensa tras la terapia con RTX. Aunque los datos relativos a la tasa de infecciones en pacientes tratados a largo plazo apuntan a un aumento moderado, el perfil de estas infecciones es similar al observado con otras terapias y no se asocia a un déficit global en la producción de inmunoglobulinas (hipogammaglobulinemia)17. La reducción en los niveles de IgG o IgM en pacientes tratados a largo plazo es moderada y proporcionalmente menor que la reducción en los niveles de autoanticuerpos. Algunas respuestas de memoria (IgG anti-toxoide tetánico o antipolisacárido neumocócico) se mantienen inalteradas por esta terapia. Sin embargo las respuestas primarias a nuevas inmunizaciones se alteran profundamente tras la depleción de células B18. Esta mayor dependencia de precursores B para mantener las plasmáticas productoras de autoanticuerpos respecto a las productoras de anticuerpos protectores podría estar relacionada con su diferente vida media. Recientes datos en el modelo animal de artritis mediada por autoanticuerpos anti-GPI apoyan esta posibilidad, al demostrar que las células plasmáticas autoinmunes tienen una menor longevidad19. Sin embargo, la vida media de las plasmáticas productoras de los diferentes autoanticuerpos es difícil de estudiar en humanos.
Estudios en el LESLos datos disponibles sobre terapias anticélulas B en el LES proceden bien de estudios individuales en pequeñas series abiertas no controladas, o bien de ensayos clínicos controlados en fases i-iii. Paradójicamente, los datos procedentes de los numerosos estudios abiertos indican que RTX es eficaz, mientras que los ensayos no demuestran efectos clínicamente relevantes20–26. La mayor dificultad para interpretar ambos tipos de estudios es que los pacientes reciben simultáneamente terapia convencional (esteroides e inmunosupresores), por lo que atribuir los cambios clínicos y biológicos al tratamiento con RTX es arriesgado. Quizás los estudios abiertos en pacientes considerados refractarios a la terapia convencional son más informativos sobre el potencial efecto de RTX21,22. En cambio, los ensayos controlados en pacientes no refractarios, a los que se trata con terapia convencional con o sin RTX, dejan un estrecho margen de acción a RTX23,24.
Los estudios en LES demuestran que RTX produce una depleción de LB en sangre periférica similar a la observada en la AR, y que otras terapias, como anti-CD22 (epratuzumab), belimumab (anti-BLyS) o atacicept (TACI soluble) también producen una depleción secundaria aunque más variable y tardía como corresponde a su mecanismo de acción5,20,25. Respecto a sus efectos sobre la producción de anticuerpos anti-DNA los datos no son concluyentes. Los anticuerpos anti-DNA son considerados de vida corta por su rápida variación con otras terapias, y son unos excelentes biomarcadores en el LES, por su implicación en la patogenia y su buena correlación con la actividad clínica. Los estudios abiertos sugieren que RTX induce una rápida reducción en los niveles de anti-DNA, mientras que en los ensayos controlados esta es similar con la terapia convencional (esteroides e inmunospresores) con o sin RTX20–26. Únicamente, en los grupos con RTX se observó una reducción significativamente mayor en los niveles de anti-DNA de forma tardía (a los 6 o 9 meses en dos ensayos)23,24. Esta última observación es interesante porque correlaciona con mayores niveles de complemento en esos puntos respecto a los no tratados con RTX, pero en ninguno de los dos casos esto se asoció a una mejor respuesta clínica renal, global, ni con la prevención de nuevos brotes.
En pacientes con LES tratados con belimumab (anti-BLyS) o atacicept los datos no son tampoco concluyentes, en este caso por el pequeño número de pacientes y la baja proporción de pacientes con anti-DNA positivos al inicio. En el caso de belimumab asociado a terapia convencional se observó una tendencia, también tardía, a una menor actividad clínica, comparada con la terapia convencional25.
Lecciones para el futuroLos estudios con RTX y otros fármacos activos sobre células B en LES confirman su acción biológica, y proporcionan información cinética sobre dosis-respuesta, que será útil para futuros estudios. Los resultados negativos obtenidos en diferentes ensayos controlados podrían considerarse más bien no informativos que negativos. Las únicas señales de modificación clínica o biológica (anti-DNA/complemento) de la enfermedad han aparecido en fases muy tardías (>6–9) meses. Esto sugiere que el efecto es verdaderamente tardío, o bien que el diseño de los estudios impide identificar efectos mas precoces de RTX enmascarados por la terapia convencional simultánea. Lo primero es plausible de acuerdo a la población celular diana de RTX, células precursoras de plasmáticas pero no plasmáticas productoras de autoanticuerpos, de acuerdo a lo observado en la AR. Sin embargo en la AR, en la que los títulos de auto-AC parecen menos informativos que en el LES, la mejoría y descenso de niveles de autoanticuerpos suele producirse a las 12–14 semanas, coincidiendo con la depleción secundaria de células plasmáticas.
La interferencia de la terapia convencional es un claro factor de confusión, puesto que es esperable que una alta proporción de pacientes respondan a esteroide más inmunosupresor, ocultando así el potencial efecto de RTX como el de cualquier otra terapia superpuesta. En el diseño de futuros estudios deberá considerarse o bien la selección de pacientes refractarios a la terapia convencional con altos índices de actividad, o bien analizar el efecto de RTX frente a placebo21,22. Estos dos modelos han permitido obtener pruebas de eficacia de múltiples terapias en la AR, pero plantean mayores problemas clínicos y éticos en el LES.
Tampoco puede descartarse que los efectos de RTX sean verdaderamente muy tardíos, de acuerdo a recientes observaciones en el tratamiento de la trombocitopenia autoinmune refractaria a esteroides. Frente a la opinión procedente de series no controladas de la rápida eficacia de RTX en esta situación, los resultados del primer ensayo controlado, indican que RTX no produce ningún beneficio sobre las cifras de plaquetas antes del 6.° mes de tratamiento27,28.
En conjunto los datos obtenidos tanto en LES como en otras enfermedades mediadas por autoanticuerpos dan señales suficientes para alentar el desarrollo de las terapias anti-célula B para el tratamiento del LES. Los futuros estudios deberán identificar mejor el potencial nicho terapéutico de estas terapias de manera que pueda definirse su estrategia de uso en relación con las terapias convencionales.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.