Actualizar la información sobre la seguridad a largo plazo de los agentes biológicos en el tratamiento de las enfermedades reumáticas.
MétodosBIOBADASER es un registro de seguridad de terapias biológicas establecido por la Sociedad Española de Reumatología. Se presenta la descripción de BIOBADASER 2.0, una cohorte de 14 centros dentro de BIOBADASER, desde el año 2000 hasta el 2009.
ResultadosHay registrados 5.493 pacientes y han recibido 8.081 ciclos de tratamiento con terapias biológicas. Un 30% (1.666) recibió más de un agente biológico durante el seguimiento. Se han producido 3.784 interrupciones. La ineficacia o pérdida de eficacia es la causa más frecuente de interrupción (1.453; 38%), seguido de los acontecimientos adversos (1.297; 34%). Se han comunicado 7.289 acontecimientos adversos (AA), un 80% (5.764) han sido considerados como acontecimientos no graves, un 19% (1.340) como graves y un 2% (110) han sido mortales. Los AA más frecuentes son las infecciones e infestaciones (2.668; 37%), seguidos de los trastornos generales y alteraciones en el lugar de administración (10%). Los trastornos cardiovasculares y las neoplasias en conjunto, suponen un 7% del total de acontecimientos adversos.
ConclusionesNo se observan tendencias diferentes de riesgo en BIOBADASER 2.0 respecto al registro global y a años anteriores.
To update the information on long-term safety of biological therapies used for the treatment of rheumatic diseases.
MethodsBIOBADASER is a safety registry of biological therapies established by the Spanish Society of Rheumatology. A description of BIOBADASER 2.0, a cohort composed of 14 centres within BIOBADASER is reported from 2000 until 2009.
ResultsThe 14 centres have registered 5,493 patients, who have received 8,081 cycles of treatment with biological therapies. 30% (1,666) has received treatment with more than one biologic agent during follow-up. There have been 3,784 treatment discontinuations, with inefficacy or loss of efficacy being the most frequent cause (1,453; 38%), followed by adverse events (1,297; 34%). Up to 7,289 adverse events (AE) have been reported, of which 80% (5,764) were considered as non serious, nearly 19% (1,340) were notified as serious and about 2% (110) were fatal. The most frequent AE were infections (2,668; 37%), followed by general problems and administration related events (10%). Cardiovascular events and cancer amounted a 7% of the total AE.
ConclusionsThere does not seem to be a trend regarding different risks in BIOBADASER 2.0 with respect to the general registry, or to previous years.
En los últimos dos años se han introducido en el mercado varios agentes biológicos1 que se han añadido al arsenal terapéutico2 de las enfermedades reumáticas. Este nuevo escenario implica una mayor complejidad en el seguimiento de la seguridad3–5 de los fármacos, puesto que las dianas moleculares varían, con lo que se esperan distintos eventos adversos, la carga de inmunosupresión aumenta, con pacientes que han sido expuestos a muchos agentes distintos6 y por años, y cada vez hay menos números de pacientes en cada tipo de tratamiento.
Asimismo la permanencia de los registros en el tiempo, entre los que se encuentra Registro Español de Acontecimientos Adversos de Terapias Biológicas en Enfermedades Reumáticas (BIOBADASER), supone un auténtico reto7, tanto para la actualización e integración de la nueva información, como para la integridad y fiabilidad de los datos recogidos. Desde su creación, BIOBADASER contaba con la participación de más de 100 centros, sin embargo, a partir de junio de 2006 se introdujeron diversos cambios en la base de datos, todos ellos con el propósito de aumentar la calidad de la información obtenida. Se ha evolucionado pues a BIOBADASER 2.0, un registro que ahora está compuesto por 14 centros, donde se ha mejorado sobretodo la forma de recoger los datos y se ha mejorado sustancialmente la monitorización, ahora es más continuada en el tiempo y más ágil. Los criterios de selección de los 14 centros fueron: que tuvieran registrados como mínimo 100 pacientes y que el porcentaje de fallos en las monitorizaciones previas fueran inferiores al 25%. Además, para los sujetos incluidos o seguidos desde junio de 2006, se incluye un consentimiento informado para que se pueda realizar una comprobación externa de su estado vital y de sus posibles ingresos hospitalarios, esta información se utiliza posteriormente para comparar con los datos del registro.
El objetivo de este informe es describir la población expuesta a biológicos en nuestro medio y explorar tendencias de seguridad con la inclusión de los nuevos biológicos.
MétodosBIOBADASER 2.0 es un registro de seguridad de medicamentos para pacientes que inician tratamiento con terapias biológicas. Se recoge la información procedente de los 14 centros participantes (ver lista en apéndice) desde el inicio de BIOBADASER en 2000 y a 3 niveles: 1) paciente (sexo, fecha de nacimiento, diagnóstico y fecha de diagnóstico, comorbilidades y factores de riesgo), 2) tratamiento (tipo de biológico, fechas de inicio y fechas de interrupción, tratamiento FAME y profilaxis de la tuberculosis, DAS/BASDAI para artritis reumatoide/espondilitis anquilosante), y 3) acontecimientos adversos (AA), con la fecha, tipo y clasificación según el Medical Dictionary of Adverse Events (MedDRA8), gravedad, desenlace y tratamientos concomitantes.
El protocolo y todos los materiales de BIOBADASER 2.0 se encuentran disponibles en el sitio Web http://www.biobadaser.ser.es/biobadaser/index.html, en donde además se introducen los datos directamente por cada responsable participante a medida que los pacientes presentan cambios en su tratamiento o tienen algún acontecimiento AA.
Se define AA relevante como cualquier suceso relacionado o no con el tratamiento biológico, que produzca la muerte, ponga en peligro la vida, precise de ingreso hospitalario o lo prolongue, o bien produzca una discapacidad persistente o importante. También se incluyen aquellos AA que el médico considere importantes por obligar a una actitud terapéutica preventiva de los anteriores supuestos.
La monitorización la lleva a cabo un monitor con experiencia en farmacovigilancia. Los datos son monitorizados on-line constantemente y una vez al año se realiza una monitorización más detallada en una selección aleatoria de 20 registros directamente en contacto con los responsables in situ. Además, una vez al año se contacta con aquellos pacientes que previamente han dado su consentimiento para confirmar su estado vital y si han sido hospitalizados durante el año. La aplicación informática también contiene filtros que limitan la entrada de datos fuera del margen admisible. El estudio está aprobado por el Comité de Investigación Clínica del Hospital Ramón y Cajal, Madrid.
Se describe la cohorte de BIOBADASER 2.0 seguida en el registro mediante medidas de tendencia central. Asimismo se muestran las frecuencias de los distintos tratamientos, motivos de suspensión y AA en general y mortales.
ResultadosA 9 de octubre de 2009, BIOBADASER 2.0 incluye un total de 5.493 pacientes y está compuesto en un 62% (3.406) por mujeres, con una edad media al inicio del tratamiento de 49 años (Desviación Estándar, DE=15) y una evolución de la enfermedad de 10 años (DE=9). Los diagnósticos más frecuentes son el de artritis reumatoide 53% (2.907), seguido de espondilitis anquilosante 16% (882) y artritis psoriásica 16% (858). El resto de diagnósticos están todos por debajo del 5% (tabla 1).
Diagnósticos de los pacientes incluidos en BIOBADASER 2.0
| Diagnóstico | n (%) |
| Artritis reumatoide | 2.907 (53) |
| Espondilitis anquilosante | 882 (16) |
| Artritis o espondiloartritis psoriásica | 858 (16) |
| Artritis idiopática juvenil | 217 (4) |
| Espondiloartropatía Indiferenciada | 210 (4) |
| Artritis enteropática | 96 (2) |
| Enfermedad de Behçet | 42 (1) |
| Lupus eritematoso sistémico | 34 (1) |
| Poliartritis crónica seronegativa | 34 (1) |
| Oligoartritis crónica seronegativa | 28 (1) |
| Overlap | 25 (<1) |
| Enfermedad de Still | 19 (<1) |
| Uveitis sin enfermedad reumática | 18 (<1) |
| Vasculitis | 18 (<1) |
| Espondiloartropatía juvenil indiferenciada | 15 (<1) |
| Espondilitis anquilosante juvenil | 15 (<1) |
| Artritis reactiva | 13 (<1) |
| Síndrome SAPHO | 12 (<1) |
| Síndrome de Sjögren primario | 11 (<1) |
| Polimiositis/dermatomiositis | 8 (<1) |
| Policondritis recidivante | 8 (<1) |
| Sarcoidosis | 8 (<1) |
| Psoriasis | 6 (<1) |
| Esclerodermia | 3 (<1) |
| Pioderma gangrenoso | 2 (<1) |
| Enfermedad de Muckle-Wells | 2 (<1) |
| Síndrome de Felty | 1 (<1) |
| Epidermiolisis Bullosa | 1 (<1) |
| Total | 5.493 |
En total se ha recogido información de 8.081 ciclos de tratamientos. De los 5.493 pacientes registrados, casi un 31% (1.666) han recibido tratamiento con más de un agente biológico durante el tiempo de seguimiento. Los fármacos más utilizados son infliximab, 2.865 (35%), etanercept, 2.621 (32%) y adalimumab, 1.902 (24%). El resto de tratamientos, rituximab (518), abatacept (104), anakinra (59) y tocilizumab (12) no suponen más del 8% total.
El tratamiento se ha suspendido en 3.784 ocasiones y en cuanto a los motivos de suspensión del tratamiento (tabla 2), la ineficacia o pérdida de eficacia es la causa más frecuente, tanto en el caso del primer tratamiento (41%), como en segundos o posteriores (35%). La aparición de un acontecimiento adverso es la segunda causa más común de suspensión para el primer tratamiento (39%), mientras que el motivo «otros» lo es para los segundos y posteriores tratamientos (34%).
Motivos de suspensión de los tratamientos biológicos según el orden de tratamiento
| Motivos de suspensión | Primer tratamiento, n (%) | Segundo tratamiento y posteriores, n (%) | Todos, n (%) |
| Ineficacia o pérdida de eficacia | 980 (41) | 473 (35) | 1.453 (38) |
| Acontecimiento adverso | 943 (39) | 354 (26) | 1.297 (34) |
| Embarazo o deseo gestacional | 72 (3) | 31 (2) | 103 (3) |
| Pérdida de paciente | 100 (4) | 30 (2) | 130 (3) |
| Remisión | 79 (3) | 14 (1) | 93 (2) |
| Otros | 239 (10) | 469 (34) | 708 (19) |
| Total | 2.413 (100) | 1.371 (100) | 3.784 (100) |
La frecuencia y el porcentaje de los diferentes AA registrados por grandes grupos de órganos y sistemas, queda reflejado en la tabla 3. Se han comunicado 7.289 acontecimientos adversos. Los más frecuentes son las infecciones e infestaciones, que suponen el 37% de todos los AA registrados, en segundo lugar están los trastornos generales y alteraciones en el lugar de administración con un 10% y en tercero los trastornos de la piel y del tejido subcutáneo con un 7%. Los trastornos cardiovasculares y las neoplasias en conjunto, suponen un 7% del total de acontecimientos adversos. Con respecto a los acontecimientos que han tenido un desenlace fatal (tabla 4), estos se han producido principalmente por infecciones en un 34% (37), seguido de trastornos cardiacos 23% (25). Las neoplasias son responsables del 10% (11) de todos los eventos fatales.
Frecuencia de acontecimientos adversos según el tipo órgano o sistema preferente
| Órganos y sistemas | n (%) |
| Infecciones e infestaciones | 2.668 (37) |
| Trastornos generales y alteraciones en el lugar de administración | 761 (10) |
| Trastornos de la piel y del tejido subcutáneo | 540 (7) |
| Trastornos gastrointestinales | 321 (4) |
| Trastornos musculoesqueléticos y del tejido conjuntivo | 310 (4) |
| Trastornos del sistema nervioso | 269 (4) |
| Exploraciones complementarias | 266 (4) |
| Procedimientos médicos y quirúrgicos | 253 (3) |
| Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéutica | 235 (3) |
| Trastornos respiratorios, torácicos y mediastínicos | 192 (3) |
| Trastornos cardiacos | 190 (3) |
| Trastornos oculares | 177 (2) |
| Neoplasias benignas, malignas y no especificadas (incl quistes y pólipos) | 169 (2) |
| Trastornos vasculares | 166 (2) |
| Trastornos de la sangre y del sistema linfático | 127 (2) |
| Trastornos renales y urinarios | 121 (2) |
| Trastornos hepatobiliares | 116 (2) |
| Trastornos psiquiátricos | 107 (1) |
| Trastornos del metabolismo y de la nutrición | 72 (1) |
| Trastornos del aparato reproductor y de la mama | 67 (1) |
| Embarazo, puerperio y enfermedades perinatales | 33 (<1) |
| Trastornos del sistema inmunológico | 33 (<1) |
| Trastornos del oído y del laberinto | 32 (<1) |
| Trastornos endocrinos | 29 (<1) |
| Trastornos congénitos, familiares y genéticos | 27 (<1) |
| Circunstancias sociales | 8 (<1) |
| Total | 7.289 |
Frecuencia de acontecimientos adversos fatales según el tipo órgano o sistema preferente
| Órganos y sistemas | n (%) |
| Infecciones e infestaciones | 37 (34) |
| Trastornos cardiacos | 25 (23) |
| Trastornos respiratorios, torácicos y mediastínicos | 13 (12) |
| Neoplasias benignas, malignas y no especificadas (incl quistes y pólipos) | 11 (10) |
| Trastornos generales y alteraciones en el lugar de administración | 9 (8) |
| Trastornos gastrointestinales | 4 (4) |
| Trastornos del sistema nervioso | 3 (3) |
| Trastornos hepatobiliares | 3 (3) |
| Trastornos vasculares | 2 (2) |
| Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéutica | 1 (1) |
| Trastornos del sistema inmunológico | 1 (1) |
| Trastornos renales y urinarios | 1 (1) |
| Total | 110 |
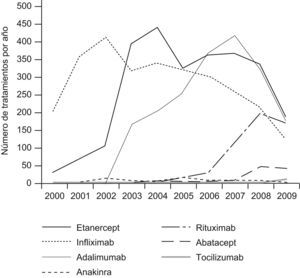
El registro refleja la situación actual de los pacientes tratados con biológicos en reumatología. Los pacientes incluidos son cada vez más heterogéneos, sobre todo ha aumentado la proporción de casos de espondiloartritis en comparación con artritis reumatoide. En la figura 1 se representa el número de nuevos tratamientos que se administran cada año y en ella se pueden diferenciar claramente 3 etapas. Una primera que va desde los comienzos del registro hasta el año 2003, en donde el principal principio activo utilizado era infliximab. Otra segunda que llega hasta el año 2005 en donde etanercept pasa a ser la opción más utilizada y una tercera en la cual adalimumab es el biológico más frecuente durante el periodo 2006–2007 y rituximab comienza su crecimiento.
Las causas de suspensión de los biológicos han sufrido ligeras modificaciones con respecto a los informes anteriores9. Tanto la ineficacia como la aparición de algún acontecimiento adverso, siguen siendo son los 2 motivos principales, sin embargo en este nuevo informe tenemos el aumento de una nueva categoría. La categoría otros está ligada al incremento en la utilización de rituximab, y se debe en parte a la forma de administrar y contabilizar los tratamientos de este fármaco. En ella se recoge principalmente la finalización de los ciclos sin problemas.
En este nuevo informe además, se ha decidido no incluir las funciones de supervivencia y las incidencias globales, puesto que las dianas moleculares varían y combinar los distintos principios activos implica una mayor complejidad, principalmente por rituximab.
En cuanto a los acontecimientos adversos, como limitación tenemos que solo podemos comparar con los informes realizados a partir del año 2007, donde se introdujo MedDRA como diccionario para clasificar los AA, anteriormente10 se utilizaba la clasificación según el diccionario de la OMS. En cualquier caso, en todos ellos9,10 se pone de manifiesto que las infecciones, los trastornos generales y alteraciones en el lugar de la administración y las alteraciones de la piel y del tejido subcutáneo, son los tres AA más frecuentes, siendo las infecciones el más numeroso de todos. Las reacciones infusionales son el segundo tipo de AA más frecuente y son uno de los principales motivos de suspensión del tratamiento11. En este contexto, es importante estar alerta a los síntomas que puedan aparecer, puesto que este tipo de reacciones pueden aparecer en cualquier momento de la enfermedad, no solo en las primeras administraciones11.
Los AA con desenlace fatal, tampoco han sufrido grandes variaciones, si acaso han aumentado ligeramente los eventos cardiacos, con respecto al informe anterior10. Pero junto con las infecciones y los trastornos respiratorios, siguen siendo los AA mortales más frecuentes. Si bien, al menos para pacientes con artritis reumatoide y biológicos, la mortalidad no parece aumentada12,13, excepto en el caso de las infecciones. Tampoco parece que lo esté en el caso de las neoplasias14.
En resumen, en este informe no se observan tendencias diferentes de riesgo en BIOBADASER 2.0 respecto al registro global y años anteriores. Esta información puede contribuir a mejorar el conocimiento del perfil de seguridad de las terapias biológicas.
FinanciaciónBIOBADASER se desarrolla en colaboración con la División de Farmacoepidemiología y Farmacovigilancia de la Agencia Española de Medicamentos y Productos Sanitarios (AEMyPS). Los siguientes laboratorios farmacéuticos con productos biológicos para las enfermedades reumáticas en el mercado apoyan económicamente el registro: Schering, Wyeth, Abbott, Roche y Bristol Myers Squibb. Según el acuerdo de colaboración, la aportación económica de todos es igual, y en ningún caso supera al doble de la aportación realizada por la SER o la AEMyPS, lo que garantiza la independencia del registro.
Los autores agradecen en especial a todos aquellos que han tenido que lidiar con BIOBADASER desde adentro, entre los que se encuentran JJ Gómez-Reino, B Pérez Zafrilla, JM Barrio Olmos, MJ García de Yébenes, J Maese, MJ Martínez Blasco y como no podía ser de otra manera, a todos los que colaboran como grupo BIOBADASER 2.0: Agustí Sellas, Basilio Rodríguez y Mireia Barceló (Ciudad Sanitaria Vall d’Hebron); Laura Cebrián, María Montoro (Hospital Gregorio Marañon); Dolores Montesinos (Hospital Universitario Virgen Macarena); Eva Pérez-Pampín (Hospital Clínico Universitario de Santiago); Ana M. Ortiz, (Hospital Universitario de La Princesa); Fred Antón, Antonio Zea (Hospital Ramón y Cajal); Francisco Javier Manero Ruiz, Chesús Beltrán, Eugenio Giménez Úbeda, Fernando Jiménez Zorzo, Jesús Marzo, Marta Medrano, Ángela Pecondón (Hospital Universitario Miguel Servet); M. Victoria Hernández, Raimon Sanmartí, Juan D Cañete (Hospital Clinic I Provincial); Carlos Rodríguez Lozano, Antonio Naranjo, Soledad Ojeda, Félix Francisco Hernández, Celia Erausquin, Íñigo Rúa, (Hospital de Gran Canaria Dr. Negrín); Inmaculada Ureña, María Victoria Irigoyen, Laura Cano (Hospital General Carlos Haya); Rosa Roselló Pardo, Carlos Vázquez Galeano, (Hospital General San Jorge); Alexia de Juanes, Beatriz Joven, Javier García (Hospital 12 De Octubre); Javier Calvo, Cristina Campos (Hospital General Universitario de Valencia); Juan José García Borras, Rosa Negueroles, Luisa Muñoz, JL Valero, D. Ybañez (Hospital La Fe).