Elaborar unas recomendaciones que sirvan de referencia a los reumatólogos y otros profesionales implicados en el tratamiento del lupus eritematoso sistémico (LES) que vayan a utilizar o consideren la utilización de terapias biológicas en su manejo.
MétodosLas recomendaciones se emitieron siguiendo la metodología de grupos nominales y basadas en revisiones sistemáticas. El nivel de evidencia y el grado de recomendación se clasificaron según el modelo del Center for Evidence Based Medicine de Oxford y el grado de acuerdo se extrajo por técnica Delphi.
ResultadosSe realizan recomendaciones sobre el uso de belimumab, actualmente única terapia biológica con aprobación para el tratamiento del LES, y otras terapias biológicas sin indicación aprobada en LES. El objetivo del tratamiento es la respuesta clínica completa, entendida como la ausencia de actividad clínica percibida o constatable. Se matiza el uso de terapias biológicas en LES y cuál debe ser la evaluación previa y la vigilancia del paciente que recibe estos fármacos.
ConclusionesSe presentan las recomendaciones SER sobre el uso de terapias biológicas en el LES.
To provide a reference to rheumatologists and other physicians involved in the treatment of systemic lupus erythematosus (SLE) who are using, or about to use biologic therapies.
MethodsRecommendations were developed following a nominal group methodology and based on systematic reviews. The level of evidence and degree of recommendation were classified according to a model proposed by the Center for Evidence Based Medicine at Oxford. The level of agreement was established through a Delphi technique.
ResultsWe have produced recommendations on the use of belimumab, the only biological agent with approved indications for SLE, and other biological agents without an indication for SLE. The objective of treatment is to achieve a complete clinical response, taken as the absence of perceived or evident disease activity. Nuances regarding the use of biologic therapies in SLE were reviewed as well, such as the evaluation that should be performed prior to administration and the follow up of patients undergoing these therapies.
ConclusionsWe present the SER recommendations for the use of biological therapies in patients with SLE.
El lupus eritematoso sistémico (LES) es una enfermedad muy heterogénea, tanto en sus manifestaciones clínicas como en su curso clínico1. Es más frecuente en el sexo femenino y en determinadas razas, y su pico de incidencia se sitúa entre los 15 y los 40 años de edad. En España, el estudio EPISER estimó una prevalencia de hasta 91 casos por 100.000 habitantes2.
El tratamiento del LES se ha basado clásicamente en el uso de glucocorticoides, ácido acetilsalicílico, antiinflamatorios no esteroideos, antipalúdicos y diversos inmunosupresores. Estos tratamientos han mejorado notablemente el pronóstico de la enfermedad en la mayoría de los pacientes, aunque no todos responden y en ocasiones su uso conlleva una importante toxicidad.
En los últimos años se han desarrollado terapias biológicas (TB) dirigidas a dianas concretas importantes en la patogenia del LES3. El belimumab (BLM) es la primera TB con indicación específica para LES en la ficha técnica4, aunque también se han utilizado para su tratamiento otras TB con indicación aprobada para otras enfermedades reumáticas5.
Todo esto justifica que desde la Sociedad Española de Reumatología se genere un consenso sobre el uso de TB en LES, en el que se emiten recomendaciones basadas en la mejor evidencia disponible y la opinión de expertos. El objetivo es ayudar a los profesionales que traten pacientes adultos con LES en relación con el uso de TB, para: a) reducir la variabilidad en el uso de TB en LES; b) aproximar la práctica clínica a la mejor evidencia científica actual, y, en definitiva, c) dar apoyo a los implicados en la toma de decisiones acerca del tratamiento de los pacientes con LES.
MetodologíaDesde la Sociedad Española de Reumatología (SER) se consideró pertinente la elaboración de recomendaciones sobre el uso de las TB en el LES. Para realizar este consenso se utilizó una modificación de la metodología RAND/UCLA6. Se crearon grupos nominales y se realizaron encuestas Delphi y revisiones sistemáticas de temas controvertidos.
Se creó un panel de expertos en LES según los siguientes criterios: a) que tuvieran artículos publicados sobre LES; b) que los artículos estuvieran indexados en MEDLINE o publicados en Reumatología Clínica o Revista Española de Reumatología, y/o c) existiera un interés y experiencia evidentes en este campo.
Se realizó una reunión del grupo nominal moderada por miembros de la Unidad de Investigación (UI) de la SER, en la que se tomaron decisiones sobre el contenido y los apartados del documento, así como el alcance y los usuarios. Partiendo del contenido decidido, los panelistas formularon preguntas que pudieran responderse mediante revisión sistemática.
En una primera fase, se asignó a cada panelista la elaboración de uno de los apartados del consenso. Una vez unificados todos los apartados en un solo documento y editados por miembros de la UI, se reenvió el texto completo a todo el panel para su corrección y la generación de recomendaciones. Finalmente, se evaluó el grado de acuerdo de las recomendaciones y se redactó el documento definitivo. El grado de acuerdo se definió como el porcentaje de consenso entre los panelistas obtenido de la votación de cada recomendación por medio de una encuesta anónima. Se consideró consenso cuando al menos el 70% de los panelistas votaron 7 o más de 7 en una escala de 1 (total desacuerdo) a 10 (acuerdo total). Aquellas recomendaciones que no alcanzaron un nivel de acuerdo superior al 70% fueron reformuladas y sometidas nuevamente a votación. El nivel de evidencia y el grado de recomendación se clasificaron de acuerdo con el modelo del Center for Evidence-Based Medicine de Oxford7.
Consideraciones previasValoración del estado de la enfermedad en el lupus eritematoso sistémicoLa actividad del LES fluctúa en el tiempo, pudiendo estar ausente durante períodos variables y añadir o no daño acumulado en el curso de la enfermedad. Los pacientes con LES precisan una monitorización estandarizada y objetiva con instrumentos validados para determinar, con la mayor exactitud posible, el grado de actividad y discriminar entre lesión activa y daño (NE 5; GR D; GA 100%). La disponibilidad de nuevos fármacos inmunosupresores y TB para su uso en el LES hace particularmente necesaria una cuidadosa y experta monitorización de todos los aspectos de la enfermedad, utilizando instrumentos validados y fiables.
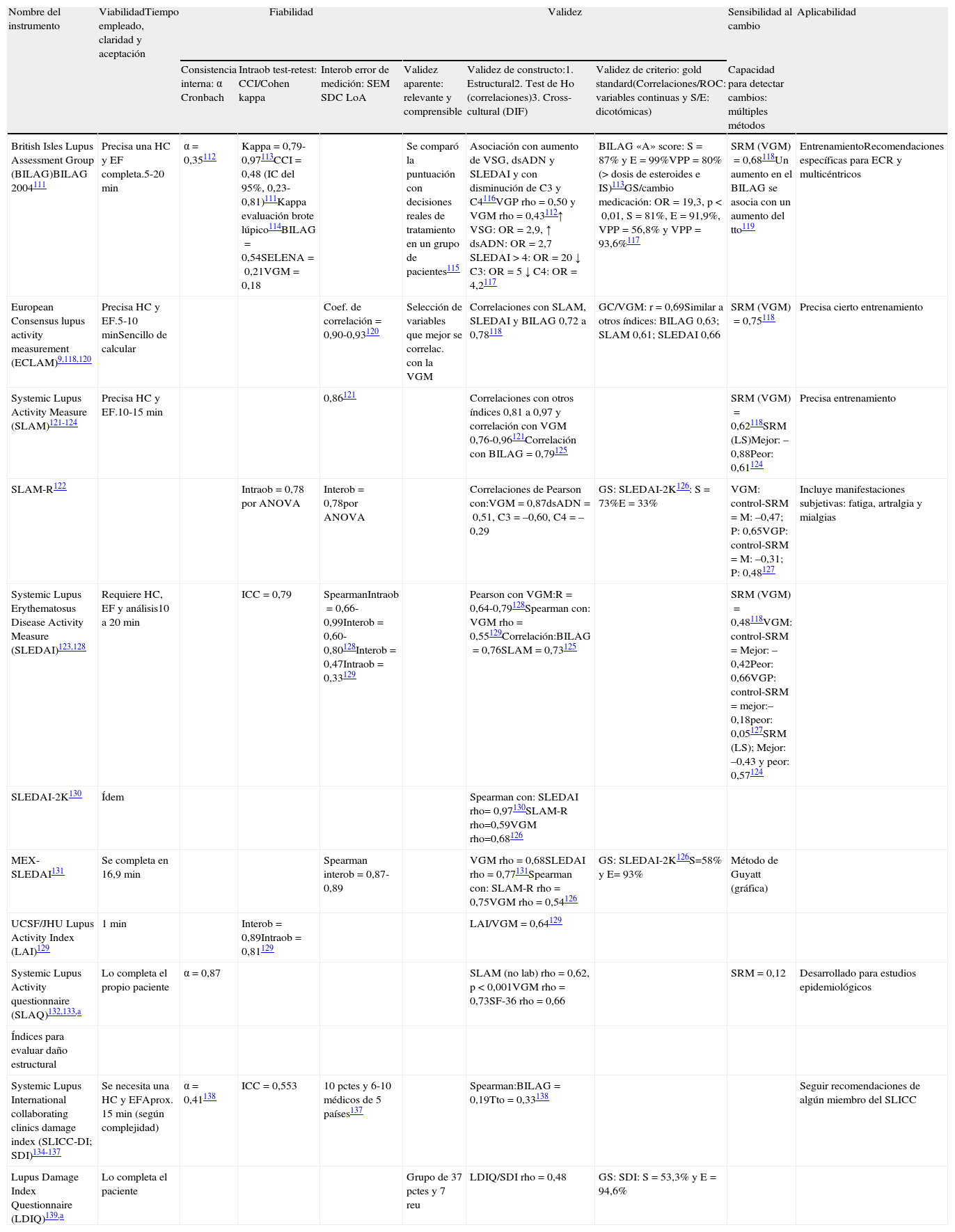
Instrumentos para medir la actividad en el lupus eritematoso sistémicoPara la valoración de la actividad disponemos de varias herramientas. La más sencilla es la valoración global de la actividad por parte del médico (VGM)8,9. Sin embargo, esta está sujeta a una importante variabilidad intra e interobservador10.
Los índices de actividad se desarrollaron como herramientas objetivas para estudios de cohortes de pacientes con LES11. Se sabe que son capaces de predecir daño y mortalidad. Además, permiten estandarizar el seguimiento del LES y valorar de forma más precisa la enfermedad, y facilitan la toma de decisiones terapéuticas, aunque su utilidad en la práctica clínica diaria está menos establecida. Al igual que EULAR12, el panel recomienda la utilización de un índice global numérico validado para valorar la actividad del LES (NE 5; GR D; GA 100%). Aunque su uso no está muy extendido en la práctica clínica, estos índices deberían ser aplicados a todos los pacientes con LES o, al menos, a aquellos que estén en tratamiento con TB (NE 5; GR D; GA 93%).
Además, el panel recomienda evaluar la actividad de la enfermedad en el LES cada 15 días-6 meses en función de los datos clínico-analíticos previos y los cambios en el tratamiento (NE 5; GR D, GA 100%).
Las características de los índices más empleados se exponen en la tabla 1. El panel recomienda preferiblemente el uso de SLEDAI (en sus versiones actualizadas: SLEDAI-2k o SELENA-SLEDAI) (NE 5; GR D; GA 93%). Es un índice global numérico, validado, breve, fiable y sencillo de aplicar, incluso para los no expertos13,14. Otros índices globales numéricos, como ECLAM o SLAM-R, pueden ser igualmente válidos. El panel considera que, a pesar de ser el BILAG el único índice de actividad por órganos o aparatos, la limitada disponibilidad de la herramienta informática (BLIPS) necesaria para su correcto uso, hace poco viable su implantación en la práctica diaria. Este índice requiere, además, de un entrenamiento específico para garantizar su correcta aplicación.
Índices de actividad y daño en LES
| Nombre del instrumento | ViabilidadTiempo empleado, claridad y aceptación | Fiabilidad | Validez | Sensibilidad al cambio | Aplicabilidad | ||||
| Consistencia interna: α Cronbach | Intraob test-retest: CCI/Cohen kappa | Interob error de medición: SEM SDC LoA | Validez aparente: relevante y comprensible | Validez de constructo:1. Estructural2. Test de Ho (correlaciones)3. Cross-cultural (DIF) | Validez de criterio: gold standard(Correlaciones/ROC: variables continuas y S/E: dicotómicas) | Capacidad para detectar cambios: múltiples métodos | |||
| British Isles Lupus Assessment Group (BILAG)BILAG 2004111 | Precisa una HC y EF completa.5-20min | α=0,35112 | Kappa=0,79-0,97113CCI=0,48 (IC del 95%, 0,23-0,81)111Kappa evaluación brote lúpico114BILAG=0,54SELENA=0,21VGM=0,18 | Se comparó la puntuación con decisiones reales de tratamiento en un grupo de pacientes115 | Asociación con aumento de VSG, dsADN y SLEDAI y con disminución de C3 y C4116VGP rho=0,50 y VGM rho=0,43112↑ VSG: OR=2,9, ↑ dsADN: OR=2,7 SLEDAI > 4: OR=20 ↓ C3: OR=5 ↓ C4: OR=4,2117 | BILAG «A» score: S=87% y E=99%VPP=80% (> dosis de esteroides e IS)113GS/cambio medicación: OR=19,3, p<0,01, S=81%, E=91,9%, VPP=56,8% y VPP=93,6%117 | SRM (VGM)=0,68118Un aumento en el BILAG se asocia con un aumento del tto119 | EntrenamientoRecomendaciones específicas para ECR y multicéntricos | |
| European Consensus lupus activity measurement (ECLAM)9,118,120 | Precisa HC y EF.5-10minSencillo de calcular | Coef. de correlación=0,90-0,93120 | Selección de variables que mejor se correlac. con la VGM | Correlaciones con SLAM, SLEDAI y BILAG 0,72 a 0,78118 | GC/VGM: r=0,69Similar a otros índices: BILAG 0,63; SLAM 0,61; SLEDAI 0,66 | SRM (VGM)=0,75118 | Precisa cierto entrenamiento | ||
| Systemic Lupus Activity Measure (SLAM)121-124 | Precisa HC y EF.10-15min | 0,86121 | Correlaciones con otros índices 0,81 a 0,97 y correlación con VGM 0,76-0,96121Correlación con BILAG=0,79125 | SRM (VGM)=0,62118SRM (LS)Mejor: –0,88Peor: 0,61124 | Precisa entrenamiento | ||||
| SLAM-R122 | Intraob=0,78 por ANOVA | Interob=0,78por ANOVA | Correlaciones de Pearson con:VGM=0,87dsADN=0,51, C3=–0,60, C4=–0,29 | GS: SLEDAI-2K126: S=73%E=33% | VGM: control-SRM=M: –0,47; P: 0,65VGP: control-SRM=M: –0,31; P: 0,48127 | Incluye manifestaciones subjetivas: fatiga, artralgia y mialgias | |||
| Systemic Lupus Erythematosus Disease Activity Measure (SLEDAI)123,128 | Requiere HC, EF y análisis10 a 20min | ICC=0,79 | SpearmanIntraob=0,66-0,99Interob=0,60-0,80128Interob=0,47Intraob=0,33129 | Pearson con VGM:R=0,64-0,79128Spearman con: VGM rho=0,55129Correlación:BILAG=0,76SLAM=0,73125 | SRM (VGM)=0,48118VGM: control-SRM=Mejor: –0,42Peor: 0,66VGP: control-SRM=mejor:–0,18peor: 0,05127SRM (LS); Mejor: –0,43 y peor: 0,57124 | ||||
| SLEDAI-2K130 | Ídem | Spearman con: SLEDAI rho= 0,97130SLAM-R rho=0,59VGM rho=0,68126 | |||||||
| MEX-SLEDAI131 | Se completa en 16,9 min | Spearman interob=0,87-0,89 | VGM rho=0,68SLEDAI rho=0,77131Spearman con: SLAM-R rho=0,75VGM rho=0,54126 | GS: SLEDAI-2K126S=58% y E= 93% | Método de Guyatt (gráfica) | ||||
| UCSF/JHU Lupus Activity Index (LAI)129 | 1 min | Interob=0,89Intraob=0,81129 | LAI/VGM=0,64129 | ||||||
| Systemic Lupus Activity questionnaire (SLAQ)132,133,a | Lo completa el propio paciente | α=0,87 | SLAM (no lab) rho=0,62, p<0,001VGM rho=0,73SF-36 rho=0,66 | SRM=0,12 | Desarrollado para estudios epidemiológicos | ||||
| Índices para evaluar daño estructural | |||||||||
| Systemic Lupus International collaborating clinics damage index (SLICC-DI; SDI)134-137 | Se necesita una HC y EFAprox. 15min (según complejidad) | α=0,41138 | ICC=0,553 | 10 pctes y 6-10 médicos de 5 países137 | Spearman:BILAG=0,19Tto=0,33138 | Seguir recomendaciones de algún miembro del SLICC | |||
| Lupus Damage Index Questionnaire (LDIQ)139,a | Lo completa el paciente | Grupo de 37 pctes y 7 reu | LDIQ/SDI rho=0,48 | GS: SDI: S=53,3% y E=94,6% | |||||
AUC: área debajo la curva; E. especificidad; EF: exploración física; GS: «gold standard»; HC: historia clínica; Interob: interobservadores; Intraob: intraobservador; LHR–: razón de verosimilitud negativa; LHR+: razón de verosimilitud positiva; LS: escala Likert; r: coeficiente de correlación Pearson; rho: coeficiente de correlación Spearman; S: sensibilidad; SRM: estándar response mean; VGM: valoración global por el médico; VGP: valoración global por el paciente; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
El panel recomienda utilizar regularmente la VGM junto con un índice global numérico, dado que puede aportar información complementaria (NE 5; GR D; GA 79%)15.
Definición de actividad clínica y brote de la enfermedadActividad clínica y brote son 2 conceptos relacionables pero no superponibles. Conceptualmente, entendemos por actividad un escenario clínico en el que la enfermedad no está adecuadamente controlada, lo que se traduce en diferentes manifestaciones clínicas y/o analíticas. Brote se refiere a la reaparición de actividad clínica, en un momento concreto, en un paciente previamente controlado. Por tanto, actividad es un concepto de carácter más estático, en cuanto es algo que está persistiendo de forma más o menos continuada en el tiempo, mientras que brote tiene un carácter más dinámico, ya que es un cambio que se produce en un momento concreto. Aunque el concepto de actividad es sencillo de entender su categorización de una forma objetiva es más complicada y se ha realizado siempre de forma arbitraria. Para ello se han utilizado definiciones basadas en los distintos índices de actividad previamente descritos. Los más utilizados han sido el SLEDAI (con diversos puntos de corte) y el BILAG (aparición de un BILAG A o 2 BILAG B), aunque otras se han propuesto otras definiciones.
En la actualidad, no disponemos de una definición universalmente aceptada de brote o exacerbación de LES16,17. Recientemente, la Lupus Foundation of America ha propuesto la definición de brote lúpico como un incremento medible de actividad en uno o más órganos con empeoramiento o aparición de nuevos signos y síntomas, y/o anomalías en los parámetros de laboratorio18. Una alternativa sería usar una definición de brote de enfermedad ligada a un punto de corte en un índice de actividad, como puede ser un cambio en SLEDAI ≥ 319, pero ello puede suponer el no captar brotes de manifestaciones no contempladas en el índice o bien el definir como brote un cambio serológico sin correlato clínico. Finalmente, en el estudio SELENA se utilizó una nueva versión del SLEDAI (SELENA-SLEDAI) y se definieron y clasificaron los brotes (en moderados y severos) utilizando un nuevo instrumento, el SELENA-SLEDAI Flare Index (SFI), que utilizaba varios puntos de corte en el índice de actividad y además incluía en las definiciones diversos tipos de manifestaciones clínicas y cambios terapéuticos así como la valoración global del médico20. El panel propone como definición de brote cualquier cambio clínico o biológico potencialmente reversible recogido en los índices de actividad o en la VGM que lleve a considerar un incremento en el tratamiento.
El panel recomienda el registro sistemático de los brotes de actividad lúpica en cada visita, preferiblemente usando un instrumento como el SFI (SELENA-SLEDAI FLARE INDEX), aunque tenga una utilidad limitada (NE 5; GR D; GA 86%)21.
Medición de daño acumuladoSe define como daño acumulado aquellas lesiones irreversibles y clínicamente relevantes, atribuibles al LES, a los tratamientos empleados o a las complicaciones asociadas.
Se recomienda evaluar anualmente el daño acumulado en todos los pacientes con LES (NE 5; GR D; GA 100%). Actualmente, solo se dispone de un instrumento validado que es el índice SLICC/ACR/DI11,22.
Clasificación del lupus eritematoso sistémico con fines terapéuticosEl LES muestra marcada heterogeneidad clínica en cuanto a la extensión y gravedad. En consecuencia, el tratamiento del LES debe adecuarse a la situación clínica del paciente y a la gravedad de la enfermedad. Genéricamente, las manifestaciones clínicas de LES pueden clasificarse en 3 niveles23,24: menores, moderadas y graves (tabla 2).
Manifestaciones leves, moderadas y graves del LES
| Definición | Afección | Tratamiento | |
| Manifestaciones menores | Aquellas que, aun afectando a la calidad de vida del paciente, no suponen una amenaza para la vida y no producen un daño irreversible, o secuela relevante | FatigaFebrículaArtralgias o artritis intermitenteManifestaciones cutáneasSerositis leve | AINEAntipalúdicos |
| Formas moderadas | Artritis persistente, deformante o erosiva.Lesiones cutáneas graves, extensas o desfigurantesSerositis moderadaTrombocitopenia moderada | Dosis bajas de esteroides (< 0,125mg/kg/día)MTXAZALeflunomidaAnticalcineurínicos | |
| Formas graves | Afección de órgano mayor, con peligro para la vida y potencial producción de daño crónico con disfunción orgánica importante | Renal relevante (glomerulonefritis proliferativa clase iii o iv, microangiopatía trombótica)Neuropsiquiátrica grave (convulsiones, síndrome cerebral orgánico, vasculitis del sistema nervioso central, mielitis transversa, psicosis, etc.)Pulmonar (neumonitis lúpica y hemorragia alveolar)Cardíacas y vasculares graves (hipertensión pulmonar, hipertensión portal, etc.)Cutánea muy grave (lupus ampolloso, paniculitis lúpica desfigurante, etc.)Citopenias graves | Dosis altas de esteroidesMMFCFM |
AINE: antiinflamatorios no esteroideos; AZA: azatioprina; CFM: ciclofosfamida; MMF: micofenolato mofetilo; MTX: metotrexato.
El objetivo del tratamiento del LES es la respuesta clínica completa, entendida como la ausencia de actividad clínica percibida o constatable e, idealmente, poder suspender el tratamiento inmunosupresor empleado en cada caso, así como el tratamiento esteroideo o al menos llegar a una dosis mínima estable aceptable (≤ 5mg/24h de prednisona o equivalente). En su defecto, el objetivo terapéutico será la actividad mínima tolerable25,26. El objetivo terapéutico debe incluir la estabilización de la enfermedad, evitando la aparición de nuevos brotes, la afectación de nuevos órganos y el desarrollo de daño tisular irreversible. No se considera subsidiario de tratamiento al paciente serológicamente activo, clínicamente quiescente.
Lupus eritematoso sistémico refractarioNo existe una definición universalmente aceptada de LES refractario. Se entiende como tal aquel que no ha respondido al tratamiento estándar o que requiere una dosis inaceptable de glucocorticoides para mantener la remisión27–31. Siempre se debe constatar que ha habido adherencia al régimen terapéutico y considerar la posibilidad de daño acumulado, no susceptible de mejorar con el tratamiento del LES. El panel propone una definición de LES refractario por cada órgano o sistema que se detalla en la tabla 3.
LES refractario
| Órgano/sistema | Criterios refractariedad |
| Sistema músculo-esquelético | Fallo a antipalúdicos, AINE, dosis bajas de GC (< 7,5mg-10mg/día de prednisona o equivalente) y MTX hasta 20-25mg/semana, durante al menos 2-3 meses140,141Necesidad de tratamiento con > 5mg diarios de prednisona o equivalente para mantener una respuesta aceptable o una remisión |
| Sistema cutáneo-mucoso | Fallo a tratamiento tópico con GC e inhibidores de la calcineurina (o con GC intralesionales en el caso de lesiones discoides) y sistémico con antipalúdicos a dosis plenas (6,5mg/kg de hidroxicloroquina o 4mg/kg de cloroquina, incluyendo biterapia con quinacrina si estuviese disponible)142 o dosis bajas de GC (7,5-10mg)143, durante al menos 2-3 mesesNecesidad de tratamiento con > 5mg diarios de prednisona o equivalente para mantener una respuesta aceptable o una remisión. Se puede considerar el uso de MTX como ahorrador de GC en algunas formas cutáneas de LES141 |
| Serositis | Fallo a antipalúdicos, AINE y dosis medias-bajas de GC (< 30mg/día de prednisona o equivalente), con persistencia del dolor o de derrame pericárdico clínicamente relevante tras al menos un mes de terapia corticoidea144 |
| Afectación renal | Glomerulonefritis membrano-proliferativa que no ha respondido a dosis altas de GC (1mg/kg/día de prednisona o equivalente y pulsos de metilprednisolona de 500 a 1.000mg/día durante 3 días) y al menos uno de los siguientes inmunosupresores: CFM intravenosa (pauta NIH o ELNT), MMF (a dosis de 3 g/día) o ácido micofenólico (a dosis de 2.160mg/día)145-150En el caso de la glomerulonefritis membranosa a la anterior definición, se añade la falta de respuesta a un inhibidor de la calcineurina, siempre y cuando se haya realizado el tratamiento de inducción de remisión con MMF151 |
| Afectación neuropsiquiátrica grave | Fallo a dosis altas de GC (1mg/kg de prednisona o equivalente, e incluyendo pulsos de metilprednisolona de 500-1.000mg/día durante 3 días) y tratamiento inmunosupresor con CFM (con o sin plasmaféresis)12,152. Se excluye de esta definición el ictus trombótico o de origen aterosclerótico |
| Afectación pulmonar grave | Fallo a dosis altas de GC (al menos 3 pulsos de 0,5g de metilprednisolona en días consecutivos) y CFM (con o sin plasmaféresis)153 |
| Afectación hematológica grave | Fallo dosis altas de GC durante 3-4 semanas e inmunoglobulinas intravenosas (en caso de trombocitopenia), no consiguiéndose cifras seguras de plaquetas (≥ 30.000-50.000/μl, dependiendo de los factores de riesgo de sangrado)154 o una cifra de hemoglobina ≥ de 10 g/dlNecesidad de tratamiento con > 5mg diarios de prednisona o equivalente en combinación con un agente inmunosupresor (AZA o MMF) durante 3 meses para mantener una respuesta aceptable o una remisión; o bien el uso continuado de inmunoglobulinas por vía intravenosa o agonistas del receptor de la trombopoyetina155 para mantener cifras seguras de plaquetas, en el caso de la trombocitopeniaEn cuanto a la PTT se considera refractaria en caso de fallo de dosis altas de GC y plasmaféresis, bien por falta de respuesta o bien por dependencia de la misma156,157 |
AINE: antiinflamatorios no esteroideos; AZA; azatioprina; CFM: ciclofosfamida; ELNT: Eurolupus Nephritis Trial; GC: glucocorticoides; LES: lupus eritematoso sistémico; MTX: metotrexato; MMF: micofenolato mofetilo; NIH: National Institute of Health; PTT: púrpura trombótica trombocitopénica.
Actualmente, el BLM es la única TB con indicación aprobada en LES, aunque se han utilizado fuera de indicación el rituximab, tocilizumab, abatacept (ABT) y los inhibidores del TNF-α.
En la tabla 4 se resume la ficha técnica de BLM. El resumen de las fichas técnicas de los tratamientos biológicos sin indicación aprobada en el LES se puede consultar en el documento de Consenso SER sobre la gestión del riesgo del tratamiento con terapias biológicas en pacientes con enfermedades reumáticas32.
Información resumida de la ficha técnica de belimumab
| Posología y administración | Dosis (según peso corporal): 10mg/kgVía: perfusión intravenosaFrecuencia: días 0, 14 y 28, y posteriormente en intervalos de 4 semanas |
| Indicaciones | Tratamiento adyuvante en pacientes adultos con LES activo, con autoanticuerpos positivos, con un alto grado de actividad de la enfermedad (p. ej., anti-dsADN positivo y bajo nivel de complemento) a pesar del tratamiento estándar |
| Contraindicaciones | Hipersensibilidad al principio activo o a alguno de los excipientes |
| Efectos adversos | Muy frecuentes: infecciones bacterianas como bronquitis o cistitis, diarrea, náuseaFrecuentes: gastroenteritis vírica, faringitis, nasofaringitis, leucopenia, reacciones de hipersensibilidad, depresión, insomnio, migraña, dolor en extremidades, reacciones relacionadas con la perfusión, pirexiaRaros: reacción anafiláctica, angioedema, urticaria, erupción cutánea |
| Nombre comercial | Benlysta® 120mg polvo para concentrado para solución para perfusión |
El BLM es un anticuerpo monoclonal humano soluble que inhibe al estimulador del linfocito B, una citocina clave para la supervivencia de los linfocitos B y que está sobreexpresada en el LES33–39.
Estudios básicosEn el ensayo inicial fase ii controlado con placebo, el BLM no alcanzó los objetivos de eficacia basados en el índice de actividad SELENA-SLEDAI a las semanas 24 y 5240. Sin embargo, un análisis post hoc demostró que el BLM reducía significativamente la actividad de la enfermedad en pacientes con anticuerpos antinucleares (ANA) o anti-ADN positivos. Por este motivo, los ensayos de registro de BLM (BLISS-5241 y BLISS-7642) incluyeron únicamente pacientes con ANA y/o anti-dsADN positivos, con un SELENA-SLEDAI ≥ 6. Los pacientes fueron aleatorizados a recibir infusiones por vía intravenosa de 1mg/kg de BLM, 10mg/kg de BLM o placebo en los días 0, 14 y 28, y posteriormente, cada 28 días. La medida de desenlace primaria fue una respuesta SLE Responder Index (SRI) a la semana 52, definida como ≥ 4 puntos de reducción en el SELENA-SLEDAI, ningún BILAG A, no más de un BILAG B y ausencia de empeoramiento en la VGM.
En el BLISS-5241 se registraron significativamente mayores porcentajes de pacientes con una respuesta SRI y una reducción ≥ 4 puntos en el SELENA-SLEDAI, y menores porcentajes de nuevos BILAG A o B y empeoramiento de la VGM en los grupos BLM frente a placebo. En el BLISS-7642, un mayor porcentaje de pacientes en el grupo de BLM 10mg/kg alcanzó una respuesta SRI a la semana 52 frente al grupo placebo (p=0,017). En ambos ensayos clínicos aleatorizados (ECA), la tasa de eventos adversos fue similar en todos los grupos de tratamiento.
Utilización en situaciones específicasNo hay evidencia en relación con el uso del BLM en manifestaciones del LES como la nefritis lúpica o en las manifestaciones neurológicas graves, ya que los pacientes con estos 2 tipos de afectación fueron específicamente excluidos de los ensayos. En un análisis post hoc de los ensayos fundamentales fase iii, se ha sugerido un efecto beneficioso de BLM sobre las medidas de desenlace renales en pacientes con afectación renal no grave43. Así mismo, otros análisis post hoc recientemente publicados han puesto de manifiesto un efecto beneficioso en las manifestaciones cutáneas y musculoesqueléticas44,45.
RecomendaciónEl panel recomienda la utilización de BLM en pacientes adultos con LES activo, con autoanticuerpos positivos y alto grado de actividad de la enfermedad a pesar de tratamiento estándar (NE 1; GR A; GA 93%). A día de hoy, los pacientes con manifestaciones clínicas no mayores (como artritis o afectación cutánea) refractarias y con datos analíticos de actividad parecen ser el escenario clínico más adecuado para el uso de este agente.
Actualmente, no se puede recomendar el uso de BLM en pacientes con LES y afectación grave del sistema nervioso central (SNC) y/o nefritis lúpica grave (NE 1; GR A; GA 93%).
Farmacovigilancia y gestión del riesgoAunque el perfil de seguridad mostrado por el BLM en los ensayos clínicos fue bueno, todavía existe poca experiencia en su uso a largo plazo. Recientemente, se ha publicado la experiencia del seguimiento de los primeros pacientes que entraron en ensayos clínicos con este fármaco y que posteriormente continuaron usándolo en fases de extensión durante 4 años (experiencia total acumulada de 1.165 paciente-años), observándose que la incidencia de efectos adversos, incluyendo reacciones infusionales, infecciones, neoplasias, alteraciones analíticas, o el número de abandonos del tratamiento por efectos no deseados se mantenían estables o declinaban46.
Ante un paciente con LES que vaya a iniciar tratamiento con BLM, se debe considerar la posible existencia de infecciones, cáncer, insuficiencia cardíaca, citopenias o cualquier otra comorbilidad relevante que se deba vigilar o sea una contraindicación para iniciar el tratamiento.
Una infección activa sistémica o localizada constituye una contraindicación para el inicio de BLM (NE 2b; GR B; GA 100%). En caso de infecciones crónicas, infecciones recurrentes o de un alto riesgo de infección, deberá valorarse estrictamente el riesgo-beneficio de su empleo y establecer una estrecha vigilancia. Se debe prestar además una atención especial al posible desarrollo de infecciones durante el tratamiento. Si se diera esta situación, resultan fundamentales un diagnóstico y un tratamiento precoces, así como la supresión temporal de BLM. Una vez resuelta la infección, se puede reiniciar la TB.
Se desconoce el riesgo de utilizar BLM en pacientes con tuberculosis (TBC) activa o latente. El panel aconseja seguir las recomendaciones generales para el uso de terapias biológicas en enfermedades reumáticas que se pueden consultar en el documento Consenso SER sobre la gestión del riesgo del tratamiento con terapias biológicas en pacientes con enfermedades reumáticas32.
Previamente al inicio del BLM, se debe tener en cuenta la historia de tumores malignos y trastornos linfoproliferativos (NE 5; GR D; GA 100%). Cuando existan estos antecedentes, se recomienda una especial precaución en su empleo, aunque no hay evidencia de riesgo incrementado de tumores sólidos en pacientes tratados con BLM. En caso de diagnosticarse una neoplasia maligna durante el tratamiento con BLM, este debería ser suspendido.
Antes de empezar el tratamiento con BLM se debe evaluar la existencia de citopenias. En caso que se atribuyan al LES, podría iniciarse el tratamiento con precaución. En caso contrario, no se debería iniciar el tratamiento hasta su resolución (NE 5; GR D; GA 100%). Si el paciente desarrolla una citopenia grave durante el tratamiento con BLM, se recomienda suspenderlo y buscar otras potenciales causas. Tras su resolución, el tratamiento podría reiniciarse.
Se recomienda realizar serologías de VHB y VHC. Se recomienda la administración de la vacuna antineumocócica y antigripal previamente al inicio del tratamiento con BLM (NE 3b; GR C; GA 100%). Se desaconseja el empleo de vacunas con gérmenes atenuados o vivos durante los 30 días previos o simultáneamente al empleo de BLM.
No se recomienda el uso de BLM en pacientes > 65 años, a menos que los beneficios esperados superen los riesgos. Tampoco está recomendado su uso en los pacientes con manifestaciones del SNC, nefritis lúpica activa grave, virus de la inmunodeficiencia humana, antecedentes o infección activa por VHB o VHC, hipogammaglobulinemia (IgG < 400mg/dl) o deficiencia de IgA (IgA < 10mg/dl), antecedentes de trasplante de órgano mayor o trasplante de células madre hematopoyéticas/médula ósea o trasplante renal, al no haber sido utilizado en esas situaciones (NE 5; GR D; GA 93%).
No se recomienda la administración de BLM junto con otros tratamientos que actúan sobre la célula B o con ciclofosfamida (CFM) (NE 5; GR D; GA 93%).
El BLM no requiere ajuste de dosis en pacientes con insuficiencia renal leve, moderada o grave. Sin embargo, debido a la ausencia de datos, se recomienda tener precaución en pacientes con insuficiencia renal grave (NE 5; GR D; GA 93%).
Se debe evitar el embarazo durante el período de tratamiento con BLM y los 4 meses posteriores a su finalización. No debe usarse BLM durante el embarazo, a no ser que sea claramente necesario (NE 5; GR D; GA 100%). Respecto a la lactancia, se debe considerar el beneficio de la misma para el niño y el beneficio del tratamiento con BLM para la madre y decidir.
En los pacientes que se vayan a someter a una cirugía, al no existir suficiente experiencia hasta la fecha, el panel recomienda suspender BLM en las 2 semanas previas a la intervención y reanudarlo tras 2-4 semanas desde la cirugía, dado el mayor riesgo de infecciones, citopenias y trastornos de coagulación en este período (NE 5; GR D; GA 100%).
Durante el seguimiento, se llevará a cabo una evaluación clínica y analítica del paciente, con una periodicidad de las visitas mensual al inicio y, posteriormente, entre 1 y 3 meses, en función de la evolución del paciente (NE 5; GR D; GA 100%).
Terapia biológica sin indicación autorizada en lupus eritematoso sistémicoRituximabDescripción del productoEl rituximab (RTX) es un anticuerpo monoclonal quimérico soluble dirigido contra el receptor de membrana CD20, presente en la mayor parte de las fases celulares en la ontogenia de la célula B (desde la célula pre-B hasta la célula B memoria), pero no en la célula plasmática. La infusión de este anticuerpo produce por diversos mecanismos (citotoxicidad mediada y no mediada por anticuerpos y apoptosis) una depleción de la población de células durante un período de 6 o más meses.
Estudios principalesActualmente, el RTX no tiene indicación aprobada en ficha técnica para el LES. Sin embargo, existen numerosos estudios abiertos que avalan el uso de RTX en diversas situaciones, incluidas formas graves como nefritis, citopenias o afectación del sistema nervioso. Sin embargo, el estudio EXPLORER no fue capaz de probar superioridad del RTX frente a placebo asociado al tratamiento convencional en pacientes con lupus activo en su variable principal (alcanzar y mantener una respuesta clínica en la semana 52 usando BILAG de 8 órganos)47. Este ECA doble ciego fase ii/iii evaluó la eficacia y la seguridad de RTX (2 dosis de 1g separadas por 14 días) o placebo añadido al tratamiento estándar (dosis variables de glucocorticoides, azatioprina [AZA], micofenolato mofetilo [MMF] o metotrexato [MTX]) en 257 pacientes con lupus sin afectación renal con actividad moderada a grave. Se han sugerido diversos problemas de diseño que podrían explicar este resultado desfavorable, como una potencia estadística insuficiente para demostrar diferencias entre 2 grupos de pacientes con medicación activa, uso de dosis variables de glucocorticoides e inmunosupresores, escaso tiempo de seguimiento (un año posiblemente no permitió evaluar efectos terapéuticos diferidos) o criterios de mejoría poco sensibles. Otro ECA realizado en pacientes con nefritis lúpica, el estudio LUNAR48, que se comentará posteriormente, tampoco identificó un beneficio adicional con el uso de RTX. No obstante, este estudió también adoleció de similares problemas metodológicos que el EXPLORER49.
La dosis específica de RTX en LES no ha sido establecida. En los ensayos clínicos generalmente se ha utilizado la misma pauta que en la artritis reumatoide, consistente en la infusión de 2 dosis de 1g separadas 14 días47,48,50-52. Sin embargo, numerosos estudios abiertos han utilizado la pauta indicada en linfomas de 4 infusiones semanales de 375mg/m253,54. Incluso se ha sugerido que una pauta reducida de 4 infusiones semanales de 100mg podría ser eficaz55.
No se ha establecido tampoco la conveniencia de administrar RTX en monoterapia o en combinación con otros inmunosupresores. En la mayor parte de los estudios abiertos se han asociado 2 dosis por vía intravenosa de 500-750mg de CFM en los días 3 y 17 a la pauta de 375mg/m2 de RTX. No obstante, esta combinación no ha demostrado ninguna ventaja en el tratamiento de inducción de la nefritis lúpica56. En el estudio LUNAR48 todos los pacientes recibieron MMF concomitantemente, por lo que no se pueden extraer conclusiones sobre la conveniencia de la combinación de fármacos. Recientemente, se ha relacionado la aparición de leucoencefalopatía multifocal progresiva en pacientes con LES tratados con RTX con el uso previo o concomitante de agentes alquilantes57.
En el registro AIR58, la combinación con cualquier inmunosupresor, incluyendo la CFM, consiguió mayores descensos en los niveles de SELENA-SLEDAI después de 6 ± 3 meses tras la infusión y un tiempo hasta la recidiva más prolongado. En la cohorte LESIMAB59 el uso concomitante de cualquier inmunosupresor distinto de la CFM se asoció a una probabilidad 3,5 veces mayor de alcanzar una respuesta clínica tras un tiempo medio de seguimiento de 20 ± 15,2 meses. En la serie de Vital et al.60, los pacientes que recibían un inmunosupresor concomitantemente obtuvieron mejores resultados que los pacientes en monoterapia, sin encontrar diferencias entre los diferentes fármacos.
El panel recomienda mantener la terapia inmunosupresora previa en aquellos pacientes con LES en los que se inicia tratamiento si se ha constatado respuesta insuficiente a los mismos (NE 4; GR C; GA 86%). Sin embargo, el panel llama la atención sobre los posibles riesgos del uso combinado con ciertos inmunosupresores, como la CFM, en cuyo caso el riesgo debería ser balanceado con la gravedad de la manifestación que se trata (NE 5; GR D; GA 93%).
En pacientes en situaciones especialmente graves también se ha usado la combinación de bolos de glucocorticoides y RTX con o sin bolos de CFM. La dosis de glucocorticoides utilizada también es variable y depende del estado del paciente.
En los ECA LUNAR y EXPLORER, la dosis de RTX se repitió a los 6 meses del tratamiento inicial y el estudio observacional de Turner-Stokes et al.61 sugiere que la repetición sistemática de dosis de RTX es más conveniente que el tratamiento a demanda. Sin embargo, y a pesar de que se ha visto que la mayoría de los pacientes con LES requiere ciclos repetidos, se ha generalizado más el uso a demanda en los pacientes que presentan una respuesta inicial. En ausencia de actividad lúpica, el panel no recomienda la administración sistemática de nuevos ciclos de RTX, salvo en pacientes con brotes particularmente graves de enfermedad, en los que un nuevo brote pudiera traer consecuencias nefastas (NE 5; GR D; GA 79%).
Utilización en situaciones específicasNefritis lúpicaEl estudio LUNAR48,50,51 comparó la eficacia de MMF y glucocorticoides en nefritis lúpica vs. su asociación con RTX. Aunque RTX no logró mejorar las medidas de desenlace clínicas, sí se registró una mayor reducción en los niveles de anti-dsADN y complemento con respecto a los pacientes del grupo control. Estudios abiertos no controlados en pacientes refractarios a inmunosupresores sí han mostrado eficacia de RTX en nefritis lúpica58,62. En el registro AIR58, de los 42 pacientes con nefritis refractarias a tratamiento convencional que recibieron RTX, el 48% alcanzó una respuesta completa y un 23% una respuesta parcial. En la serie de 164 pacientes con nefritis refractarias tratados con RTX del grupo UK-Biogeas62, el 67% consiguió alguna respuesta renal, la proteinuria mejoró en el 90% de los pacientes y el filtrado glomerular mejoró en la mitad de la cohorte. En la cohorte LESIMAB59 el 82% de los 63 pacientes con afectación renal alcanzaron respuesta renal tras el tratamiento con RTX. Finalmente, una revisión sistemática publicada en 201063 encontró que el 29% de los casos con nefritis tratados con RTX conseguían una respuesta completa y el 37%, una respuesta parcial.
Por tanto, pese a no haber demostrado un claro efecto positivo añadido al tratamiento con MMF en ensayos clínicos, el RTX puede ser un fármaco eficaz en el control de pacientes refractarios a inmunosupresores habituales, especialmente CFM y MMF (NE 2b; GR B; GA 93%).
ArtritisNo existen ensayos clínicos que evalúen específicamente la eficacia y seguridad de RTX en la artritis del LES. En la cohorte LESIMAB, el 93% de los pacientes que presentaban artritis activa al iniciar el tratamiento respondieron a RTX59. Una revisión de 100 pacientes también ha observado esta eficacia de RTX a nivel articular64. De los 36 pacientes con artritis tratados con RTX evaluados en el registro AIR, el 52% consiguió una remisión completa y el 20% una remisión parcial tras el tratamiento con RTX58. Por último, en la serie retrospectiva de 52 pacientes de García-Carrasco et al.65, el 76% de los 25 que tenían artritis intensa alcanzaron una remisión completa a los 6 meses de tratamiento. Sobre la base de estos datos procedentes de estudios abiertos, se considera que el RTX es eficaz en el tratamiento de la artritis del LES (NE 4; GR C; GA 93%).
Afectación del sistema nervioso centralLa experiencia con RTX en el neurolupus es escasa y se limita a varias series de casos publicadas. En una serie de 22 pacientes con lupus del SNC66 tratados con RTX, el 72% experimentó una rápida mejoría, mientras que en el 28% restante la enfermedad progresó o se mantuvo estable. El tipo de afectación que más mejoró fue el estado confusional agudo, seguido de la disfunción cognitiva, la psicosis y las convulsiones. En otra serie67 con 12 pacientes con neurolupus tratados con RTX se observó una mejoría en 9 de ellos (4 con mielopatía, 4 con polineuropatía y uno con polineuropatía y convulsiones). En la cohorte LESIMAB59, 11 pacientes recibieron RTX por neurolupus, observándose resultados favorables en más de un 70% de los casos. Por lo tanto, se puede utilizar RTX en pacientes con formas difusas de neurolupus, déficits cognitivos, psicosis o crisis comiciales (NE 4; GR C; GA 93%).
Afectación hematológicaSe han publicado numerosas series de casos de pacientes con citopenias, fundamentalmente trombocitopenia, tratados con RTX. En una serie retrospectiva68 de 31 pacientes con LES y trombocitopenia refractaria a esteroides e inmunoglobulinas, el 56% de los pacientes normalizaron los recuentos plaquetarios a los 6 meses de tratamiento con RTX. Otras series con menos de 10 pacientes han obtenido resultados similares54,64,65,67. En la serie de 10 pacientes de Chen et al.55, el 70% alcanzó una respuesta completa (> 50.000 plaquetas) tras recibir 4 infusiones de solo 100mg de RTX. Se ha descrito también algún caso con buena respuesta a RTX tras fallar la esplenectomía69.
El RTX es una opción válida de tratamiento en la trombocitopenia u otras citopenias refractarias a glucocorticoides, hidroxicloroquina y al menos un inmunosupresor (AZA o MMF) (NE 4; GR C; GA 93%).
Recomendación de usoEl RTX debe reservarse para pacientes con actividad moderada o grave y respuesta insuficiente, o resistentes, al tratamiento estándar con corticoides, inmunosupresores (AZA, MTX, MMF, CFM o anticalcineurínicos) y actualmente BLM (dependiendo de la manifestación de que se trate) (NE 2b; GR B; GA 93%). La necesidad de dosis relativamente altas de glucocorticoides para mantener el control de la enfermedad también puede constituir una indicación (tabla 5).
Tabla de evaluación previa a la prescripción de un fármaco biológico y control durante el tratamiento en pacientes con LES
| Antes del tratamiento | Durante el tratamiento | Suspensión del tratamiento |
| a) Aspectos clínicos:– Descartar: infección activa (incluyendo TBC), descartar infección latente TBC, cáncer, citopenia, comorbilidad relevante– Descartar contactos recientes con pacientes con TBC– Desaconsejar embarazob) Pruebas complementarias:– Hemograma, bioquímica, Ig– Serología VHB, VHC– Rx de tórax– Mantoux y retestc) Otras actuaciones:– Vacuna antineumocócica y antigripal– Valorar vacuna VHB, antimeningocócica, para Haemophilus según enfermedad de base o comorbilidadd) Evitar vacunas con gérmenes atenuados o vivos durante 30 días antes o simultáneamente a BLM | a) Aspectos clínicos– Aparición de infecciones (incluyendo TBC), cáncer, citopenia graveb) Pruebas complementarias:– Hemograma y bioquímica general mensual durante los 3 primeros meses, posteriormente cada 3-4 mesesc) Otras actuaciones:– En función de la evolución del paciente | a) Aparición de cáncer, citopenia grave u otros eventos graves relacionados con el fármacob) Suspensión temporal si infección o cirugía mayor electiva en período perioperatorioc) Valorar si embarazo o lactancia |
BLM: belimumab; Rx: radiografía; TBC: tuberculosis; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C.
En relación con la gestión del riesgo, se ha visto que el retratamiento con RTX es seguro durante al menos 6-12 meses70.
A falta de datos de farmacovigilancia específica, se recomienda seguir las indicaciones emitidas sobre gestión del riesgo del uso de RTX en otras enfermedades articulares inflamatorias crónicas (NE 5; GR D; GA 93%).
Antagonistas del factor de necrosis tumoral alfaDescripción del productoLos niveles de TNF-α sérico están muy aumentados en pacientes con LES y se correlacionan con la actividad de la enfermedad71–73. Es por ello que a priori su bloqueo pudiese ser eficaz en el tratamiento de estos pacientes.
Estudios principalesEn relación con la evidencia disponible sobre eficacia y seguridad con estos agentes en el LES, se debe señalar que los 2 únicos ECA con infliximab (IFX) y etanercept (ETN) doble ciego frente a placebo se cerraron de forma prematura74,75, por lo que actualmente los datos disponibles se basan en pequeños estudios abiertos no controlados o series de casos.
En una publicación76 que mostraba datos de 13 pacientes refractarios a la terapia estándar, 6 procedentes de un estudio abierto anterior77 y 7 de diversos centros, se observó que un ciclo de 4 infusiones de IFX junto con inmunosupresores mejoró la nefritis lúpica (iii, iv, v) en términos de mejoría > 50% de la proteinuria y estabilización de la creatinina sérica en 7 de 9 pacientes, de los que 4 continuaron estables en el tiempo (hasta 5 años) y 3 empeoraron a pesar nuevos ciclos de IFX. Los 5 pacientes con artritis entraron en remisión, aunque el tratamiento crónico mantuvo su efecto solo en 2 pacientes. En otro estudio abierto con 11 pacientes78 se constató que IFX durante 6 meses fue superior al tratamiento estándar en la mejoría del SLEDAI pero no hubo diferencias en los cambios de dosis de corticoides, SF-36, SLICC/ACR/DI, proteinuria, complemento o niveles de autoanticuerpos. Un tercer estudio abierto con IFX ha mostrado resultados muy similares a los anteriores79. Por otro lado, existen casos o series de casos sobre el uso de IFX en pacientes con afectación pulmonar o linfohistiocitosis hemofágica76,80-82.
Existen algunos casos publicados de pacientes con LES y ETN83–85. Igualmente, no existe evidencia suficiente en relación con el uso de adalimumab, certolizumab y golimumab, así como tampoco sobre el uso de anti-TNF-α para otras manifestaciones clínicas relevantes del LES.
Utilización en situaciones especiales. RecomendacionesEn pacientes con nefritis lúpica refractarios a glucocorticoides e inmunosupresores, incluyendo la CFM, AZA y MMF, así como el RTX, se puede valorar la posibilidad de un ciclo corto de anti-TNF como terapia fuera de indicación (NE 4; GR C; GA 73%).
En pacientes con LES y artritis la utilización de agentes anti-TNF podría plantearse solo en aquellos casos de fallo al tratamiento inmunosupresor estándar, así como a otras terapias biológicas (o imposibilidad de su uso) como BLM, RTX y, probablemente, ABT. En cualquier caso, su uso mantenido debería hacerse únicamente tras un cuidadoso análisis del balance riesgo/beneficio (NE 5; GR D; GA 73%).
Farmacovigilancia y gestión del riesgoEn relación con la gestión del riesgo del uso de los anti-TNF, dado el escaso volumen de pacientes y el tiempo de exposición no se pueden extraer datos concluyentes. Se han descrito casos de infecciones graves y linfoma. Igualmente, se ha observado que en el tratamiento a corto plazo con IFX se producen incrementos transitorios de autoanticuerpos pero en el largo plazo puede aumentar los niveles de anti-ADN de doble cadena76. De la misma manera, al menos hay un paciente descrito que desarrolló una trombosis venosa profunda que pudo estar en relación con la medicación, sugiriéndose que pueda ser más frecuente en casos de nefritis lúpica tipo v86.
A falta de datos de farmacovigilancia específica, se recomienda seguir las indicaciones emitidas sobre gestión del riesgo del uso de anti-TNF en otras enfermedades articulares inflamatorias crónicas (NE 5; GR D; GA 100%).
Se recomienda precaución en pacientes con síndrome nefrótico y/o proteinuria masiva (más frecuente en la nefritis lúpica tipo v), a los que se les paute un anti-TNF por el riesgo potencial de desarrollar una trombosis venosa profunda (NE 5; GR D; GA 86%).
AbataceptDescripción del productoEl ABT es una proteína de fusión formada por el dominio extracelular del CTLA-4 humano unido a un fragmento Fc de la IgG1 humana. El ABT inhibe de forma selectiva la coestimulación linfocitaria bloqueando la unión de CD80/CD86 a CD28 sin producir depleción de células T87.
Estudios principalesLa eficacia y la seguridad de ABT en pacientes con LES ha sido estudiada en ECA en 2 situaciones bien diferenciadas. Por un lado, en pacientes con manifestaciones activas extrarrenales88, y, más recientemente, en pacientes con nefritis lúpica89.
En un ECA doble-ciego y controlado con placebo88 se evaluaron la eficacia y la seguridad de ABT en pacientes con LES sin afectación renal. Se incluyó a 180 pacientes con enfermedad activa (poliartritis, serositis y lupus discoide), que fueron aleatorizados a recibir ABT 10mg/kg o placebo durante un año. Todos los pacientes recibieron prednisona (30mg/día durante un mes y posteriormente pauta descendente). No se observaron diferencias significativas en cuanto a la proporción de pacientes con nuevo brote de LES (BILAG A o B) tras iniciar el descenso de prednisona ni en ninguno de los objetivos secundarios dependientes del BILAG.
En un análisis post hoc se observó una mayor eficacia de ABT para la poliartritis (62,5 vs. 36,5%), la valoración del brote por parte del médico (82,3 vs. 63,6%) y en la proporción de pacientes sin recidiva durante los meses 10-12 en tratamiento con dosis menores de 7,5mg/día de prednisona (42,4 vs. 28,1%). El ABT demostró cierta eficacia en variables dependientes de los pacientes (SF-36, fatiga o trastornos del sueño). La frecuencia de acontecimientos adversos graves fue mayor en el grupo de ABT (19,8 vs. 6,8%).
Otro ECA doble-ciego y controlado con placebo89 evaluó la eficacia y la seguridad de ABT en 298 pacientes con nefritis lúpica activa clase iii o iv Los pacientes recibieron ABT 10mg/kg/mes durante 12 meses, o 30mg/kg/mes durante 3 meses seguido de 10mg/kg/mes durante 9 meses o placebo durante un año. Todos los pacientes recibieron MMF 1,5-3g/d y prednisona (hasta 60mg/día durante un mes, y posteriormente en pauta descendente). No se observaron diferencias significativas entre los grupos en cuanto al tiempo hasta la respuesta renal completa ni tampoco en los objetivos secundarios. En un subanálisis de los pacientes con síndrome nefrótico (n = 122), se observó una tendencia a una mayor eficacia de ABT en la reducción de la proteinuria a partir del sexto mes, manteniéndose hasta el final del estudio.
Estos resultados negativos de ABT en ECA contrastan con los datos en modelos animales, y con la experiencia clínica fuera de ensayos clínicos. Aspectos dependientes del diseño de los estudios, como su corta duración, objetivos no validados, poblaciones heterogéneas o el uso de terapias concomitantes sumamente eficaces, parecen contribuir de forma clara a los resultados negativos de estos ECA90,91. En el caso del ABT, la posible eficacia en subgrupos de pacientes con poliartritis o síndrome nefrótico sugiere al menos una cierta utilidad en determinados pacientes con LES92.
Recomendación de usoEl panel no aconseja la utilización de ABT para el tratamiento del LES, ni en sus manifestaciones renales como extrarrenales (NE 1; GR A; GA 93%).
No obstante, en pacientes con poliartritis refractaria a otras terapias, y en los que no sea posible otra opción terapéutica, el ABT puede ser de utilidad (NE 4; GR D; GA 86%).
Farmacovigilancia y gestión del riesgoA falta de datos de farmacovigilancia específica, se recomienda seguir las indicaciones emitidas sobre gestión del riesgo del uso de ABT en otras enfermedades articulares inflamatorias crónicas (NE 5; GR D; GA 100%).
TocilizumabDescripción del productoEl tocilizumab (TCZ) es un anticuerpo monoclonal humanizado dirigido contra el receptor de la IL-6. Suprime la señal IL-6 mediada por receptores membranosos y solubles de IL-693. En el LES existe un aumento de IL-6 sérica71,73,86,94–96 que se relaciona con la actividad clínica y con la concentración de anticuerpos anti-dsADN.
Estudios principalesNo existen ECA doble-ciego que demuestren la eficacia de TCZ en el tratamiento del LES. Shirota et al.97 comunicaron en 2005 los resultados de un estudio en el que se administraron infusiones de TCZ quincenales, a dosis de 2mg/kg (n=4), 4mg/kg (n=6) u 8mg/kg (n=3) durante 12 semanas a pacientes con LES, con un seguimiento posterior de 8 semanas. Observaron que el tratamiento con TCZ disminuye la activación linfocitaria, altera la homeostasis de las células T y B, bloqueando la diferenciación y/o el tráfico en pacientes con LES, y normaliza los subgrupos de células T y B anormales.
En un estudio abierto con escalada de dosis98 se evaluaron la seguridad y la eficacia de TCZ en 16 pacientes con LES moderado activo. Se administraron 7 infusiones quincenales (2mg/kg en 4 pacientes, 4mg/kg en 6 pacientes y 8mg/kg en otros 6), durante 12 semanas, con un seguimiento posterior de 8 semanas. Se observó una neutropenia relacionada con la dosis, recuperándose tras la suspensión del tratamiento. Se observaron 11 infecciones no relacionadas con la neutropenia. Hubo una mejoría en el SELENA-SLEDAI en 8 de 15 pacientes y la artritis mejoró en los 7 pacientes que la tenían basalmente, resolviéndose por completo en 4. Sin embargo, no se observó mejoría de la proteinuria en los 5 pacientes con nefropatía. Los niveles de anti-dsADN e IgG disminuyeron en los grupos de 4 y 8mg/kg, sugiriendo una acción específica del TCZ sobre las células productoras de autoanticuerpos. Aunque en AR se ha comunicado un aumento de ALT/AST y colesterol relacionado con el TCZ99,100; en este último estudio98 no se observaron cambios significativos en sus concentraciones séricas en pacientes con LES. En todos los casos se produjo una disminución significativa de volumen de sedimentación globular y proteína C reactiva.
Recomendaciones de usoEl panel propone considerar la utilización de TCZ en pacientes seleccionados con LES refractario a los tratamientos clásicos (hidroxicloroquina, glucocorticoides, AZA, MTX, ciclosporina, CFM y MMF) que no respondan o no toleren BLM y RTX (NE 4; GR C; GA 86%).
Farmacovigilancia y gestión del riesgoEn relación con la gestión del riesgo del uso de TCZ, dado el escaso volumen de pacientes y tiempo de exposición no se pueden extraer datos concluyentes. Se han descrito casos de neutropenia y se ha observado que en el tratamiento a corto plazo con TCZ se producen incrementos transitorios de transaminasas, colesterol y triglicéridos en pacientes con AR, aunque este efecto no se ha observado en LES.
A falta de datos de farmacovigilancia específica, se recomienda seguir las indicaciones emitidas sobre gestión del riesgo del uso de TCZ en otras enfermedades articulares inflamatorias crónicas (NE 5; GR D; GA 100%).
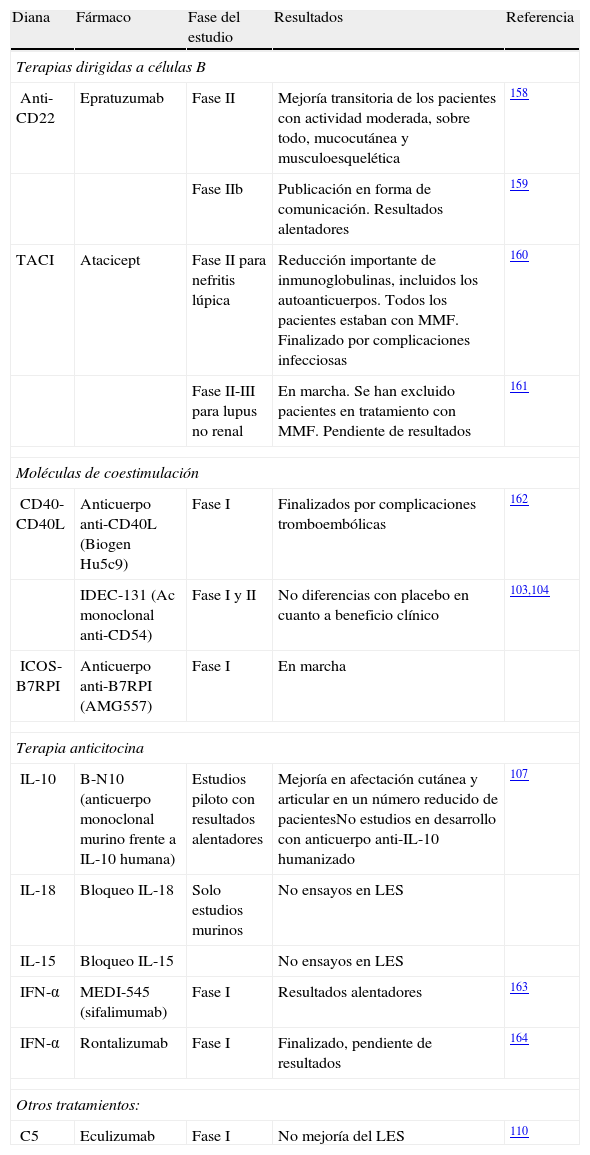
Terapias experimentalesIntroducciónOtros tratamientos actualmente en fase de desarrollo incluyen fármacos específicos frente a células B, moléculas de coestimulación, citocinas y determinadas vías de señalización intracelular. De todos ellos, cabe destacar epratuzumab, atacicept, rontalizumab y sifalimumab, anticuerpos monoclonales dirigidos frente al antígeno de superficie específico de células B CD22, TACI e interferón-alfa (IFN-α) (los 2 últimos agentes), respectivamente.
A continuación, se dará una breve explicación del mecanismo de acción de cada molécula. Los estudios disponibles con cada una de ellas se resumen en la tabla 6.
Terapias experimentales
| Diana | Fármaco | Fase del estudio | Resultados | Referencia |
| Terapias dirigidas a células B | ||||
| Anti-CD22 | Epratuzumab | Fase II | Mejoría transitoria de los pacientes con actividad moderada, sobre todo, mucocutánea y musculoesquelética | 158 |
| Fase IIb | Publicación en forma de comunicación. Resultados alentadores | 159 | ||
| TACI | Atacicept | Fase II para nefritis lúpica | Reducción importante de inmunoglobulinas, incluidos los autoanticuerpos. Todos los pacientes estaban con MMF. Finalizado por complicaciones infecciosas | 160 |
| Fase II-III para lupus no renal | En marcha. Se han excluido pacientes en tratamiento con MMF. Pendiente de resultados | 161 | ||
| Moléculas de coestimulación | ||||
| CD40-CD40L | Anticuerpo anti-CD40L (Biogen Hu5c9) | Fase I | Finalizados por complicaciones tromboembólicas | 162 |
| IDEC-131 (Ac monoclonal anti-CD54) | Fase I y II | No diferencias con placebo en cuanto a beneficio clínico | 103,104 | |
| ICOS-B7RPI | Anticuerpo anti-B7RPI (AMG557) | Fase I | En marcha | |
| Terapia anticitocina | ||||
| IL-10 | B-N10 (anticuerpo monoclonal murino frente a IL-10 humana) | Estudios piloto con resultados alentadores | Mejoría en afectación cutánea y articular en un número reducido de pacientesNo estudios en desarrollo con anticuerpo anti-IL-10 humanizado | 107 |
| IL-18 | Bloqueo IL-18 | Solo estudios murinos | No ensayos en LES | |
| IL-15 | Bloqueo IL-15 | No ensayos en LES | ||
| IFN-α | MEDI-545 (sifalimumab) | Fase I | Resultados alentadores | 163 |
| IFN-α | Rontalizumab | Fase I | Finalizado, pendiente de resultados | 164 |
| Otros tratamientos: | ||||
| C5 | Eculizumab | Fase I | No mejoría del LES | 110 |
ICOS: inducible costimulator; IFN –α: interferón-alfa; IL: interleucina; LES: lupus Eritematoso Sistémico; MMF: micofenolato de mofetilo; TACI: transmembrane activator and calcium modulator and cyclophilin ligand interactor.
El antígeno CD22 es una glucoproteína de 135 kDa que se expresa de forma restringida en los linfocitos B y participa regulando su activación e interacción con las células T101. Se expresa en el citoplasma de las células pro-B y pre-B, y en la superficie de las células B maduras. Epratuzumab es un anticuerpo monoclonal recombinante anti-CD22, con un 90-95% de origen humano. Tiene un efecto fundamentalmente inmunomodulador sobre las células B a diferencia del RTX, que es sobre todo un agente citotóxico.
AtaciceptAtacicept es una proteína quimérica de fusión del dominio extracelular del receptor Transmembrane Activator and Calcium modulator and cyclophilin ligand Interactor (TACI) unido al dominio IgG1 humano, que bloquea la estimulación de las células B dependiente de Blys y de APRIL. Estudios realizados en modelos murinos y en humanos han demostrado una marcada reducción en los niveles de inmunoglobulinas (incluyendo los autoanticuerpos) tras el tratamiento debido a su efecto sobre las células plasmáticas.
Bloqueo de señales reguladorasLas señales de coestimulación promueven la diferenciación de las células T y la proliferación y activación de las células B. Dentro de todas las vías de coestimulación conocidas, en el LES solo se ha estudiado específicamente la compuesta por CD40-CD40 ligando (CD40L o CD154) y la de B7-CD28. Los anticuerpos neutralizantes de CD40L pueden interferir con las reacciones que ocurren en los centros germinales y reducen también la activación de los linfocitos B de la zona marginal102. Se han realizado estudios en pacientes con LES finalizados prematuramente por complicaciones tromboembólicas.
Se han realizado otros 3 ensayos con IDEC-131, un anticuerpo monoclonal frente a CD154, que han incluido a un total 110 pacientes103–105 y han demostrado la seguridad y la buena tolerancia al fármaco en pacientes con LES. En cuanto a la eficacia, no alcanzó diferencias significativas respecto a placebo105.
La molécula inducible costimulator (ICOS) es una molécula específica de las células T, estructural y funcionalmente relacionada con CD28. Se induce en la superficie de las células T tras ser activadas. Transmite señales de coestimulación para las células T. ICOS y su ligando participan en la interacción entre células T y B, y en la diferenciación de estas últimas. Aunque parece una diana terapéutica prometedora en modelos murinos de lupus, no existe experiencia en humanos106. Por último, y en relación con las moléculas de coestimulación, en la actualidad hay un ensayo en fase i con el anticuerpo anti-B7RP1 (AMG557) en pacientes con LES.
Tratamientos anticitocinaAunque el papel de la IL-10 en la patogenia del LES no está del todo definido, sí parece estar implicada en la hiperactivación de las células B y la producción de anticuerpos. Se ha desarrollado un anticuerpo monoclonal murino que neutraliza la IL-10 humana (B-N10), existiendo un pequeño estudio abierto con 6 pacientes con mejoría de la actividad clínica y reducción de la dosis de prednisona. Sin embargo, este agente no ha tenido desarrollo clínico con posterioridad107.
El IFN-α es una citocina pleiotrópica esencial en la patogenia del LES108. Sus niveles están aumentados en suero en los pacientes con LES, el perfil de expresión génica de las células mononucleares de sangre periférica es dependiente de IFN-α y, por último, el suero de los pacientes con LES es capaz de inducir la maduración de las células dendríticas por un efecto dependiente también de IFN-α. Casi 2 tercios de los pacientes con LES muestran unas características comunes ligadas a IFN-α. En ratones, además, se ha demostrado su implicación en la linfopenia dependiente de células B, la diferenciación de los centros germinales y la generación de células plasmáticas. De ahí que se considere como una muy buena diana terapéutica. Hasta la fecha, se han probado 2 anticuerpos monoclonales frente a IFN-α, el sifalimumab y el rontalizumab. No obstante, resultados de un ensayo fase ii de este último agente recientemente reportados109 no parecen mostrar diferencias con respecto al placebo.
Otras dianasRecientemente, se han diseñado nuevos anticuerpos monoclonales anti-CD20 humanizados, como ofatumumab (HuMax CD20), IMMU-106 (hA20), GA-101, con alto potencial citotóxico sobre las células B. Su experiencia se limita a estudios preclínicos pero no se han probado todavía en pacientes con LES.
Por último, eculizumab es un anticuerpo que inhibe específicamente la activación terminal del complemento110.
ConclusionesAl igual que en otras enfermedades reumatológicas, los tratamientos con fármacos biológicos han irrumpido con fuerza en el LES. De hecho, el primer fármaco que ha recibido la aprobación en las últimas 5 décadas como tratamiento específico para el LES ha sido un anticuerpo monoclonal que bloquea la acción de una citocina esencial en la supervivencia y la maduración de los linfocitos B. Sin embargo, el LES, a diferencia de otros tipos de enfermedades, es una entidad especialmente heterogénea, con diferentes tipos de manifestaciones clínicas y que, por tanto, plantea enormes dificultades a la hora de realizar una evaluación estandarizada y objetiva sobre su situación clínica en un momento determinado, así como de la respuesta ante los diferentes esfuerzos terapéuticos. Todo ello ha dificultado, en muchos casos, el desarrollo de ensayos o bien ha condicionado que sus resultados resulten poco concluyentes.
Por todo lo anterior, la aprobación de BLM como terapia específica para LES ha constituido un hecho relevante en esta enfermedad y que puede marcar un punto de inflexión en su tratamiento. Sin embargo, la indicación clínica que se especifica en la ficha técnica del producto resulta un tanto indefinida y, por tanto, dificulta un posicionamiento claro de este agente en el arsenal terapéutico del LES.
El presente documento nace con el objetivo de clarificar y optimizar el uso de los fármacos biológicos en una enfermedad tan compleja como el LES. Partiendo de un análisis de la evidencia disponible un panel de expertos en el manejo de estos pacientes y de acuerdo con una metodología validada y preestablecida se han establecido por consenso unas recomendaciones de utilización de estos agentes para que puedan servir de guía en esta materia.
En primer lugar, se considera necesario que, a pesar de las limitaciones que tienen los diferentes índices de actividad clínica, se debe hacer un esfuerzo en conseguir una aplicación rutinaria de los mismos en la atención a los pacientes con LES con el objeto de lograr una utilización lo más racional posible de este tipo de fármacos, sin que ello conlleve un menoscabo del juicio clínico del médico en una situación clínica concreta.
El BLM (ya aprobado para su utilización en el LES) y el RTX son los 2 fármacos biológicos en la actualidad tienen, potencialmente, una mayor cuota de utilización en el LES. En el primer caso, su posicionamiento actual parece estar como primer agente biológico a utilizar en casos resistentes al tratamiento inmunosupresor estándar con manifestaciones clínicas no mayores, especialmente pacientes con artritis, manifestaciones cutáneas y quizá cuadros vasculíticos no críticos. La ausencia de indicación en casos graves de nefritis o afectación del SNC no debe tomarse como una contraindicación, sino como una falta de datos sobre su utilidad en estos casos. Por su parte, el RTX, y al margen de las contradicciones de la literatura ya expuestas, parece que puede ser útil en los pacientes que fracasen al tratamiento con BLM y fundamentalmente en los pacientes con manifestaciones clínicas mayores (nefritis, SNC, citopenias graves) que no hayan respondido a los inmunosupresores adecuados.
El ABT, los antagonistas del TNF-α y el TCZ constituyen opciones muy excepcionales en la actualidad. La experiencia acumulada en cualquiera de estos agentes es escasa y siempre deben quedar en segundo plano frente a los anteriores agentes biológicos ante su fallo o una posible intolerancia. El ABT puede ser especialmente efectivo en casos de artritis, los antagonistas del TNF-α podrían considerarse en casos de nefritis multirresistentes y del TCZ existen evidencias analíticas y experimentales que fundamentan su utilización en LES, pero la experiencia clínica es todavía más escasa y no se pueden establecer escenarios clínicos específicos para su indicación.
El presente documento finaliza con una descripción del futuro en el LES en el campo de los biológicos, incluyendo agentes en pleno desarrollo, como el epratuzumab, un modulador de la célula B, o los agentes anti-IFN-α o agentes dirigidos frente a otras dianas terapéuticas, como el receptor inducible ICOS, la IL-10 o la IL-17. Hoy por hoy, estos agentes no tienen papel en la práctica clínica pero abren importantes expectativas de futuro para la mejora en el tratamiento de los pacientes con esta compleja enfermedad.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesMaría Ángeles Aguirre Zamorano ha asistido a cursos/congresos patrocinada por BMS y GSK.
Jaime Calvo Alén ha asistido a cursos/congresos patrocinado por Abbott, MSD y Pfizer.
María José Cuadrado ha asistido a congresos patrocinada por GSK.
Antonio Fernández Nebro ha realizado ensayos clínicos para MSD, Pfizer, Roche y UCB, y ha asistido a cursos/congresos patrocinado por MSD, Pfizer y Roche.
María Galindo Izquierdo ha recibido becas de investigación por ≥ 5.000 €/persona/año de GSK y MSD, ha realizado ensayos clínicos para Roche y ha asistido a cursos/congresos patrocinada por Abbott, BMS, GSK, MSD y UCB.
Juan J. Gómez-Reino ha recibido becas de investigación por ≥ 5.000 €/persona/año de BMS, MSD, Roche y UCB, ha recibido honorarios por ponente por ≥ 5.000 €/persona/año de BMS, MSD, Pfizer, Roche y UCB y ha realizado ensayos clínicos para Abbott, BMS, GSK, MSD, Pfizer, Roche y UCB.
Javier López Longo ha realizado ensayos clínicos para Roche y UCB, ha tenido contratos con GSK y ha asistido a cursos/congresos patrocinado por Abbott, BMS, GSK, Roche y UCB.
Estibaliz Loza ha realizado revisión de slides y ha asistido a cursos patrocinada por Roche.
José Luis Marenco ha recibido honorarios o pagos por ≥ 5.000 €/persona/año de Abbott, MSD, Pfizer y Roche, ha dado charlas en Atención Primaria para BMS, ha realizado ensayos clínicos para Roche y ha asistido a cursos/congresos patrocinado por BMS, MSD, Pfizer y Roche.
Carmen Martínez Fernández declara no tener ningún conflicto de interés.
Víctor M. Martínez Taboada ha recibido becas de investigación por ≥ 5.000 €/persona/año de Roche y honorarios por ≥ 5.000 €/persona/año de Abbott, ha realizado ensayos clínicos para MSD, Pfizer, Roche y UCB, ha tenido contratos con Abbott, Pfizer, Roche, UCB y ha asistido a cursos/congresos patrocinado por Abbott, BMS, Pfizer, Roche y UCB.
Alejandro Olive ha recibido becas de investigación, pagos y honorarios por ponente por ≥ 5.000 €/persona/año, ha realizado ensayos clínicos y ha asistido a cursos/congresos patrocinado por Abbott, BMS, MSD, Pfizer y Roche,
José María Pego Reigosa ha recibido becas de investigación por ≥ 5.000 €/persona/año de GSK, Pfizer, Roche y UCB, ha dado charlas en Atención Primaria para MSD, ha realizado ensayos clínicos para UCB y ha asistido a cursos/congresos patrocinado por Abbott, GSK y Pfizer.
Íñigo Rúa-Figueroa ha tenido contratos con GSK y ha asistido a cursos/congresos patrocinado por GSK y MSD.
Lucia Silva-Fernández ha asistido a cursos/congresos patrocinada por Abbott, Pfizer, Roche y UCB.
Eduardo Úcar Angulo declara no tener ningún conflicto de interés.
Antonio Zea Mendoza ha recibido becas de investigación por ≥ 5.000 €/persona/año de MSD, ha realizado ensayos clínicos para Abbott, MSD, Pfizer y Roche, y ha asistido a cursos/congresos patrocinado por Abbott, BMS, MSD, Pfizer, Roche y UCB.