Chikungunya (CHIKV) es un virus RNA endémico en algunas regiones de Asia y África. En Colombia en el año 2014 inicia su dispersión de manera explosiva y rápida. La presentación del CHIKV es una condición febril con síntomas musculoesqueléticos que pueden progresar a artropatía erosiva y deformidad poliarticular. El propósito de este estudio es evaluar en pacientes aquejados por la infección por CHIKV en Neiva, Huila que acuden a la consulta de Reumatología, el comportamiento sintomático y serológico, y describir comorbilidades asociadas a la fase crónica de la enfermedad.
MétodosSe realizó un análisis observacional, longitudinal y retrospectivo, de datos recolectados en 410 pacientes aquejados por el virus CHIKV con síntomas de más de tres meses de duración que persistían con afecciones musculoesqueléticas y articulares. Los pacientes fueron clasificados según su compromiso en: artralgias postvirales, poliartritis postviral, artritis reumatoide (AR) postCHIKV, espondiloartritis postCHIKV y reumatismo de tejidos blandos. El análisis estadístico fue realizado usando SPSS software (versión 24). Se llevó a cabo análisis descriptivo para evaluar variables cuantitativas como la media (desviación estándar) y variables categóricas como la frecuencia (%). Las variables categóricas fueron comparadas usando la ecuación X2. Como significancia estadística se consideró una p < 0,05.
ResultadosDe los 410 pacientes, 89,23% fueron mujeres, con compromiso poliarticular en 92,26% de los casos. El 49,83% de los pacientes presentaban de base osteoartritis. Al momento de la evaluación en la consulta de Reumatología, 46,3% de los pacientes cursaron con artralgias no inflamatorias persistentes y 53,7% de los casos presentaban artritis al examen físico, de los cuales, de manera remarcable 20,3% cumplieron criterios para AR postCHIKV.
ConclusionesEl desarrollo de síntomas musculoesqueléticos luego de la infección por CHIKV es un problema de salud pública bastante serio, con complicaciones persistentes y riesgo de morbilidad a largo plazo en la vida real. La presencia de artritis postviral neta es de resaltar, sin embargo, el desarrollo de AR postCHIKV requiere usualmente medidas de índole farmacológico más avanzadas, incluso, en algunos casos es necesario referir a los pacientes a terapia biológica. La presencia de síntomas de insuficiencia venosa en miembros inferiores desarrollados con la infección por CHIKV, fue un hallazgo incidental que requiere de un estudio más preciso.
Chikungunya (CHIKV), is an endemic RNA virus in some regions of Asia and Africa. In Colombia in 2014, its spread starts explosively and quickly. The presentation of CHIKV is a febrile condition, with musculoskeletal symptoms, which can progress to erosive arthropathy and polyarticular deformity. The purpose of this study is to evaluate in patients suffering from CHIKV infection in Neiva, Huila who attend the Rheumatology clinic, the symptomatic and serological behavior, and to describe comorbidities associated to the chronic phase of the disease.
MethodsAn observational, longitudinal and retrospective analysis of data collected in 410 patients afflicted with the CHIKV virus, with symptoms lasting more than 3 months, who persisted with musculoskeletal and joint symptoms. The patients were classified according to their commitment in post-viral arthralgias, polyarthritis post viral, Rheumatoid Arthritis (RA) post CHIKV, Spondyloarthritis postCHIKV, and soft tissue rheumatism. The statistical analysis was performed using SPSS software (version 24). A descriptive analysis was carried out to evaluate quantitative variables such as the mean (standard deviation), and categorical variables such as frequency (%). The categorical variables were compared using the Chi-square equation. As a statistical significance, a p less than .05 was considered.
ResultsOf the 410 patients, 89.23% were women, with polyarticular involvement in 92.26% of the cases. Of the patients, 49.83% had osteoarthritis. At the time of the evaluation in the Rheumatology clinic, 46.3% of the cases presented persistent non-inflammatory arthralgias, and 53.7% of the patients underwent arthritis on physical examination, of which, remarkably, 20.3% met the criteria for rheumatoid arthritis postCHIKV.
ConclusionsThe development of musculoskeletal symptoms after CHIKV infection is a very serious public health problem, with persistent complications and long-term morbidity risk in real life. The presence of net postviral arthritis is noteworthy, however the development of postCHIKV rheumatoid arthritis usually requires more advanced pharmacological measures, including, in some cases, transition to biological therapy. The presence of symptoms of venous insufficiency in the lower limbs that developed with CHIKV infection was an incidental finding that requires a more precise study.
El virus Chikungunya (CHIKV), un arbovirus tipo RNA de la familia Togaviridae y género Alfavirus, es transmitido por el Aedes aegypti y Aedes albopictus y es endémico en regiones de África y Asia, especialmente en la India1-3. Se conoce desde 1952 con su primer brote en Tanzania, que presenta periodos interepidémicos entre cuatro y 30 años. En 2004 presenta distribución mundial, partiendo del brote generado en el Océano Indico y la India4-7, llegando al continente americano en 2013 en Saint Martin8-10, y siendo una realidad en Colombia, en el año 2014 con el primer caso importado de República Dominicana, y confirmado el 19 de julio de 2014 en Palmira, Valle, así como el primer caso autóctono el 11 de septiembre de 2014, en la vereda San Joaquín, en Mahates, Bolívar. Clásicamente la presentación del CHIKV es un cuadro febril, asociado a síntomas de origen musculoesquelético que resuelven en un 87,9%, aunque pueden dejar secuelas crónicas inflamatorias persistentes en un 5,9% de los casos11; también puede presentarse como artropatía erosiva y poliartritis deformante en un 5,6% (asociados a anticuerpos anticitrulinas [AntiCCP] positivos12). Hay una gran variabilidad en los estudios que indican que los síntomas osteomusculares asociados a CHIKV, con rangos entre 14,4 y 87,2%13-15, con aproximaciones más recientes según datos de India y La Reunión, Francia que indican que aproximadamente un 47,57% a 20 meses pueden tener síntomas persistentes14. Se ha denotado en Latinoamérica y sobre todo en Colombia, un cuadro más agresivo, y con síntomas más persistentes, tanto evidentes en la cohorte de Sucre (39 casos, 89,7% a 15 meses), Venadillo-Tolima (44,3%), y La Virginia-Risaralda (53,7%), sin embargo, sólo entre un 1,4 a 20% son enviados a valoración y seguimiento por Reumatología16-18. El objetivo de este estudio observacional, longitudinal y prospectivo es caracterizar el comportamiento sintomático de los pacientes que han cursado con infección crónica por CHIKV en un centro de atención de Reumatología en Neiva, Huila que acuden remitidos de centros primarios de atención, y definir su comportamiento serológico, así como factores de mal pronóstico para condicionamiento de patología persistente y limitante. Es el primer estudio tomado de la vida real en nuestro medio, en pacientes que se evalúan en una consulta supraespecializada y que han logrado una valoración integral.
Materiales y métodosSe logran reclutar 433 pacientes, a los cuales con financiación del Laboratorio de Investigación Humana (LIH) de la Universidad Manuela Beltrán, se les realizó la medición confirmatoria del anticuerpo IgG contra Chikungunya (KIT ELISA MyBiosource, Inc. San Diego, CA), descartando 23 pacientes que resultan negativos para la serología, y/o pacientes que son positivos, pero no tienen datos completos para su análisis, por tanto, la casuística final, resume a 410 pacientes. Para la evaluación clínica de los pacientes se realiza una exploración completa al interrogatorio con antecedentes claros, teniendo en mente las predicciones previas en estudios de otras cohortes16-18, la predominancia en mujeres mayores de 40 años con patologías articulares previas, presencia o no de menopausia, antecedentes de consumo de suplencia de calcio, antecedente de tabaquismo, y antecedentes familiares de patología reumatológica, así como examen físico detallado. Se evalúa el comportamiento de presentación del virus definiendo síntomas monoarticulares (una articulación), oligoarticulares (dos a cuatro articulaciones), y poliarticulares (más de cuatro articulaciones), la fecha de inicio de síntomas, síntomas venosos previos, antecedentes de comorbilidades de índole cardiovascular, articular o inflamatorio, tabaquismo activo o previo, antecedentes familiares de patologías reumatológicas, consumo de calcio vigente al momento de la evaluación, tratamientos recibidos previo a la evaluación de Reumatología (tanto tratamiento convencional como naturista, ampliamente usado en nuestro medio para múltiples afecciones de salud), presencia de artritis al examen clínico por reumatólogo experto. Los diagnósticos de las patologías musculoesqueléticas reumáticas en general son de diagnóstico clínico, sin embargo se utilizaron los criterios clasificatorios de ACR/EULAR 2010, en pacientes con poliartralgias persistentes y que cumplen los criterios para Artritis Reumatoide (AR), así como criterios ASAS para espondiloartritis periférica y axial (EspP y EspAx), criterios ACR/EULAR para lupus eritematoso sistémico (LES), criterios BCDJ para Enfermedad de Behcet y criterios diagnósticos de fibromialgia ACR 2010. Los pacientes con artralgias, consecuencia del proceso viral, sin signos inflamatorios fueron clasificados como artralgias postvirales, y aquellos pacientes con progreso poliarticular inflamatorio que no cumplen criterios para lograr clasificarlos como AR o alguna otra artritis específica siguiendo los criterios clasificatorios indicados previamente, se encasillaron como poliartritis postviral, así como los pacientes con dolores en tejidos blandos, con tumefacción local, o presencia de cualquier tipo de tenosinovitis, fascitis, bursitis y/o dolores localizados no inflamatorios, fueron clasificados como reumatismo de tejidos blandos (incluyendo pacientes con fibromialgia). Por último, se solicitan paraclínicos inmunológicos complementarios (según la evaluación de pertinencia del caso), reactantes de fase aguda en los pacientes con artritis clínicamente evidente, para predicción pronóstica del caso, además de variables como estudios tiroideos, tamizaje de osteoporosis y medición de 25 (OH) Vitamina D. Todos los datos fueron recopilados, tabulados, y analizados estadísticamente en SPSS versión 24.0, realizando un análisis descriptivo de cada una de las variables, así como un análisis uni y bivariado para determinar la fuerza de asociación por X2.
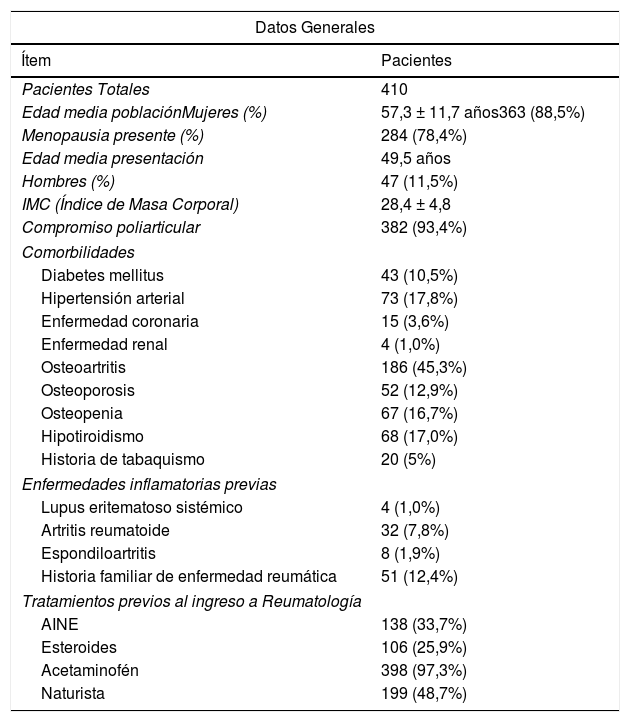
ResultadosDesde el inicio del brote epidémico del virus en la región del Huila, se decide iniciar la recolección de datos de la atención en Reumatología, en pacientes que inicialmente cumplen criterios epidemiológicos para infección por CHIKV, usando los criterios diagnósticos del INS 2015 para caso confirmado por clínica: fiebre mayor a 38°C, artralgia grave o artritis de comienzo agudo, y eritema multiforme o síntomas que no se explican por otras condiciones médicas, que resida o haya visitado un municipio con evidencia de circulación del virus CHIKV, y que además cumplan los criterios de afección crónica por el virus CHIKV establecidos por la PAHO 201519, en pacientes que acuden a nuestro servicio desde marzo de 2015 hasta la actualidad (tiempo de corte para publicación diciembre de 2019, se siguen recibiendo pacientes con afección de larga data por primera vez en consulta de Reumatología, dados temas del sistema de salud local y oportunidad de atención especializada). De un total de 410 pacientes que fueron reclutados y aceptaron participar en el seguimiento, 363 eran mujeres (88,5%, de las cuales el 78,4% cursaban estado postmenopáusico establecido) y 47 eran hombres (11,5%), con edad media de 57,3 ± 11,7 años, fecha de inicio de síntomas más predominante entre diciembre de 2014 y febrero 2015 (69% de los casos), y compromiso articular predominante poliarticular (93,4% de los casos). En la tabla 1 se denotan las comorbilidades preexistentes en los pacientes, detallando que ya algunos tienen patología inflamatoria preexistente con reagudización sintomática (7,8% con AR, 1,9% con espondiloartritis y 1,0% con LES). Cabe resaltar que el 45,3% de los pacientes tenía osteoartritis clínicamente evidente (compatible con el grupo etáreo mayor a 40 años, con mayor persistencia de enfermedad), el uso previo de esteroides orales o IM (25,9% de los casos), y de manera llamativa el extensivo uso de terapia naturista (48,7% de los casos). Las mujeres que ya se encontraban en estado menopáusico correspondían al 78,4% de los casos, con edad media de presentación de 49,5 años. El índice de masa corporal (IMC) de la cohorte total fue de 28,4 ± 4,8 kg/m2 SC.
Características de los pacientes
| Datos Generales | |
|---|---|
| Ítem | Pacientes |
| Pacientes Totales | 410 |
| Edad media poblaciónMujeres (%) | 57,3 ± 11,7 años363 (88,5%) |
| Menopausia presente (%) | 284 (78,4%) |
| Edad media presentación | 49,5 años |
| Hombres (%) | 47 (11,5%) |
| IMC (Índice de Masa Corporal) | 28,4 ± 4,8 |
| Compromiso poliarticular | 382 (93,4%) |
| Comorbilidades | |
| Diabetes mellitus | 43 (10,5%) |
| Hipertensión arterial | 73 (17,8%) |
| Enfermedad coronaria | 15 (3,6%) |
| Enfermedad renal | 4 (1,0%) |
| Osteoartritis | 186 (45,3%) |
| Osteoporosis | 52 (12,9%) |
| Osteopenia | 67 (16,7%) |
| Hipotiroidismo | 68 (17,0%) |
| Historia de tabaquismo | 20 (5%) |
| Enfermedades inflamatorias previas | |
| Lupus eritematoso sistémico | 4 (1,0%) |
| Artritis reumatoide | 32 (7,8%) |
| Espondiloartritis | 8 (1,9%) |
| Historia familiar de enfermedad reumática | 51 (12,4%) |
| Tratamientos previos al ingreso a Reumatología | |
| AINE | 138 (33,7%) |
| Esteroides | 106 (25,9%) |
| Acetaminofén | 398 (97,3%) |
| Naturista | 199 (48,7%) |
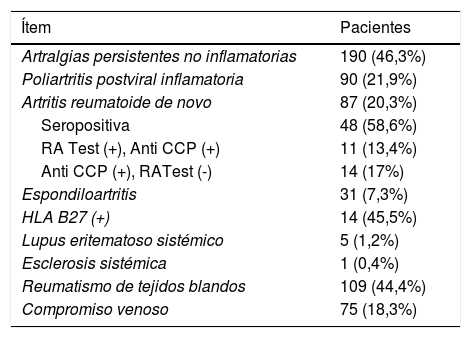
En la tabla 2 se describe el comportamiento de los pacientes, denotando que en la valoración inicial por Reumatología un 46,3% de los pacientes cumplen criterios para artralgias persistentes no inflamatorias, mientras 53,7% de los pacientes presentaban artritis al examen físico. Luego de las pesquisas paraclínicas iniciales (medición de autoanticuerpos, reactantes de fase aguda y confirmación de caso con medición de CHIKV IgG), así como la evaluación clínica por experto en Reumatología, se determina la subclasificación de dichos pacientes así: 21,9% (90 pacientes) con poliartritis inflamatoria postviral neta, 20,3% (87 pacientes) con diagnóstico de AR de novo postCHIKV (58,6% de ellos seropositivos, dentro de los cuales 11 pacientes (13,4%) tiene doble seropositividad para RA test/AntiCCP positivo, y de manera remarcable 14 pacientes (17%) fueron positivos para AntiCCP con RA test negativo); 7,3% (31 pacientes) con diagnóstico de espondiloartritis axial y/o periférica (15 pacientes con compromiso periférico, 11 pacientes con compromiso axial y cinco pacientes con desarrollo de artropatía psoriásica), con presencia de HLA-B27 positivo en 46,7%, 45,5% y 0% de los casos, respectivamente; 1,2% (cinco pacientes) que desarrollan criterios para LES, todos con compromiso articular, sin afecciones de órgano blanco y controlados con uso de cloroquina + azatioprina; y 0,4% (un paciente) que desarrolla una esclerosis sistémica con compromiso cutáneo limitado y compromiso pulmonar, requiere manejo con ciclofosfamida. Para el análisis estadístico, se realiza un modelo de regresión lineal simple en SPSS, calculando la fuerza de asociación con un intervalo de confianza del 95%, donde se pudo identificar como factores de riesgo para el desarrollo de AR postCHIKV, la presencia de anticuerpos anticitrulinas positivos (p = 0,000), PCR positiva (p = 0,000), VSG elevada (p = 0,002), así como la preexistencia de osteoartrosis (p = 0,001).
Clasificación diagnóstica al ingreso
| Ítem | Pacientes |
|---|---|
| Artralgias persistentes no inflamatorias | 190 (46,3%) |
| Poliartritis postviral inflamatoria | 90 (21,9%) |
| Artritis reumatoide de novo | 87 (20,3%) |
| Seropositiva | 48 (58,6%) |
| RA Test (+), Anti CCP (+) | 11 (13,4%) |
| Anti CCP (+), RATest (-) | 14 (17%) |
| Espondiloartritis | 31 (7,3%) |
| HLA B27 (+) | 14 (45,5%) |
| Lupus eritematoso sistémico | 5 (1,2%) |
| Esclerosis sistémica | 1 (0,4%) |
| Reumatismo de tejidos blandos | 109 (44,4%) |
| Compromiso venoso | 75 (18,3%) |
Adicionalmente, las intervenciones farmacológicas en cada grupo de pacientes, difirió según su diagnóstico indicado. Es así que los pacientes con criterios para poliartritis postviral, recibieron manejo con cloroquina en 75,5% con aceptable respuesta clínica (68 pacientes), y 24,5% (22 pacientes) requirió avance a terapia FARME en monoterapia con metotrexato; a diferencia de los pacientes con AR, que requirieron inicio de monoterapia con metotrexato en el 65,1% (56 pacientes), terapia combinada FARME metotrexato /leflunomida en el 10,5% (nueve pacientes), y de manera interesante, seis pacientes requirieron paso a terapia biológica (tres pacientes con AR de novo postCHIKV, tres pacientes con AR preexistente que luego de la infección viral fallaron a su tratamiento convencional FARME).
DiscusiónEn diciembre de 2013, la PAHO realiza una alerta epidemiológica dada las primeras detecciones del virus del CHIKV en el Continente Americano20, la cual proclamaba que el virus «llegó para quedarse». Desafortunadamente, y a pesar de las advertencias generadas, en países de la región andina, como Colombia, el mecanismo de prevención es insuficiente, lo cual ha generado una problemática de salud pública mayor, particularmente en zonas cálidas tropicales en donde ya existen otras condiciones como el dengue8,21. En Colombia, desde que se documentó el primer caso autóctono de CHIKV en la región de San Mahates, Bolívar en septiembre de 2014, la infección se instauró de manera muy rápida, teniendo registros en los primeros meses de 2015 de más de 200.000 casos confirmados. La presencia de complicaciones osteoarticulares y musculoesqueléticas han venido en aumento generando un mayor número de consultas por dolor persistente; así mismo, en muchos casos, el desarrollo de patología inflamatoria permanente, limitante e incluso en casos avanzados de carácter secuelar (referido en otras cohortes como reumatismo inflamatorio crónico postCHIKV – RIC), ha requerido una intervención avanzada en la consulta de Reumatología, y se ha logrado evidenciar que el 20,3% de pacientes con síntomas persistentes han desarrollado una AR con un comportamiento clínico muy similar a la AR convencional, y con datos muy cercanos a los encontrados previamente en La Reunión, Francia22,23, que igualmente y de manera observacional denotamos la necesidad de tratamiento agresivo, e incluso en algunos de estos pacientes, ha requerido paso a terapia biológica, teniendo en mente que la presencia inicial de anticuerpos anticitrulinas (mas no de Factor Reumatoide), PCR positiva, VSG elevada y/o historial de osteoartrosis previa, han actuado como factores de riesgo para facilitar el desarrollo de la patología inflamatoria crónica. Así mismo, el desarrollo de otras patologías como las espondiloartitis tanto axial como periférica en pacientes previamente asintomáticos (con asociación al HLA-B27 en un 45,5% de los casos), así como la aparición aislada de cinco casos de lupus eritematoso sistémico (no previamente existente) y un caso de esclerosis sistémica es de remarcar, como medida observacional de nuestra cohorte.
De manera llamativa y en concordancia con otras cohortes que evalúan la casuística de pacientes con afecciones crónicas, se ha definido la presencia de situaciones preexistentes como disparadores y perpetuadores del proceso inflamatorio, favorecidas en gran medida por la población que compromete, usualmente con comorbilidades asociadas, edad mayor a 45 años, severidad y duración de la fase inicial inflamatoria24-26. Aunque en algunas cohortes el género femenino no ha sido significantemente asociado (como en nuestro caso) como factor predisponente27-29, en nuestra cohorte la casuística corresponde en su mayoría a mujeres en etapa postmenopáusica y con síntomas articulares previos, principalmente de osteoartritis, con ausencia de ingesta de calcio, e IMC en rangos de sobrepeso a obesidad. Adicionalmente, la presencia de reumatismo de tejidos blandos (referidos también como desórdenes musculoesqueléticos postCHIKV)30, comparativamente con cohortes como la India, muestra un mayor porcentaje, lo cual permitiría sugerir una mayor susceptibilidad a la presentación de síntomas de pacientes mujeres postmenopáusicas desprotegidas de suplencia de calcio, con tendencia a sobrepeso; pero también aumenta la sospecha que existe sobre la afección de la fibra muscular promovida directamente por el virus (más evaluada en la fase aguda, aún sin clara certeza en inflamación crónica), dada la acción de IL-6, MCP-I, IL-8, MIF, GM-CSF, y activación de C3. De remarcar como particularidades observacionales de los pacientes, hay dos datos muy interesantes: 1) El desarrollo de reumatismo de tejidos blandos se encuentra en un 44,4% de los pacientes, que comparativamente con la cohorte de la India es mucho mayor (27,7%); dentro de ellas el 71,4% son mujeres en etapa postmenopáusica, 26,6% cursan con deficiencia de Vitamina D (< 30 ng/dL), y 19,5% con patología tiroidea autoinmune como perpetuador del cuadro doloroso; 2) El desarrollo de patología venosa estásica de miembros inferiores, o el empeoramiento de la condición de base se presentó en el 18,3% de los pacientes, situación no previamente descrita en otros estudios o cohortes, la cual requiere un estudio más preciso dado que no existe casuística previa con dicha mención sintomática, y que igualmente asociada al resto de síntomas se convierte en un causal de consulta y limitación para el paciente.
Conflictos de interésTodos los autores declaran no tener conflictos de interés.
Los autores agradecen a la Universidad Manuela Beltrán su apoyo con el Laboratorio de Investigación en Salud.