Evaluar las diferencias en el manejo clínico y terapéutico de la artritis reumatoide (AR) precoz y establecida en la práctica clínica.
Pacientes y métodoEstudio retrospectivo y multicéntrico en el que se incluyó a 360 pacientes con diagnóstico de AR. Mediante la revisión de historias clínicas se recogieron variables sociodemográficas, clínicas y terapéuticas en los 12 meses previos al inicio del estudio.
ResultadosSe estudió a 152 pacientes con AR precoz (ARp) y 208 con AR establecida (ARe). El 97,5% había recibido fármacos modificadores de enfermedad (FAME) y el 43,6% tratamiento anti-factor de necrosis tumoral (TNF) entre el diagnóstico y el inicio del estudio. Los anti-TNF fueron utilizados con mayor frecuencia en pacientes con ARe (el 60,1 frente al 21,1%; p<0,001). El metotrexato fue el fármaco más utilizado (70,6%). Se detectó cambio del tratamiento en un 79% de pacientes con ARp y en el 60,6% con ARe. El cambio de dosis fue la modificación más frecuente y una respuesta inadecuada el motivo más frecuente. El 25,8% de los tratamientos se suspendieron por reacciones adversas. La disminución media±desviación estándar del DAS28 fue 0,9±1,5 en ARp y 0,2±1,0 en ARe. El 35,8% de las ARp presentó buena respuesta EULAR, mientras sólo el 16,2% de las ARe (p<0,001). La determinación del factor reumatoide y la valoración de la progresión radiológica fueron más solicitadas en la ARp (p<0,05).
ConclusionesLos reumatólogos españoles utilizaron agentes biológicos con mayor frecuencia en los pacientes con enfermedad más evolucionada, ajustándose a las recomendaciones de las principales guías de práctica clínica.
To assess the differences in the clinical and therapeutic management of early and established rheumatoid arthritis (RA) in clinical practice.
MethodsRetrospective and multicentre study including 360 patients diagnosed with RA. During the 12 months prior to the study, onset, sociodemographic, clinical and therapeutic data were collected by clinical chart review.
ResultsA total of 152 patients with early RA and 208 with established RA were studied. 97.5% had received disease-modifying anti-rheumatic drugs (DMARDs) and 43.6% a TNFa blocker between the diagnosis and the start of the study. Established RA patients used TNFa blockers more frequently than early RA patients (60,1% vs 21,1%, p<0,001). Methotrexate was the most commonly used drug (70.6%). A treatment change was seen in 79% of patients with early RA and 60.6% of those with established RA. A dose change was the most frequent modification and an inadequate response the most frequent reason. A 25.8% of treatments were stopped due to adverse events. The mean (SD) decrease on DAS28 score was 0.9 (1.5) on early RA and 0.2 (1.0) on established RA patients. A 35.8% of early RA patients showed a good EULAR response, while only 16.2% among established RA patients (p<0.001). Rheumatoid factor and radiological progression assessment were the most requested determinations in early RA (p<0.05).
ConclusionsSpanish rheumatologists used biological drugs with a higher frequency in patients with more advanced disease, as recommended in the main clinical practice guidelines.
La artritis reumatoide (AR) es una enfermedad sistémica de origen autoinmune. Su carácter crónico y progresivo provoca un gran impacto en la calidad de vida del paciente, que viene derivado de la discapacidad funcional y una disminución de la esperanza de vida1. Su prevalencia en España en la población mayor de 20 años es del 0,5%2. La AR afecta más a mujeres que a varones (3:1) y aparece con más frecuencia entre la cuarta y sexta décadas de la vida3. Su repercusión socioeconómica es muy elevada. Los costes de la AR en el año 2001 en España alcanzaron los 2.250 millones de euros. El 70% correspondían a costes directos y el 30% a costes indirectos4. Los costes intangibles, consecuencia del deterioro de la calidad de vida de estos pacientes y de su consecuente repercusión familiar y social, son más difíciles de cuantificar. Se calcula que el 5% de las bajas laborales en nuestro país se debe a la AR4–6.
Los objetivos terapéuticos actuales se basan en el tratamiento sintomático del dolor y la inflamación, asociado a un tratamiento de fondo que modifique la progresión, retrase el daño estructural y mejore la calidad de vida del paciente con AR7,8. La mayoría de las guías y los consensos recomiendan iniciar el tratamiento con fármacos modificadores de la enfermedad de acción lenta (FAME) tan pronto como se establezca el diagnóstico7,9,10. Aún así, cada centro puede aplicar modificaciones propias por motivos asistenciales o de gestión. Incluso, en ocasiones, parece que la experiencia y el manejo adaptado a las características y la evolución de cada caso podrían imponerse en el abordaje del paciente.
El objetivo de este estudio fue conocer el manejo clínico y terapéutico de la AR en España (estudio ARES) en consultas de reumatología en condiciones de práctica clínica habitual. Para ello, se han evaluado los tratamientos empleados, así como sus modificaciones a lo largo del tiempo diferenciando entre pacientes con AR precoz (ARp) y pacientes con AR establecida (ARe).
Pacientes y métodosSe realizó un estudio observacional, retrospectivo, multicéntrico, en condiciones de práctica clínica habitual, en el que se revisaron las historias clínicas (HHCC) de pacientes con AR en un marco temporal de 1 año (los 12 meses previos a la fecha de inclusión de cada paciente). La revisión de las HHCC del estudio ARES se llevó a cabo durante el primer semestre del año 2007.
Las HHCC elegidas correspondían a pacientes con AR seleccionados mediante reclutamiento consecutivo entre aquellos pacientes de ambos sexos, mayores de 18 años, que acudían a la consulta del reumatólogo. Cada investigador debía incluir a 4 pacientes con ARp y otros 4 con ARe. Se definió ARp como aquella forma de artritis reumatoide con tiempo de evolución ≤ 2 años y ARe aquellas con una evolución > 2 años. Todos los pacientes incluidos firmaron un consentimiento de aceptación a participar en el estudio antes de su inicio. El estudio había sido previamente aprobado por el comité de bioética de referencia y, posteriormente, por todos los centros participantes.
Se registraron las siguientes variables sociodemográficas y clínicas basales: sexo, edad, antecedentes familiares de enfermedad reumática, fechas de inicio de los síntomas y diagnóstico de AR, y antecedentes de intervenciones quirúrgicas relacionadas con la enfermedad. Se recogieron, además, datos relativos a las visitas realizadas por el reumatólogo durante el año anterior a la fecha de inclusión en el estudio: actividad asistencial (número de visitas), evolución de la AR y manejo clínico-terapéutico de la enfermedad.
Igualmente, se registraron todos los tratamientos utilizados para el control de la AR durante el año previo a la fecha de inclusión, así como el tratamiento en la última visita del período estudiado. Los tratamientos de fondo se agruparon por familia terapéutica y principio activo de manera que quedaron codificados en 3 grupos: FAME, fármacos neutralizantes del factor de necrosis tumoral (antagonistas del TNF o anti-TNF) y otros.
Se analizaron todos los tratamientos recibidos durante la evolución de la enfermedad, los del último año y los recibidos en la última visita. Para este análisis, se consideró el tiempo transcurrido hasta la modificación del tratamiento, definiendo modificación de tratamiento como cualquier cambio, tanto de pauta como de dosis. Asimismo, se recogieron los motivos de finalización según el grupo terapéutico. En este análisis, se definió sustitución como cualquier cambio en el principio activo. Para analizar el tiempo de duración de cada uno de los tratamientos se realizó un análisis de supervivencia por el método de Kaplan-Meier.
Se analizaron las medidas asistenciales y de seguimiento tomadas a lo largo del año, así como la evolución de la actividad de la AR según los criterios de respuesta EULAR11. Dicha evolución se valoró en función del tratamiento recibido por el paciente en la última visita del período de revisión.
El tamaño muestral se calculó de forma que permitiera evaluar el manejo clínico y terapéutico de la AR, con una proporción (p) de 0,50, una precisión del 7% y un nivel de significación del 0,05. La muestra teórica de pacientes fue de 196 por cada grupo, es decir, de 392 pacientes en total. El análisis estadístico se realizó para el conjunto de la muestra global y de forma estratificada según el diagnóstico fuera ARp o ARe. Se realizó un análisis descriptivo de las variables sociodemográficas y clínicas de la muestra, y un análisis comparativo de las éstas entre los dos grupos de estudio, mediante las pruebas ANOVA y de la t de Student para las variables continuas y mediante la prueba de la χ2 para las variables categóricas. En todas las pruebas se consideró significativa una p<0,05. Los resultados se analizaron mediante el paquete estadístico SAS versión 8.02 para Windows®.
ResultadosCaracterísticas sociodemográficas y clínicas de la muestraLa muestra final la constituyeron un total de 360 pacientes, de los que el 42,2% (152) presentaban ARp y el 57,8% (208) ARe. La tabla 1 muestra las características demográficas y clínicas basales de la muestra, total y estratificada por tipos de AR. La mediana del tiempo de evolución de la ARp fue de 1 año y de 5 años en la ARe (p<0,001). El tiempo entre el inicio de los síntomas y el diagnóstico fue también menor en el grupo de ARp (p<0,001).
Características demográficas y clínicas basales de la población.
| ARp | ARe | Total | p | |
| Sexo | n (%) | n (%) | n (%) | 0,36 |
| Varón | 34 (22,4) | 55 (26,5) | 89 (24,7) | |
| Mujer | 118 (77,6) | 152 (73,1) | 270 (75,3) | |
| Total | 152 (100) | 208 (100) | 360 (100) |
| Media±DE | Media±DE | Media±DE | ||
| Edad (años) | 52,4 (15,8) | 55,2 (13,8) | 54,0 (14,7) | 0,08 |
| Mediana (P25-P75) | Mediana (P25-P75) | Mediana (P25-P75) | ||
| Tiempo evolución AR (años) | 1 (0-1) | 5 (3-11) | 2 (1-6) | < 0,001 |
| Tiempo inicio síntomas (años) | 1 (1-1) | 6 (3,5-11,5) | 2 (1-7) | < 0,001 |
| Tiempo entre inicio síntomas y diagnóstico AR (años) | 0,3 (0,2-0,5) | 0,5 (0,3-1,0) | 0,3 (0,2-0,8) | < 0,001 |
| Antecedentes familiares | n (%) | n (%) | n (%) | 0,22 |
| Sin antecedentes | 121 (79,6) | 181 (87,1) | 302 (83,9) | |
| AR | 18 (11,8) | 15 (7,2) | 33 (9,2) | |
| Artrosis | 6 (3,9) | 4 (1,9) | 10 (2,8) | |
| Osteoporosis | 3 (2,0) | 5 (2,4) | 8 (2,2) | |
| Poliartritis | 1 (0,7) | 1 (0,5) | 2 (0,6) | |
| Lupus | 1 (0,7) | 2 (1,0) | 3 (0,8) | |
| Síndrome de Sjögren | 0 (0,0) | 3 (1,4) | 3 (0,8) | |
| Otros antecedentes | 5 (3,3) | 2 (1,0) | 7 (1,9) |
AR: artritis reumatoide; ARp: artritis reumatoide precoz; ARe: artritis reumatoide establecida; DE: desviación estándar.
Los datos se presentan como número de pacientes (n) y porcentajes (%), y como medias o medianas (percentil 25-percentil 75).
El 16,1% de los pacientes presentaba antecedentes de otras enfermedades reumáticas. Un dato interesante es que el 9,2% de la muestra total tenía antecedentes familiares de AR; este porcentaje fue mayor en el grupo de ARp (el 11,8 frente al 7,2% en ARe), aunque esta diferencia no resultó significativa.
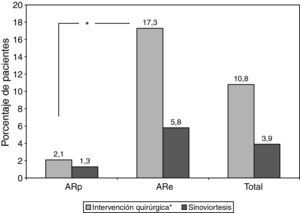
El 13,3% de pacientes requirieron cirugía o sinoviortesis durante la evolución. Considerando los resultados por grupos, el 3,3% de los pacientes con ARp se sometió a cirugía o sinoviortesis en algún momento, mientras que el porcentaje de pacientes con ARe fue del 20,7% (fig. 1). Las diferencias observadas entre los pacientes intervenidos quirúrgicamente entre ambos grupos resultaron significativas (p<0,001).
Distribución de pacientes según presentaran o no antecedentes de cirugía y/o sinoviortesis en función del tipo de AR.
AR: artritis reumatoide; ARp: artritis reumatoide precoz; ARe: artritis reumatoide establecida.
Los datos se presentan en porcentaje (%) de pacientes.
*Intervención quirúrgica: p<0,001 entre ambos grupos: ARp frente a ARe.
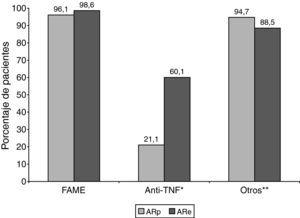
Todos los pacientes habían recibido en algún momento algún tratamiento para el control de la AR. Un 97,5% (351) de los pacientes había recibido tratamiento con FAME; un 43,6% (157) habían sido tratados con anti-TNF y un 91,1% (328) con otros tipos de tratamiento; existiendo diferencias en la proporción de pacientes que siguieron tratamiento con antagonistas del TNF (p<0,001) o con otros tratamientos (p=0,04) según el tipo de AR (fig. 2).
Distribución del tratamiento de fondo para la AR durante la evolución de la enfermedad en función del tipo de AR.
AR: artritis reumatoide; ARp: artritis reumatoide precoz; ARe: artritis reumatoide establecida; FAME: fármacos modificadores de la enfermedad de acción lenta; anti-TNF: antagonistas del factor de necrosis tumoral alfa.
*p<0,001; ** p=0,04; ARp frente a ARe.
En la tabla 2 se muestran los tratamientos seguidos durante el año previo hasta la fecha de inclusión. Entre los pacientes con ARp, la proporción que recibía más de un FAME al mismo tiempo fue un 8% mayor que en la ARe, mientras que el porcentaje de pacientes tratados con anti-TNF fue un 35,1% superior en el grupo de ARe (p<0,001). Los principios activos más utilizados (≥ 10%) fueron: metotrexato (70,6%), prednisona (33,3%), etanercept (30%), leflunomida (29,4%), deflazacort (28,3%), indometacina (17,8%), diclofenaco (13,6%) y adalimumab (10,0%). En cuanto al tratamiento actual, un 59,4% estaba en tratamiento con metotrexato, un 27,8% con etanercept, un 25,8% con prednisona, deflazacort (23,1%), leflunomida (20,8%), indometacina (14,2%) y diclofenaco (11,7%); otros principios activos eran utilizados por menos del 10% de los pacientes.
Tratamiento recibido durante el último año y tratamiento actual en función del tipo de AR.
| En el último año | Tratamiento actual | |||||||
| ARp n (%) | ARe n (%) | p | Total n (%) | ARp n (%) | ARe n (%) | p | Total n (%) | |
| Tratamientos recibidos | 151 (99,3) | 207 (99,5) | 358 (99,4) | 147 (96,7) | 205 (98,6) | 352 (97,8) | ||
| FAME | 143 (94,1) | 166 (79,8) | 0,05 | 309 (85,8) | 131 (86,2) | 154 (74,0) | 0,005 | 285 (79,2) |
| 1 FAME | 87 (60,8) | 113 (68,1) | NS. | 200 (64,7) | 101 (77,1) | 131 (85,1) | NS | 232 (81,4) |
| 2 FAME | 45 (31,5) | 45 (27,1) | 0,08 | 90 (29,1) | 24 (18,3) | 19 (12,3) | 0,05 | 43 (15,1) |
| 3 FAME | 8 (5,6) | 7 (4,2) | NS | 15 (4,8) | 6 (4,6) | 4 (2,6) | NS | 10 (3,5) |
| > 3 FAME | 3 (2,1) | 1 (0,6) | NS | 4 (1,3) | – | – | – | – |
| Antagonistas del TNF | 31 (20,4) | 124 (59,6) | < 0,001 | 155 (43,1) | 30 (19,7) | 114 (54,8) | < 0,001 | 144 (40,0) |
| Otros | 139 (91,4) | 176 (84,6) | 0,05 | 315 (87,5) | 121 (79,6) | 160 (76,9) | NS | 281 (78,1) |
AR: artritis reumatoide; ARp: artritis reumatoide precoz; ARe: artritis reumatoide establecida; FAME: fármacos modificadores de la enfermedad de acción lenta; NS: no significativo; TNF: factor de necrosis tumoral.
Los datos se presentan como número de pacientes (n) y porcentajes (%).
En 7 de cada 10 pacientes se produjo algún cambio en el tratamiento de fondo, entendiendo como tal todo cambio de pauta, de dosis o de principio activo (tabla 3). Esta proporción fue superior en los pacientes con ARp respecto a aquellos con ARe (el 78,9 y el 60,6%, respectivamente; p<0,001). El tipo de cambio más frecuente fue el cambio de dosis (36,4%) y el motivo, una respuesta parcial o falta de respuesta (46,7%).
Cambios en el tratamiento de fondo para la enfermedad durante el año de seguimiento en función del tipo de AR.
| ARp n (%) | ARe n (%) | Total n (%) | p | |
| Sí cambios de tratamiento | 120 (78,9) | 126 (60,6) | 246 (68,3) | < 0,001 |
| Tipo de cambio* | ||||
| Cambio de fármaco | 41 (27,0) | 46 (22,1) | 87 (24,1) | NS |
| Cambio de dosis | 59 (38,8) | 72 (34,6) | 131 (36,4) | NS |
| Cambio de pauta | 10 (6,6) | 26 (12,5) | 36 (10,0) | 0,06 |
| Otro tipo de cambio | 71 (46,7) | 50 (24,0) | 121 (33,6) | < 0,001 |
| Motivos del cambio* | ||||
| Reacciones adversas | 21 (13,8) | 31 (14,9) | 52 (14,4) | NS |
| Respuesta parcial /no respuesta | 89 (58,6) | 79 (38,0) | 168 (46,7) | < 0,001 |
| Otros motivos | 40 (26,3) | 53 (25,5) | 93 (25,8) | NS |
AR: artritis reumatoide; ARp: artritis reumatoide precoz; ARe: artritis reumatoide establecida; NS: no significativo.
Los datos se presentan como número de pacientes (n) y porcentajes (%).
La mediana de tiempo transcurrido entre la instauración de un tratamiento y la finalización de éste por retirada, sustitución o cambio de principio activo fue, en el caso de los FAME (2,3 años; intervalo de confianza [IC] del 95%, 2,0-3,0) inferior al de los antagonistas del TNF (3,6 años; IC del 95%, 3,0-4,5) y al del resto de los tratamientos (4,9 años; IC del 95%, 3,7-8,7). Respecto a los motivos de finalización, se observó falta de efectividad en un 60,4% (464) de los tratamientos y en un 25,8% de los casos (198) el tratamiento se suspendió por reacciones adversas.
Actividad asistencial en el seguimiento de la artritis reumatoideRespecto al número de visitas al reumatólogo, se registraron un total de 1.419; 42,8% (607) correspondientes al grupo de ARp y un 57,2% (812) al de ARe. El 85,8% (309) de los pacientes realizó entre 3-5 visitas al año, lo que supone una media±desviación estándar (DE) de 3,9±1,1 visitas-año, y no se observaron diferencias entre los dos grupos. El principal motivo de visita fue el control programado de la enfermedad (tabla 4). Las determinaciones de la velocidad de sedimentación globular (VSG) y la proteína C reactiva (PCR) fueron las pruebas más solicitadas y la valoración del DAS de 3 variables y del cuestionario HAQ las menos solicitadas. Cabe señalar que el DAS28 se recogió en 6 de cada 10 visitas y que sólo se apreciaron diferencias entre los pacientes con ARp y ARe en la determinación del factor reumatoide y en la valoración de la progresión radiológica; ambas pruebas se solicitaron con más frecuencia en los pacientes con ARp (p<0,05).
Actividad asistencial: motivo de la visita y proporción de pacientes en los que se han realizado exploraciones para la AR en el último año.
| ARp, n (%) | ARe, n (%) | Total, n (%) | p | |
| Motivo de la visita* | ||||
| Control programado | 556 (91,6) | 779 (95,9) | 1.335 (94,1) | < 0,001 |
| Complicaciones de la AR | 10 (1,6) | 9 (1,1) | 19 (1,3) | NS |
| Administración de tratamiento | 10 (1,6) | 38 (4,7) | 48 (3,4) | 0,002 |
| Otros motivos | 41 (6,8) | 25 (3,1) | 66 (4,7) | 0,001 |
| Pruebas realizadas* | ||||
| VSG | 141 (92,8) | 201 (96,6) | 342 (95,0) | NS |
| PCR | 145 (95,4) | 199 (95,7) | 344 (95,6) | NS |
| Factor reumatoide | 129 (84,9) | 156 (75,0) | 285 (79,2) | 0,02 |
| DAS28 | 98 (64,5) | 130 (62,5) | 228 (63,3) | NS |
| DAS de 3 variables | 20 (13,2) | 15 (7,2) | 35 (9,7) | 0,06 |
| Presencia nódulos reumatoides | 114 (75,0) | 150 (72,1) | 264 (73,3) | NS. |
| Valoración progresión radiográfica | 94 (61,8) | 104 (50,0) | 198 (55,0) | 0,03 |
| Cuestionario HAQ | 63 (41,4) | 77 (37,0) | 140 (38,9) | NS |
AR: artritis reumatoide; ARp: artritis reumatoide precoz; ARe: artritis reumatoide establecida; DAS: índice de actividad de la enfermedad (Disease Activity Score); HAQ: cuestionario de calidad de vida (Health Assessment Questionnaire); NS: no significativo; PCR: proteína C reactiva; VSG: velocidad de sedimentación globular.
Los datos se presentan como número de pacientes (n) y porcentajes (%).
La tabla 5 muestra la evolución de la actividad de la enfermedad según el tipo de AR. Así, vemos que los pacientes con ARp presentan una disminución media±DE en los valores del DAS28 de 0,9±1,5 durante el estudio frente a una variación de 0,2±1,0 en los pacientes con ARe (p<0,001). El porcentaje de pacientes con buena respuesta EULAR fue mayor en los individuos con ARp (35,8%) respecto a los sujetos con ARe (16,2%) (p<0,001). Si consideramos sólo a los pacientes en tratamiento con antagonistas del TNF, también se apreciaron diferencias entre ambos grupos en cuanto a que la mejoría fuera excelente o buena (p<0,001).
Evolución de la actividad de la enfermedad en función del tipo de AR.
| ARp | ARe | Total | p | |
| Diferencia DAS28*(media±DE) | 0,9±1,5 | 0,2±1,0 | 0,5±1,3 | < 0,001 |
| Cambios del DAS28**, n (%) | < 0,001 | |||
| Mejoría nula/no mejoría | 36 (44,4) | 77 (69,4) | 113 (58,9) | |
| Moderada | 16 (19,8) | 16 (14,4) | 32 (16,7) | |
| Buena/excelente | 29 (35,8) | 18 (16,2) | 47 (24,5) | |
| Total | 81 (100) | 111 (100) | 192 (100) | |
| Cambios del DAS28 en pacientes con anti-TNF**, n (%) | < 0,001 | |||
| Mejoría nula /no mejoría | 8 (44,4) | 36 (80,0) | 44 (69,8) | |
| Moderada | 5 (27,7) | 6 (13,3) | 11 (17,5) | |
| Buena/excelente | 5 (27,7) | 3 (6,7) | 8 (13,7) | |
| Total | 18 (100) | 45 (100) | 63 (100) | |
AR: artritis reumatoide; ARp: artritis reumatoide precoz; ARe: artritis reumatoide establecida; DAS: índice de actividad de la enfermedad (Disease Activity Score); DE: desviación estándar; TNF: factor de necrosis tumoral.
Los datos se presentan como número de pacientes (n) y porcentajes (%), y como medias±desviación estándar.
El presente estudio pretende reflejar la realidad en cuanto al manejo clínico-terapéutico del paciente con AR en las consultas de reumatología de nuestro entorno. Para ello, cuenta con una muestra considerable de pacientes; incluso se puede llevar a cabo un análisis estratificado en función del tipo de AR, bien sea precoz o establecida.
En relación con las características demográficas de la muestra, hay que señalar que presenta unas características generales acordes con los datos epidemiológicos recogidos en la literatura científica2. Sin embargo, sorprende que el subgrupo de pacientes con ARp presentara una media de edad similar al conjunto global. La elevada media de edad observada en el grupo precoz nos hace pensar que probablemente existe cierto retraso en el diagnóstico o en la derivación al especialista. El porcentaje de pacientes con antecedentes familiares de AR en nuestro estudio fue elevado. Conviene resaltar el mayor porcentaje de pacientes con ARp y antecedentes familiares respecto a la ARe, por lo que es posible que exista una mayor concienciación sobre este aspecto en la anamnesis del paciente con ARp.
La práctica totalidad de los pacientes incluidos había recibido algún tratamiento durante el año evaluado y más del 95% estaban en tratamiento en el momento actual. Se observó una mayor proporción de pacientes con ARp en tratamiento con FAME respecto a los sujetos con ARe. Actualmente, los principales consensos recomiendan iniciar tratamiento con FAME en los 3 meses siguientes al diagnóstico7,9. En este sentido, el mayor uso de FAME en ARp obtenido en nuestra serie se ajusta a las recomendaciones establecidas por la Sociedad Española de Reumatología, según las cuales es necesario el tratamiento con al menos un FAME convencional, preferiblemente metotrexato, en monoterapia o terapia combinada, en escalada rápida de dosis hasta 20mg en 2-3 meses, salvo aparición de toxicidad7,9,10,12,13.
Sin embargo, la eficacia de los FAME sobre la progresión radiológica sigue siendo muy debatida, debido en parte a las diferentes técnicas empleadas para la evaluación del daño articular14. El problema de la duración de la terapia con FAME se ha abordado en distintos estudios que demuestran que la suspensión después de la remisión se acompaña de una reagudización de la enfermedad15. El riesgo de toxicidad, unido al bajo porcentaje de pacientes que alcanzan la remisión16, podría explicar en parte el hecho de que a los 5 años de tratamiento sólo un 40% de los pacientes tratados con metotrexato sigue tomando la medicación y el porcentaje es aún menor con otros FAME.
En los últimos años, los antagonistas del TNF han mostrado ser eficaces en más de la mitad de los pacientes con AR en los que había fracasado previamente el tratamiento convencional y han mostrado que pueden incluso inducir la remisión de la afección17,18. El hecho de que en nuestro estudio se observe que el tratamiento con anti-TNF se emplee con más frecuencia en los pacientes con ARe refleja que el manejo de los reumatólogos en España se ajusta a lo que establecen las principales guías terapéuticas actuales. Nuestros hallazgos son similares a los datos recientemente publicados del estudio CORRONA19. En dicha cohorte, aproximadamente un tercio de los pacientes con AR recibían tratamiento anti-TNF, 40% de ARe frente a un 25% de ARp19, mientras en nuestro estudio estos porcentajes se situaron en el 55 y el 20%, respectivamente. Es posible que la financiación total de estos tratamientos en nuestro sistema sanitario favorezca también un uso mayor de las terapias biológicas.
Sin embargo, Van der Heijde et al20 demostraron que el mayor daño estructural se produce en los dos primeros años desde el inicio de los síntomas. Si a ello añadimos que el paciente con AR activa presenta una concentración elevada de TNF en el líquido sinovial, podría justificarse la prescripción de fármacos anti-TNF a pacientes con ARp y la instauración de un tratamiento intensivo lo antes posible21,22. El estudio COMET23,24 pone de manifiesto la eficacia del tratamiento con anti-TNF como fármacos de primera línea en combinación con metotrexato, consiguiendo porcentajes de remisión del 50% en pacientes con ARp en el primer año. El estudio BeSt ha puesto también de manifiesto que es posible mantener la remisión incluso una vez retirado el tratamiento biológico25.
Respecto a la frecuencia y los cambios de tratamiento, el grupo con ARp presentó una mayor proporción de cambios, probablemente motivado por un planteamiento más exigente para alcanzar la remisión clínica de forma temprana.
En relación con el número de visitas realizadas a los pacientes para el seguimiento y el control de la AR, éstas fueron más frecuentes en los pacientes con ARe y eran acordes con las recomendaciones actualmente preconizadas7,26,27. Sin embargo, las visitas debidas a complicaciones y otros motivos fueron más frecuentes en la ARp respecto a las realizadas en la ARe. Las determinaciones más solicitadas en este grupo de pacientes fueron la VSG y la PCR, en más del 90% de las visitas y, posteriormente, el factor reumatoide y la valoración de la presencia de nódulos reumatoides.
En la AR existen muchos criterios de respuesta que permiten evaluar la evolución de la enfermedad28. Los criterios EULAR11,20,29 definen la respuesta (buena, moderada y ausente) según ciertos puntos de corte para los valores absolutos y los cambios relativos en el DAS. Los pacientes con mejoría en la ARe alcanzan sólo el 30,6%, mientras que los de ARp superan el 50%. Estas diferencias podrían tener su explicación en la relación existente entre la inflamación y la discapacidad en las fases más tempranas de la enfermedad.
El presente estudio presenta algunas limitaciones. En primer lugar, su diseño retrospectivo realizado mediante la revisión de HHCC. Es probable que el investigador no cuente con toda la información, por lo que podría existir un sesgo de registro. Sin embargo, y con objeto de minimizar este tipo de sesgo, se optó por seleccionar HHCC de pacientes que acudían regularmente a consulta y cumplían con los criterios establecidos por protocolo. De este modo, se contaba con la colaboración del paciente y la posibilidad de entrevistarlo para el registro de variables que estuvieran ausentes en la HHCC. En segundo lugar, hubiera sido deseable que algunas variables pudieran relacionarse con los diferentes tipos de tratamiento. Sin embargo, y dado el tamaño de nuestra muestra y la gran variedad de posibilidades terapéuticas, se hubiesen generado numerosos grupos minúsculos que dificultarían el análisis final, por lo que se optó por crear grupos mayores de tratamiento que permitieran una interpretación más general de los resultados. Por otro lado, no se documentó de forma específica la determinación de antipéptidos cíclicos citrulinados al no ser un marcador que se determine de forma sistemática en la práctica clínica en pacientes con AR. Además, para evaluar la actividad asistencial en cada una de las cohortes de estudio hubiera sido interesante disponer de los datos de remisión clínica de los pacientes, aunque este dato no se recogió de forma sistematizada durante el estudio.
En resumen, podríamos concluir que los reumatólogos españoles se ajustan a las recomendaciones de las principales guías de práctica clínica en cuanto al manejo clínico-terapéutico del paciente con AR. La distribución de tratamientos en función del tipo de AR refleja una correcta aplicación de la escala de tratamientos actualmente recomendada.
FinanciaciónEste trabajo se ha realizado con el patrocinio y el apoyo de Wyeth-Farma, S.A.
Conflictos de interesesE. Marced es gerente médico para el área de reumatología del Departamento Médico de Wyeth-Farma. El resto de los autores no presentan conflicto de intereses en relación con el presente estudio.
Hospital de Basurto; Hospital de Bellvitge; H. Central de Asturias; Hospital Central de la Defensa Gómez Ulla; Clínica Girona; Hospital Clínico Lozano Blesa; Hospital Comarcal Alt Penedés; Hospital Comarcal de Melilla; Hospital Donostia; Hospital de El Escorial; Hospital de Elda; Hospital de Figueras; Hospital de Fuenlabrada; Hospital de Galdakao; Hospital General de Castellón; Hospital General de Ciudad Real; Hospital General de la Palma; Hospital General de Vic; Centro Médico de Especialidades Grande Covián; Hospital Insular de Gran Canaria; Hospital de Jerez; Hospital La Fe; Hospital de Llerena/Hospital de Zafra; Hospital de la Marina Baixa; Hospital Marqués de Valdecilla; Hospital Meixoeiro; Hospital de la Merced de Osuna; Hospital Morales Meseguer; Hospital Nuestra Señora del Prado; Hospital Nuestra Señora de Sonsoles; Hospital Nuestra Señora de Valme; Hospital d’ Ontinyent Xàtiva; Hospital de Palamós; Hospital POVISA; Hospital La Princesa; Hospital Provincial de Córdoba; Hospital Puerta del Mar; Hospital de la Ribera; Hospital de Sagunto; Hospital San Pedro de Alcántara; Hospital San Rafael; Hospital Santa María del Rosell; Hospital de Torrecárdenas; Hospital Vall d’Hebrón; Hospital Virgen de la Concha; Hospital Virgen de la Macarena; Hospital Virgen de la Salud; Hospital Virgen del Puerto; Hospital Virgen del Rocío.