Paciente de 33 años, con antecedentes de lupus eritematoso sistémico que consulta por disnea progresiva de moderados esfuerzos acompañada de dolor torácico derecho de características pleuríticas. En la radiografía simple de toráx se evidenció elevación del hemidiafragma derecho. Se discute a continuación el abordaje diagnóstico y terapéutico de la paciente.
A 33-year-old woman with a previous history of systemic lupus erythematosus complained of exerptional dyspnea and pleuritic chest pain accompanied by polyarthritis. Chest-X-rays revealed an elevation of the right hemidiaphragm. We discuss the diagnostic and therapeutic approach.
Mujer de 33 años sin alergias medicamentosas ni hábitos tóxicos. Como antecedentes patológicos destacan una pielonefritis por Escherichia coli en junio de 2006, anemia ferropénica de origen multifactorial y lupus eritematoso sistémico (LES) diagnosticado en noviembre de 2004 a raíz de poliartritis simétrica de carpos, de interfalángicas proximales (IFP) y de rodillas, con leucocitopenia y linfocitopenia mantenidas, anticuerpos antinucleares (ANA) positivos a títulos elevados (1/2.560) y anticuerpos anti-ADN de doble cadena (ADNds) >100U (Crithidia lucilae). Presentó una única determinación positiva de anticardiolipina (aCL) IgM en marzo de 2006, pero sin historia previa de trombosis o abortos a repetición. El resto del perfil de autoanticuerpos fue negativo, incluidos los anti-Sm, anti-Ro (SSA), anti-La (SSB), antipéptidos cíclicos citrulinados (CCP), factor reumatoide, test de Coombs y anticoagulante lúpico.
Se inició tratamiento con hidroxicloroquina (200mg/día vía oral) en marzo de 2005 y luego se añadió metotrexato vía oral (10mg/semana) desde junio de 2005 hasta febrero de 2006; se suspendió este último por ineficacia, y requirió dosis altas de corticoides (hasta 20mg/día) para el control de la clínica articular. Luego realizó tratamiento con azatioprina (150mg/día por vía oral) desde febrero de 2006 hasta septiembre de 2006, el cual se suspendió por ineficacia. Actualmente, sigue tratamiento con hidroxicloroquina (400mg/día) desde marzo de 2005, prednisona 15mg/día e indometacina 50mg/8h.
La paciente acude a visita de control, en la que refiere disnea progresiva de moderados esfuerzos de 5–6 meses de evolución, acompañada de dolor torácico derecho de características pleuríticas, sin tos ni expectoración. En la última semana presentó aumento de la sensación disneica, fiebre de hasta 38°C y brote poliarticular que afectaba a hombros, manos y rodillas.
En la exploración física se constató que la paciente se hallaba febricular, normotensa, con saturación de oxígeno basal del 98% y frecuencia respiratoria de 18/min. No presentaba lesiones cutáneas ni adenopatías periféricas. En la auscultación respiratoria se evidenciaba un murmullo vesicular conservado con hipofonesis basal derecha y en el aparato locomotor se constató sinovitis en el carpo derecho, metacarpofalángicas (segunda y tercera derechas, tercera izquierda), IFP (tercera derecha y quinta izquierda), así como limitación de la extensión de ambos codos y hombros, dolor y calor de rodilla izquierda, sin evidencia clara de derrame articular. El resto de la exploración por aparatos resultó normal.
Las determinaciones de glucosa, creatinina, ionograma y enzimas musculares fueron normales. En el hemograma se objetivó: hemoglobina de 9,6g/dl (VCM, 82,5 fl; HCM, 25,4 pg) con fórmula leucocitaria y plaquetas normales. La velocidad de sedimentación globular (VSG) y la proteína C reactiva (PCR) fueron de 23mm/h y 4,1mg/dl respectivamente. Los tiempos de coagulación fueron normales, mientras que el dímero D fue débilmente positivo (650ng/ml; valor normal<500ng/ml). El sedimento de orina fue normal, así como la proteinuria en 24h.
Se realizaron hemocultivos, cultivos de micobacterias y serologías para virus de hepatitis C, virus de hepatitis B, Micoplasma pneumoniae, Rickettsia connori, virus de Epstein-Barr, citomegalovirus, Legionella peumoniae, Chlamydia pneumoniae, Parvovirus B19 y Aspergillus, que fueron todo negativos. Los antígenos para Legionella y neumococo en orina y el PPD fueron negativos.
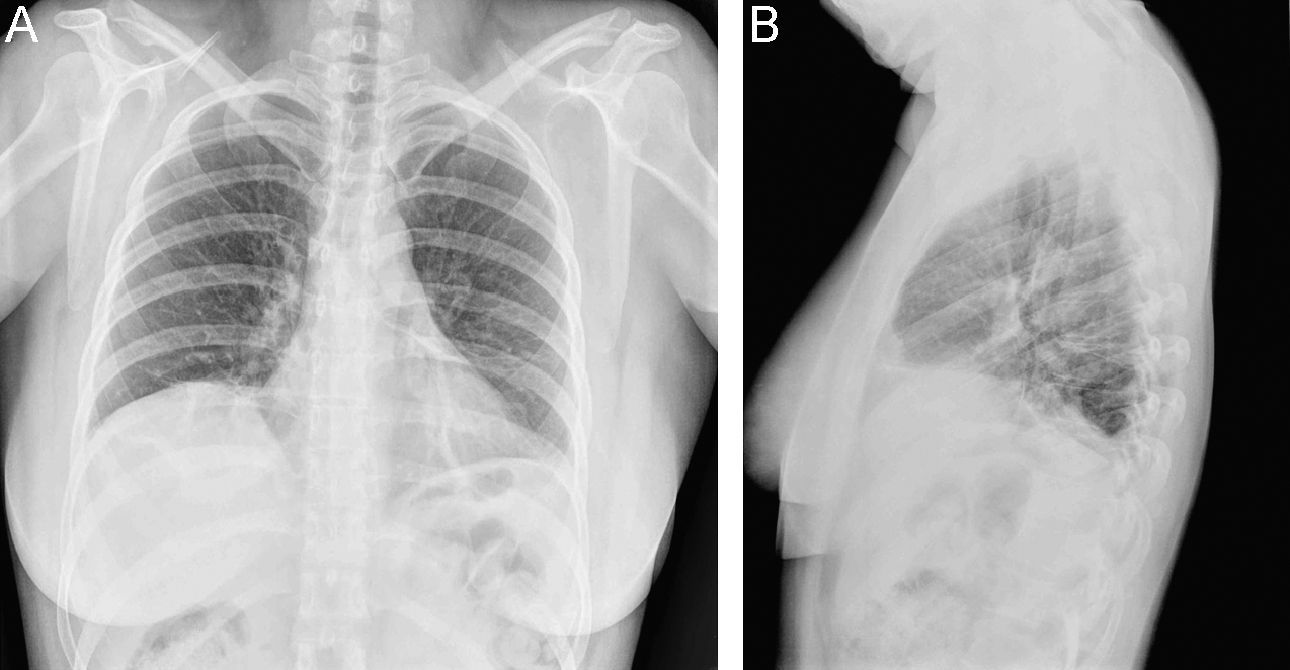
En la radiografía simple de tórax se objetivó una elevación del hemidiafragma derecho, atelectasias laminares en base izquierda y pinzamiento del seno costofrénico izquierdo (fig. 1). En el electrocardiograma se observó ritmo sinusal de 80lat/min, sin alteraciones en la repolarización. Se realizó una ecografía abdominal que mostró una escasa movilidad diafragmática sin evidencia de colecciones intraabdominales. Se realizó un angio-TC de tórax donde se observaron varias atelectasias en ambos pulmones que afectaban a los segmentos apical y basal posterior del lóbulo inferior derecho, lóbulo medio, língula y lóbulo inferior izquierdo. No se encontraron signos de afección vascular ni derrame pleural. Adicionalmente, se realizó una ecocardiografía transtorácica que no mostró disfunción ventricular, afección valvular, derrame pericárdico ni signos de hipertensión pulmonar.
La espirometría mostró un volumen espiratorio forzado en el primer segundo (FEV1) del 58%, con una relación FEV1/capacidad vital forzada (FVC) de 86. La capacidad de difusión del monóxido de carbono (DLCO) se encontró moderadamente reducida. Las pruebas de función muscular respiratoria mostraron disfunción muscular de moderada intensidad, con presión inspiratoria máxima (PIM) de 62 cmH2O (el 60% predicho) y presión espiratoria máxima (PEM) de 78 cmH2O (el 54% del predicho).
Diagnóstico diferencial (Dr. J.A. Gómez-Puerta)Nos encontramos frente a una paciente con LES de predominio articular que presenta un nuevo brote en forma de poliartritis y fiebre con elevación en los reactantes de fase aguda (PCR y VSG). Adicionalmente, presenta dificultad respiratoria de larga evolución, sin taquipnea ni desaturación y sin evidencia de un proceso infeccioso pulmonar sobreañadido (múltiples estudios microbiológicos negativos).
El LES es una enfermedad sistémica compleja en la cual los pacientes pueden manifestar disnea por diversas causas que incluyen tanto complicaciones inherentes a la enfermedad (causas primarias) como complicaciones concomitantes (causas secundarias)1,2 (tabla 1). Teniendo en cuenta los antecedentes de una determinación positiva para aCL y la determinación de dimero D positiva, la primera opción a descartar en esta paciente era la de tromboembolia pulmonar (TEP). No obstante, cabe mencionar que la probabilidad pretest era baja ya que la paciente no estaba taquicárdica y no presentaba desaturación. En esto caso, la angio-TC descartó una TEP o afección pleural.
Causas de disnea en pacientes con lupus eritematoso sistémico
| Primarias |
| Enfermedad pleural: |
| Pleuritis |
| Neumotórax |
| Enfermedad parenquimatosa: |
| Neumonitis lúpica aguda |
| Neumonitis lúpica crónica (fibrótica) |
| Hemorragia alveolar |
| Obstrucción de vía aérea |
| Enfermedad vascular: |
| Hipertensión pulmonar |
| Tromboembolia |
| Hipoxemia aguda reversible |
| Vasculitis |
| Enfermedad muscular respiratoria |
| Enfermedad de vía aérea superior |
| Secundarias |
| Infecciones |
| Toxicidad medicamentosa |
| Enfermedades concomitantes |
| Edema pulmonar urémico |
| Pneumonitis posparto |
| Bronquitis/BOOP |
| Sarcoidosis |
| Neumonía intersticial linfocítica |
| Linfoma |
BOOP: bronquiolitis obliterante con neumonía origanizativa.
Modificado de Wallace et al2.
Una vez descartadas estas dos causas de disnea, creo que nos deberíamos enfocar en una causa restrictiva que nos explique la disnea y la elevación diafragmática observada tanto en la radiografía simple como en la ecografía abdominal.
Las pruebas funcionales respiratorias mostraron un trastorno ventilatorio restrictivo (probablemente extrínseco) acompañado de una disfunción muscular diafragmática. Las causas de miopatías en los pacientes con LES son diversas e incluyen las miopatías inflamatorias, tanto la relacionada con la polimiositis y la dermatomiositis (las cuales pueden acompañar al LES hasta en un 10% de los casos) como una miopatía inflamatoria propia de la enfermedad3. En segundo lugar tenemos que mencionar la miopatía por toxicidad farmacológica, en la que se incluyen, principalmente, los corticoides4, los antimaláricos5 y las estatinas, entre otros6. Otras causas menos frecuentes de miopatía en el LES son los cuadros «miasteniformes» o la miastenia grave concomitante y la debilidad muscular por déficit de vitamina D, que suele ser insuficiente en los pacientes con LES por la escasa exposición solar, el uso de antisolares y la propia actividad de la enfermedad7. En último lugar debemos mencionar una disfunción diafragmática aislada.
En el presente caso no se mencionan signos de miopatía sistémica ni de debilidad muscular en extremidades u otros grupos musculares. Al mismo tiempo las enzimas musculares fueron normales, lo que hace menos probable una miopatía inflamatoria. A pesar de que la paciente ha recibido dos medicamentos potencialmente miotóxicos (antimaláricos y corticoides), es improbable una afección selectiva del diafragma por estos fármacos. No conocemos las concentraciones de 25-OH vitamina D en la paciente, no obstante la hipovitaminosis D se relaciona más con un cuadro de fatiga y debilidad muscular generalizada que con una afección selectiva de grupos musculares7.
Diagnóstico clínico (Dr. J.A. Gómez-Puerta)Teniendo en cuenta lo anterior y una vez descartadas de forma razonable las causas más frecuentes de disnea en paciente con LES, considero que la paciente podría tener síndrome de pulmón encogido (SPE) o shrinking lung syndrome.
El SPE fue descrito originalmente por Hoffbrand et al8 en 1965 y se caracteriza por: a) disnea de causa no explicable; b) pulmón pequeño con patrón restrictivo, y c) elevación del diafragma. El SPE no se presenta exclusivamente en pacientes con LES, también se ha descrito en otros procesos autoinmunitarios sistémicos, como la esclerosis sistémica9 y el síndrome de Sjögren primario10. No se conoce exactamente la prevalencia del SPE en pacientes afectos de LES. Hasta la fecha, sólo se han comunicado 70 casos en la literatura. Warrington et al11 analizaron 49 casos publicados desde 1965 hasta 1997. Posteriormente, se han descrito 21 casos más9,12–19.
La patogenia del SPE continúa sin conocerse. Inicialmente se propuso como causa el desarrollo de atelectasias laminares secundarias a la pérdida de surfactante8. Se ha descrito también una disfunción diafragmática primaria (aislada o en el contexto de una miopatía) determinada mediante balones de presión esofágicos y gástricos20. Rubin et al21 realizaron estudios post mórtem y encontraron una marcada y difusa fibrosis diafragmática en esos pacientes. Adicionalmente, se apunta a que participan diversos factores que restringen la distensibilidad torácica22.
Los pacientes con SPE refieren disnea de esfuerzo que progresa en semanas o meses, que lleva a una marcada disminución en la tolerancia al ejercicio y, en ocasiones, puede producir disnea en reposo. El dolor pleurítico también es un síntoma frecuente en estos pacientes. A la exploración física destaca una limitación en la expansión torácica que, en ocasiones, obliga a un movimiento respiratorio paradójico y a la utilización de músculos accesorios. La auscultación pulmonar suele ser normal, aunque se puede escuchar crepitantes bibasales como resultado de las atelectasias en las bases pulmonares. En la radiografía simple de tórax destaca una elevación del hemidiafragma, en ocasiones pueden observarse atelectasias basales, engrosamiento pleural y, ocasionalmente, derrame pleural. La gasometría con el paciente en reposo suele ser normal o puede mostrar una leve hipoxemia que empeora con el ejercicio11.
El SPE puede presentarse en cualquier fase de la enfermedad (entre 4 meses y 24 años después del diagnóstico) o incluso puede ser su primera manifestación12. El SPE puede estar relacionado o no con una miositis o con un brote de la enfermedad. Algunos pacientes tienen historia de dolor pleural recurrente o historia de pericarditis11.
Las pruebas funcionales respiratorias suelen mostrar un patrón restrictivo con una capacidad vital (CV) reducida (el 52%; intervalo del 18–90% del valor predicho). Los pacientes con una miositis concomitante suelen tener volúmenes pulmonares más reducidos con una CV media alrededor del 40%. La DLCO suele estar disminuida, pero corregida porque el volumen alveolar es normal o está levemente disminuido (el 95%; intervalo, 77–104%). La PIM y la PEM que determinan la función respiratoria general suelen estar disminuidas en la mayoría de los casos descritos con SPE11. No obstante, estas pruebas suelen subestimar la capacidad muscular en ciertos pacientes debido a una activación incompleta durante las maniobras realizadas23. Por tal motivo, Laroche et al22 valoraron la presión durante las maniobras de inspiración nasal forzada (sniff), que brindan una información más precisa sobre la activación de músculos inspiratorios; 9 de 12 pacientes con SPE a quienes se realizó mediciones de la presión transdiafragmática tuvieron un estudio estrictamente normal. En 3 pacientes la presión transdiafragmática máxima estuvo disminuida, pero tras estimulación del nervio frénico se comprobó que estaba en relación con una activación incompleta del diafragma durante un esfuerzo voluntario máximo, más que con una alteración primaria del diafragma22.
Los estudios con electromiografía (EMG) del nervio frénico han arrojado resultados dispares. Hardy et al19 y Omdal et al24 encontraron alteraciones en forma de mononeuropatía del nervio frénico en la EMG. Por otro lado, Wilcox et al25 no encontraron ningún signo de degeneración axonal en los 9 pacientes estudiados, y afirman que es improbable que el SPE se explique por una neuropatía del nervio frénico.
A pesar de estos resultados dispares y teniendo en cuenta las múltiples limitaciones de cada una de las pruebas musculares respiratorias, propongo realizar un EMG del nervio frénico con el fin de descartar en nuestra paciente una neuropatía en esta zona.
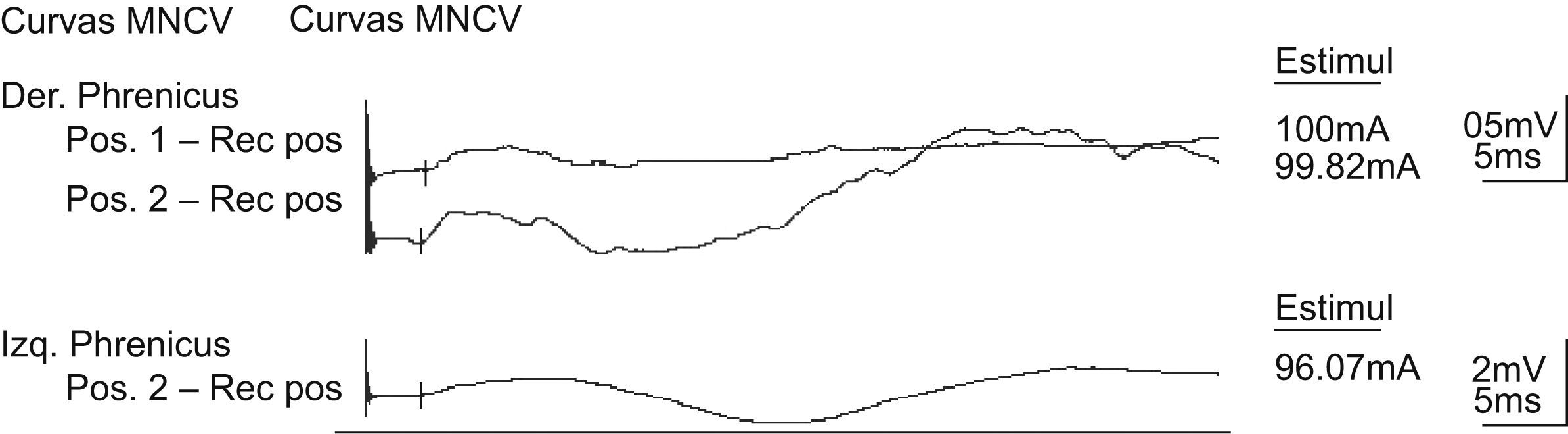
Resultados (Dra. D. Taverner)Se realizó un electromiograma de nervios frénicos. Se observó una axonotmesis parcial del nervio frénico derecho con una caída mayor del 50% de la amplitud respecto al contralateral y con una disgregación del potencial. La latencia distal motora permaneció conservada de forma simétrica (fig. 2). Con todo lo anterior y teniendo en cuenta los hallazgos radiológicos y la historia clínica de la paciente, llegamos al diagnóstico de SPE relacionado con neuropatía del nervio frénico.
Comentarios (Dra. D. Taverner)El tratamiento del SPE continúa siendo empírico. En la mayoría de los casos se suele aumentar las dosis de glucocorticoides que ya utilizan los pacientes hasta 30–60mg/día11,15,26. Recientemente Oud et al15 describieron la respuesta a dosis moderadas-elevadas de corticoides (entre 30 y 40mg/día) en 5 pacientes con SPE. Dos de los 5 pacientes desarrollaron un SPE a pesar de tratarse con metotrexato e hidroxicloroquina respectivamente. Los autores indican que, a pesar de que se empieza a observar respuestas desde el primer mes tras el tratamiento, se debe esperar hasta 4 meses para obtener una respuesta. No obstante, cabe mencionar que la recuperación total de la capacidad vital es infrecuente.
La teofilina también ha mostrado ser beneficiosa en el SPE, con mejorías de hasta un 31% en la capacidad pulmonar27. El uso de los beta-agonistas también parece ser beneficioso, tal como se recoge en un caso de mejoría tras salbutamol inhalado28. Datos anecdóticos también apoyan la utilización de otros inmunosupresores, como la ciclofosfamida o la azatioprina en los pacientes sin respuesta a corticoides11.
Según los datos recogidos en la literatura, el pronóstico de los pacientes con SPE suele ser favorable. Martens et al29 describieron un curso satisfactorio en 7 pacientes con SPE seguidos durante un período de 38,5 pacientes/año. Sólo hay un informe de caso en el que se describe a un paciente que fallece a consecuencia de una dependencia a ventilación mecánica con la posterior insuficiencia respiratoria21.
El curso evolutivo de nuestra paciente fue favorable; tras el diagnóstico se le administraron pulsos mensuales de metilprednisolona a dosis de 500mg intravenosos durante 3 meses. Progresivamente la paciente refirió mejoría tanto de la disnea como del dolor torácico pleurítico, y está totalmente asintomática a los 6 meses del último pulso. Un año más tarde se le realizaron nuevas pruebas de función respiratoria en las que se observó una estabilidad con respecto a las pruebas previas (capacidad pulmonar total, 60%; FEV1/FVC, 86; DLCO disminuida de moderada intensidad [61%] que se corrige con el volumen alveolar).
Caso cerrado presentado en la sesión de la Sociedad Catalana de Reumatología el día 30 de noviembre de 2007.