No existen a la fecha estudios controlados que evalúen la eficacia de rituximab (RTX) comparando con un tratamiento estándar, como ciclofosfamida, en pacientes con lupus eritematoso generalizado (LEG).
ObjetivoComparar la eficacia de RTX con ciclofosfamida en pacientes con manifestaciones graves de LEG.
Material y métodoEstudio clínico aleatorizado, multicéntrico, controlado y abierto en adultos con LEG activo. Se administró RTX o bolos de ciclofosfamida, con mismo esquema de esteroides. Se evaluó MEX-SLEDAI, dosis de esteroide y eventos adversos, durante 12 meses. Se empleó estadística descriptiva y comparativa.
ResultadosFueron 19 pacientes, 17 mujeres, con edad de: 35,7 años ±12,1, y tiempo de evolución de 5,6 años (0,35–30,8). No hubo diferencias en género, edad, tiempo de evolución, tratamientos previos o actividad de la enfermedad al inicio entre los grupos. Se observó descenso en el MEX-SLEDAI de 12 a 3 en el grupo 1, y de 9 a 2 en el grupo 2 (p=0,80). El grupo que recibió RTX tuvo mejoría más rápida. La dosis acumulada de esteroide fue similar. En ambos grupos se observó reducción en niveles de anti-DNAds e incremento de C3. Los eventos adversos fueron semejantes.
ConclusiónEste ensayo clínico comparativo muestra que RTX puede ser tan eficaz como ciclofosfamida, para el control de manifestaciones graves del LEG, con respuesta más rápida. Los eventos adversos inmediatos y mediatos no fueron diferentes. RTX puede considerarse una opción terapéutica adecuada en este tipo de pacientes.
There are no controlled studies that compare the efficacy of RTX with standard treatment, such as cyclophosphamide, in patients with systemic lupus erythematosus (SLE).
ObjectiveThe objective of this study was to compare the efficacy of rituximab to that of cyclophosphamide in patients with severe manifestations of SLE.
Materials and methodThis is a multicenter, randomized open and controlled trial in adults with a diagnosis of active SLE. Patients were randomized into two groups; group 1: treated with RTX and group 2: cyclophosphamide pulses with the same steroid scheme. We registered MEX-SLEDAI, steroid requirements and adverse events for 12 months. Descriptive and comparative statistic analysis was performed.
Results19 patients were included, 17 females, mean age 35.7±12.1 years and duration of disease 5.6 years (range 0.35 to 30.8 years). There were no differences at baseline regarding gender, age, duration of disease, previous treatments or disease activity between both groups. MEX-SLEDAI was reduced from 12 to 3 in group 1 and from 9 to 2 in group 2 (p=0.80). Nevertheless, patients treated with RTX had a faster improvement. There was no difference in the cumulative steroid dose. Both groups had significant reduction in antinuclear antibody levels and similar increase in C3 levels. Adverse events were similar in both groups.
ConclusionThis comparative clinical study in patients with SLE shows that rituximab can be as useful as cyclophosphamide for severe manifestations, maybe showing a faster response. Adverse events were no different. Rituximab should be considered as an adequate alternative for this group of patients.
El lupus eritematoso generalizado (LEG) es la enfermedad difusa del tejido conectivo prototipo de las enfermedades autoinmunes. Afecta prácticamente cualquier órgano o sistema, y tiende a presentar un curso progresivo, alternando con recaídas y remisiones en la mayoría de los enfermos1. Alrededor del 40% de los pacientes pueden tener manifestaciones severas de la enfermedad, que inciden en forma significativa en la morbimortalidad2. Dentro de las manifestaciones más severas del lupus se cuentan la afección renal, hematológica, del SNC y la vasculitis1.
La etiopatogenia del LEG es compleja, dentro de las diversas alteraciones observadas destacan la pérdida de tolerancia a autoantígenos, con activación policlonal subsecuente de linfocitos B y formación de auto-Ac, y la alteración en la función de los linfocitos T, con producción de múltiples citocinas3.
En relación con la participación de los linfocitos B, los pacientes con lupus sufren falla en la eliminación de clonas autorreactivas en una fase inicial del desarrollo, implicándose a varios genes, pero en especial al VH4-34, que se expresa en forma exagerada en los linfocitos B4. Además, la secuenciación de los genes de inmunoglobulinas muestra mayor edición de las cadenas ligeras, como un intento frustrado del sistema inmune por mantener la tolerancia. Las células B tienen también una función central en la presentación de antígenos, pudiendo activar y polarizar a las células T, modificando así la secreción de distintas citocinas5. Existe evidencia de que la depleción de las células B tiene un efecto benéfico sobre la actividad de la enfermedad. En modelos murinos de lupus, los ratones deficientes en células B no desarrollan nefritis, mientras que las estirpes con células B intactas desarrollan afección severa1,3.
Es por estos motivos que se ha considerado a la depleción de las células B, por medio del uso de rituximab, como un posible blanco terapéutico en el LEG. El rituximab es un Ac monoclonal quimérico, dirigido contra la molécula CD20 de los linfocitos B6, y que depleta estas células por diversos mecanismos7.
A partir de la primera publicación sobre el uso de rituximab en LEG en 20018, numerosos reportes de casos han notificado respuestas favorables en distintas manifestaciones de esta enfermedad9,10. Sin embargo, no existen a la fecha resultados de estudios clínicos controlados que evalúen su eficacia comparando con un tratamiento estándar.
En este trabajo desarrollamos un estudio clínico abierto, multicéntrico, para comparar la eficacia de rituximab versus ciclofosfamida en bolos, que ha sido considerado durante mucho tiempo como estándar de oro para manifestaciones graves del lupus.
Material y métodosDiseño del estudioSe realizó un estudio multicéntrico en distintos hospitales del Instituto de Seguridad y Servicios Sociales para los Trabajadores del Estado (ISSSTE), con asignación aleatoria, controlado y abierto, para evaluar la eficacia del tratamiento de rituximab versus ciclofosfamida en bolos, en pacientes con manifestaciones severas de lupus. Como objetivos secundarios se evaluaron los eventos adversos.
Se obtuvo un consentimiento informado en todos los pacientes, de acuerdo a los lineamientos del comité de ética. Se formaron 2 grupos de acuerdo a una tabla de asignación al azar, para recibir los siguientes tratamientos: grupo 1: rituximab 1gr en infusión i.v. para 4h, previa premedicación con hidroxicina, paracetamol y dexametasona 8mg i.v. los días 1 y 15 del estudio. La reinfusión del medicamento en caso de recaída se administró a partir del sextomes. Grupo 2: Ciclofosfamida en bolo 750 a 1g/m2sc, previa hidratación i.v. y administración de MESNA (80% de la dosis de ciclofosfamida) administrada cada mes durante los primeros 6 meses, y posteriormente trimestral hasta el final del estudio. Ambos grupos recibieron esteroide de manera inicial a dosis altas (1gr i.v. por 3 dosis o 1mg/kg/d) con reducción gradual, y se llevo a cabo un seguimiento por 12 meses.
Sujetos de estudioLa población en estudio consistió en 19 pacientes, mayores de 18 años, con diagnóstico de LEG según los criterios de clasificación del Colegio Americano de Reumatología, con enfermedad activa definida con MEX-SLEDAI ≥3 y afección a nivel renal, hematológica, del SNC o vasculitis, definida de la siguiente forma: actividad renal, proteinuria >0,5g/l, eritrocitos >5/c, aumento en creatinina >0,5mg/dl y/o presencia de cilindros en la orina; actividad hematológica, hemólisis con hemoglobina<12g/dl y reticulocitos >3% o trombocitopenia<100.000; actividad neurológica, psicosis, convulsiones, ECV, síndrome orgánico cerebral, neuropatía y/o mielitis; y vasculitis: úlcera, infartos o nódulos definida por biopsia o angiografía. Para los pacientes en edad fértil, se empleó un anticonceptivo confiable. Los criterios de exclusión consistieron en la presencia de embarazo o lactancia, antecedente de hepatitis, necesidad de uso de otro inmunosupresor en forma concomitante (excepto antimaláricos), o infección activa al inicio del estudio. Los pacientes pudieron recibir esteroide en bolos o por vía oral en función del grado de actividad, y la dosis necesaria de esteroide durante el estudio se consideró como un indicador de eficacia del inmunosupresor. Los pacientes pudieron continuar con el uso de antimaláricos, antihipertensivos, anticoagulantes, hipolipemiantes y antiinflamatorios según fuera necesario.
EvaluacionesSe realizaron evaluaciones mensuales durante los primeros 6 meses, y en forma bimensual hasta el año de seguimiento. En cada visita se interrogaron síntomas sugestivos de actividad, se realizó exploración física completa por un reumatólogo. Se registró el puntaje absoluto del MEX-SLEDAI (0–32) y se definió la actividad de la enfermedad como ausente o remisión (<3), leve (3–5) o presente (>5)11 Además se realizaron biometría hemática, química sanguínea, examen de orina, depuración de creatinina, albúmina en orina de 24h, C3 y C4. Se midieron Ac anti-DNA de doble cadena (anti-DNAds) por método de ELISA, y subpoblación de linfocitos CD19 (cifra absoluta/μl y porcentaje) en la visita inicial, a 6 meses y al año.
Análisis estadísticoSe empleó estadística descriptiva, prueba exacta de Fisher para variables cualitativas y T de Student o U-Mann Whitney para cuantitativas. La comparación de MEX-SLEDAI y de la dosis de prednisona se realizó con Kruskal-Wallis. Se empleó el programa SPSS-15.
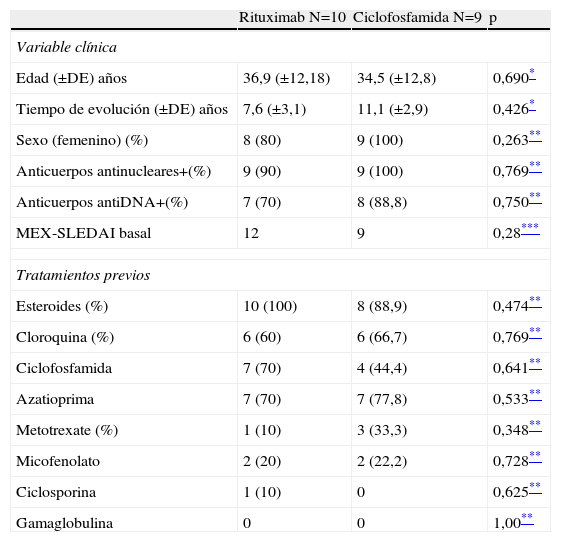
ResultadosCaracterísticas de los sujetos de estudioSe incluyeron 19 pacientes, 17 fueron mujeres, con media de edad de 35,7 años±12.1 (promedio±DE) y tiempo de evolución de la enfermedad de 5,6 años (0,35 a 30,8). Los datos demográficos y los tratamientos previos se describen en la tabla 1. No se observaron diferencias en género, edad, tiempo de evolución o tratamientos inmunosupresores previos entre los pacientes tratados con rituximab (grupo 1: 10), y los tratados con ciclofosfamida (grupo 2: 9). El grado de actividad, medido por MEX-SLEDAI era mayor en los pacientes asignados a rituximab comparado a los pacientes asignados a ciclofosfamida, sin embargo esta diferencia no fue estadísticamente significativa.
Variables demográficas y tratamientos previos
| Rituximab N=10 | Ciclofosfamida N=9 | p | |
| Variable clínica | |||
| Edad (±DE) años | 36,9 (±12,18) | 34,5 (±12,8) | 0,690* |
| Tiempo de evolución (±DE) años | 7,6 (±3,1) | 11,1 (±2,9) | 0,426* |
| Sexo (femenino) (%) | 8 (80) | 9 (100) | 0,263** |
| Anticuerpos antinucleares+(%) | 9 (90) | 9 (100) | 0,769** |
| Anticuerpos antiDNA+(%) | 7 (70) | 8 (88,8) | 0,750** |
| MEX-SLEDAI basal | 12 | 9 | 0,28*** |
| Tratamientos previos | |||
| Esteroides (%) | 10 (100) | 8 (88,9) | 0,474** |
| Cloroquina (%) | 6 (60) | 6 (66,7) | 0,769** |
| Ciclofosfamida | 7 (70) | 4 (44,4) | 0,641** |
| Azatioprima | 7 (70) | 7 (77,8) | 0,533** |
| Metotrexate (%) | 1 (10) | 3 (33,3) | 0,348** |
| Micofenolato | 2 (20) | 2 (22,2) | 0,728** |
| Ciclosporina | 1 (10) | 0 | 0,625** |
| Gamaglobulina | 0 | 0 | 1,00** |
Los motivos de inclusión por el tipo de actividad de la enfermedad fueron: actividad renal en 10 pacientes, hematológica en 5, neurológica en 1 y vasculitis en 3 (ver tabla 2). Hubo más pacientes con afección renal en los pacientes del grupo 2 (7 vs 3), aunque esta diferencia no alcanzó significancia estadística.
Motivo de inclusión al estudio
| Tipo de actividad | Manifestaciones (♯ de pacientes) | Rituximab N=10 (%) | Manifestaciones (♯ de pacientes) | Ciclofosfamida N=9 (%) | p* |
| Hematológica | Anemia hemolítica (3) | 4 (40) | Trombocitopenia (1) | 1 (1,1) | 0,33 |
| Trombocitopenia (1) | |||||
| Renal | Nefritis IV (3) | 3 (30) | Nefritis III (4), IV (2) | 7 (77,8) | 0,07 |
| Proteinuria (3) | Proteinuria (5) | ||||
| Leucoeritrocituria (3) | Leucoeritrocituria (7) | ||||
| > azoados (2) | > azoados (4) | ||||
| Neurológica | Sx. cerebeloso | 1 (10) | 0 | 1,0 | |
| Vasculitis | Lesiones cutáneas (2) | 2 (20) | Lesiones cutáneas (1) | 1 (1,1) | 0,75 |
| Total | 10 | 9 |
#: número de pacientes con esa alteración.
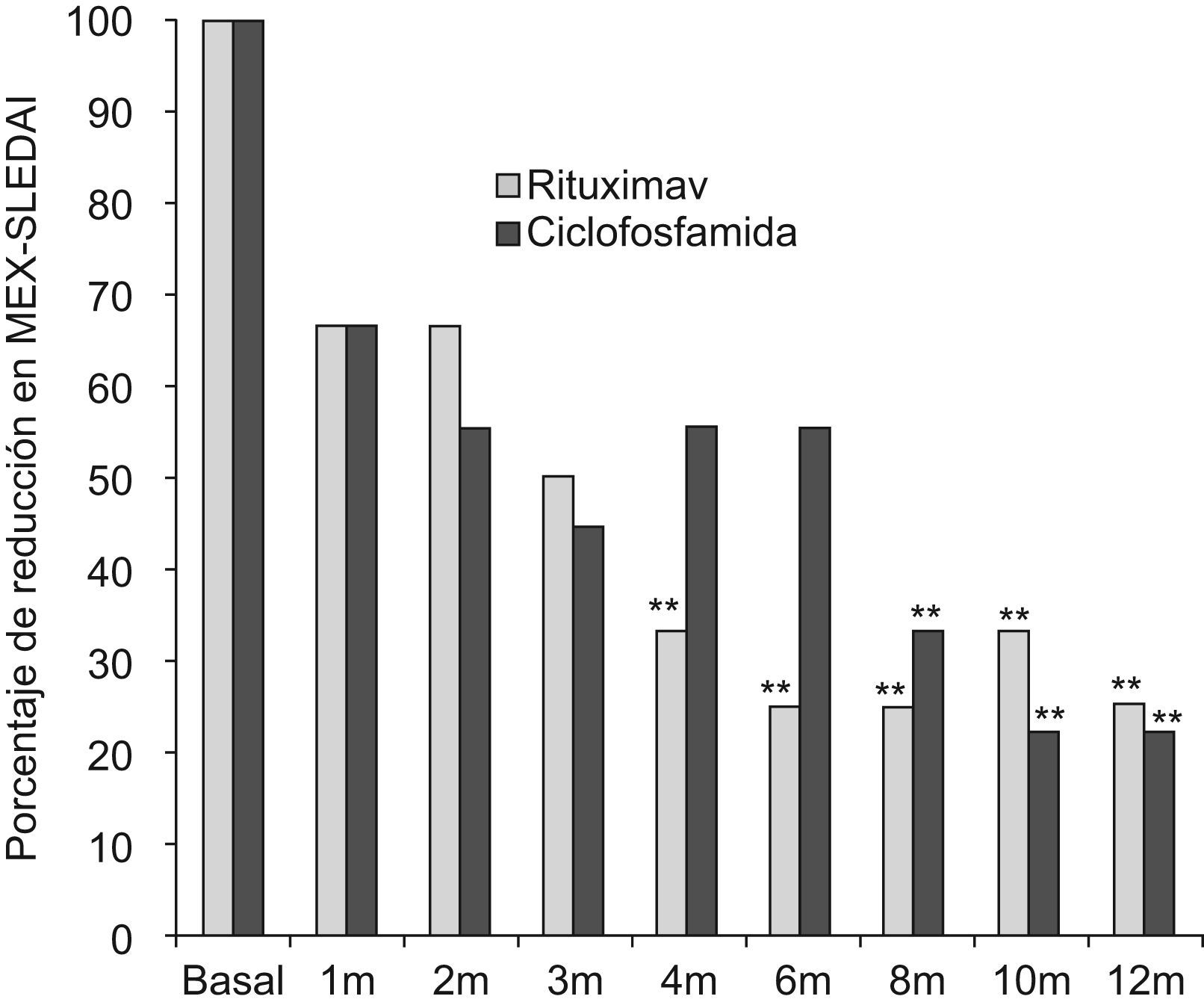
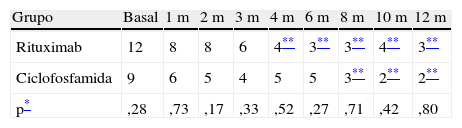
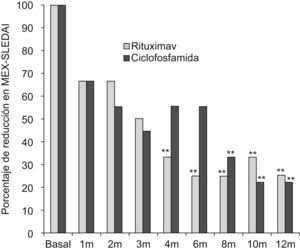
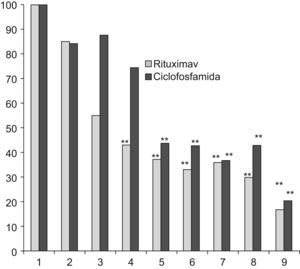
En ambos grupos de pacientes se observó buena respuesta clínica, con descenso en el MEX-SLEDAI de 12 a 3 puntos en el grupo 1, y de 9 a 2 puntos en el grupo 2 (p=0,80) al año de seguimiento. El grupo que recibió rituximab tuvo mejoría más rápida, alcanzando diferencia significativa en relación con la visita basal a los 4 meses, contra 8 meses en el grupo tratado con ciclofosfamida (ver tabla 3 y fig. 1). Considerando MEX-SLEDAI de <3, presentaron remisión 8 pacientes con rituximab y 6 con ciclofosfamida a los 6 meses y al año 9 pacientes con rituximab y 8 con ciclofosfamida. Un paciente del grupo de rituximab requirió reinfusión del medicamento a los 11 meses por recaída renal.
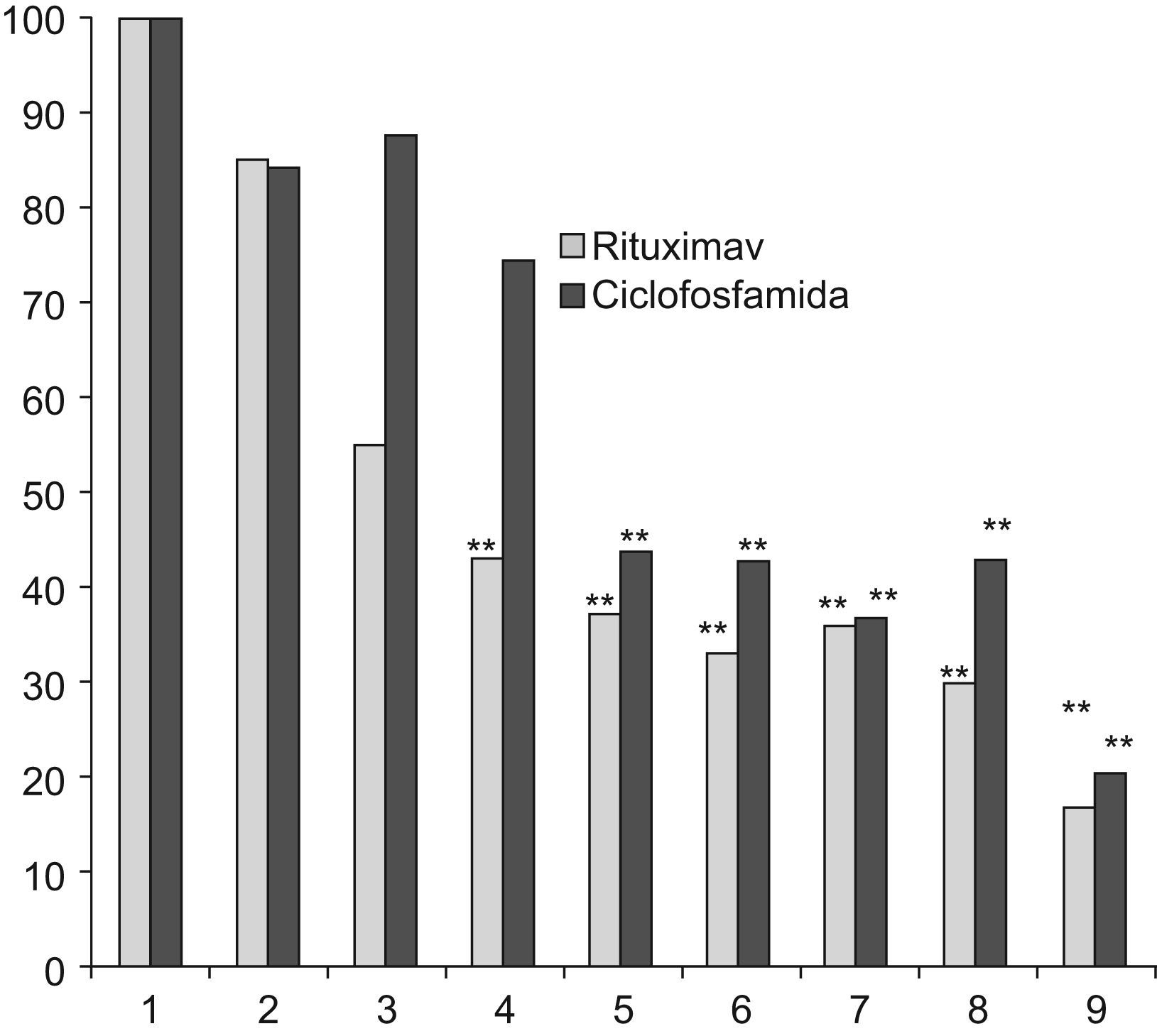
Como medida indirecta de eficacia clínica de los inmunosupresores, la dosis promedio de prednisona en cada visita fue semejante en ambos grupos. En los pacientes del grupo de rituximab el descenso de la misma fue más rápido; sin embargo, no hubo diferencias en la dosis acumulada final, siendo ésta de 689,18mg para el grupo de rituximab, y de 755,90mg en el grupo de ciclofosfamida (ver fig. 2).
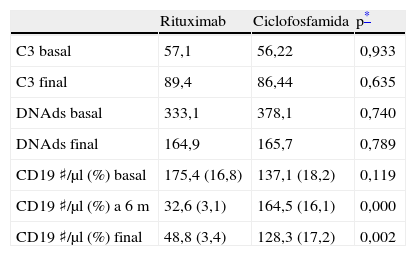
Variables serológicasSe observó aumento de las cifras de C3 en ambos grupos en comparación con la basal (57,1 a 89,4 en el grupo 1 vs 56,2 a 86,4 en el grupo 2), sin que hubiera diferencia entre ambos grupos.
Quince pacientes tuvieron títulos positivos de anti-DNAds (7 del grupo 1 y 8 del grupo 2). Durante el seguimiento ocurrió descenso significativo en los títulos, sin diferencia en los grupos.
Se midió subpoblación de linfocitos CD19 en forma basal, a los 6 y 12 meses de seguimiento. Ninguno de los pacientes tratados con ciclofosfamida tuvo disminución en la cuantificación de CD19 durante el estudio. En el grupo de pacientes que recibió rituximab el número promedio de CD19 basal fue de 16,8%, a los 6 meses de 3,1% y a los 12 meses de 43,4% (ver tabla 4). De los 10 pacientes, solo uno no mostró depleción de linfocitos B, este hallazgo no tuvo relación con la respuesta clínica, que fue satisfactoria, con cambio en el MEX-SLEDAI de 11–3 a los 6 meses y 0 al año. El paciente con recaída clínica a los 11 meses mantuvo buena depleción de linfocitos B: basal 14%, 4% a los 6 meses y 4% a los 12 meses.
Resultados serológicos
| Rituximab | Ciclofosfamida | p* | |
| C3 basal | 57,1 | 56,22 | 0,933 |
| C3 final | 89,4 | 86,44 | 0,635 |
| DNAds basal | 333,1 | 378,1 | 0,740 |
| DNAds final | 164,9 | 165,7 | 0,789 |
| CD19 ♯/μl (%) basal | 175,4 (16,8) | 137,1 (18,2) | 0,119 |
| CD19 ♯/μl (%) a 6m | 32,6 (3,1) | 164,5 (16,1) | 0,000 |
| CD19 ♯/μl (%) final | 48,8 (3,4) | 128,3 (17,2) | 0,002 |
#/ml: número de células CD19 por microlitro.
En general, tanto rituximab como ciclofosfamida fueron bien tolerados durante el estudio. Los eventos adversos se dividieron como reacciones inmediatas a la infusión, eventos adversos no serios no inmediatos, eventos infecciosos y eventos adversos serios. Ocurrieron 3 reacciones adversas durante la infusión de rituximab que consistieron en erupción cutánea, prurito y taquicardia y que cedieron con el uso de esteroides y antihistamínicos. Las reacciones asociadas a la infusión de ciclofosfamida, (que ocurrieron en 8 infusiones) fueron náusea, vómito, cefalea y escalosfrío, principalmente. En total se registraron 23 eventos adversos no relacionados con la infusión en los pacientes tratados con rituximab comparado con 16 en los pacientes tratados con ciclofosfamida. Estos fueron diversos, predominando cefalea, dispepsia, mareo, erupción cutánea y alopecia. Las infecciones no serias (8 en los pacientes que recibieron rituximab y 10 en los tratados con ciclofosfamida) fueron infecciones de vías urinarias, vías respiratorias altas, celulitis y 2 casos de herpes zoster, ambos en pacientes que recibieron ciclofosfamida. Los eventos adversos serios en el grupo tratado con rituximab consistieron en un cuadro de artritis séptica y una hemartrosis, y en el grupo que recibió ciclofosfamida un absceso anal y un cuadro de leucopenia febril. No se presentaron muertes, neoplasias o infecciones oportunistas durante el seguimiento de 12 meses.
DiscusiónAunque el uso de rituximab aun no ha sido aprobado por la FDA para el tratamiento de lupus eritematoso sistémico, al momento existe ya un gran número de pacientes con este padecimiento que han sido tratados con el fármaco en estudios clínicos abiertos y reportes de casos, sugiriendo buena respuesta (en más del 90% de los casos reportados) y adecuada tolerabilidad en pacientes con enfermedad refractaria a otros tratamientos, en especial en el caso de manifestaciones hematológicas, renales y del sistema nervioso9,10.
La primera serie de casos de lupus tratado con rituximab fue la publicada por Leandro y cols en 200212. A partir de ese momento, existen numerosos reportes de buena eficacia en pacientes con LEG con diversas manifestaciones, empleando tanto las dosis recomendadas por los oncólogos, como, sobre todo recientemente, las usadas en artritis reumatoide y, en combinación o no con otros inmunosupresores, específicamente ciclofosfamida4,9,10.
El equipo de la Dra. Leandro ha reportado posteriormente los resultados obtenidos en 13 pacientes13, y recientemente un análisis retrospectivo de 7 años en el que encontraron que, de 45 pacientes tratados con rituximab, 42% presentó remisión completa y 47% remisión parcial, todo ello relacionado con la depleción de células B14,15.
El grupo de Rochester, encabezado por Looney y cols, realizó el primer estudio fase I/II de escalamiento de dosis, encontrando que rituximab fue en general seguro y bien tolerado, causando depleción de células B que fue acorde con mejoría clínica y sostenida16. Este grupo ha reportado que la variablidad en la respuesta al tratamiento parece asociarse con el grado de depleción de células B, la presencia de Ac antiquiméricos humanos, polimorfismos en la expresión de alelos de FcγRIIIa y la ascendencia afroamericana17,18. Otros autores han confirmado que los pacientes con lupus tienen una respuesta de depleción de linfocitos B menos uniforme que los pacientes con artritis reumatoide y mayor porcentaje de formación de Ac antiquiméricos humanos19.
Sfikakis y cols emplearon rituximab en pacientes con nefritis lúpica refractaria, obteniendo depleción de células B y buena respuesta clínica20.
Vigna-Pérez y cols reportaron un estudio clínico abierto de 22 pacientes con nefritis lúpica refractaria al tratamiento convencional, que recibieron rituximab, con mejoría significativa en el índice MEX-SLEDAI y en la proteinuria. Veinte pacientes tuvieron depleción de linfocitos B y se encontró elevación en las cifras linfocitos T reguladores, además de incremento en la apoptosis de las células T. Estos y otros autores han sugerido que pueden obtenerse buenos resultados incluso con dosis menores de rituximab21.
Varios estudios han sugerido la utilidad del rituximab como agente aislado para inducción de remisión en nefritis lúpica22. Recientemente se ha comparado la utilidad de rituximab sólo contra rituximab más ciclofosfamida en un estudio aleatorio y abierto de pacientes con nefritis lúpica. Los autores no encontraron ningún beneficio adicional de la combinación de rituximab con ciclofosfamida comparado con el uso de rituximab como único inmunosupresor23.
En relación con las manifestaciones neuropsiquiátricas, Tokunaga y cols. publicaron una revisión de 10 pacientes que recibieron rituximab en dosis variables, todos ellos presentaron mejoría de los síntomas y remisión que duró entre 4–35 meses24. El mismo grupo reportó un estudio abierto multicéntrico fase I/II, en 15 pacientes con LEG activo refractario. En el estudio se comparó el uso de rituximab, 4 dosis semanales de 500mg contra 1g los días 1 y 15. A las 28 semanas se encontró mejoría semejante en ambos grupos en el índice BILAG, sin evidenciarse diferencia en la dosis requerida de prednisolona ni en la tolerabilidad25.
Recientemente se ha publicado la experiencia del Instituto Karolinska en Suecia, que incluye a 16 pacientes con manifestaciones graves de lupus y que recibieron tratamiento combinado con rituximab y ciclofosfamida, obteniendo mejoría clínica según SLEDAI en 13 de los 16 y remisión en 9 pacientes26.
En base a estos resultados, presentamos un estudio comparativo abierto, multicéntrico en población mexicana con lupus eritematoso generalizado y manifestaciones severas, tratados en forma comparativa con rituximab versus la terapia estándar con ciclofosfamida en bolos i.v. Optamos por este estudio cara a cara porque pesar de que los primeros reportes usaron rituximab combinado con ciclofosfamida, reportes recientes no observan ventaja con esta combinación23. En este grupo de pacientes observamos respuesta clínica, evaluada por MEX-SLEDAI, muy semejante en ambos grupos de tratamiento, aunque mas rápida en el grupo de pacientes que recibieron rituximab. El porcentaje de pacientes que logró remisión con este fármaco fue de 90%, cifra comparable a la reportada en la literatura10.
También se observó reducción en los niveles de autoAc específicos y mejoría en el consumo de complemento. Este cambio serológico fue semejante en ambos grupos y semejante a lo ya reportado en series de casos y estudios abiertos14,15.
En relación con la tolerabilidad, no se observó diferencia en la prevalencia de reacciones inmediatas a la infusión, eventos adversos no graves, eventos infecciosos y eventos adversos graves entre los pacientes tratados con ciclofosfamida y los tratados con rituximab. Aunque uno de los beneficios sugeridos del rituximab es que pudiera asociarse con menos eventos adversos (sobre todo infecciosos) en comparación con la ciclofosfamida, en nuestros pacientes esta diferencia no fue evidente. Esto pudiera deberse en primer lugar al número reducido de pacientes, así como al tiempo de seguimiento y a que la mayoría de los pacientes tenían lupus de larga evolución y habían recibido previamente otros tratamientos inmunosupresores, lo que dificulta atribuir los eventos adversos mediatos o tardíos a un tratamiento específico. Por el tiempo de seguimiento no fue posible evaluar efectos adversos más tardíos, como infertilidad, oncogenicidad o incluso el remoto riesgo de leucoencefalopatía progresiva multifocal.
Nuestro estudio incluyó un número limitado de pacientes con diferentes manifestaciones graves de lupus, cuya evolución y respuesta al tratamiento puede ser difícil de comparar. Fue por ello que elegimos como variables de análisis de eficacia un índice global y validado de actividad (MEX-SLEDAI), así como los niveles de Ac anti-DNAds, complemento, y la dosis requerida de esteroide.
Prácticamente todos los pacientes que recibieron rituximab depletaron células B, y este efecto fue duradero. En el único paciente con reactivación durante el tiempo de seguimiento no se observó repleción de los niveles de CD19 e incluso en un paciente no logró demostrarse depleción de células B y aún así existió adecuada respuesta. Ya ha sido reportado que en los pacientes con lupus existe mucho mayor variabilidad en cuanto a la depleción de linfocitos B lograda con el rituximab y poca consistencia con la respuesta clínica19.
Al momento no existe ningún ensayo clínico que compare en forma paralela la eficacia y seguridad de rituximab contra ciclofosfamida, el tratamiento considerado como estándar de oro para manifestaciones graves de lupus. Aunque nuestro estudio incluye un número limitado de pacientes, los resultados obtenidos con el tratamiento a base de rituximab son comparables a los obtenidos con el esquema de ciclofosfamida, lo que apoya lo reportado hasta el momento en series de casos y estudios no comparativos en relación con la eficacia de la depleción de células B como tratamiento para las manifestaciones graves del lupus eritematoso generalizado.
Actualmente se encuentran en curso otros ensayos clínicos controlados de rituximab en LEG. El estudio EXPLORER tiene como objetivo comprobar la eficacia y seguridad de rituximab versus placebo más un medicamento inmunosupresor de base27, y el estudio LUNAR, evaluará la eficacia y seguridad de rituximab más micofenolato de mofetilo contra placebo más micofenolato en pacientes con nefritis lúpica28. También se encuentra en estudio fase I/II el Ac anti CD20 humanizado27–29.
Conflicto de interesesLa Dra. Andrade ha participado como conferencista para Pizer y Roche.
La Dra. Irazoque ha sido asesor externo para Bristol Myers Squibb, Roche, Schering-Ploug y Wyeth.
El Dr. Rivas ha sido asesor externo para IMSS, Roche, Silanes, Bayer y Abbot.