1) Revisar sistemática y críticamente la evidencia sobre las características de uso, eficacia y seguridad de los glucocorticoides (GC) en la artritis reumatoide (AR); 2) emitir recomendaciones prácticas sobre su utilización.
MétodosSe realizó una revisión sistemática de la literatura con una estrategia de búsqueda bibliográfica sensible en Medline, Embase y Cochrane Library. Se seleccionaron ensayos clínicos aleatorizados que analizasen la eficacia y/o la seguridad de los GC en pacientes con AR. Dos revisores realizaron la primera selección por título y abstract y 10, la selección tras lectura en detalle y la recogida de datos. La calidad se evaluó con la escala de Jadad. En una reunión de grupo nominal con base en sus resultados se consensuaron una serie de recomendaciones.
ResultadosSe incluyeron 47 artículos. Los GC, en combinación con los fármacos antirreumáticos modificadores de la enfermedad, ayudan a controlar la actividad de la enfermedad y a inhibir la progresión radiográfica, especialmente en el corto-medio plazo y en las AR de inicio. Los GC pueden mejorar la función y el dolor. Distintos tipos y vías de administración son eficaces, sin que exista un esquema de tratamiento estandarizado (dosis de inicio, desescalada y duración del tratamiento con los GC) superior a otro. Los acontecimientos adversos de los GC son muy frecuentes, dependientes de la dosis, de gravedad variable, muchos de ellos leves. Se generaron 7 recomendaciones sobre el uso y la gestión del riesgo de los GC.
ConclusionesEstas recomendaciones pretenden resolver algunos interrogantes clínicos habituales y facilitar la toma de decisiones con respecto al uso de GC en la AR.
1) To systematically and critically review the evidence on the characteristics, efficacy and safety of glucocorticoids (CS) in rheumatoid arthritis (RA); 2) to generate practical recommendations.
MethodsA systematic literature review was performed through a sensitive bibliographic search strategy in Medline, Embase and the Cochrane Library. We selected randomized clinical trials that analyzed the efficacy and/or safety of CS in patients with RA. Two reviewers performed the first selection by title and abstract. Then 10 reviewers selected the studies after a detailed review of the articles and data collection. The quality of the studies was evaluated with the Jadad scale. In a nominal group meeting, based on the results of the systematic literature review, related recommendations were reached by consensus.
ResultsA total of 47 articles were finally included. CS in combination with disease-modifying antirheumatic drugs help control disease activity and inhibit radiographic progression, especially in the short-to-medium term and in early RA. CS can also improve function and relieve pain. Different types and routes of administration are effective, but there is no standardized scheme (initial dose, tapering and duration of treatment) that is superior to others. Adverse events when using CS are very frequent and are dose-dependent and variable severity, although most are mild. Seven recommendations were generated on the use and risk management of CS.
ConclusionsThese recommendations aim to resolve some common clinical questions and aid in decision-making for CS use in RA.
Los glucocorticoides (GC) son una de las terapias más empleadas en el campo de la Reumatología1–4, y su eficacia y perfil de seguridad están extensamente descritos5–10. Se ha demostrado que pueden ayudar en el control de la inflamación y la sintomatología de estas enfermedades. Sin embargo, su mecanismo de acción, efectividad y papel dentro de la estrategia terapéutica de la mayoría de las enfermedades inmunomediadas es muy distinto comparado, por ejemplo, con los fármacos antirreumáticos modificadores de la enfermedad (FAME). De igual manera, su perfil de seguridad, especialmente en el medio y largo plazo o con el uso de dosis altas, genera dudas importantes, ya que se asocia a acontecimientos adversos (AA) relevantes como la osteoporosis o el riesgo cardiovascular.
Por otro lado, en el caso concreto de la artritis reumatoide (AR), una de las primeras experiencias se remonta a 1949, cuando Philip Hench comunicó un efecto clínico espectacular tras administrar GC en pacientes con AR11. Aunque desde entonces el arsenal terapéutico ha aumentado enormemente con el inicio del uso de los FAME sintéticos y la posterior llegada de las terapias biológicas, los GC siguen siendo una terapia muy empleada en la AR12,13.
Curiosamente, más de 60 años después todavía existen dudas respecto al papel exacto que juegan los GC actualmente en el manejo de la AR. Así, existe cierta variabilidad en las recomendaciones dadas por sociedades científicas, tanto nacionales como internacionales. En todas se recomienda su uso en la AR de inicio como tratamiento coadyuvante de los FAME sintéticos14–19. Sin embargo, no todas hacen referencia a su uso en las AR establecidas; algunas recomiendan su uso en este tipo de pacientes como tratamiento sintomático15, o si hay fallo a FAME o biológico14, o en caso de reactivaciones17. A partir de aquí, las indicaciones muchas veces son poco precisas, especialmente en relación con las dosis, los plazos y las suspensiones, aunque en general se recomienda el uso de GC a las dosis más bajas posible con el objetivo de ir disminuyéndolas hasta su suspensión, en el menor tiempo posible14,16,18,19. En cuanto a la definición de dosis bajas, en ocasiones simplemente se indica «dosis bajas»16; en otras, se definen como≤10mg/día, como en el documento de la ACR14, o de 7,5mg/día en el de EULAR19. En cuanto a los plazos, nos podemos encontrar, por ejemplo, con recomendaciones de un uso temporal (<6 meses)18, o en ciclos cortos al iniciar o cambiar de FAME19. La guía de APLAR, por otro lado, incluye las dosis altas para manifestaciones extraarticulares17, y las de EULAR, las infiltraciones locales con GC para los síntomas locales de inflamación18, así como la dosis única intramuscular (120mg de metilprednisolona) y la dosis única intravenosa (250mg de metilprednisolona)19. Por otro lado, el documento de consenso de PANLAR sobre el manejo de la AR no hace mención del uso de GC20.
Con base en lo anteriormente descrito, y en el contexto del proyecto NEXUS, el objetivo de esta revisión sistemática fue básicamente el de analizar la eficacia y la seguridad del uso de los GC en la AR para, con ello, emitir una serie de recomendaciones prácticas que sirvan de guía a los clínicos en la práctica diaria.
MétodosProyecto NEXUSEsta publicación forma parte del proyecto NEXUS, compuesto por 2 coordinadores nacionales, 8 grupos de trabajo con un coordinador regional cada uno y 2 o 3 revisores (dependiendo del grupo), para un total de 22 revisores. Cada año se analizan distintos temas de interés en el ámbito de la AR; los de la presente edición han sido el uso de GC y de la terapia combinada con FAME sintéticos en la AR. La Sociedad Española de Reumatología garantiza que la metodología usada es adecuada, pero no avala las conclusiones, puesto que tiene posiciones oficiales al respecto.
Protocolo de la revisiónEn un primer momento el coordinador generó las siguientes preguntas para que fueran contestadas mediante una RSL: ¿cuál es la dosis efectiva de GC? (dosis a la que disminuye e, incluso, controla totalmente la actividad AR u otros parámetros de eficacia), ¿a qué dosis (y/o dosis acumuladas) de GC aparecen AA, qué tipo de AA?, ¿qué son bajas dosis de GC? (las definiciones dadas por los artículos, especialmente si es que la definen), ¿cuál es el patrón, esquema, protocolo de uso de los GC en la AR? (en las AR de inicio, establecidas o en caso de brote, a qué dosis se inician, mantienen, cómo se disminuye la dosis, en qué plazos, etc.). Con las mismas se definió un protocolo de la RSL.
PICO y criterios de selección de estudiosLas preguntas anteriormente mencionadas se transformaron en el PICO con el que se definieron los criterios de inclusión y exclusión. Se seleccionaron estudios que incluyesen pacientes con AR (criterios internacionales o a juicio del clínico), adultos (≥18 años), independientemente de la duración de la enfermedad o los tratamientos previos ?P?; en tratamiento con GC ?I? con o sin FAME (sintético o biológico), independientemente del tipo, la dosis, el esquema de tratamiento, la vía de administración, etc. Como comparador ?C?, los estudios podían utilizar el placebo o un comparador activo (AINE, FAME, etc.). Además, se buscaron artículos que en sus resultados ?O, por outcomes? analizasen las características de los GC empleados, la dosis y/o el tiempo de uso de GC a los que se produce eficacia (cualquier parámetro utilizado habitualmente para medir eficacia clínica en la AR), dosis y/o tiempo de uso de GC con AA y tipos de AA. También aquellos que definiesen qué es dosis baja de GC, dosis acumuladas y efecto sobre el paciente, etc. Finalmente, solo se incluyeron estudios con los siguientes diseños: metaanálisis, revisiones sistemáticas y ensayos clínicos aleatorizados (ECA). Se excluyeron los estudios en animales y de ciencia básica.
Estrategia de búsquedaCon la ayuda de una experta documentalista se generaron las estrategias de búsqueda para las distintas bases de datos. Para ello se utilizaron términos MeSH y términos en texto libre. Como límites se buscaron solo artículos en humanos, y en inglés o español.
Para esta revisión se han cribado las siguientes bases de datos bibliográficas: Medline, Embase y Cochrane Library (todas, desde su inicio hasta julio de 2017). Dado el volumen de citas que se recuperó, se decidió no revisar la literatura gris de los principales congresos de Reumatología, nacionales e internacionales. Posteriormente, se realizó una búsqueda manual secundaria de la bibliografía de los artículos que finalmente se incluyeron. En el material suplementario se muestran las estrategia de búsqueda en Medline, Embase y Cochrane, así como el número de citas que se recuperaron.
Todas las citas resultantes de las búsquedas se introdujeron en el programa EndNote para facilitar su gestión.
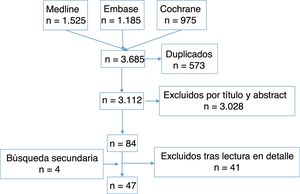
Selección de artículosA continuación, 2 revisores realizaron la primera selección de artículos resultantes de la estrategia de búsqueda con su lectura por título y abstract, siguiendo los criterios de inclusión y exclusión, de forma independiente. En caso de discrepancia, una tercera revisora se encargó de decidir. Posteriormente, 10 revisores realizaron la segunda selección de artículos con su lectura en detalle, de forma independiente y aplicando los mismos criterios de inclusión y exclusión. Para ello, el número de citas recuperadas se distribuyó equitativamente entre los 10 revisores. Además, uno de los revisores de la fase anterior también revisó todos los artículos de esta fase actuando como el comparador de los 10 revisores. En caso de discrepancia, el otro revisor de la fase anterior resolvió el problema. En la figura 1 mostramos el diagrama de flujo del proceso de selección de los artículos, y en el material suplementario, las características de los estudios incluidos y excluidos.
Recogida de datos y evaluación de la calidad de los estudiosLos 10 revisores, así como uno de los revisores de la primera fase de selección, recogieron los datos de los estudios incluidos utilizando plantillas específicas prediseñadas para esta revisión (CRD). Para evaluar la calidad metodológica de los estudios incluidos, se utilizó la escala de Jadad21. De nuevo, en casos de discrepancia el otro revisor de la fase anterior resolvió el problema.
Análisis y presentación de los datosSe crearon tablas de evidencia y de resultados en las que se describen las principales características y resultados de los estudios incluidos. Algunos de estos se expresan como número y porcentaje, media y desviación estándar, mediana y rango intercuartílico (p25-p75); otros, como odds ratio, riesgo relativo o hazard ratio, y sus intervalos de confianza al 95%. Solo se valoró la posibilidad de realizar un metaanálisis en caso de homogeneidad.
Reunión de grupo nominal y generación de las recomendacionesEn una reunión de grupo nominal de 2 días a la que asistieron todos los integrantes del proyecto NEXUS, se presentaron y discutieron los resultados de la RSL. Con ello se consensuaron una serie de recomendaciones. A cada una de las recomendaciones, con asistencia de la metodóloga, se les asignó un nivel de evidencia y un grado de recomendación según las recomendaciones para medicina basada en la evidencia del Centre for Evidence-Based Medicine de Oxford22.
ResultadosLas estrategias de búsquedas recuperaron 3.112 citas (fig. 1), de las que finalmente se incluyeron 47 ECA23–69, de calidad variable (Jadad 1 a 5), la mayoría moderada. La duración también fue variable, desde 12 semanas27 hasta 4 años39. El artículo más antiguo es del año 1954 y el más reciente se publicó en 2016. Se analizaron más de 5.000 pacientes con AR, tanto de inicio23,25,55,58 como establecida26,27,29,40,64. En cuanto a las variables de resultado analizadas y sus instrumentos, en los estudios se incluye la actividad de la AR (recuentos articulares, índices compuestos, rigidez matutina), función (Health Assessment Questionnaire), daño radiográfico (Sharp van der Heijde, Sharp, Larsen, Ratingen), calidad de vida (SF-36, EuroQol), dolor (escala analógica visual), calidad del sueño (escala analógica visual), valoración global del paciente y valoración global del médico con escala analógica visual, o variables relacionadas con su empleo.
La tabla 1 resume las conclusiones y las recomendaciones de la RSL. Se puede consultar también el material suplementario.
Conclusiones principales y recomendaciones de la revisión
| Conclusiones | |
| 1 | Se consideran dosis bajas de corticoides las iguales o inferiores a 7,5mg/día de prednisona o su equivalente (NE 5; GR D) |
| 2 | Los corticoides en combinación con los FAME ayudan a controlar la actividad de la enfermedad e inhibir la progresión radiográfica, especialmente en el corto-medio plazo y en las AR de inicio (NE 1b; GR A) |
| 3 | Los corticoides pueden mejorar otras variables como la función y el dolor (NE 1b; GR B) |
| 4 | Distintos tipos de corticoides y vías de administración son eficaces (NE 1a; GR A) |
| 5 | Con la evidencia disponible no es posible definir una pauta estandarizada que sea claramente superior en la relación eficacia/seguridad en la dosis de inicio, desescalada y duración del tratamiento con los corticoides (NE 5; GR D) |
| 6 | Los AA con el uso de corticoides son muy frecuentes, dependen de la dosis y el tiempo de administración y su gravedad es muy variable (NE 1a; GR A) |
| Recomendaciones | |
| 1 | En pacientes con AR de inicio se recomienda el tratamiento con corticoides en combinación con FAME sintéticos (NE 1b; GR A) |
| 2 | En AR establecidas se recomienda individualizar el uso de corticoides como tratamiento sintomático (NE 5; GR D) |
| 3 | Se recomienda como terapia puente en la AR de inicio tanto el uso de corticoides a dosis bajas (≤7,5mg/día de prednisona o equivalente) como a dosis medias (30mg/día) en pauta descendente rápida (NE 1b; GR A) |
| 4 | En pacientes con AR se recomienda utilizar corticoides a la menor dosis eficaz y durante el menor tiempo posible (NE 1b; GR B) |
| 5 | Si se plantea el uso de corticoides en pacientes con AR se recomienda evaluar a los pacientes antes de iniciar el tratamiento para descartar comorbilidades y riesgo de infección (NE 5; GR D) |
| 6 | Si se pautan corticoides a medio-largo plazo en pacientes con AR se recomienda una monitorización estrecha de los factores de riesgo cardiovascular y de la densidad mineral ósea (NE 5; GR D) |
| 7 | Si se pautan corticoides a medio-largo plazo en pacientes con AR se recomienda la profilaxis de osteoporosis inducida por corticoides (de acuerdo con las recomendaciones de las guías internacionales) (NE 5; GR D) |
AR: artritis reumatoide; FAME: fármacos modificadores de la enfermedad; GR: grado de recomendación; NE: nivel de evidencia.
No existe una definición universal aceptada de dosis bajas de GC. Dependiendo del estudio, se consideran generalmente dosis de hasta 15mg/día5,6: 5mg/día68,70, 6,25mg/día51,71, 7mg/día28, 7,5mg/día23,24,33,47,54,72,73, 10mg/día48,57,74,75, 15mg/día76,77. En un estudio se consideran dosis de 5mg/día o inferiores como dosis muy bajas61.
Características del uso de los GCLos que más frecuentemente se prescribieron fueron prednisona y prednisolona, pero también otros como metilprednisolona, dexametasona, acetato de cortisona o deflazacort. Se administraron principalmente por vía oral, pero también intramuscularmente29 e, incluso, en bolos intravenosos23 o como infiltración intraarticular40,49.
Se usaron en monoterapia o asociados a otros FAME (a su vez, en monoterapia23–25,41,51,58,60 o en terapia combinada23,25,32,49,62), a dosis muy variables, tanto de inicio como de mantenimiento. Las dosis de inicio variaron desde<15mg/día6 hasta un mínimo de 1-4mg/día52; hubo estudios donde comienzan con dosis altas de 60mg/día y van bajando la dosis hasta los 7,5mg/día25,36. Las dosis de mantenimiento son también muy variables, pero generalmente<7,5mg/día.
En cuanto a los esquemas de tratamiento, se han publicado distintos tipos. En general, al usar dosis más altas de inicio el descenso se realiza también con dosis mayores, describiéndose reducciones de hasta 10mg/sem. La dosis de descenso más baja encontrada ha sido de 2,5mg/sem. En muchos estudios se va disminuyendo la dosis progresivamente hasta llegar a lo que se considera como mínima dosis efectiva (criterio generalmente no definido)34,35,78. La tabla 2 describe los principales esquemas encontrados en la RSL23,25,30,31,36,38,48,51,53,55,58–60,64,79.
Esquemas de tratamiento con corticoides
| 1 | Prednisolona, 1.a semana 60mg/día, 2.a semana 40mg/día, 3.a semana 25mg/día, 4.a semana 20mg/día, 5.a semana 15mg/día, 6.a semana 10mg/día, 7.a semana 7,5mg/día. Esta pauta algunos autores la consideran en la estrategia COBRA clásica |
| 2 | Esta es, según los autores, una estrategia COBRA Light. Prednisolona semana 30mg/día, 1.a semana 27,5mg/día, 2.a semana 25mg/día, 3.a semana 22,5mg/día, 4.a semana 20mg/día, 5.a semana 17,5mg/día, 6.a semana 15mg/día, 7.a semana 12,5mg/día, 8.a semana 10mg/día, 9.a semana 7,5mg/día |
| 3 | Esta es la incluida en las estrategias COBRA Slim y COBRA Avant-Garde. Prednisolona semana 30mg/día 1.a semana, 20mg/día 2.a semana, 12,5mg/día 3.a semana, 10mg/día 4.a semana, 7,5mg/día 5.a semana, 5mg/día 6.a semana |
| 4 | Prednisona 60mg/día 1.a semana → 40mg/día 2.a sem → 25mg/día 3.a semana → 20mg/día 4.a semana → 15mg/día 5.a semana → 10mg/día 6.a semana → 7,5mg/día hasta la semana 28, con posterior retirada de un día a la semana de prednisona, 2 días por semana, 3 días por semana, 4 días por semana, 5 días por semana, 6 días por semana y 7 días por semana, hasta suspensión total la semana 35 |
| 5 | Prednisolona 60mg/día inicialmente, reducido hasta 7,5mg/día a las 6 semanas, 7,5mg/día de la semana 6 a la 28, se suspende a la semana 34 |
| 6 | Prednisona 60mg/día durante una semana, descendiendo hasta 7,5mg/día en la semana 7 hasta la 28 y finalmente se reduce hasta suspender en la semana 36 |
| 7 | Prednisona 20mg/día (días 1-5), 10mg/día (días 6-10), 5mg/día (días 11-14), luego ajuste según actividad de la enfermedad |
| 8 | Prednisona 30mg/día por 15 días → 20mg/día por 15 días → hasta 2,5-15mg/día para controlar la actividad de la AR |
| 9 | Prednisona 20mg/día (días 1-5), 10mg (días 6-10), 5mg/día a partir de entonces ajustado según clínica |
| 10 | Prednisona 15mg/día un mes, si respuesta clínica (según criterio del paciente) se bajaba en 2,5mg/día a intervalos de 4 semanas hasta mínima dosis eficaz |
| 11 | Prednisona 20mg/día 15 días → 10mg/día 90 días |
| 12 | Deflazacort 24mg/día 15 días → 13mg/día 90 días |
| 13 | Prednisona 10mg/día durante 12 semanas y reducción a 7,5mg/día las semanas 13 y 14, luego a 5mg/día semanas 15 y 16, a 2,5mg/día semanas 17 y 18 para suspender con lo que no hay prednisona las semanas 19 y 20 |
| 14 | Prednisona 12,5mg/día durante 2 semanas, con descenso progresivo (pauta no especificada) a 6,25mg/día |
AR: artritis reumatoide.
En cuanto a la actividad de la AR, los GC producen un mejor control en comparación con el placebo o los AINE (como ibuprofeno o AAS), al menos en el corto-medio plazo6,27,42,43,65,66. Además, su combinación con los FAME sintéticos (monoterapia o terapia combinada), en AR precoz (≤2 años), consigue una mejora mayor y más rápida23,25,51, aunque en la AR establecida también ayudan en el control de la actividad26,27,29,40,64. Este control se consigue incluso con dosis bajas (≤7,5mg/día de prednisona o equivalente)27 y desde el primer mes (efecto rápido)29, aunque los GC a dosis medias (20-30mg/día prednisona o equivalente)60 o altas (60mg/día) con reducción de dosis rápida30,36 también han demostrado eficacia como terapia puente. A largo plazo también hay datos que evidencian su eficacia clínica30,39,54. Una alternativa a los GC orales con reducción de dosis rápida puede ser una inyección intramuscular de 120mg de metilprednisolona o un bolo intravenoso de 250mg23,29. Las infiltraciones intraarticulares también pueden ayudar en el control de la actividad en pacientes con FAME38,40,49. Finalmente, en términos del control de la actividad, no se ha demostrado que una dosis de inicio, un esquema de descenso o una dosis de mantenimiento sea mejor que otra31, aunque se ha visto que en AR controladas, dosis de 5mg/día de mantenimiento producen un efecto positivo52.
Por otro lado, al analizar la progresión del daño radiográfico, los GC ayudan a los FAME en la inhibición de la misma como mínimo durante los primeros 2-3 años de tratamiento7,23,24,29,30,36,37,53,54,57,61; algunos estudios demuestran que este efecto protector continúa hasta los 4-5 años39, tanto con dosis de inicio medias-altas25,30,53 como bajas (<10mg/día)24,39,54,57,61. Sin embargo, hay que indicar que no todos los ECA confirman su capacidad para prevenir el daño radiográfico58,59.
En relación con la función, el uso de GC al inicio de la AR junto con FAME ayuda a mejorarla sobre todo en el corto plazo26,29,30,36,37,54, donde la mejoría en más rápida (mejor que si no se asocian), tanto con dosis de inicio medias-altas (15-60mg/día)30,36,37 como bajas (≤10mg/día)26,39,54. A largo plazo también puede contribuir positivamente, hasta los 4 años23,24,39.
Se ha visto también que en pacientes con AR controlada, las dosis de mantenimiento bajas (<5mg/día) pueden contribuir al control del dolor52. La calidad de vida puede mejorar con el uso de GC26,30,53, pero su eficacia en relación con otras variables como la valoración global del médico, la valoración global del paciente o las relacionadas con el ámbito laboral actualmente está poco analizada29,52. Y al igual que en el control de la actividad de la AR, no existe una dosis de inicio, un esquema de reducción de dosis o una dosis de mantenimiento mejor que otra.
SeguridadLa aparición de AA con el uso de GC (cualquier tipo y vía de administración) en pacientes con AR es muy frecuente; la tasa de cualquier AA varía desde menos del 50%27 hasta casi el 100% según el artículo31. La mayoría son dependientes de la dosis y pueden aparecer (muchos) con ciclos muy cortos de GC27,32,37,38,44,49. Por otro lado, la tasa de AA graves es baja, generalmente inferior al 5%, las muertes, excepcionales, y la tasa de interrupción también es baja, al menos en el corto plazo23,24,26,27,29,30,43,44,53.
Los AA más frecuentes, especialmente a corto plazo, son digestivos (náuseas, vómitos, dispepsia, gastritis, etc.), cefalea, ansiedad, hipertensión arterial, hiperglucemia y trastornos cutáneos27,31,32,36–38,43,44,49; a medio-largo plazo, osteoporosis, infecciones, eventos cardiovasculares y otros factores de riesgo cardiovascular28–30,36,43,44,50,51,53,54,57,60,61.
Por otro lado, en relación con el metabolismo óseo y la osteoporosis, existe una clara asociación con una disminución de la densidad mineral ósea a nivel lumbar y de cadera (menos claro, depende del estudio)33,80, dependiente de la dosis, cuyo proceso comienza desde el inicio del tratamiento81. El uso a largo plazo está asociado a fracturas vertebrales incluso con dosis bajas (<10-15mg/día)6.
En cuanto al riesgo cardiovascular, los GC incrementan el riesgo de cualquier evento cardiovascular (riesgo relativo 1,47; intervalo de confianza del 95% 1,34-1,60; p<0,001), así como de IAM, ACVA, insuficiencia cardiaca y AA mayor cardiovascular82,83.
Respecto a las infecciones, con base en los datos de los ECA no se ha podido objetivar una clara asociación con las mismas, quizá debido a su diseño, el tipo de pacientes incluidos y el número tan pequeño de AA de este tipo84. Sin embargo, en estudios observacionales sí que se ha visto claramente como un factor de riesgo para las infecciones85,86, especialmente en pacientes de mayor edad.
Finalmente, es imposible determinar si dosis o esquemas de administración concretos implican una clara mejoría en términos de seguridad, salvo el uso de dosis lo más bajas posible y el tratamiento preventivo de la osteoporosis41.
DiscusiónLos GC actualmente tienen un papel muy importante en el manejo de los pacientes con AR, avalado por la evidencia y muchos años de experiencia clínica5–10. Sin embargo, especialmente su perfil de seguridad hace que puedan existir limitaciones en cuanto a su uso5–10. Es por ello que las recomendaciones emitidas por sociedades científicas nacionales e internacionales van encaminadas, en general, a un uso de los GC en la AR a las dosis más bajas y durante el menor tiempo posible14,16,18,19.
Las conclusiones expuestas en este documento pretenden ayudar al clínico con el uso de GC, bien reforzando (por su trascendencia) los mensajes ya emitidos, bien concretando otros aspectos donde pudiesen existir más dudas. En resumen, con base en su demostrada eficacia, pero también en sus AA, hemos recomendado su uso especialmente en AR de inicio, siempre a las dosis más bajas y durante el tiempo más corto posible. También queremos señalar que no hemos encontrado ninguna dosis de inicio, esquema de tratamiento o vía de administración mejor que otra.
Esta RSL presenta algunas limitaciones. A pesar del gran número de ECA analizados, existe una gran variabilidad entre ellos, en relación, por ejemplo, con la calidad de los estudios, sus contextos, es decir, se han analizado artículos con más de medio siglo de diferencia, con las desigualdades tan abismales que existen respecto a nuestra praxis. También el hecho de que se utilicen los GC a dosis, vías de administración, descenso de dosis y duraciones diferentes limita o complica en ocasiones la estandarización de los resultados. De igual manera, el uso concomitante de otros fármacos en muchos estudios puede influir en los resultados globales, haciendo difícil a veces calcular la verdadera magnitud de los efectos de los GC. Además, el diseño de los ECA no siempre permite una correcta evaluación del perfil de seguridad de los fármacos, en este caso de los GC.
Pero, a pesar de estas limitaciones, y ayudados por muchos años de experiencia en el uso de los GC en la AR, esperamos que los resultados, las conclusiones y las recomendaciones emitidos en este documento puedan contribuir positivamente al uso racional de estos fármacos en la AR.
FinanciaciónEl proyecto NEXUS estuvo financiado por Roche, que no participó en la elección de los temas ni en el desarrollo de la revisión, las conclusiones o las recomendaciones.
Conflicto de interesesLos autores refieren no tener ningún conflicto de intereses.
A Roche, por su implicación en el proyecto NEXUS. A los integrantes del grupo NEXUS, por su participación en la revisión: Rosa Gonzalez Crespo y Alejandro Escudero. Y a las Dras. Liliana Ercole y Estíbaliz Loza, por su coordinación metodológica y logística.