La enfermedad injerto contra receptor crónica (EICRc) es una complicación inmunomediada sistémica que aparece en aproximadamente la mitad de los pacientes sometidos a trasplante alogénico de progenitores hematopoyéticos (alo-TPH) y, aunque se asocia con efectos beneficiosos de injerto versus tumor y tasas de recaída más bajas, sigue siendo la principal causa de morbimortalidad tardía en estos pacientes. El objetivo de esta revisión sistemática de la literatura es proporcionar una visión actual sobre las manifestaciones musculoesqueléticas diagnósticas de EICRc, su evaluación clínica y sus posibilidades terapéuticas.
MétodosSe realizó una búsqueda sistemática en PubMed, Embase y Cochrane Library. Se incluyeron estudios de los últimos 20 años, y se dio prioridad a los estudios transversales para evaluar métodos diagnósticos y a los ensayos clínicos en el caso de artículos referidos a tratamiento. La búsqueda se limitó a humanos y a artículos publicados en inglés o español.
ResultadosIdentificamos 6423 estudios, de los cuales finalmente seleccionamos 86 (37 sobre clínica y evaluación diagnóstica y 49 sobre tratamientos). Los estudios específicos de complicaciones fasciales y articulares son escasos y de baja calidad, al incluir únicamente casos clínicos aislados o series de casos. La detección temprana de la EICRc con afectación fascial y/o articular requiere de evaluaciones cuidadosas y repetitivas, incluidos exámenes físicos por parte de especialistas con experiencia en trasplantes, comenzando antes del trasplante y continuando a través del seguimiento posterior, para permitir el diagnóstico y la evaluación de la trayectoria de la enfermedad.
ConclusionesEs necesaria la búsqueda de nuevos biomarcadores o de técnicas de imagen avanzada que permitan realizar un diagnóstico precoz. La fisioterapia es esencial para mejorar la funcionalidad y prevenir la progresión de la enfermedad. Se precisan estudios controlados para establecer recomendaciones sobre las segundas líneas de tratamiento. Por su carácter multisistémico, la EICRc requiere un abordaje multidisciplinar.
Chronic graft-versus-recipient disease (cGVRD) is a systemic immune-mediated complication that occurs in approximately half of the patients undergoing allogeneic haematopoietic stem cell transplantation (allo-HCT) and, although it is associated with beneficial graft versus tumour effects and lower relapse rates, it remains the leading cause of late morbidity and mortality in these patients. The aim of this systematic review of the literature is to provide a current overview on the diagnostic musculoskeletal manifestations of cGVRD, its clinical evaluation, and therapeutic possibilities.
MethodsWe ran a systematic search in PubMed, Embase, and Cochrane Library. Studies from the last 20 years were included. Priority was given to cross-sectional studies to evaluate diagnostic methods and to clinical trials in the case of articles referring to treatment. The search was limited to humans and articles published in English or Spanish.
ResultsWe identified 6423 studies, of which we selected 86 (37 on clinical and diagnostic evaluation and 49 on treatments). Specific studies on fascial and joint complications are scarce and of low quality, including only isolated clinical cases or case series. Fasciitis is the most relevant musculoskeletal manifestation, and isolated joint involvement is low, sometimes unnoticed and underdiagnosed, if a thorough exploration of joint mobility is not performed. Early detection of cGVRD with fascial and/or joint involvement requires careful and repeated evaluation.
ConclusionsThe search for new biomarkers or advanced imaging techniques that allow early diagnosis is necessary. Physiotherapy is essential to improve functionality and prevent disease progression. Controlled studies are needed to establish recommendations on second lines of treatment. Because of its multisystemic nature, cGVRD requires a multidisciplinary approach.
El trasplante alogénico de progenitores hematopoyéticos (alo-TPH) es el tratamiento de elección y la única estrategia curativa en múltiples patologías hematológicas malignas y no malignas1. Consiste en la sustitución completa de la hematopoyesis del paciente, por ser insuficiente o neoplásica, por células progenitoras hematopoyéticas de un donante sano compatible, previo acondicionamiento del paciente con quimioterapia y/o radioterapia. Su eficacia se basa en el efecto beneficioso de los linfocitos del donante, responsables del efecto injerto contra tumor (EICT), en el que actúan las células T del donante frente a las células malignas del receptor, aportando un potencial curativo en hemopatías en las que no es posible alcanzar la curación con el tratamiento quimioterápico o farmacológico disponible2.
La enfermedad injerto contra receptor (EICR) es una de las principales complicaciones no deseables del alo-TPH, correlacionándose con un aumento de la mortalidad, con la presencia de segundas neoplasias y con un impacto negativo en la calidad de vida3. Las principales corrientes de investigación actuales tratan de minimizar el riesgo de EICR manteniendo el EICT. La EICR crónica (EICRc) tiene una incidencia variable en función de los factores de riesgo (30-70%) y es la complicación tardía más frecuente3,4. La mediana de aparición de la EICRc es a los 6 meses tras el alo-TPH y generalmente ocurre dentro de los 3 años posteriores al trasplante4. Las manifestaciones clínicas son muy diversas; los síntomas son característicos de enfermedad alo/autoinmune con datos de inflamación crónica y fibrosis de intensidad variable. Cerca del 50% de los pacientes tendrán una afectación multiorgánica5. La piel es el órgano más frecuentemente afectado, pero es común que se vean comprometidos otros tejidos (mucosa oral, ocular y genital, hígado, pulmones, tracto gastrointestinal) y también articulaciones y fascias. La afectación de los distintos órganos puede ser de forma simultánea o sucesiva, produciendo gran repercusión en la calidad de vida del paciente6,7. Debido a la inmunosupresión mantenida, presentan infecciones frecuentes, que comprometen la supervivencia de los pacientes.
Uno de los mayores desafíos en el manejo de la EICRc es el establecimiento de un diagnóstico correcto de una forma precoz. Reconociendo estas dificultades, el Instituto Nacional de Salud Norteamericano (NIH) promovió la formación de un grupo de consenso internacional de EICRc que propuso unas guías para el correcto diagnóstico clínico y patológico, unificó los criterios de respuesta y realizó recomendaciones del tratamiento de soporte8, con dos actualizaciones posteriores, la última en 20209–11. Este consenso NIH incluye la fascitis y/o contracturas articulares como criterio diagnóstico definitivo de EICRc (no precisando pruebas complementarias adicionales) (tabla 1). La reducción del rango de movilidad articular es generalmente secundaria a los cambios esclerodermiformes y/o fascitis, ya que la afectación articular inflamatoria se ha objetivado en muy raras ocasiones. Para una correcta aproximación diagnóstica de EICRc se requiere establecer el diagnóstico, puntuar la gravedad de cada órgano afectado y clasificar la EICRc en leve, moderada o grave.
Criterios diagnósticos y distintivos de EICR crónica musculoesquelética
| Órgano | Diagnóstico(suficiente para establecer diagnóstico de EICRc) | Distintivo(observado en EICRc, insuficiente por sí solo para establecer diagnóstico) | Otras características o entidades |
| Músculo, fascia, articulación | Fascitis, contracturas articulares secundarias a esclerosis | Miositis o polimiositis | Edema, calambres musculares, artralgia o artritis |
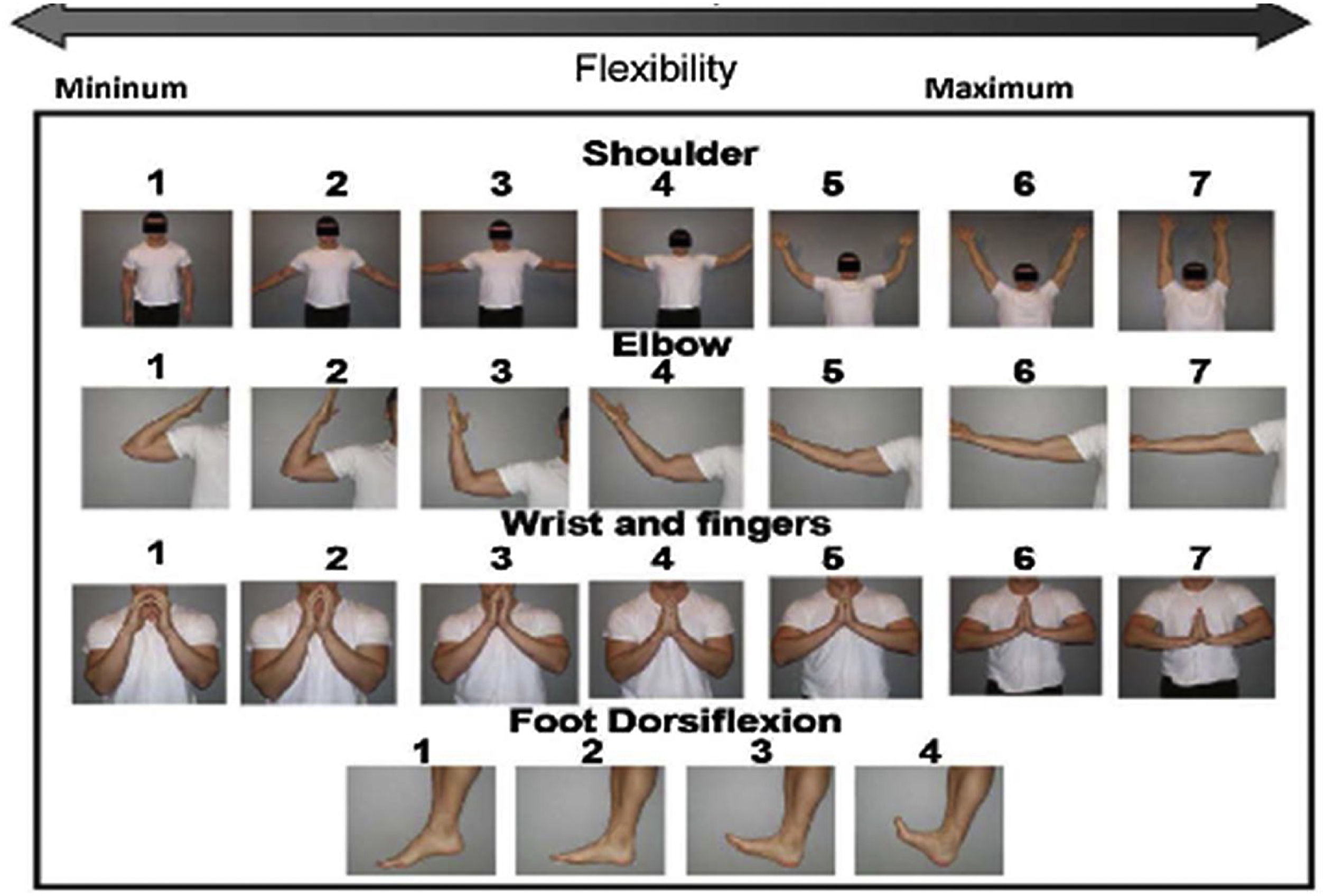
Se han propuesto diferentes escalas para valorar la afectación de fascias y articulaciones: la escala articular/fascial de NIH (Joint and Fascia Score) de 0-3 es un índice compuesto que evalúa la rigidez articular, el rango de movilidad (ROM) y las actividades de la vida diaria (AVD) (tabla 2). La escala fascial de Hopkins utiliza una escala de 0-3 puntos, pero solo puntúa la rigidez. La escala de rango de movimiento fotográfico (P-ROM) es una serie de imágenes que captura ROM por separado para hombros, codos, muñecas/dedos y tobillos; las puntuaciones más bajas indican un ROM más limitado. La puntuación total de P-ROM es la suma de las puntuaciones en las 4 articulaciones, con una puntuación máxima posible de 25 (fig. 1). El uso de la escala P-ROM ha supuesto un gran avance en términos de simplicidad y objetividad; además, es útil en la detección de cambios longitudinales midiendo la respuesta al tratamiento. La escala NIH captura con mayor precisión la mejoría, mientras que la escala P-ROM captura mejor el empeoramiento12,13.
Escala articular/fascial NIH
| 0: Asintomático |
| 1: Tirantez en brazos o piernas, movilidad articular normal o levemente disminuida que no afecta las AVD |
| 2: Tirantez en brazos o piernas, contracturas articulares, eritema debido a fascitis, movilidad articular afectada moderadamente que limita las AVD de manera leve o moderada |
| 3: Contracturas con afectación grave de la movilidad articular que afecta gravemente las AVD (incapaz de atarse los zapatos, vestirse, etc.) |
AVD: actividades de la vida diaria; NIH: Instituto Nacional de Salud Norteamericano.
La piel es el órgano afectado con mayor frecuencia, y muchas veces constituye la manifestación inicial de la EICRc14. La esclerodermia generalizada puede generar contracturas articulares y gran limitación funcional, afectando frecuentemente a manos, muñecas, hombros, codos y tobillos15,16. La fascitis por inflamación de la fascia con un componente eosinofílico puede manifestarse como rigidez, edema, artralgias, reducción de la movilidad y ocasionalmente sinovitis17,18.
Por el carácter multisistémico de la EICRc, su seguimiento y tratamiento requieren un abordaje multidisciplinar19. Dependiendo de su gravedad, de las comorbilidades y del riesgo de recaída de la enfermedad de base del paciente, la primera línea de tratamiento en los casos moderados/graves son los corticoides20. Dos de cada 3 pacientes no van a responder de forma adecuada y mantenida a este tratamiento y requerirán tratamiento de rescate21,22.
ObjetivosRealizar una revisión sistemática de la literatura sobre la afectación musculoesquelética (fascial/articular) como manifestación de la enfermedad injerto contra receptor crónica fenotipo esclerótico en pacientes sometidos a trasplante alogénico de progenitores hematopoyéticos.
Describir las características clínicas, las herramientas diagnósticas y las posibilidades terapéuticas en la actualidad, debido a la ausencia de publicaciones de revisión sobre este tema.
Material y métodosFuentes de datos y estrategia de búsquedaSe realizó una búsqueda bibliográfica en PubMed, Embase y Cochrane, utilizando términos MeSH y palabras clave para seleccionar artículos con información sobre enfermedad injerto contra receptor crónica y afectación musculoesquelética diagnóstica (fascial, articular), caracterización clínica, métodos de evaluación diagnóstica y tratamientos (ver estrategia de búsqueda en el anexo 1 del material adicional).
Criterios de selecciónDado que es un tema poco conocido desde el punto de vista reumatológico, se realizó una búsqueda amplia en la literatura existente. Se incluyeron estudios de los últimos 20 años. Se priorizó la búsqueda de estudios transversales para evaluar los métodos diagnósticos y de ensayos clínicos en el caso de los artículos referentes al tratamiento. Para las manifestaciones clínicas, se tuvieron en cuenta series de casos y estudios prospectivos o retrospectivos. Se excluyeron aquellos artículos sin relación con la búsqueda (necrosis avascular, pérdida de masa ósea, infecciones articulares postrasplante, síndrome de Sjögren y otras enfermedades autoinmunes sistémicas, osteoporosis, osteonecrosis, osteomielitis, afectación únicamente dermatológica, no trasplante alogénico), estudios exclusivamente experimentales/preclínicos, en otros idiomas diferentes a inglés o castellano, aquellos que solo incluían población pediátrica y los que se referían exclusivamente a EICR aguda (EICRa). Excluimos la afectación muscular (miositis) por no ser criterio diagnóstico de EICRc y por la existencia de una revisión sistemática reciente sobre esta manifestación23.
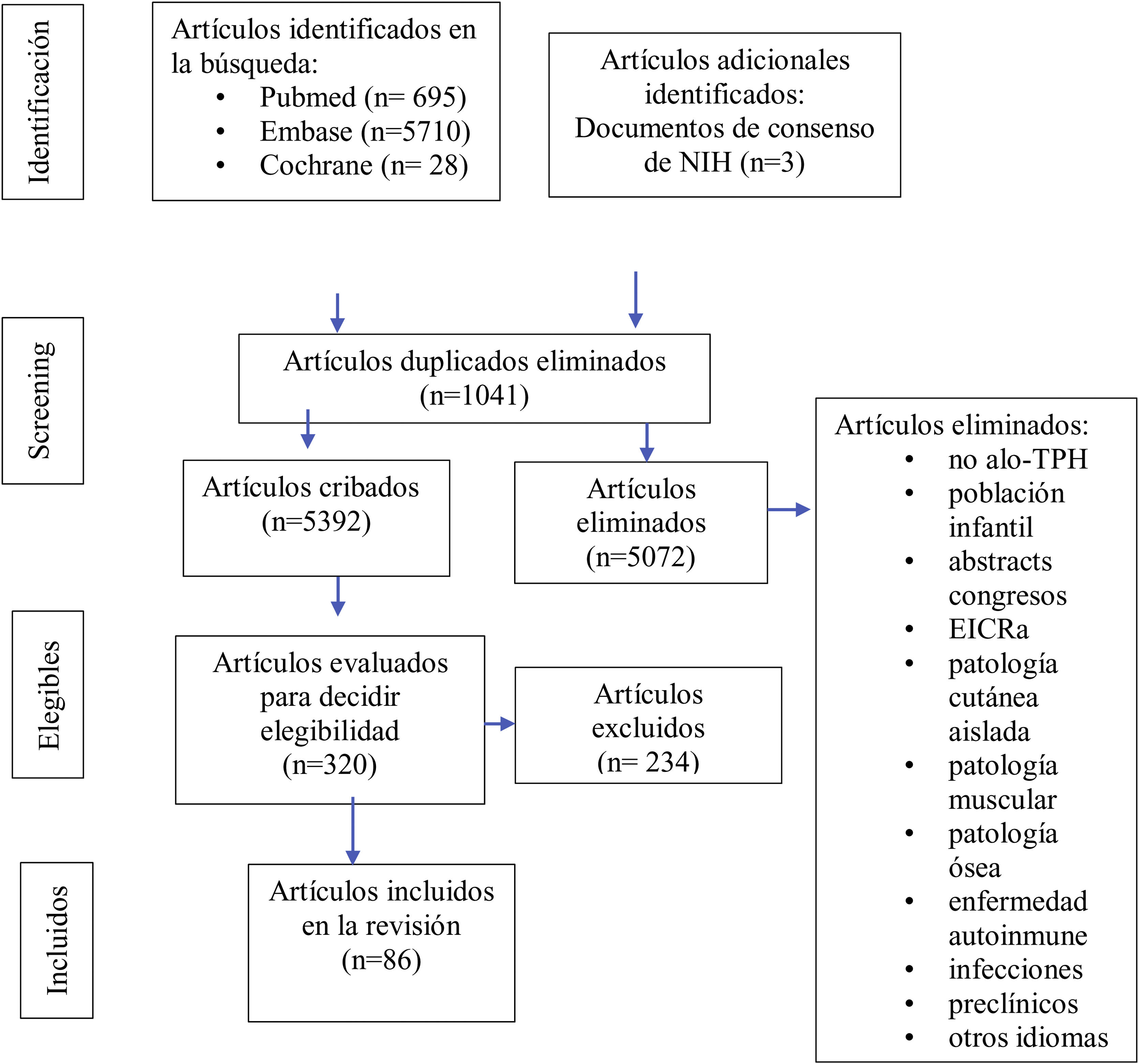
Los criterios de inclusión fueron: estudios originales (ensayos clínicos, revisiones sistemáticas, casos y controles, cohortes prospectivas o retrospectivas, series de casos, casos aislados), receptores de alo-TPH, relación de las manifestaciones musculoesqueléticas con la EICRc. Revisando las referencias de los artículos más relevantes se identificaron otras publicaciones adicionales de interés. Los artículos se importaron al administrador de referencias Zotero y se eliminaron aquellos que estaban duplicados. Todos los resúmenes fueron leídos por CHC y MDSG y se consiguieron los artículos completos para su revisión. Cuando hubo discrepancias se consensuaron con los otros autores (LLC y JML). En la figura 2 se detalla el diagrama de flujo para la selección de los artículos.
Extracción de datosClasificamos los artículos en función de la afectación musculoesquelética a la que se referían (fascitis, artropatía) y según la temática de la publicación (clínica, diagnóstico o tratamiento). Se extrajeron datos demográficos, tiempo postrasplante de la clínica, características diferenciales, tratamiento y otros resultados sobre las distintas técnicas de interés.
ResultadosIdentificamos 6423 estudios, de los cuales revisamos en profundidad 126, para finalmente seleccionar 86: 37 sobre clínica y evaluación diagnóstica (28 en relación a fascitis, de los cuáles 23 hacen referencia a manifestaciones clínicas5,14,17-19,24-42 y 5 a diagnóstico13,43-46, y 9 sobre artropatía, de los cuales 6 sobre clínica6,7,47-51 y 3 sobre diagnóstico13,43-46) y 49 sobre tratamientos administrados (7 sobre fascitis8,12,52-56, 9 referentes a artropatías15,16,57-63 y 33 sobre terapias administradas en EICRc esclerodermiforme con afectación fascial y/o articular64-96) (fig. 2). En el anexo 2 (material adicional) pueden consultarse todos los artículos analizados, con los datos extraídos. En el anexo 3 (material adicional) se adjunta un glosario de términos y el código de colores asociado a cada manifestación musculoesquelética para su mejor comprensión.
La mayoría de los artículos son de baja calidad, al incluir únicamente casos clínicos aislados o series de casos con un tamaño muestral pequeño y no controlados (36 artículos, aproximadamente 41%). También hay 14 revisiones (≈16% de revisiones o consensos), 14 (≈16%) estudios observacionales retrospectivos, 11 (≈12%) prospectivos y solo 7 (8%) de ensayos fase II. Hemos encontrado únicamente 3 revisiones sistemáticas: 3 relacionadas con tratamientos (UVA87, rituximab85 y fotoféresis extracorpórea [FEC])79 y una revisión narrativa exhaustiva sobre fascitis eosinofílica (FE) relacionada con EICRc realizada por CHC y LLC, publicada recientemente24.
Es necesario identificar los primeros signos, síntomas u otros determinantes diagnósticos de la EICRc, que se asocian de manera constante con la progresión posterior a formas altamente mórbidas de EICRc11. La detección temprana de la EICRc requiere evaluaciones cuidadosas y repetitivas, incluidos exámenes físicos por parte de especialistas con experiencia en trasplantes, comenzando antes del trasplante y continuando a través del seguimiento posterior, para permitir el diagnóstico formal y la evaluación de la trayectoria de la enfermedad97. Es importante la educación al paciente para su participación de forma activa en la detección de síntomas y signos tempranos.
FascitisAunque los cambios cutáneos son frecuentes, la detección de fascitis no es tan común y su diagnóstico es más difícil, ya que los signos físicos y los hallazgos de laboratorio no están siempre presentes. La fascitis es la manifestación musculoesquelética más relevante de la EICRc, con una incidencia anual reportada del 0,5- 47%24,31,41,42,48,54. Es importante distinguir la fascitis de la EICR esclerodermiforme, aunque ambas pueden coexistir en hasta el 80% de los pacientes24,48. El edema suele ser el primer signo de afectación fascial42. Las lesiones de fascitis suelen localizarse en las zonas proximales de las extremidades y abdomen, respetando las manos y los pies42,52. La FE-like en el contexto de EICRc tiene apariencia de pseudocelulitis debido a la fibrosis septal y fascial subcutánea, con frecuencia se presenta con induración cutánea, con aspecto de la típica «piel de naranja» u ondulaciones (rippling), artromialgias, eosinofilia periférica y desarrollo de contracturas articulares en los casos más graves (signo del rezo).
Es muy importante realizar una cuidadosa historia clínica del paciente y una exploración física sistematizada5, ya que la fascitis avanzada apenas se distingue de la EICRc esclerótica cutánea65, además de anotar la gradación de la gravedad en hojas de recogida (anexo 4, en material adicional)45.
Al examinar al paciente, la progresión de piel móvil fácil de comprimir a «no movible» y con tirantez similar a una «piedra» por engrosamiento difuso sugiere fibrosis crónica difícil de revertir60. Se debe evaluar el rango de movimiento (idealmente con P-ROM) en todos los pacientes al inicio y en las revisiones posteriores, lo que nos permitirá calificar la gravedad y monitorizar la respuesta al tratamiento5,12,13. Las medidas de elastografía33,80 son prometedoras, aunque no se han realizado ensayos grandes para validarlas. En este sentido, en la mayoría de los artículos se hace hincapié en que el diagnóstico de fascitis se establezca por los hallazgos histopatológicos —indistinguibles de los de la FE clásica— en la biopsia profunda de piel18,25,30,33,41,42 y por las alteraciones en la fascia objetivadas en resonancia magnética18,33,34,36, como prueba no invasiva18, que permite distinguir entre manifestaciones exclusivamente cutáneas, fascitis y miositis, permitiendo también localizar la zona óptima donde realizar la biopsia25.
En los exámenes histopatológicos de la fascitis, el edema y la fibrosis se limitan a las fascias y los septos subcutáneos, con atrapamiento de la grasa subcutánea y un infiltrado linfoplasmocitario celular pericapilar45.
La historia natural de la fascitis en la EICRc a menudo es progresiva, lo que lleva a un deterioro significativo de la calidad de vida y la funcionalidad del paciente por la rigidez, contractura articular y reducción del ROM, además de la aparición de úlceras crónicas y problemas de cicatrización, lo que hace que el diagnóstico y la terapia precoz con inmunosupresión sistémica sean cruciales para prevenir la progresión.
La FEC, con una respuesta del 55-85%, o el PUVA además de la inmunosupresión sistémica, puede mejorar la afectación fascial y prevenir las contracturas56,70,75.
La fisioterapia es el pilar del tratamiento de apoyo de la fascitis58,63,98, especialmente las modalidades térmicas, estiramientos, movilización articular y drenaje linfático, y deben iniciarse lo antes posible con el fin de prevenir o resolver las contracturas articulares. Los ejercicios de fortalecimiento son controvertidos, al igual que la terapia quirúrgica de articulaciones afectadas16. Además, es necesario tener precaución con la fisioterapia o el drenaje linfático en la etapa edematosa aguda de la fascitis, ya que los procesos inflamatorios pueden aumentar por irritación mecánica.
La respuesta al tratamiento de la fascitis en la EICR es difícil de evaluar y a menudo se ha basado en criterios variables y subjetivos, aunque prácticos («respuesta completa», «respuesta parcial», «ningún cambio», «progresión»). Las escalas de afectación cutánea o fascial se han validado prospectivamente35.
ArtropatíaLa afectación de la fascia/articulación es común en pacientes con EICRc, pero la incidencia de afectación articular aislada es baja49, en ocasiones inadvertida e infradiagnosticada en estadios iniciales, si no se realiza una exploración minuciosa de la movilidad articular. En estadios avanzados provocan contracturas articulares, a veces irreversibles, que causan gran discapacidad y pérdida de calidad de vida12. Las articulaciones más frecuentemente afectadas son los tobillos (93%), seguidos de los hombros (19%), muñecas y dedos (16%) y codos (9%). Hay alta correlación de esclerosis fascial/articular con afectación cutánea; se han descrito niveles altos de C348.
En comparación con los pacientes que presentan cambios cutáneos escleróticos, los pacientes con afectación articular parecen tener menos discapacidad funcional, empiezan antes tras el diagnóstico de EICRc y tienen niveles más bajos de marcadores de inflamación49. Se necesitan estudios adicionales para determinar si la afectación articular en ausencia de cambios en la piel representa la participación del tejido profundo por debajo del límite de detección clínica o un proceso clínico separado.
Para el diagnóstico de la afectación articular, se ha empleado ecografía99 y gammagrafía ósea100, además de resonancia magnética y TAC.
También se ha encontrado en la literatura sinovitis relacionada con EICRc, con presencia de células del donante en la infiltración de la sinovial98.
La fisioterapia y rehabilitación son fundamentales; es importante que se inicien de forma precoz: masaje, calor, ultrasonidos, parafina, estiramientos, hidromasaje, fortalecimiento y entrenamiento de AVD63.
Tratamiento farmacológicoEn la EICRc leve se utiliza tratamiento tópico o corticoides sistémicos en monoterapia. Si hay fascitis, debe añadirse AINE. Si la EICRc es moderada, el tratamiento será con un IS sistémico (generalmente prednisona con o sin inhibidores de calcineurina) y tratamiento tópico. Respecto a la EICRc grave, el tratamiento consistiría en el de la EICR moderada, añadiendo otros IS21.
1.a línea de tratamiento:
- -
Prednisona 1mg/kg/día durante 2-3 semanas, luego a días alternos durante 2 semanas y luego disminuir a 1mg/kg cada 2 días durante un período de 6 a 8 semanas si los síntomas son estables o mejoran; mantener esta dosis de 2 a 3 meses o continuar directamente para disminuir en un 10 a 20% por mes20.
- -
Según la gravedad, se asociará a inhibidores de calcineurina (ciclosporina A y tacrolimus).
2.a línea de tratamiento: No hay protocolos establecidos ni un tratamiento estándar, los tratamientos de segunda línea o de rescate se prescriben dentro de las numerosas opciones disponibles, adaptándolos individualmente (tabla 3).
Opciones de tratamiento de rescate en enfermedad injerto contra receptor crónica (EICRc) con afectación fascial/articular
| Tratamiento | Evidencia | Referencias |
|---|---|---|
| Fotoféresis, UVA, UVA 1, UVB | II | 58,61,70,75,79,87,90,91,94,96 |
| Inhibidores de calcineurina (ciclosporina A y tacrolimus) | III-I | 20,70 |
| Inhibidores de mTOR (sirolimus, everolimus) | III-I | 21 |
| Inhibidores de tirosina cinasa (imatinib, dasatinib, bosutinib, ruxolitinib, nilotinib) | III-I | 21,55,71,72,77,78,81,82,84,86,88,91 |
| Inhibidores de proteosoma (ixazomib) | II | 67 |
| Inhibidores de IFN I | 76 | |
| IL2 | III-3 | 68,74 |
| Lidocaína iv | III-2 | 20,95 |
| Rituximab | II | 72,77,85,89 |
| Alemtuzumab | III-3 | 21 |
| Alefacept | III-3 | 21 |
| Pentostatina | II | 21 |
| Láser CO2 | III-2 | 12,67 |
| Anti-TNFα (etanercept, infliximab, adalimumab) | III-3 | 21 |
| Metotrexato | III-I | 21 |
| Vismodegib | III-3 | 64 |
| Células madre mesenquimales | III-3 | 66,83,93 |
| Irradiación toracoabdominal | III-2 | 18 |
| Fisioterapia | III-I | 58,63,98 |
| Lámina tópica de gel de silicona | III-3 | 93 |
| Halofuginona tópica | III-3 | 91 |
Fuerza del nivel de evidencia:
• II: >1 ensayo clínico bien diseñado sin aleatorización, de cohortes o de casos y controles, estudios analíticos (preferiblemente de >1 centro) o de múltiples series de tiempo, o resultados dramáticos de experimentos no controlados.
• III: opiniones de autoridades respetadas basadas en experiencia clínica, estudios descriptivos o informes de comités de expertos:
∘ III-1: varios informes de evaluaciones retrospectivas o pequeños ensayos clínicos no controlados.
∘ III-2: un informe de ensayo clínico pequeño no controlado o evaluaciones retrospectivas.
∘ III-3: reportes de casos.
Existe una necesidad de identificar biomarcadores que permitan prever la respuesta al tratamiento20. Se han descrito células B CD5+ como biomarcador de respuesta al tratamiento con rituximab y nilotinib72.
Debemos destacar también la importancia de la terapia de soporte para la atención a largo plazo de los pacientes, ya que cada vez hay más TPH y los receptores tienen una mayor supervivencia8, y el valor de las consultas multidisciplinares para una atención integral de los pacientes24.
DiscusiónLos estudios y revisiones específicos acerca de manifestaciones musculoesqueléticas en EICRc son limitados y de baja calidad, como hemos reflejado en los resultados.
Hemos constatado que existe una necesidad de evaluar de forma sistemática, objetiva, fiable a la vez que sencilla, las manifestaciones articulares y fasciales, ya que un diagnóstico y tratamiento precoces son decisivos en la evolución del paciente52.
Es destacable que la puntuación de la fascia/articulación de los Consensos NIH no distingue las contribuciones a la gravedad de la EICRc por compromiso articular aislado en comparación con la restricción articular asociada con esclerosis de la piel6–8.
Es cierto que la afectación de la fascia/articulación es frecuente en la EICRc y la incidencia de contractura articular aislada en ausencia de esclerosis cutánea es baja49, pero también es probable que esté infradiagnosticada si no se realiza de forma habitual un examen completo del rango de movilidad; de ahí la importancia de registrar el P-ROM en las revisiones periódicas de los pacientes12,42.
Se necesitan estudios adicionales para determinar si la afectación articular en ausencia de cambios escleróticos de la piel representa la afectación de los tejidos profundos por debajo del límite de detección clínica o si se trata de un proceso clínico separado. Es posible que los refinamientos futuros de los criterios de los NIH deban reconocer las restricciones articulares que ocurren en ausencia de afectación esclerótica de la piel49.
Se desconocen los factores clínicos, genéticos y biológicos que se relacionan de forma específica con la afectación musculoesquelética y articular en pacientes con EICRc31.
En estos pacientes es necesario realizar una evaluación analítica en busca de eosinofilia periférica como marcador serológico precoz de EICRc, en concreto de fascitis, así como la determinación de enzimas musculares25,29–31. La búsqueda de biomarcadores séricos en esta entidad fibrosante, como autoanticuerpos específicos (antiesclerosis) ha resultado infructuosa hasta el momento. En una serie de pacientes con fascitis eosinofílica-like relacionada con EICRc, se detectaron anticuerpos antinucleares positivos en el 25% de los pacientes, siendo el patrón nucleolar el más frecuente24.
Los pacientes con manifestaciones clínicas sugestivas de EICRc similar a FE deben someterse a una biopsia profunda (piel, músculo y fascia) y en algunos casos estudio de resonancia magnética para ver el alcance de la afectación y monitorizar la respuesta al tratamiento25,30. La fascitis según el Consenso NIH es una entidad «diagnóstica» que no necesita confirmación con pruebas adicionales, pero ante síntomas sugestivos como artralgias, calambres musculares, rigidez de la articulación o roce de tendones habría que valorar la realización de pruebas de imagen (RM, US de alta frecuencia)44,80 e incluso biopsia diagnóstica, en determinados casos aislados o dudosos.
La evaluación de la movilidad articular activa como medida objetiva con P-ROM es una muy buena opción en la práctica habitual, junto con la escala de articulación/fascia de los NIH12. La puntuación de la articulación/fascia de los NIH y la puntuación total de P-ROM deben utilizarse para evaluar la respuesta terapéutica en la EICRc articular/fascia. Un cambio de 0 a 1 en la puntuación de la articulación/fascia de los NIH no debe considerarse como un empeoramiento.
En cuanto al tratamiento, siguen utilizándose como primera línea los corticoides a dosis altas, con sus efectos adversos reconocidos (inmunodepresión, osteopenia, necrosis avascular, fracturas, atrofia muscular y cutánea, edema, retraso en cicatrización…) y ante cortico-refractariedad o intolerancia a la primera línea, no hay un tratamiento estándar establecido, por lo que la decisión se basa en las circunstancias de cada paciente, analizadas de forma individualizada. La fisioterapia y otras terapias físicas han demostrado su eficacia para mejorar la funcionalidad y prevenir la progresión de la enfermedad, debiendo iniciarse de forma lo más precoz posible.
ConclusionesLa afectación musculoesquelética relacionada con EICRc es frecuente y puede causar un deterioro funcional significativo, con gran impacto en la calidad de vida. Los estudios específicos de complicaciones fasciales y articulares son escasos y de baja calidad. Uno de los mayores desafíos en el manejo de la EICRc es el establecimiento de un diagnóstico correcto de una forma precoz, para favorecer las probabilidades de respuesta al tratamiento y la prevención de secuelas irreversibles. Se necesitan nuevos biomarcadores que permitan un tratamiento más dirigido en pacientes tras el fallo de la primera línea de tratamiento. La fisioterapia es esencial para mejorar la funcionalidad y prevenir la progresión de la enfermedad, debiendo iniciarse de forma temprana. Por el carácter multisistémico de la EICRc, su seguimiento y tratamiento requieren un abordaje multidisciplinar.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.