El síndrome antifosfolipídico (SAF) se caracteriza por la asociación de los anticuerpos antifosfolipídicos (AAF) con trombosis de repetición, abortos o pérdidas fetales recurrentes y trombocitopenia. Los AAF más estudiados son los anticuerpos anticardiolipina, el anticoagulante lúpico y los anticuerpos anti-ß2-glucoproteína I. El SAF puede presentarse de forma aislada, denominándose SAF primario, o bien asociado a otras enfermedades autoinmunes sistémicas, fundamentalmente a lupus eritematoso sistémico. Más recientemente, se ha descrito un subgrupo de SAF en el que los pacientes desarrollan múltiples trombosis durante un corto espacio de tiempo, que se ha denominado SAF catastrófico. Aunque parece clara la asociación entre la presencia de AAF y trombosis, la actitud terapéutica no debe ir dirigida primariamente a la eliminación o a la reducción de los niveles de estos anticuerpos mediante recambios plasmáticos, gammaglobulinas intravenosas o inmunodepresores (excepto en el SAF catastrófico), ya que no existe una clara correlación entre los niveles de los AAF y los episodios trombóticos. El tratamiento de estos pacientes debe basarse en el uso de antiagregantes plaquetarios o anticoagulantes.
The classical clinical picture of the antiphospholipid syndrome (APS) is characterized by venous or arterial thromboses, fetal losses and thrombocytopenia, in the presence of antiphospholipid antibodies (aPL), namely lupus anticoagulant, anticardiolipin antibodies or antibodies directed to various proteins, mainly β2 glycoprotein I, or all three. Apart from being “primary” (without any discernable underlying systemic autoimmune disease), or associated to another disease (usually to systemic lupus erythematosus), it may also occur rapidly over days or weeks when it has been termed “catastrophic” APS. Therapy should not primarily be directed at effectively reducing the aPL levels and the use of immunotherapy (including high dose steroid administration, immunosuppression or plasma exchange) is generally not indicated, unless in the catastrophic APS. Treatment of APS patients should be based on the use of antiaggregant and anticoagulant therapy.
El término “síndrome antifosfolipídico” (SAF) se utiliza para describir la asociación de los anticuerpos antifosfolipídicos (AAF) a un cuadro clínico de hipercoagulabilidad caracterizado por trombosis de repetición y por abortos o pérdidas fetales recurrentes, que a menudo se acompaña de trombocitopenia discreta o moderada. Los AAF son una familia de autoanticuerpos que reconocen varias combinaciones de fosfolípidos, proteínas unidas a fosfolípidos o ambos. De todos ellos, los más estudiados son los anticuerpos anticardiolipina (AAC), el anticoagulante lúpico (AL) y los anticuerpos anti-ß2-glucoproteína I1.
El SAF puede presentarse de forma aislada, denominándose SAF primario, o bien asociado a otras enfermedades autoinmunes sistémicas, fundamentalmente a lupus eritematoso sistémico (LES). También se pueden detectar AAF en otras situaciones, como infecciones, neoplasias o en relación con la toma de fármacos. Más recientemente, se ha descrito un subgrupo de SAF en el que los pacientes desarrollan múltiples trombosis, sobre todo en los vasos de pequeño calibre de diversos órganos, durante un corto espacio de tiempo, que se ha denominado SAF catastrófico y que es responsable de una mortalidad de hasta un 30%2.
El tratamiento óptimo de los pacientes con SAF es controvertido y está en continua revisión, debido a que el número reducido de pacientes dificulta la elaboración de estudios prospectivos adecuados que permitan obtener conclusiones definitivas. Aunque parece clara la asociación entre la presencia de AAF y trombosis, la actitud terapéutica no debe ir dirigida primariamente a la eliminación o a la reducción de los niveles de estos anticuerpos mediante recambios plasmáticos, gammaglobulinas intravenosas o inmunodepresores (excepto en el SAF catastrófico), ya que no existe una clara correlación entre los niveles de los AAF y los episodios trombóticos. El tratamiento de estos pacientes debe basarse en el uso de antiagregantes plaquetarios o anticoagulantes. Asimismo, en pacientes con AAF deben ser reducidos o eliminados aquellos factores adicionales de riesgo vascular, tales como hipertensión arterial, hipercolesterolemia, tabaquismo o uso de anticonceptivos orales que contengan estrógenos.
Tromboprofilaxis primariaLa primera consideración en los pacientes que presentan títulos elevados de AAF, pero que todavía no han desarrollado trombosis (tromboprofilaxis primaria), debe ser la de evitar o controlar otros factores de riesgo trombótico adicional, tales como el hábito de fumar, el sedentarismo, la ingesta de anticonceptivos orales, la hipertensión arterial, la diabetes, el síndrome nefrótico, etc3.
Respecto al tratamiento farmacológico, la práctica más común es la antiagregación plaquetaria con dosis bajas de aspirina (de 75 a 150mg)3. Sin embargo, uno de los pocos estudios epidemiológicos que incluyen este punto observó que las dosis bajas de aspirina no previenen la trombosis venosa ni el embolismo pulmonar en varones con AAF4. Asimismo, en el único ensayo clínico aleatorizado y controlado con placebo que se ha realizado, Erkan et al5 tampoco encontraron un efecto beneficioso de la aspirina superior al placebo, aunque el número de pacientes que desarrollaron episodios trombóticos fue muy reducido en ambos grupos.
Sin embargo, en otros estudios la aspirina fue eficaz en la prevención de trombosis en pacientes con LES6 y en mujeres con AAF y abortos previos7. No hay datos sobre la eficacia de otros fármacos antiagregantes en pacientes con AAF.
En pacientes con LES, una alternativa a la aspirina puede ser el uso de antimaláricos, como la hidroxicloroquina o la cloroquina. Además de mejorar manifestaciones inflamatorias del LES, como la afectación articular o cutánea, estos fármacos tienen conocidas propiedades antiagregantes8. El inconveniente de su uso a largo plazo es la posibilidad de toxicidad ocular.
El uso de antiacoagulantes orales, manteniendo una intensidad de anticoagulación baja (relación internacional normalizada o RIN = 1,5) se ha demostrado eficaz para prevenir trombosis en otros estados protrombóticos, como el cáncer de mama en estadio IV, cateterización venosa central o pacientes varones con riesgo de enfermedad coronaria. Podría ser, por lo tanto, una alternativa terapéutica en estos pacientes.
Mientras no haya datos avalados por estudios prospectivos más amplios que sugieran otra aproximación farmacológica, la práctica clínica más habitual es tratar con dosis bajas de aspirina a todos aquellos pacientes con AL o con AAC persistentemente positivos, sobre todo si son del isotipo IgG y a títulos medios o altos, así como controlar estrictamente la existencia de otros factores de riesgo asociados9.
Tromboprofilaxis secundariaLos pacientes con SAF que han padecido una trombosis tienen un riesgo elevado de sufrir nuevos fenómenos trombóticos. El tratamiento óptimo para prevenir estas recurrencias es todavía objeto de debate. Mientras la mayoría de los estudios coincide en que el tratamiento con anticoagulantes orales es superior al tratamiento con antiagregantes solamente, no existe el mismo acuerdo sobre la intensidad y la duración de la anticoagulación. El riesgo de hemorragia, que es la mayor complicación del tratamiento anticoagulante, y la necesidad de controlar frecuentemente la intensidad de la anticoagulación mediante la determinación de la RIN son factores que urgen a buscar alternativas terapéuticas. Una característica común a la mayoría de los pacientes con SAF es que las trombosis suelen recurrir en el mismo territorio vascular, es decir, las recurrencias de trombosis venosas suelen ser venosas y las de trombosis arteriales suelen ser también arteriales en casi un 80% de los casos.
Prevención de las recurrencias venosasRespecto a la intensidad de la anticoagulación, varios estudios retrospectivos10–13 encuentran pocas recurrencias o ninguna cuando la RIN es superior a 3. Las mayores limitaciones de estos estudios son sus diseños retrospectivos y el hecho de no analizar separadamente las trombosis venosas y las arteriales, así como la aparición de varios episodios hemorrágicos. Se plantea entonces la cuestión de si todos los pacientes con SAF y trombosis previas necesitan la misma intensidad de anticoagulación. Dos estudios prospectivos concluyen que una RIN entre 2 y 3 es suficiente para evitar recurrencias trombóticas14,15. La anticoagulación con RIN superior a 3 se debería reservar para aquellos casos en que haya recurrencias trombóticas venosas con RIN entre 2 y 3 (fundamentalmente si hay también antecedentes de trombosis arteriales). No se ha demostrado que el añadir aspirina disminuya el riesgo de recurrencias y sí parece aumentar el riesgo de hemorragia16.
Respecto a la duración de la anticoagulación, los estudios de Rosove et al10 y de Khamashta et al11 describen una tasa de recurrencias del 53% y del 69%, respectivamente. El estudio de Schulman et al14 encuentra que la presencia de AAF es un factor de riesgo para recurrencias trombóticas. Estos autores determinaron AAC de isotipo IgG después de la primera trombosis venosa e interrumpieron la anticoagulación en todos los pacientes después de 6 meses. Los resultados fueron que el 29% de los pacientes con AAC tuvo un nuevo episodio trombótico durante el tiempo de seguimiento (4 años) frente al 14% de los pacientes que no tenía AAC. Estos datos sugieren, por tanto, que la anticoagulación no debe suspenderse en pacientes con SAF.
Varios trabajos recientes17–19 revisan los estudios publicados sobre tratamiento de pacientes con SAF después de una trombosis venosa. La recomendación más habitual, por tanto, es utilizar tratamiento con anticoagulantes orales por tiempo indefinido, mientras no haya episodios o claros factores de riesgo de hemorragia (hipertensión arterial no controlada, edad avanzada, etc.) y mantener una RIN entre 2 y 39. En pacientes que hayan sufrido una trombosis venosa claramente asociada a un factor de riesgo conocido, por ejemplo la ingesta de anticonceptivos orales, puede considerarse interrumpir la anticoagulación.
Prevención de las recurrencias arterialesLas trombosis arteriales más frecuentes en los pacientes con AAF son los accidentes vasculares cerebrales (AVC), los accidentes isquémicos transitorios y el infarto de miocardio.
En la población general, las recomendaciones para la prevención de AVC recurrentes dependen de la presencia o no de una patología cardioembólica. Los pacientes con fibrilación auricular son generalmente anticoagulados de por vida con RIN entre 2 y 3. Los antiagregantes se usan sobre todo en AVC no embólicos o en accidentes isquémicos transitorios, a pesar de que algunos estudios han descrito que estos fármacos sólo reducen el riesgo de recurrencia arterial o de muerte en un 13%20. Actualmente, no hay datos concluyentes de estudios prospectivos sobre la prevención de AVC en pacientes con AAF. Las diferentes opciones propuestas incluyen dosis bajas de aspirina u otros antiagregantes, anticoagulación oral con RIN entre 2 y 3 por un tiempo corto o una combinación de ambos tratamientos21–23. Se ha sugerido también tratamiento antiagregante para aquellos pacientes con otros factores de riesgo evidentes para trombosis y para títulos bajos de AAF, reservando la anticoagulación oral para aquellos pacientes con recurrencias trombóticas a pesar del tratamiento antiagregante21. Debido a la alta tasa de recurrencias trombóticas asociada a la presencia de AAF y a la alta morbilidad y mortalidad asociada a AVC e infarto de miocardio, la anticoagulación oral por tiempo indefinido es la opción más ampliamente aceptada9,24. Algunos estudios retrospectivos11,25 y los resultados observacionales de la cohorte Euro-phospholipid26 aconsejan una intensidad alta de anticoagulación (RIN 3-4).
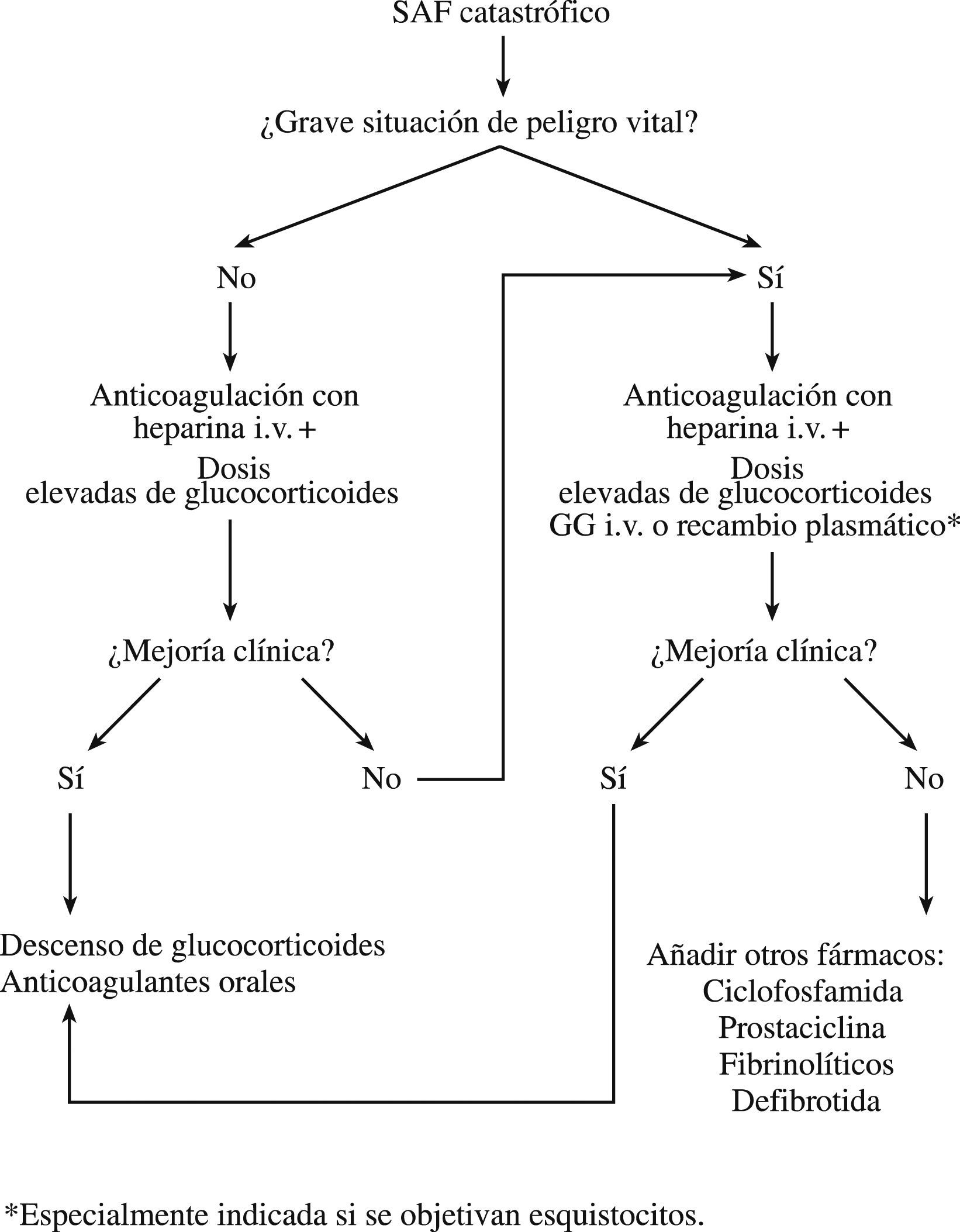
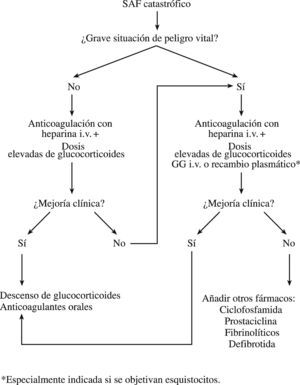
Tratamiento del síndrome antifosfolipídico catastróficoEn el tratamiento para el SAF catastrófico se deben tener en cuenta tres objetivos: tratar cualquier factor desencadenante (el uso temprano de los antibióticos cuando se sospeche alguna infección, amputación de cualquier órgano necrosado, extremo cuidado en los pacientes con SAF que deban someterse a una intervención quirúrgica o a un procedimiento invasivo), tratar los continuos fenómenos trombóticos y suprimir el exceso de la “cascada” de citocinas2,27–31. Los estudios de las grandes series de pacientes con esta enfermedad indican que la combinación de anticoagulación con glucocorticoides junto con los recambios plasmáticos o gammaglobulinas intravenosas proporcionan la más alta tasa de supervivencia (el 70%)29. Por lo tanto, cuando se tiene la sospecha de SAF catastrófico se recomienda el uso de los siguientes tratamientos (fig. 1).
Anticoagulación: es necesaria la administración de heparina intravenosa para inhibir la producción de coágulos y lisar los coágulos existentes. Generalmente es necesario administrar mayor dosis de heparina que la habitual, con un seguimiento con un tiempo de tromboplastina parcial activado (TTPA) seriado para alcanzar una anticoagulación correcta. Se recomienda una dosis intravenosa inicial de 5.000 unidades de heparina seguida de una infusión continua de 1.500unidades/h con un control estricto de TTPA. Si el curso clínico es satisfactorio, se debe mantener la heparina intravenosa durante 7 a 10 días, para luego ser sustituida por terapia anticoagulante oral. Aunque se ha recomendado mantener la RIN por encima de 311, una cifra menor (entre 2,5 y 3) puede ser igualmente eficaz con menores problemas hemorrágicos. La heparina no se debe retirar antes de alcanzar una RIN correcta con anticoagulantes orales.
Glucocorticoides: es necesaria la instauración temprana de glucocorticoides intravenosos para superar la respuesta excesiva de citocinas en estos pacientes28. También son necesarios para tratar las vasculitis en caso de coexistir. En el caso de una situación que ponga en peligro la vida del paciente, se recomienda comenzar con pulsos intravensos de metilprednisolona (1.000mg/día durante 3 a 5 días), seguidos de altas dosis de metilprednisolona intravenosa (1 a 2mg/kg/día). La dosis se debe mantener de acuerdo con la respuesta terapéutica.
Terapias de segunda líneaEstán indicadas en casos de mala evolución clínica o ante la presencia de una situación que ponga en peligro la vida del paciente.
Gammaglobulinas: las gammaglobulinas intravenosas han sido eficaces para alcanzar una rápida reducción de los títulos de AAF en algunos pacientes. También son útiles en los pacientes con trombocitopenia intensa (que no responde a las dosis altas de corticoterapia). La dosis recomendada es de 400mg/kg/día (aproximadamente 25g/día) durante 5 días.
Recambios plasmáticos: la razón fundamental para la utilización de recambios plasmáticos se basa en que es el tratamiento de elección en los pacientes con púrpura trombótica trombocitopénica (PTT), en los cuales también se desarrolla microangiopatía trombótica. El recambio plasmático también elimina los AAF y, por tanto, beneficia al paciente. Asimismo, el plasma fresco congelado que se administra contiene anticoagulantes naturales y puede ser beneficioso cuando estos compuestos se consumen en el proceso de la coagulación. Por tanto, los recambios plasmáticos deberían estar indicados en aquellos pacientes con SAF catastrófico que muestren características serológicas de microangiopatía (como la presencia de esquistocitos debidos a anemia hemolítica microangiopática) y se deben continuar durante al menos 3 a 5 días, aunque no hay directrices respecto a la duración de este tratamiento. Neuwelt et al30 emplearon recambios plasmáticos durante más de 3 años en un paciente con SAF catastrófico. Debe tenerse en cuenta que los recambios plasmáticos pueden interferir con el tratamiento anticoagulante. Se ha empleado una combinación de anticoagulantes, glucocorticoides y gammaglobulinas intravenosas o recambios plasmáticos en más de 50 pacientes con SAF catastrófico obteniéndose una mejoría en el 70% de ellos29,31.
Otras terapiasLas siguientes terapias deben considerarse en pacientes que presentan trombosis multiorgánica resistente a los tratamientos de elección descritos previamente.
Fibrinolíticos: los fibrinolíticos están justificados en los pacientes que no responden a la heparina32. Los principales fibrinolíticos son la estreptocinasa, la urocinasa y el activador del plasminógeno tisular, que pueden emplearse seguidos de heparina, como se describió previamente. La hemorragia inducida por fibrinolíticos se puede tratar con transfusiones sanguíneas.
Ciclofosfamida: las series más grandes29,31 no demostraron beneficio tras el uso adicional de la ciclofosfamida. Por el contrario, la ciclofosfamida se asoció a una menor tasa de supervivencia, aunque estos pacientes podrían haber presentado una forma más grave de la enfermedad. Sin embargo, este fármaco podría utilizarse en los casos de SAF catastrófico grave asociado a reactivación del LES o en aquellos pacientes con niveles muy elevados de AAC para prevenir cualquier rebote después del empleo del recambio plasmático o de la infusión intravenosa con gammaglobulinas28. La dosis habitual es un pulso intravenoso de 0,5 a 1g/m2.
Terapias poco frecuentesLas siguientes terapias han sido administradas ocasionalmente en pacientes con SAF catastrófico.
Prostaciclina: la prostaciclina es una sustancia natural producida por el endotelio vascular. Provoca vasodilatación de todos los lechos vasculares y es un potente inhibidor endógeno de la agregación plaquetaria. La prostaciclina se ha evaluado solamente en un paciente con esclerosis sistémica y con SAF catastrófico33. La infusión continua de prostaciclina intravenosa (5ng/kg/min) se administró durante 7 días, pero el paciente murió cuando esta terapia se interrumpió.
Ancrod: esta sustancia es una fracción purificada del veneno de la serpiente pitón de Malasia, que se ha observado que corrige las deficiencias del factor estimulante de prostaciclina y del activador del plasminógeno vascular. Sin embargo, se ha descrito su uso solamente en un paciente que obtuvo buena respuesta al fármaco34.
Defibrotida: este compuesto es una sal metálica alcalinizante de una sola cadena que se ha mostrado que actúa como un potente inhibidor de la endotelina i, de la agregación plaquetaria inducida por la trombina y de la síntesis de tromboxano, así como un inhibidor potente de la formación del coágulo. Al igual que el ancrod, ocasionalmente se ha empleado con éxito en los pacientes con SAF catastrófico.
Terapias de cuidados intensivosEs necesario instaurar la terapia intensiva en casos que comprometan la vida del paciente. La insuficiencia renal rápidamente progresiva requiere de diálisis, el síndrome de distrés respiratorio agudo generalmente requiere de ventilación asistida y también se puede requerir de los fármacos vasoactivos en caso de un shock cardiogénico. Todas estas medidas juegan un papel esencial en la tasa de supervivencia de los pacientes con SAF catastrófico.
En conclusión, el SAF catastrófico es una enfermedad con una alta probabilidad de comprometer la vida del paciente y con un índice elevado de mortalidad que requiere un cuidado exhaustivo. Por lo tanto, son esenciales el diagnóstico precoz y el tratamiento enérgico. El tratamiento de elección en los pacientes con esta enfermedad es la combinación de altas dosis de heparina y de glucocorticoides junto con gammaglobulinas o con recambios plasmáticos. También pueden ser efectivas las medidas preventivas en los pacientes con SAF para evitar el desarrollo de SAF catastrófico35.
Prevención de las pérdidas gestacionalesEl tratamiento actual para que las pacientes con AAF no tengan abortos o pérdidas fetales incluye dosis bajas de aspirina, heparina o ambos (tabla 1). Los glucocorticoides, que se usaron en los primeros años de la descripción del SAF, han caído en desuso después de que estudios prospectivos demostraran su falta de eficacia y su morbilidad.
Profilaxis de las pérdidas gestacionales en pacientes con anticuerpos antifosfolipídicos y con síndrome antifosfolipídico
| 1) | Gestante con AAF y embarazos previos normales: |
| Opcional: aspirina (100mg/día) desde el momento en el que la mujer decide quedar embarazada y a lo largo de todo el embarazo | |
| 2) | Primigesta con AAF: |
| a) Sin enfermedad asociada: | |
| Opcional: aspirina (100mg/día) desde el momento en el que la mujer decide quedar embarazada y a lo largo de todo el embarazo | |
| b) Con LES asociado: | |
| Recomendado: aspirina (100mg/día) desde el momento en el que la mujer decide quedar embarazada y a lo largo de todo el embarazo | |
| 3) | Gestante con AAF y patología obstétrica asociada pero sin historia de trombosis: |
| Recomendado: aspirina (100mg/día) desde el momento en el que la mujer decide quedar embarazada y a lo largo de todo el embarazo | |
| Prednisona: sólo por razones no obstétricas (actividad del LES o intensa trombocitopenia), intentando no sobrepasar los 30mg/día | |
| 4) | Gestante con AAF y trombosis previas: |
| Interrumpir la administración de dicumarínicos antes de la 6.a semana de embarazo (el riesgo de teratogenia por dicumarínicos es máximo entre las semanas 6.a y 11.a) | |
| Administrar aspirina (100mg/día) asociado a heparina de bajo peso molecular | |
| Consideraciones especiales: | |
| a) Si es necesaria la reintroducción de los dicumarínicos, se hará a partir del 2.o trimestre del embarazo | |
| b) Si se desea lactancia materna, hay que mantener el tratamiento con heparina de bajo peso molecular, ya que los dicumarínicos pasan a la leche materna. | |
| 5) | Fracaso terapéutico con las pautas anteriores: |
| a) Si la paciente recibió solamente aspirina en el embarazo previo: | |
| Añadir a la aspirina, en el momento de confirmarse el embarazo, heparina de bajo peso molecular | |
| b) Si la pauta anterior fracasa: | |
| Valorar añadir gammaglobulinas intravenosas (400mg/kg/día durante 5 días, que se puede repetir mensualmente a lo largo del embarazo) |
AAF: anticuerpos antifosfolipídicos; LES: lupus eritematoso sistémico.
Inicialmente, se había recomendado tratar con aspirina a aquellas pacientes que no tuvieran antecedentes de trombosis ni de pérdidas fetales y reservar el tratamiento con heparina para aquéllas con trombosis previas o con una historia obstétrica previa con complicaciones asociadas a los AAF36. Ésta es todavía la práctica habitual en muchos centros. Recientemente, se han publicado 2 estudios prospectivos que indican que el tratamiento con aspirina más heparina es superior a la aspirina sola para prevenir las pérdidas gestacionales en mujeres con AAF y con abortos previos37,38. En cambio, otros 2 estudios prospectivos indican que la aspirina sola tuvo un efecto similar a la combinación de aspirina y de heparina39 o a la combinación de aspirina y de glucocorticoides40. Finalmente, otro estudio prospectivo41 que incluye pacientes con AAF y con abortos de repetición, sin historia de trombosis previa, describe la misma tasa de nacimientos vivos (80%) entre un grupo tratado con aspirina y otro grupo tratado con placebo. Para aquellas pacientes que ya han tenido previamente pérdidas fetales durante el segundo o el tercer trimestre, el tratamiento con aspirina más heparina parece ser superior al de aspirina sola24. Nuestro grupo ha demostrado que la utilización de aspirina sola, pero administrada desde antes de la concepción, previene las pérdidas fetales en más del 90% de los casos42–44, por lo que ésa es nuestra práctica habitual en aquellas pacientes con pérdidas fetales sin antecedentes trombóticos9.
El tratamiento con inmunoglobulinas intravenosas se ha utilizado en casos aislados, sobre todo en pacientes con pérdidas fetales a pesar del tratamiento con aspirina más heparina. Hay descritos casos con buenos resultados pero un estudio prospectivo, aleatorizado, no ha encontrado diferencias entre el tratamiento con aspirina más heparina y el grupo tratado con aspirina, heparina más inmunoglobulinas intravenosas45.
Aquellas pacientes con trombosis previas que están en tratamiento con anticoagulación oral van a necesitar seguir anticoaguladas durante toda la gestación. Los anticoagulantes orales tienen efectos teratogénicos, especialmente entre las semanas 6 y 11 de gestación, y deben ser cambiados a heparina subcutánea. Idealmente, deberían ser sustituidos antes de la concepción, pero si esto no es posible, al menos debe hacerse al tener la primera prueba de embarazo positiva. En cambio, pueden ser utilizados si existe una diátesis protrombótica muy intensa entre las semanas 14 y 34. Ni las heparinas convencionales ni las heparinas de bajo peso molecular atraviesan la placenta y, por tanto, no afectan el desarrollo del feto. El uso prolongado de heparina fraccionada se ha asociado a la producción de osteoporosis en la madre. Las heparinas de bajo peso molecular se están usando para tratar a estas pacientes y parecen tener menos efectos sobre la masa ósea46. La heparina debe mantenerse durante todo el embarazo y el puerperio hasta que la paciente vuelva a tomar anticoagulantes orales.
Un seguimiento cuidadoso de estas pacientes por parte de un equipo multidisciplinario es tan importante para el éxito de la gestación como el tratamiento medicamentoso.
Tratamiento de las alteraciones hematológicasLa trombocitopenia asociada a la presencia de AAF suele ser moderada (normalmente, la cifra de plaquetas es superior a 50.000/ml) y no requiere tratamiento. Si es intensa, el tratamiento con prednisona suele ser efectivo. Otras alternativas, en casos refractarios, son las gammaglobulinas intravenosas, el danazol, la dapsona o, incluso, la esplenectomía47. La cloroquina y las dosis bajas de aspirina han conseguido, en ocasiones, incrementar la cifra de plaquetas. Recientemente se han descrito resultados positivos con el uso de anticuerpos monoclonales anti-CD20 (rituximab)48. La anemia hemolítica asociada a los AAF es poco frecuente y suele requerir el mismo tratamiento que la trombocitopenia, a la cual se asocia en muchas ocasiones (síndrome de Evans)9.
Tratamiento de las alteraciones cardíacasLas lesiones valvulares cardíacas son frecuentes en los pacientes con SAF. Dado que los engrosamientos valvulares y las vegetaciones pueden producir embolismos, se recomienda la anticoagulación para aquellos pacientes con valvulopatía en los que se haya producido un fenómeno embólico. La profilaxis con antiagregantes plaquetarios podría ser apropiada para los pacientes con valvulopatía asintomática. Algunos autores consideran el uso de los glucocorticoides para las fases agudas de inflamación valvular, pero se desconoce su efectividad real.
La presencia de trombos intracardíacos también obliga a la anticoagulación y debe individualizarse la posibilidad de escisión quirúrgica.
La hipertensión pulmonar requiere la administración de anticoagulantes, así como debe considerarse la administración de vasodilatadores (bosentán, epoprostenol)49.