Hablar de estrés crónico es hablar de alteraciones en los mecanismos adaptativos que nuestro organismo tiene frente a agresiones externas. Existen varios ejes hormonales que participan en estas variaciones en la homeostasis del organismo. Existen múltiples ejes alterados en situaciones de estrés: prolactina, tirotropina, vasopresina, hormona folículo estimulante, hormona luteinizante, hormona del crecimiento/factor de crecimiento similar a la insulina, tipo 1 (GH/IGF-1). En el estrés agudo existen evidencias de una estimulación hiperadrenérgica y de un aumento del tono hipotálamo-hipófiso-suprarrenal (glucocorticoides y andrógenos). Sin embargo, ante una situación crónica estas respuestas son más dispares, existiendo en algunos casos un verdadero hipoadrenalismo. No ha quedado demostrado que el sustituir dicha deficiencia esteroidea tenga una capacidad paliativa sobre los procesos de dolor crónico como la fibromialgia. En cambio, el tratar las alteraciones del eje somatotropo (somatostatina/GH/IGF-1), en subgrupos muy seleccionados de síndrome fibromiálgico, con hormona de crecimiento recombinante nos permite tener un modelo in vivo de la capacidad de modulación sobre el dolor que tienen algunas hormonas.
Chronic stress, understood as a disturbance of the body homeostasis, is partially driven by many hormonal pathways. Prolactine, TSH (Thyrotropin), vasopresin, FSH (Follicle-Stimulating Hormone), LH (Luteinizing Hormone), and GH (Growth Hormone) have been involved in many stress reactions. In acute stress, there are many evidences for the increased both cathecolaminergic and hypothalamic-pituitary-adrenal axis. In chronic conditions, these hyperactivations are controversial and some cases may present a true hypoadrenalism. There is no evidence that treating such androgen/glucocorticoids deficiency may relief chronic pain processes such as fibromyalgia. However, treating somatotroph axis dysfunctions (somatostatin, GH/IGF1 [growth hormone/ insulin-like growth factor-1]) with recombinant GH in carefully seleccioned subgroups of fibromyalgic syndrome, offers us an in-vivo model of the capacity of some hormones to modulate pain.
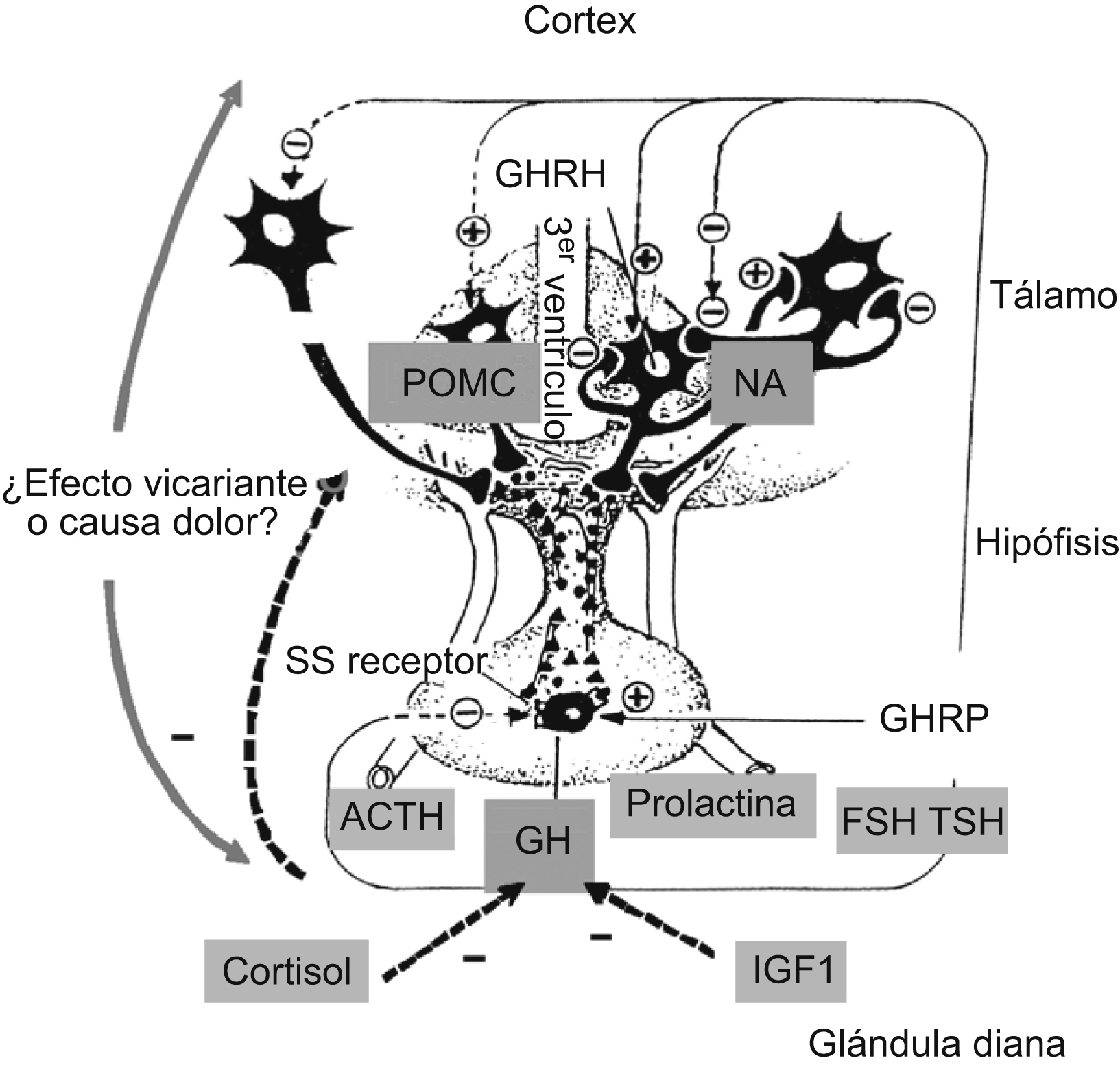
Estrés, palabra muy habitual hoy en día y normalmente relacionada con temas laborales, significa realmente, desde un punto de vista fisiológico, cualquier situación que pone al cuerpo en estado de alerta. Puede ser cualquier situación que requiera del organismo un esfuerzo suplementario, desde una agresión hasta una situación de miedo, desde un episodio de fiebre hasta cualquier infección1. En este sentido, el dolor mantenido es una situación que, obviamente, puede provocar estrés crónico. Sabemos que existen múltiples alteraciones hormonales vinculadas al estrés (figura 1): hipotiroidismo subclínico (tirotropina elevada) en depresiones, abolición de hormona folículo estimulante y hormona luteinizante en anorexias nerviosas o estados de ansiedad, hiperprolactinemia en pacientes con alteraciones del sueño. Sin embargo el número de hormonas que a la vez participan en situaciones de estrés y de dolor simultáneamente es más reducido (tabla 1). ¿Qué evidencias tenemos de la participación de las hormonas en procesos dolorosos? En primer lugar, existe una contigüidad anatómica entre determinadas áreas claves en la modulación del dolor (tálamo, cíngula) y el hipotálamo, verdadero nexo de unión entre el sistema nervioso central (SNC) y la mayoría de los órganos de secreción interna de nuestro organismo. Además, sabemos de la existencia de receptores específicos para hormonas (factor de crecimiento similar a la insulina tipo 1 [IGF-1], factor de crecimiento parecido a la insulina tipo 2, hormona del crecimiento [GH], esteroides) en hipocampo2.
Figura 1. Esquema de interrelaciones entre hormonas hipotálamo-hipofisarias en la fibromialgia.
Tabla 1. Principales hormonas vinculadas al estrés y al dolor
| Hormonas vinculadas al stress |
| • Sistema dopaminérgico • Prolactina • TSH (TRH) |
| Hormonas vinculadas al stress y al dolor |
| • Corticoides: CRH-ACTH, DHEA • Médula adrenal: sistema adrenérgico • Vasopresina • Oxitocina • ¿GH? |
ACTH: hormona adrenocorticotropa; CRH: corticotropin releasing hormone ‘hormona liberadora de corticotropina’; DHEA: dehidroepiandrosterona; GH: hormona del crecimiento; TSH: tirotropina.
Cuando sometemos una rata a un proceso de estrés/dolor existe básicamente una doble activación: el eje adrenérgico (adrenalina en caso de una hipoglucemia, noradrenalina en caso de frío o formalina) y el eje corticoideo (hemorragia, inmovilización). Cabe señalar la diferente respuesta hormonal en función de los diferentes estímulos estresantes3.
El estímulo adrenérgico, clave en los procesos de respuesta inmediata, se origina en el locus ceruleus talámico para posteriormente por vía neural influir en la médula suprarrenal en la producción de catecolaminas. La respuesta al miedo en forma de taquicardia, sudoración, diarrea, piloerección es debida a la hiperactividad adrenérgica. ¿Qué ocurre en situaciones de estrés/dolor crónico como la fibromialgia (FM)? Según Martínez-Lavín et al4, existe también una hiperadrenergia demostrada por el aumento en la variabilidad nocturna del RR en electrocardiogramas. Sin embargo, existen otros autores que postulan una disminución del tono catecolaminérgico en la FM: menor frecuencia cardíaca, menor respuesta al efecto de la clonidina y disminución de la respuesta adrenérgica al ejercicio en la FM5,6,7. Probablemente ambas respuestas sean válidas y dependan del factor tiempo, con el consiguiente agotamiento del estímulo neural en el SNC o el agotamiento de las reservas en la médula suprarrenal.
El eje corticoideo hipofiso-pituitario-adrenal (HPA) empieza a nivel talámico con la propiomelanocortina, precursor de la CRH (corticotropin releasing hormone ‘hormona liberadora de corticotropina’) hipotalámica (y también del eje opioide), que a su vez actúa sobre la hormona adrenocorticotropa (ACTH) hipofisaria, que en último término actúa sobre las zonas fasciculada y reticular de la corteza suprarrenal para inducir la secreción de glucocorticoides y andrógenos (dehidroepiandrosterona [DHEA]). Estos son probablemente los mediadores clásicos mejores conocidos del estrés1. Los glucocorticoides ejercen acciones pleiotrópicas en todo el organismo (hiperglucemia, hipertensión, depresión, catabolismo, etc.) siendo también capaces de controlar —independientemente de su efecto inmunosupresor— procesos dolorosos en la esclerosis múltiple o en la neuralgia postherpética. En modelos de dolor crónico como la FM existen controversias sobre el estado del eje HPA.
Inicialmente tenemos una activación del eje, como demuestra la elevación de los niveles salivares de cortisol matinal, el mantenimiento de su ritmo circadiano8 o incluso la menor frenación con dexametasona en pacientes fibromiálgicas9.
Al igual que ocurría con el estímulo adrenérgico, a medida que va descendiendo la secreción de CRH10, se incrementan sus receptores hipofisarios, motivo por el cual en pacientes con FM tenemos una hiperrespuesta de la ACTH al test de CRH. Este mecanismo adaptativo también cede, momento en que aparecen situaciones de hipoadrenalismo relativo (disminución del cortisol 8 a. m., disminución del cortisol salival7, disminución de DHEA11 o incluso insuficiencia suprarrenal con test de Synachten patológico12) que se añaden a una insensibilización periférica a los corticoides.
Cabe resaltar que estas alteraciones hormonales parecen ser preexistentes en la población de riesgo (situaciones emocionales de estrés mantenido) y previas a la aparición de dolor8. Aceptamos que las hormonas sean mediadoras del estrés y que se vean modificadas de forma vicariante en procesos de dolor, pero ¿pueden estar implicadas en la génesis o modulación del estímulo doloroso?
Los ensayos clínicos con dosis bajas de hidrocortisona13 o DHEA14 no han demostrado una reducción significativa de los puntos dolorosos aunque sí un elevado riesgo de frenación del eje corticoideo endógeno.
Existen muchas otras hormonas, habitualmente olvidadas y que en una situación de dolor crónico como modelo de estrés tienen mucha importancia: vasopresina, oxitocina, GH, IGF-1.
Las hormonas de la hipófisis posterior parecen estar más implicadas en procesos agudos, modulando las sinapsis catecolaminérgicas (todos estos ejes están interconectados entre sí) y parecen mediar reacciones agresivas asociadas al estrés.
El eje somatotropo (GH/IGF-1) adquirió un gran protagonismo cuando, a finales de la década de 1990, Bennett describió el paralelismo existente entre la FM y un déficit de la GH en el adulto (DGHA): fatiga, alteraciones del sueño, pérdida de la memoria, tristeza, parestesias15. Además los pacientes con FM —interpretados de forma global como entidad— presentan niveles séricos del IGF-1 menores a los de la población normal15. Los resultados de los estímulos de secreción de la GH en la FM son dispares. Globalmente, los pacientes con FM tienen una menor secreción integrada de la GH en 24h, aunque un estímulo suprafisiológico potente —como es el test de hipoglucemia insulínica— muestre una respuesta normal16. También sabemos que al utilizar inhibidores de la somatostatina, arginina o piridostigmina tenemos una normalización de la secreción de la GH17. ¿El aumento del tono somatostatinérgico hipotalámico (que a su vez resulta del aumento en la CRH, de nuevo todo está interrelacionado) impide una correcta secreción de la GH hipofisaria?
Quizás el error resida en no individualizar y segmentar a los pacientes en función de su patrón de respuesta somatotropo. Sabemos que existen subgrupos con patrones de respuesta bioquímicos característicos de un verdadero déficit de la GH, a la vez que también tenemos evidencias (Malemud et al) de individuos con patrones propios de resistencia a la GH (cifras basales elevadas con IGF-1 bajo).
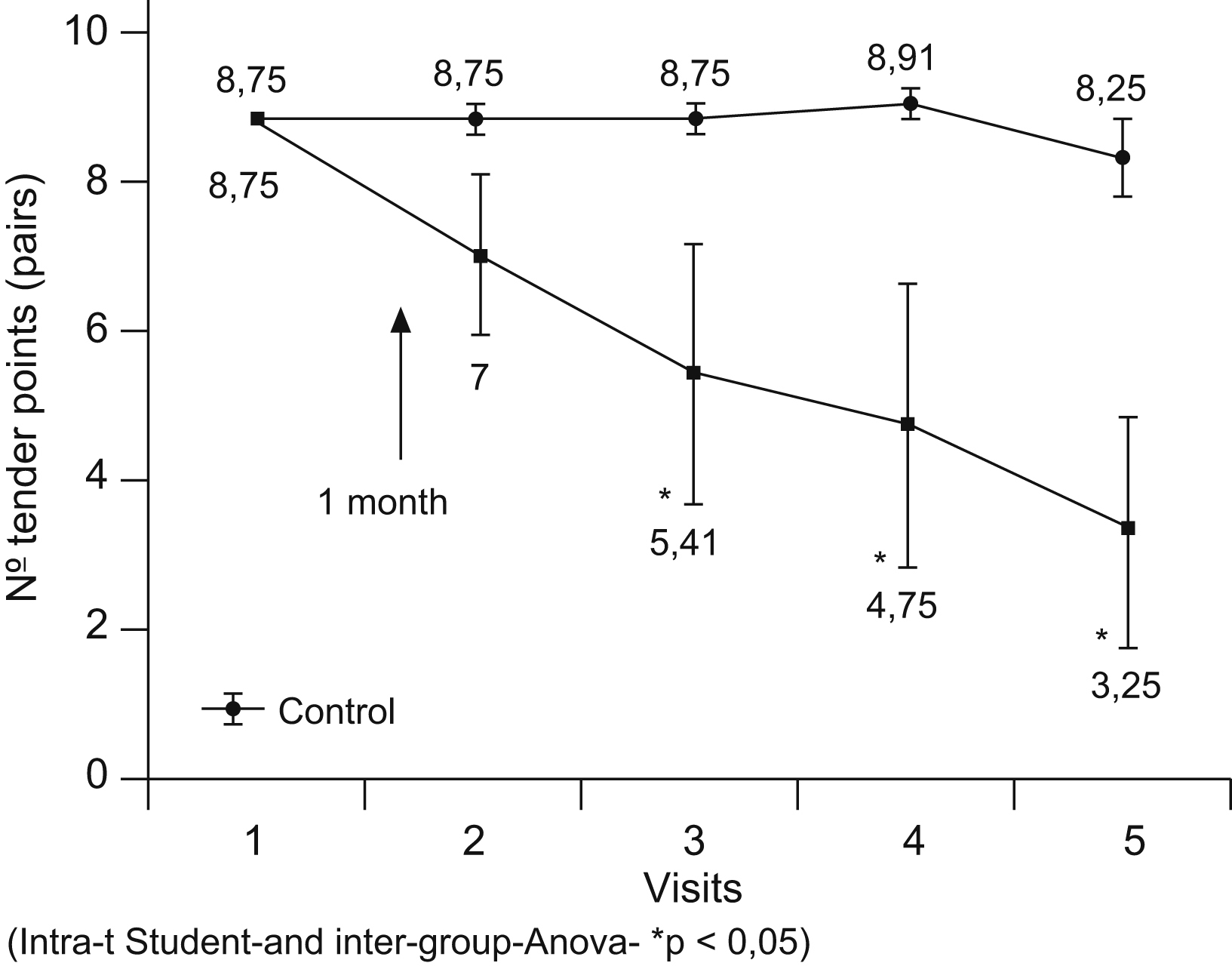
Todo ello sirvió de base para el primer ensayo a doble ciego, placebo-control, usando hormona de crecimiento recombinante en pacientes con FM. No sólo hubo una mejoría significativa del FIQ (Fibromyalgia Impact Questionnaire) y sus subescalas, sino también un descenso en la escala analógica visual (EVA) y el número de puntos dolorosos18. Más recientemente ha sido publicado un segundo ensayo clínico en una población fibromiálgica de mayor severidad y más homogénea: FIQ>75, >16 puntos dolorosos, todas en tratamiento opioide, con serotoninérgicos y antidepresivos tricíclicos, que además presentaban niveles bajos del IGF-1 (-1DE). Con una dosis media de 0,0125mg/kg/día durante 1 año se observó una importante mejoría en los cuestionarios de calidad de vida (EQ-5D [Euro Quality of Life - 5 Dimensions], FIQ y subescalas) y sobre todo una reducción de puntos dolorosos y EVA para el dolor (reducción del 60%)19 (figura 2). Debemos ser cautelosos a la hora de interpretar estos resultados, necesitando evidencias con una muestra mayor y estudios a doble ciego, placebo-control.
Figura 2. Objetivo primario: puntos dolorosos.
Quizás el síndrome fibromiálgico, desde un punto de vista endocrinológico, sea una expresión en forma de dolor del DGHA, ítem no valorado en los grandes estudios de seguimiento hechos hasta la fecha (KIMS, HypoCCs). O quizás, desde un punto de vista reumatológico, la deficiencia o insuficiencia parcial de la GH, por un lado, y la resistencia a la GH (con el mismo descenso en los niveles del IGF-1), por otro lado, permitan explicar etiologías concretas de casos de FM.
Desconocemos si este efecto beneficioso de la GH es mediado por sistemas eferentes opioides, endocannabinoides o adrenérgicos o bien debido a efectos centrales (es conocida la estimulación de los oligodendrocitos y su capacidad para estimular la neuroglia) por parte del propio eje GH/IGF-120, o incluso debido a sus propiedades sobre músculo esquelético (diferenciación fibroblástica, aumento de la sensibilidad al calcio).
Hemos descrito una pequeña parte de las alteraciones hormonales vinculadas al dolor como modelo de estrés crónico. No existe un patrón único sino múltiples combinaciones entre ejes. Sin duda, depende del momento evolutivo en el que estudiemos ese dolor, pero también existe una gran variabilidad individual. En el amplio concepto del síndrome fibromiálgico con diferentes etiologías cabe la posibilidad de que existan subgrupos bien definidos de población deficitaria para la GH, al igual que casos individuales de insuficiencia suprarrenal. Aunque sean pocos casos y falten evidencias de mayor impacto, la terapia hormonal sustitutiva podría ofrecer una nueva alternativa terapéutica.