Conocer las coberturas de vacunación frente a gripe estacional y neumococo en pacientes reumatológicos con terapia biológica. Identificar las variables que predicen adherencia a la vacunación.
Material y métodoEstudio transversal. Se incluyeron los pacientes reumatológicos que iniciaron terapia biológica entre el 01/01/2016 y el 31/12/2016 en un hospital autonómico de referencia. Se recogieron variables sociodemográficas, relacionadas con el diagnóstico, médico prescriptor, derivación a la Unidad de Vacunas y vacunación frente a neumococo con vacuna conjugada de 13 serotipos (VNC13) y polisacárida de 23 serotipos (VNP23), así como gripe estacional (2016/17). Se realizó análisis univariante, bivariante (Chi-cuadrado) y multivariante (regresión logística). Se consideró significativa una p<0,05 y se utilizó el programa PASW v.18.
ResultadosSe incluyeron 222 pacientes. Las coberturas de vacunación fueron: VNC13, 80,2%; VNP23v, 77,9%; gripe 2016/17, 78,8%; VNC13+VNP23, 75,2%; VNC13+VNP23+gripe 2016/17, 68,9%. La espondilitis axial registró las coberturas más altas (>80%) para la vacunación antineumocócica y en combinación con la antigripal. El 27% de los pacientes no fueron derivados a la Unidad. El médico prescriptor se asoció de manera estadísticamente significativa con cada una de las vacunas y sus combinaciones, pero fue la derivación a la Unidad de Vacunas la que se asoció de manera independiente con las mayores coberturas de vacunación (p<0,001) en todos los casos.
ConclusionesComparando con la literatura científica, consideramos que las coberturas frente a neumococo y gripe en estos pacientes son elevadas. La derivación de estos pacientes a la Unidad de Vacunas resulta clave para garantizar una correcta inmunización y minimizar así algunos de los posibles efectos adversos infecciosos de las terapias biológicas.
Vaccination coverage for seasonal influenza and pneumococcus in rheumatology patients receiving biological treatment. To identify variables that predict vaccination adherence.
Material and methodDescriptive cross-sectional study. The study involved rheumatology patients who initiated biological therapy between 01/01/2016 and 12/31/2016 in a regional referral hospital. Variables included sociodemographic information, diagnostic data, treating physician, referral to the vaccine unit and vaccination against pneumococcus with 13-valent pneumococcal conjugate vaccine (PCV13) and 23-valent pneumococcal polysaccharide vaccine (PPSV23), as well as seasonal influenza (2016/17). Univariate, bivariate (Chi-square) and multivariate analysis (logistic regression) were performed. The differences were considered significant (P<.05) and the PASW v.18 software package was used.
ResultsIn all, 222 patients were included. Vaccination coverage was: PCV13, 80.2%; PPSV23, 77.9%; influenza 2016/17, 78.8%; PCV13+PPSV23, 75.2%; PCV13+PPSV23+influenza 2016/17, 68.9%. Axial spondylitis had the highest coverage (>80%) for pneumococcal vaccination and combination of pneumococcal with influenza. Overall, 27% of the patients were not referred to the unit. The treating physician was associated with statistical significance in each vaccine alone or combined, but referral to the vaccine unit was independently associated with the highest vaccination coverage (P<.001) in all cases.
ConclusionsCompared to the scientific literature, we consider that the coverage of our patients against pneumococcus and influenza is high. Referral of these patients to the vaccine unit is the key to guarantee a correct immunization and to minimize some of the possible infectious adverse effects of biological therapies.
La prevalencia de las enfermedades musculoesqueléticas ha experimentado, en los últimos años, un importante incremento a nivel mundial. Afectan a la calidad de vida y a la capacidad funcional de las personas y repercuten, de manera significativa, en el gasto sanitario1.
En ocasiones, el abordaje terapéutico de estas patologías resulta complicado por lo que, hoy, cada vez son más los pacientes que precisan terapia biológica. Estos fármacos modulan la respuesta inmune al dirigirse a ciertas dianas terapéuticas de la línea de inmunidad celular, los mediadores inflamatorios o los receptores de superficie2,3. Además, es sabido que no son inocuos, ya que según el registro español de acontecimientos adversos de terapias biológicas en enfermedades reumáticas (BIOBADASER) las infecciones representan el 23,2% de los acontecimientos adversos graves y el 18,1% de los mortales. Las infecciones del tracto respiratorio superior e inferior y las neumonías ocupan las primeras posiciones4.
La valoración especializada de los calendarios de vacunación de estos pacientes en las Unidades de Vacunas se convierte en un aspecto fundamental en la prevención de infecciones5,6. A pesar de que son numerosas las publicaciones relacionadas con la vacunación en pacientes con artritis reumatoide7-9, por ejemplo, no son tan frecuentes las que evalúan las coberturas vacunales en los pacientes con enfermedades reumatológicas en general, sobre todo cuando estos reciben o son candidatos a recibir una terapia biológica. Es más, entre las investigaciones existentes, se puede observar gran variabilidad en los resultados10-13.
Todo lo anterior, añadido a que la inmunización activa es considerada como una de las herramientas más coste-efectivas dentro de las actividades preventivas del sistema sanitario público, y que las 3 vacunas estudiadas están recomendadas y financiadas en el calendario autonómico oficial para estos pacientes, hace que sea necesario conocer y reforzar las coberturas vacunales en esta población.
Por ello, el objetivo del presente estudio es evaluar las coberturas de vacunación frente a la gripe estacional y el neumococo en pacientes reumatológicos que reciben terapia biológica, así como identificar las variables que predicen la adherencia a la vacunación en estos pacientes.
Material y métodosTipo de estudioSe ha realizado un estudio descriptivo transversal.
Participantes: muestra y selecciónSe han estudiado los pacientes reumatológicos que iniciaron, por primera vez, una terapia biológica entre el 1 de enero de 2016 y el 31 de diciembre de 2016 en un hospital autonómico de referencia.
Fuentes de datosLa fuente de información principal fue el registro de terapias biológicas del Servicio de Farmacia Hospitalaria. Para la evaluación de las coberturas de vacunación se consultó la base de datos de la Unidad de Vacunas del Servicio de Medicina Preventiva y Salud Pública del propio centro hospitalario, además del registro de vacunación de Atención Primaria (OMI-AP) que alcanza toda la comunidad autónoma.
Variables de estudioSe tuvieron en cuenta variables sociodemográficas y las relacionadas con el diagnóstico reumatológico, el tratamiento biológico, el médico prescriptor de la terapia y la derivación a la Unidad de Vacunas del hospital. Se evaluaron las coberturas frente a neumococo con vacuna conjugada de 13 serotipos (VNC13) y con vacuna polisacárida de 23 serotipos (VNP23), así como frente a la gripe estacional en la campaña 2016/17. Para ello se verificaron los registros de vacunación antes mencionados. Se crearon dos variables adicionales en las que se contempló la vacunación combinada frente a neumococo (VNC13 y VNP23) y la vacunación conjunta con ambas vacunas antineumocócicas y la gripe estacional 2016/17.
Análisis estadísticoSe realizó un análisis descriptivo de cada variable (análisis univariante), expresando las frecuencias absolutas y relativas de las variables cualitativas investigadas. Se calcularon las coberturas de vacunación para cada uno de los valores de las variables estudiadas. Se realizó un análisis bivariante para identificar si cada una de las variables del estudio estaban o no asociadas con la cobertura de vacunación, utilizando la prueba Chi-cuadrado. Se realizó un análisis multivariante mediante una regresión logística para identificar las variables predictoras asociadas con la adherencia a la vacunación de manera independiente. A su vez, se valoró si el resto de variables del estudio estaban asociadas con la derivación del paciente a la Unidad de Vacunas del hospital mediante un análisis bivariante y multivariante. Se consideró estadísticamente significativa una p<0,05. Para el análisis estadístico se utilizó el programa PASW versión 18 (denominado anteriormente SPSS).
ResultadosDescripción generalLa muestra de estudio se compuso de un total de 222 pacientes de los cuales 127 (57,2%) fueron mujeres. La media de edad fue de 52,68 años y la desviación típica de ±14,52 años. El número de médicos especialistas prescriptores de terapias biológicas en Reumatología fue de 5. El 73% de los tratamientos pertenecieron a la familia de los anti-TNF, seguidos de los anti-IL6 (8,6%) y los anti-CD20 (7,2%); el resto de tratamientos (anti-IL12/23, anti-LT, antiIL17 y anti-PDE4) se agruparon en la categoría de otros (11,4%). En cuanto al diagnóstico reumatológico principal, la artritis reumatoide registró la mayor carga de enfermedad (34,2%), por delante de la artropatía psoriásica (31,5%) y la espondilitis axial (23,4%); el resto de diagnósticos (artritis idiopática infantil, artritis indiferenciadas, conectivopatías y vasculitis) se agruparon en la categoría de otros (10,8%). El 73% de los pacientes habían sido derivados a la Unidad de Vacunas del hospital para la evaluación y actualización del calendario de vacunación.
Coberturas de vacunaciónEl 80,2% de los pacientes evaluados tenían registrada la vacunación frente a VNC13 y el 77,9% frente a VNP23. La pauta combinada de vacunación antineumocócica se observó en el 75,2% de la muestra del estudio. Por otro lado, el 78,8% de los pacientes recibieron la vacuna antigripal estacional en la campaña 2016/17. De manera global, el 68,9% había recibido correctamente las 3 vacunas indicadas (VNC3+VNP23+gripe 2016/17). La tabla 1 muestra las coberturas de vacunación en función de las diferentes variables de estudio (sexo, edad, diagnóstico, fármaco, médico prescriptor y derivación a la Unidad de Vacunas) y los valores de significación estadística del análisis bivariante.
Coberturas de vacunación en función de las variables del estudio: sexo, edad, diagnóstico, fármaco, médico prescriptor y derivación a la Unidad de Vacunas (análisis bivariante)
| Variable | Valor | N (%) | Cobertura de vacunación (%) | ||||
|---|---|---|---|---|---|---|---|
| VNC13 | VNP23 | VNC13 + VNP23 | Gripe | VNC13 + VPN23 + Gripe | |||
| Sexo | Mujer | 127 (57,2) | 82,7 | 79,5 | 77,2 | 81,9 | 72,4 |
| Hombre | 95 (42,8) | 76,8 | 75,8 | 72,6 | 74,7 | 64,2 | |
| Valor p | 0,281 | 0,506 | 0,439 | 0,197 | 0,190 | ||
| Edad | <30 años | 13 (5,9) | 61,5 | 53,8 | 53,8 | 53,8 | 38,5 |
| 30-65 años | 165 (74,3) | 83,0 | 79,4 | 77,6 | 80,0 | 72,1 | |
| >65 años | 44 (19,8) | 75,0 | 79,5 | 72,7 | 81,8 | 65,9 | |
| Valor p | 0,109 | 0,097 | 0,148 | 0,073 | 0,037 | ||
| Diagnóstico | Artritis reumatoide | 76 (34,2) | 80,3 | 75,0 | 71,1 | 82,9 | 65,8 |
| Artropatía psoriásica | 70 (31,5) | 80,0 | 81,4 | 80,0 | 78,6 | 74,3 | |
| Espondilitis axial | 52 (23,4) | 84,6 | 82,7 | 80,8 | 73,1 | 69,2 | |
| Otros | 24 (10,8) | 70,8 | 66,7 | 62,5 | 79,2 | 62,5 | |
| Valor p | 0,254 | 0,065 | 0,042 | 0,346 | 0,164 | ||
| Fármaco | Anti-TNF | 162 (73,0) | 83,3 | 83,3 | 80,9 | 79,6 | 73,5 |
| Anti-IL6 | 19 (8,6) | 52,6 | 42,1 | 36,8 | 68,4 | 36,8 | |
| Anti-CD20 | 16 (7,2) | 87,5 | 81,3 | 75,0 | 81,3 | 62,5 | |
| Otros | 25 (11,4) | 80,0 | 68,0 | 68,0 | 80,0 | 96,0 | |
| Valor p | 0,039 | 0,003 | <0,001 | 0,701 | 0,033 | ||
| Médico prescriptor | Médico A | 23 (10,4) | 82,6 | 69,6 | 69,6 | 69,6 | 60,9 |
| Médico B | 22 (9,9) | 45,5 | 45,5 | 36,4 | 54,5 | 27,3 | |
| Médico C | 118 (53,2) | 83,9 | 83,1 | 82,2 | 80,5 | 74,6 | |
| Médico D | 49 (22,1) | 87,8 | 89,8 | 83,7 | 89,8 | 81,6 | |
| Médico E | 10 (4,5) | 70,0 | 50,0 | 50,0 | 80,0 | 50,0 | |
| Valor p | <0,001 | <0,001 | <0,001 | 0,013 | <0,001 | ||
| Derivación Unidad Vacunas | Sí | 162 (73,0) | 97,5 | 95,7 | 94,4 | 91,4 | 88,3 |
| No | 60 (27,0) | 33,3 | 30,0 | 23,3 | 45,0 | 16,7 | |
| Valor p | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | ||
| Total | 222 (100) | 80,2 | 77,9 | 75,2 | 78,8 | 68,9 | |
Las coberturas más altas para cada una de las vacunas en cada categoría, y los valores p estadísticamente significativos, se marcan en negrita.
Al analizar las coberturas de vacunación según el sexo no se observaron diferencias estadísticamente significativas en la cobertura de la pauta combinada de vacunación antineumocócica (p=0,439), ni en la vacunación antineumocócica y la antigripal conjuntamente (p=0,190). Con respecto a la edad, solo se encontraron diferencias significativas en la vacunación conjunta frente a neumococo y gripe (p=0,037), con las coberturas más altas en el grupo de 30-65 años.
Entre las 3 patologías más prevalentes en la cohorte de estudio (artritis reumatoide, artropatía psoriásica y espondilitis axial) se observa que esta última registra las mayores coberturas de vacunación para VNC13 (84,6%), VNP23 (82,7%) y la pauta combinada de ambas (80,8%); en este último caso de manera estadísticamente significativa con respecto al resto de patologías (p=0,042). La cobertura de vacunación antigripal es mayor para la artritis reumatoide (82,9%) mientras que la cobertura más alta para las 3 vacunas corresponde a la artropatía psoriásica (74,3%), pero las diferencias no fueron estadísticamente significativas.
También se encontraron diferencias significativas al comparar las coberturas de vacunación antineumocócica según el tipo de fármaco, excepto para la vacunación antigripal por separado, con las coberturas más bajas asociadas a los anti-IL6 de manera consistente.
El médico prescriptor se asoció de manera estadísticamente significativa con cada una de las vacunas de manera individual y combinada. Cabe decir que, sistemáticamente, el médico D fue el que registró mayores coberturas en todos los casos y siempre por encima del 80%. En contraposición, el médico B obtuvo como cobertura máxima la correspondiente a la vacunación antigripal (54,5%) y como mínima la combinación de las 3 vacunas (27,3%).
Por otro lado, la derivación a la Unidad de Vacunas fue la variable que estuvo sistemáticamente asociada con las mayores coberturas de vacunación (p<0,001) para todas las vacunas combinadas o por separado.
Además, se constató una asociación estadísticamente significativa (p<0,001) entre la vacunación antigripal y la pauta secuencial antineumocócica, de manera que el 90,4% de los que recibieron la pauta combinada también estaban vacunados frente a la gripe.
En el análisis multivariante (tabla 2), la única variable asociada estadísticamente con mejores coberturas vacunales, independientemente del resto, fue la derivación a la Unidad de Vacunas (p<0,001), con OR consistentemente muy elevadas tanto para las vacunas por separado como para la vacunación conjunta. Respecto al médico prescriptor, solo se mantuvieron coberturas de vacunación estadísticamente más altas para el médico D con respecto a la vacuna VNP23 y para el conjunto de las 3 vacunas. A su vez, se encontró que el fármaco empleado estaba asociado significativamente con la vacunación frente a neumococo, por separado y de manera combinada, con coberturas más altas para los usuarios de anti-CD20 y, aunque solo para la vacuna VNP23, de anti-TNF. No se encontró asociación estadística con el sexo ni con el diagnóstico, pero sí con la edad, con mayor probabilidad de vacunación frente a la gripe, y para las 3 vacunas en conjunto, en los grupos de más edad respecto a los menores de 30 años.
Análisis multivariante (regresión logística) de los factores asociados con las coberturas de vacunación para cada vacuna o combinación de vacunas
| Vacunación | ||||||
|---|---|---|---|---|---|---|
| Variable | Valor | VNC13 | VNP23 | VNC13 + VNP23 | Gripe | VNC13 + VPN23 + Gripe |
| Sexo | Mujer | 1,8 (0,6-5,5) | 2,6 (0,8-8,2) | 2,0 (0,7-5,9) | 1,3 (0,6-3,0) | 1,9 (0,8-4,8) |
| Hombre | — | — | — | — | — | |
| Valor p | 0,334 | 0,107 | 0,206 | 0,539 | 0,165 | |
| Edad | <30 años | — | — | — | — | — |
| 30-65 años | 4,7 (0,4-60,4) | 6,3 (0,6-71,7) | 5,4 (0,6-52,9) | 6,5 (1,4-31,5) | 11,6 (2,1-63,1) | |
| >65 años | 1,5 (0,1-23,3) | 13,2 (0,9-203,2) | 3,8 (0,3-44,0) | 7,8 (1,4-31,5) | 7,1 (1,1-45,5) | |
| Valor p | 0,203 | 0,178 | 0,326 | 0,056 | 0,016 | |
| Diagnóstico | Artritis reumatoide | 2,4 (0,3-19,9) | 2,0 (0,3-13,7) | 1,7 (0,3-10,9) | 0,6 (0,1-2,9) | 0,3 (0,1-2,1) |
| Artropatía psoriásica | 0,9 (0,1-9,5) | 2,9 (0,4-24,1) | 1,9 (0,3-14,8) | 0,3 (0,04-1,6) | 0,4 (0,1-3,0) | |
| Espondilitis axial | 2,9 (0,3-33,0) | 5,3 (0,7-43,7) | 3,5 (0,4-27,8) | 0,2 (0,04-1,4) | 0,5 (0,1-3,1) | |
| Otros | — | — | — | — | — | |
| Valor p | 0,427 | 0,455 | 0,653 | 0,406 | 0,713 | |
| Fármaco | Anti-TNF | 1,8 (0,2-13,1) | 12,0 (1,5-93,3) | 5,7 (0,9-37,8) | 0,9 (0,2-4,2) | 2,5 (0,5-13,6) |
| Anti-IL6 | — | — | — | — | — | |
| Anti-CD20 | 46,0 (2,4-886,1) | 89,5 (4,9-1.646) | 41,5 (3,1-550,9) | 1,8 (0,3-14,6) | 6,3 (0,7-55,1) | |
| Otros | 1,9 (0,2-20,3) | 3,1 (0,3-28,6) | 3,5 (0,4-32,0) | 0,9 (0,1-5,5) | 3,1 (0,4-23,4) | |
| Valor p | 0,072 | 0,016 | 0,043 | 0,893 | 0,398 | |
| Médico prescriptor | Médico A | 5,1 (0,3-79,3) | 0,2 (0,02-1,7) | 0,6 (0,1-4,8) | 0,8 (0,1-5,0) | 1,4 (0,2-11,1) |
| Médico B | — | — | — | — | — | |
| Médico C | 6,7 (0,7-63,0) | 1,6 (0,3-9,6) | 3,4 (0,5-23,3) | 3,3 (0,6-17,0) | 5,2 (0,7-37,4) | |
| Médico D | 4,1 (0,4-40,5) | 10,8 (1,1-106,7) | 3,6 (0,5-26,5) | 2,9 (0,6-15,3) | 8,2 (1,1-60,4) | |
| Médico E | 10,7 (0,5-235,9) | 1,2 (0,1-26,0) | 1,9 (0,1-35,8) | 6,2 (0,6-68,6) | 4,3 (0,3-65,9) | |
| Valor p | 0,492 | 0,041 | 0,204 | 0,170 | 0,094 | |
| Derivación Unidad Vacunas | Sí | 132,6 (31,9-551) | 88,6 (24,1-325) | 77,8 (24,1-251) | 15,6 (6,3-38,3) | 43,6 (16,1-118) |
| No | — | — | — | — | — | |
| Valor p | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | |
Odds ratio e intervalo de confianza del 95%; las filas vacías indican el valor de referencia.
Los valores estadísticamente significativos se marcan en negrita.
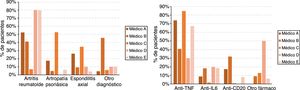
Por último, los médicos prescriptores presentaron perfiles diferenciados, con diferencias estadísticamente significativas, tanto en los diagnósticos de los pacientes (p<0,001) como en los fármacos utilizados (p<0,001) que, a su vez, estaban asociados entre sí (p<0,001). El la figura 1 se muestran los perfiles de diagnóstico y fármaco según el médico prescriptor.
Derivación a la Unidad de VacunasSe observaron diferencias estadísticamente significativas en la derivación a la Unidad de Vacunas (tabla 3) según el médico prescriptor, tanto en el análisis bivariante (p<0,001) como en el multivariante (p=0,002), donde uno de ellos presentó porcentajes de derivación significativamente más bajos. A su vez, se encontró una asociación significativa con el fármaco utilizado (p=0,001 para el bivariante y p=0,019 para el multivariante), con los mayores porcentajes de derivación a la Unidad de Vacunas en los usuarios de anti-TNF. No hubo relación de la edad, el sexo o el diagnóstico con la derivación a la Unidad de Vacunas.
Análisis bivariante (Chi-cuadrado) y multivariante (regresión logística) de los factores asociados con la derivación del paciente a la Unidad de Vacunas del hospital
| Variable | Valor | Derivación a la Unidad de Vacunas | |
|---|---|---|---|
| Bivariante% | MultivarianteOR (IC 95%) | ||
| Sexo | Mujer | 74,0 | 1,2 (0,6-2,4) |
| Hombre | 71,6 | — | |
| Valor p | 0,686 | 0,636 | |
| Edad | <30 años | 61,5 | — |
| 30-65 años | 73,3 | 2,3 (0,6-9,2) | |
| >65 años | 75,0 | 2,7 (0,6-13,3) | |
| Valor p | 0,617 | 0,459 | |
| Diagnóstico | Artritis reumatoide | 71,1 | 0,7 (0,2-3,2) |
| Artropatía psoriásica | 77,1 | 0,5 (0,1-2,2) | |
| Espondilitis axial | 75,0 | 0,5 (0,1-2,2) | |
| Otros | 62,5 | — | |
| Valor p | 0,531 | 0,753 | |
| Fármaco | Anti-TNF | 79,6 | 7,1 (2,0-25,1) |
| Anti-IL6 | 42,1 | — | |
| Anti-CD20 | 56,3 | 3,2 (0,6-16,9) | |
| Otros | 64,0 | 3,4 (0,8-15,3) | |
| Valor p | 0,001 | 0,019 | |
| Médico prescriptor | Médico A | 78,3 | 9,9 (2,1-47,6) |
| Médico B | 27,3 | — | |
| Médico C | 78,0 | 10,1 (2,5-40,1) | |
| Médico D | 50,0 | 15,6 (3,7-65,7) | |
| Médico E | 83,7 | 3,5 (0,6-22,6) | |
| Valor p | <0,001 | 0,002 | |
Bivariante: % de derivación a la Unidad de Vacunas; multivariante: odds ratio e intervalo de confianza del 95%; las filas vacías indican el valor de referencia.
Los valores estadísticamente significativos se marcan en negrita.
Con los resultados obtenidos a través de la metodología expuesta creemos haber dado respuesta a los objetivos planteados. El estudio ha sido realizado en un hospital autonómico de referencia que abarca 3 de las 8 áreas sanitarias y que asiste, aproximadamente, al 40% de la población reumatológica de la comunidad autónoma.
En lo que respecta a los pacientes inmunodeprimidos y a pesar de que, a día de hoy, no se discute la importancia de la vacunación en este grupo de riesgo6, es sabido que existe una imperiosa necesidad de mejorar las coberturas vacunales. Investigaciones en las que se incluyen más de 22.000 inmunodeprimidos estadounidenses se observa cómo solamente el 5,2% de los trasplantados de órgano sólido recibieron la vacunación antineumocócica, y es el grupo de los pacientes con VIH el que registra mayores coberturas (31%)14. También, cuando se han evaluado pacientes dermatológicos que reciben terapia biológica, solo el 17% había recibido la vacuna frente a neumococo y el 38% la antigripal a pesar de tener, en más del 25% de los casos, otras comorbilidades con indicación de vacunación15.
Actualmente, existe una gran variabilidad entre autores con relación a las coberturas vacunales en los pacientes con terapia biológica. Así, algunos estudios obtienen coberturas desde un 28%12 hasta un 60%13 para la vacuna antigripal. En el caso de la antineumocócica, la investigación más destacada registra una cobertura del 58%11, mientras que en otras apenas supera el 12%10. En contraposición, la presente investigación supera el 80% de cobertura frente a VNC13 y casi llega al 78% en la VNP23, siendo la cobertura de la pauta combinada de vacunación del 75,2%. Además, la cobertura antigripal también es mayor en esta cohorte que la descrita por otros autores12.
Por otro lado, la derivación a la Unidad de Vacunas hospitalaria parece cumplir un papel muy relevante en la adherencia a los esquemas de inmunización. Es lógico pensar que la organización y seguimiento personalizado de los calendarios de vacunación en este tipo de Unidad está asociada a mejores coberturas vacunales, tal y como se demuestra en la presente investigación. Igualmente, la asociación de la edad con una mayor adherencia a la vacunación antigripal concuerda con lo esperado ya que la edad propiamente dicha es un factor de riesgo de complicación por el virus de la gripe16.
La vacunación en función de la variable sexo ha sido también objeto de estudio por parte de otros autores, sobre todo en cohortes de pacientes con artritis reumatoide7,8. Así pues, de manera convergente con la literatura, no se han encontrado diferencias estadísticamente significativas entre las coberturas en hombres y mujeres a pesar de que, en la presente investigación, las mujeres obtuvieron mayores coberturas de manera sistemática para todas las vacunas y sus combinaciones.
Cabe decir que, aunque algunas publicaciones evalúan las coberturas de vacunación como indicador de resultado de una intervención dirigida6,12,17,18, la presente investigación representa la primera evaluación de la vacunación en pacientes reumatológicos con terapia biológica realizada en nuestro ámbito. De la misma manera, tampoco se han encontrado estudios nacionales con los que poder comparar estos resultados. Por ello, los autores interpretamos de forma positiva lo observado puesto que, aunque mejorables, son mayores de lo esperado teniendo en cuenta el contexto internacional. Esto se entiende como la responsabilidad y preocupación activa de los reumatólogos en el abordaje integral y multidisciplinar del paciente que recibe terapia biológica, cuestión que otros autores han demostrado con relación a la vacunación antigripal en mayores de 65 años y la vacunación frente a tos ferina en el embarazo cuando se encontró que las altas coberturas de vacunación se asociaban a la recomendación directa y proactiva por parte del sanitario hacia el paciente19-21.
Por último, cabe decir que, a pesar de los resultados obtenidos, esta investigación no se encuentra exenta de limitaciones. Principalmente, se trata de un estudio unicéntrico lo que hace que los resultados no puedan ser extrapolables a otros contextos. Aun así, y dada la escasez de estudios realizados sobre la temática en el territorio nacional, consideramos que la muestra incluida es suficiente para una primera aproximación al tópico de estudio.
En conclusión, las coberturas de vacunación antigripal y antineumocócica en la cohorte estudiada son mayores que las observadas por otros autores. La derivación de estos pacientes por parte del reumatólogo a la Unidad de Vacunas resulta clave para garantizar una correcta inmunización y minimizar así algunos de los posibles efectos adversos infecciosos de las terapias biológicas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.