Determinar factores predictores de desarrollo de nefritis lúpica (NL) al momento del diagnóstico del lupus eritematoso sistémico (LES).
MétodosSe realizó un estudio de casos y controles en un único centro. Participaron 595 pacientes con diagnóstico de LES sin NL por parámetros clínicos o de laboratorio; al diagnosticarlos, fueron seguidos durante una media de 6,8 (±4,5) años, conformándose de los datos de sus expedientes dos grupos: con NL (casos) y sin NL (controles) al final del seguimiento. Se compararon entre ambos grupos variables sociodemográficas, clínicas, serológicas, inmunológicas y la relación albúmina/globulina (RAG), calculada como la albúmina /proteínas totales −albúmina al diagnóstico. Se efectuó un análisis univariado y multivariado.
ResultadosEn el seguimiento presentaron NL 124 (20,8%) pacientes y no desarrollaron NL 471 (79,2%). Análisis univariado: variables asociadas significativamente al desarrollo de NL: hábito de fumar, úlceras orales, serositis, más de cuatro criterios de clasificación, inicio abrupto del LES, mayor valor de SLEDAI, baja la RAG, bajos niveles de C3, títulos elevados de anti-DNA doble cadena (anti-DNAdc), anti-nucleosomas y positividad de la inmunofluorescencia en piel. Análisis multivariado: factores predictores de desarrollar NL: niveles séricos elevados de anti-DNAdc (odds ratio [OR]:15,82; intervalo de confianza [IC]:1,08-1,22, p<0,0001), disminución de la fracción C3 (OR: 36,50; IC: 13,52-81,91, p<0,0001) y la RAG<1 (OR: 47,58; IC: 11,85-79,17, p<0,0001).
ConclusiónLa RAG por debajo de uno fue el mayor predictor de aparición de la NL; conjuntamente con los niveles bajos de C3 y elevados de anticuerpos anti-DNAdc, pueden contribuir a identificar pacientes con mayor riesgo de presentar NL.
To determine predictive factors for the development of lupus nephritis (LN) at the time of diagnosis of systemic lupus erythematosus (SLE).
MethodsA case-control study was carried out in a single centre, 595 patients participated diagnosed with SLE without LN by clinical or laboratory parameters at diagnosis. They were followed for a mean of 6.8 (±4.5) years, two groups were formed from the data from their records: with NL (cases) and without NL (controls) at the end of the follow-up. Sociodemographic, clinical, serological, immunological variables and albumin/globulin ratio (AGR), calculated as albumin /total protein −albumin at diagnosis, were compared between both groups. A univariate and multivariate analysis was carried out.
Results124 (20.8%) patients had LN during follow-up and 471 (79.2%) did not develop LN. Univariate analysis: variables significantly associated with the development of LN: smoking, oral ulcers, serositis, more than four classification criteria, abrupt onset of SLE, higher SLEDAI score, low AGR, low C3 levels, high anti-titres double stranded DNA (anti-dc DNA), anti-nucleosomes and positivity of immunofluorescence in skin. Multivariate analysis: predictors of developing LN: elevated serum levels of anti-dc DNA (odds ratio [OR]: 15.82; confidence interval [CI]: 1.08-1.22, P<.0001), decrease in C3 fraction (OR: 36.50; CI: 13.52-81.91, P<.0001) and RAG<1 (OR: 47.58; CI: 11.85-79.17, P<.0001).
ConclusionAn AGR below one was the greatest predictor of the appearance of LN, together with low levels of C3 and high levels of anti-dc DNA antibodies; these may contribute to identifying patients at higher risk of presenting LN.
El lupus eritematoso sistémico (LES) es una enfermedad crónica autoinmune que puede afectar múltiples órganos y tejidos, y el desarrollo de enfermedad renal es el más importante predictor de morbimortalidad. La nefritis lúpica (NL) es una complicación grave de la enfermedad; afecta del 25 al 75% de los pacientes, influida esta frecuencia por la etnia, el sexo y la edad de presentación, entre otros factores1-3. A pesar de los avances que se han obtenido en el tratamiento de la NL, un grupo no despreciable de enfermos desarrollaran daño renal irreversible4-6.
La NL puede constituir la primera manifestación del LES; es más frecuente que aparezca en el primer año del diagnóstico, pero puede desarrollarse durante el curso de la enfermedad7,8. El diagnóstico temprano, la utilización de agentes inmunosupresores y la respuesta a la terapia de inducción son factores importantes para lograr mejores resultados en su control9-12.
Cuando se comparan la eficacia de los tratamientos según el momento de aparición de la NL, haya sido al inicio de la enfermedad o en el curso de la misma, se han obtenido los peores resultados en el segundo grupo de pacientes8,13,14. Otros estudios han incursionado en identificar diferencias demográficas, clínicas, serológicas e inmunológicas entre los grupos con disímiles resultados14-16. Se ha analizado, además, la asociación con el desarrollo ulterior de NL de los niveles de globulina y albúmina en suero y de la presencia de depósitos de inmunoglobulinas en la unión dermoepidérmica en piel16-19.
El objetivo de este estudio fue determinar los factores predictores de desarrollo de NL al momento del diagnóstico de LES.
Pacientes y métodosDel universo de pacientes diagnosticados de LES en el servicio de Reumatología del hospital Hermanos Ameijeiras, en La Habana, Cuba, entre el 3 de enero 2005 y el 31 de diciembre del 2019 se realizó un estudio de casos y controles; los pacientes cumplían con los criterios de clasificación para LES del Colegio Americano de Reumatología (ACR)20. Se excluyeron los pacientes que presentaron alguno de los siguientes datos de laboratorio de NL clínica al diagnosticarse la afección: proteinuria ≥0,5g/24h o proteinuria+++, creatinina sérica ≥123,7μmol/l, tasa de filtrado glomerular estimada ≤60ml/min/1,73m2, recuento de eritrocitos o leucocitos ≥10 células por campo de alto poder, ≥3 cilindros granulares o celulares por campo de alto poder. Los que tenían infección activa confirmada por cultivos, disfunción hepática, malignidad diagnosticada, embarazadas y los casos en que los datos de sus expedientes se encontraban incompletos y no permitían su valoración fueron seguidos durante una media de 6,8 (±4,5) años, conformándose de los datos de sus expedientes dos grupos: uno que desarrolló NL clínica o por biopsia renal (casos) y el otro sin llegar a presentar NL clínica (controles) durante el seguimiento.
Se recogieron del momento del diagnóstico los siguientes datos basales: edad, sexo, etnia según color de piel y características antropométricas clasificadas por tres especialistas en blancos, negros o mestizos, escolaridad, hábito de fumar, consumo de alcohol, presencia de síntomas clínicos como artritis, fotosensibilidad, eritema facial, eritema discoide, alopecia, úlceras orales, fiebre, serositis, afectación del sistema nervioso central (SNC), cuantificación del número de criterios de clasificación, forma de presentación de la afección: abrupta (presentación de los síntomas en menos de 4semanas) o insidiosa (más de 4semanas en la presentación de síntomas).
Se consideraron además los valores o presencia de: hemoglobina, leucocitos, linfocitos, plaquetas, velocidad de sedimentación globular (VSG), proteínaC reactiva (PCR), creatinina, urea, proteínas totales y albúmina séricas, relación albúmina-globulina (RAG) obtenida por la ecuación RAG=albúmina /(proteínas totales −albúmina), transaminasa glutámico pirúvica (TGP), transaminasa glutámico oxalacética (TGO), tasa de filtración glomerular (FG), fracción C3 y C4, anticuerpos anti-DNA doble cadena (anti-DNAdc), anti-Smith (antiSm), anti-RNP, anti-nucleosomas, anti-Ro/SSa y anti-La-SSb, anticoagulante lúpico, presencia de depósitos de inmunoglobulinas en estudio de inmunofluorescencia en biopsia de piel sana expuesta al sol (banda lúpica). La actividad de la enfermedad se midió con el Systemic Lupus Erythematosus Disease Activity Index (SLEDAI)21. Para lograr el objetivo del estudio se definió la existencia de NL en el seguimiento por la presencia de uno de los dos siguientes criterios:
- 1.
Por biopsia renal según la clasificación de la Sociedad Internacional de Nefrología y Patología Renal22.
- 2.
Presencia de NL clínica: proteinuria ≥0,5g/24h o proteinuria+++; y/o una de las siguientes características atribuibles al LES, presentes en ≥2 visitas con separación de al menos 6meses entre ellas: proteinuria++, creatinina sérica ≥123,7μmol/l, tasa de filtrado glomerular estimada ≤60ml/min/1,73m2, recuento de eritrocitos o leucocitos ≥10 células por campo de alto poder, ≥3 cilindros granulares o celulares por campo de alto poder.
El tiempo de desarrollo de la nefritis se consideró como la diferencia entre el diagnóstico del LES y el momento en que apareció la NL.
El proyecto de esta investigación fue aprobado por el Comité de Ética y el Consejo Científico del centro, institución del Ministerio de Salud Pública de la República de Cuba. Se preservó la identidad de los pacientes; al ser un estudio retrospectivo, no requirió consentimiento informado.
Análisis estadísticoLa comparación entre grupos se realizó mediante la prueba de chi cuadrado (χ2) o el test exacto de Fisher para las variables cualitativas, según fuese apropiado. Para las variables cuantitativas se empleó la prueba t de Student para muestras independientes o la prueba U de Mann-Whitney, de acuerdo a la normalidad de la población entre los grupos. Para identificar los predictores de NL se realizó un análisis multivariado de regresión logística binaria (RLB). En los resultados del modelo final de RLB, para cada variable predictiva se mostraron los odds ratio (OR) y los intervalos de confianza (IC), así como la significación estadística (valor de p). Se consideraron estadísticamente significativas las pruebas de hipótesis con una p<0,05. Se realizaron curvas ROC para las variables predictoras de NL y se estimó el área bajo la curva (AUC). Los datos fueron analizados utilizando el paquete estadístico SPSS versión 20.0.
ResultadosDe los 768 pacientes con diagnóstico de LES atendidos, 148 fueron excluidos por presentar NL al inicio de la enfermedad (19,3%), 10 por infección activa, 8 que presentaban disfunción hepática, 3 por enfermedad maligna, 2 por estar embarazadas y 2 por expedientes incompletos, quedando incluidos en el estudio 595 pacientes.
No tenían datos de NL al diagnóstico del LES 595 pacientes; durante el seguimiento desarrollaron NL 124 (20,8%) y 471(79,2%) permanecieron sin nefritis. La media de duración del seguimiento fue de 6,8 (±4,5) años y el tiempo medio de desarrollo de NL fue de 14,7(±11,3) meses. La incidencia acumulada de NL fue del 35,4%. De los casos incluidos, el 93,1% eran del sexo femenino, con una relación mujer:hombre de 13,5:1.
Se diagnosticó la nefropatía por biopsia en 122 casos; 67 de ellos (55,7%) tenían claseIV, 21 (16,9%) claseII, 19 (15,3%) claseIII y 15 (12,1%) clase V. En 2 no se pudo hacer biopsia por tener trastornos de la coagulación y ser imperioso iniciar tratamiento; cumplían estos 2 pacientes con los criterios de laboratorio señalados en el método para considerar existencia de NL.
En la tabla 1 se observa que la distribución por edad fue similar en ambos grupos, al igual que el predominio del sexo femenino, y que la etnia negra se asoció significativamente con la aparición de NL. Hubo un conjunto de variables que presentaron valores o frecuencias mayores en el grupo que desarrolló NL, como el tabaquismo, el inicio abrupto de la enfermedad, los valores de SLEDAI, anti-DNAdc, anti-nucleosomas, todas con diferencias significativas, al igual que los niveles bajos de C3 y la RAG <1.
Características al diagnóstico de los pacientes con LES que desarrollaron o no nefritis lúpica en el seguimiento (análisis univariado)
| Variables | LES con nefritisn = 124 | LES sin nefritisn = 471 | p |
|---|---|---|---|
| Edad en años (DE) | 34,1 (11,3) | 33,7 (12,0) | 0,738 |
| Sexo femenino | 116 (93,5%) | 438 (93,0%) | 0,506 |
| Etnia | |||
| Blanca | 81 (65,3%) | 306 (64,9%) | 0,177 |
| Negra | 22 (17,7%) | 47 (10,1%) | 0,021 |
| Mestiza | 21 (17%) | 118 (25%) | 0,019 |
| Tabaquismo | 49 (39,5%) | 85 (18,0%) | <0,001 |
| Artritis | 98 (79%) | 320 (67,9%) | 0,010 |
| Fotosensibilidad | 77 (62,1%) | 325 (69,0%) | 0,089 |
| Eritema facial | 85 (68,5%) | 307 (65,2%) | 0,277 |
| Fiebre | 78 (62,9%) | 245 (52,0%) | 0,019 |
| Alopecia | 72 (58,1%) | 207 (43,9%) | 0,003 |
| Úlceras orales | 58 (46,8%) | 146 (31,0%) | <0,001 |
| Serositis | 38 (30,6%) | 80 (17,0%) | <0,001 |
| Eritema discoide | 15 (12,1%) | 97 (20,6%) | 0,019 |
| Manifestaciones del SNC | 15 (12,1%) | 40 (8,5%) | 0,145 |
| Criterios ACR, más de 4 | 81 (65,3%) | 179 (38,0%) | <0,001 |
| Inicio abrupto de la enfermedad | 8 (6,5%) | 0 (0,0%) | <0,001 |
| SLEDAI | 12,1±3,5 | 9,3±4,13 | <0,001 |
| Creatinina sérica (μmol/l) | 76±13 | 79±12 | <0,001 |
| Proteinas totales (g/l) | 74±5,9 | 78±6,8 | <0,001 |
| Albúmina sérica (g/l) | 36±3,5 | 38±3,2 | <0,001 |
| RAG <1 | 110 (88,7%) | 66 (14,0%) | <0,001 |
| RAG | 0,805±0,198 | 1,095±0,289 | <0,001 |
| TGP (U/l) | 32,5±10,7 | 32,3±9,1 | 0,913 |
| TGO (U/l) | 28,4±10,3 | 30,0±9,8 | 0,072 |
| C3 (g/l) | 0,7±0,3 | 1,1±0,3 | <0,001 |
| C4 (g/l) | 0,14±0,1 | 0,15±0,1 | 0,336 |
| Anti-nucleosoma (U/l) | 10,8±62,6 | 0,17±0,38 | <0,001 |
| Anti-DNAdc (U/ml) | 109,6±84,1 | 20,1±42,8 | <0,001 |
| Anti-Smith (U/ml) | 0,96±9,05 | 0,15±0,36 | 0,054 |
| Anti-SSA/Ro (U/ml) | 0,20±0,4 | 0,20±0,4 | 0,983 |
| Ant-SSB/La (U/ml) | 0,08±0,3 | 0,06±0,2 | 0,468 |
| Anti-RNP (U/ml) | 0,18±0,39 | 0,17±0,37 | 0,747 |
| Anticoagulante lúpico positivo | 10 (8,1%) | 49 (10,4%) | 0,428 |
| Inmunofluorescencia de piel sana positiva | 95 (76,6%) | 144 (30,6%) | <0,001 |
ACR: Colegio Americano de Reumatología; dc: doble cadena; DE: desviación estándar; RAG: relación albúmina-globulina; SLEDAI: índice de actividad del lupus eritematoso sistémico; SNC: sistema nervioso central; TGO: transaminasa glutámico oxalacética; TGP: transaminasa glutámico pirúvica;
Otras de las variables comparadas entre los grupos y que resultaron significativas con p<0,001 fueron la alopecia, las úlceras orales y las serositis, tener más de 4 criterios ACR de clasificación, creatinina sérica, proteínas totales, albumina sérica, C3 y la inmunofluorescencia de piel sana positiva.
El resto de variables analizadas no fueron estadísticamente diferentes entre los dos grupos.
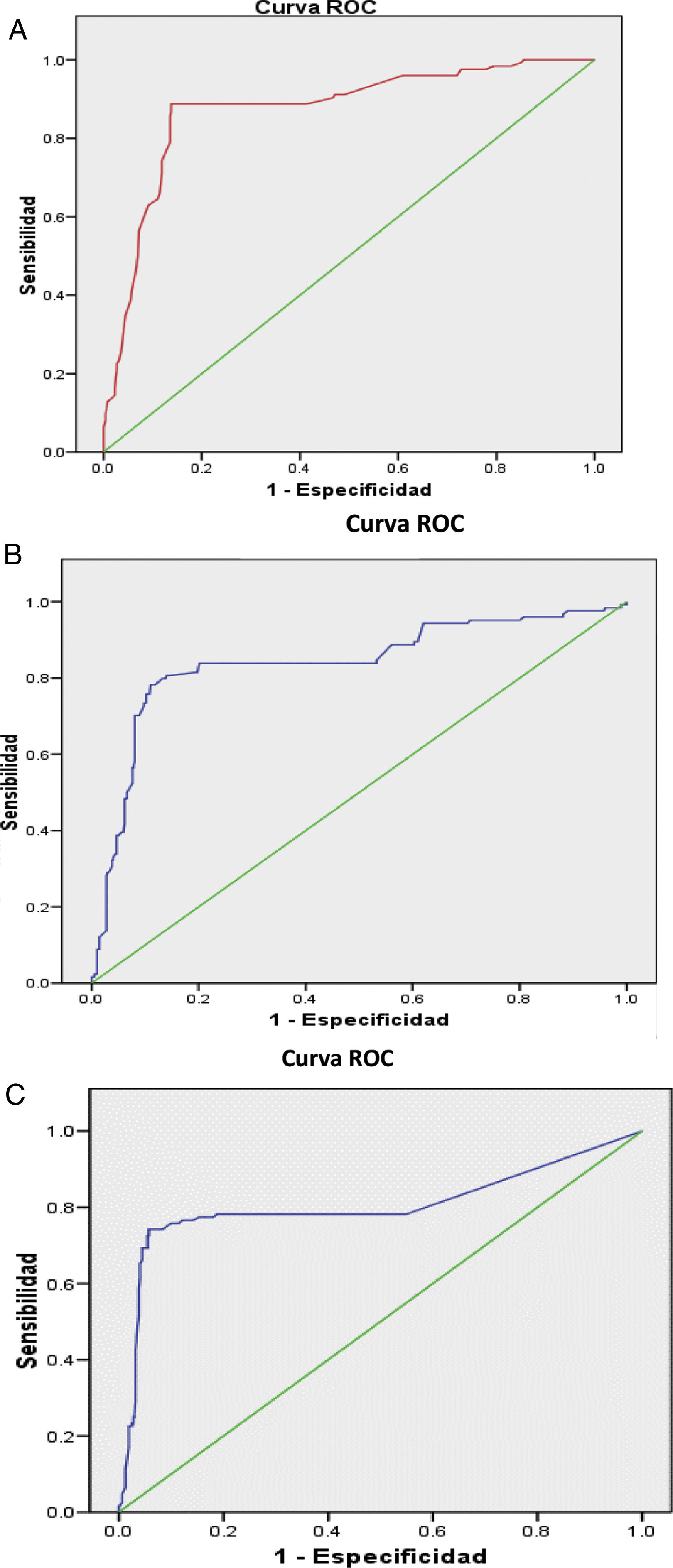
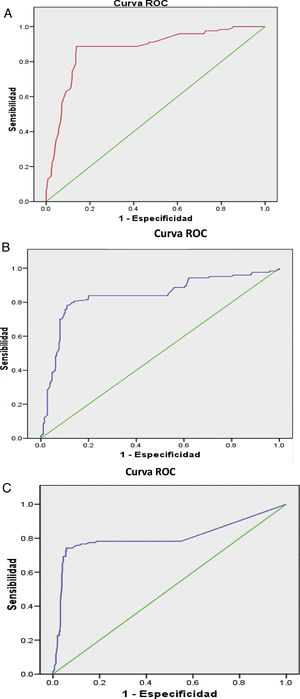
El análisis multivariado (tabla 2) muestra las variables que constituyeron factores predictores de NL, e incorporó las que habían resultado significativas en el univariado; se incluyeron en la tabla además los valores del AUC de las curvas ROC de los factores predictores, que se muestran en la figura 1A-C), resaltando como principal factor predictor de NL la RAG inferior a la unidad. El resto de las variables que habían sido significativas en el univariado no se asociaron con el desarrollo de NL en el análisis multivariado.
Factores predictores del desarrollo de nefritis lúpica (análisis multivariado)
| Variables | OR | IC 95% | p | AUC |
|---|---|---|---|---|
| anti-DNAdc | 15,82 | 1,08-1,22 | <0,0001 | 0,80 |
| C3 bajo | 36,50 | 13,52-81,91 | <0,0001 | 0,83 |
| RAG <1 | 47,58 | 11,85-79,17 | <0,0001 | 0,87 |
AUC: área bajo la curva; dc: doble cadena; IC: intervalo de confianza; OR: odds ratio; RAG: relación albúmina-globulina.
Este estudio reafirma la utilidad que tiene el valor de la RAG al inicio de la enfermedad como factor predictor de riesgo de desarrollar NL durante el curso del LES. Los pacientes con valores inferiores a uno tienen un pronóstico mayor de tener NL en la evolución de la enfermedad; esto pudiera estar justificado por un nivel superior de globulinas dentro del total de proteínas, muy unido a la presencia elevada de autoanticuerpos necesarios para que se exprese la afección renal22.
El valor de la RAG ha sido utilizado como indicador pronóstico en otras enfermedades como el cáncer23, pero en el LES existen pocos reportes de su uso en este sentido y han sido realizados en población asiática16, por lo que consideramos que los resultados constituyen un aporte en población diferente, en este caso de descendencia hispana y africana.
El estudio incluye un número de pacientes elevado, y al tratarse de casos de un único centro hospitalario puede asegurar mayor uniformidad de resultados en una población muy mezclada étnicamente entre blancos, negros y mestizos, lo que conlleva inevitablemente un sesgo difícil de controlar al definirla, ya que en nuestro medio no es infrecuente ver personas de color de piel blanco con algún familiar cercano negro. No obstante, los pacientes de raza negra se asociaron significativamente al desarrollo de NL, ratificando la mayor severidad de la enfermedad en personas de descendencia africana, lo cual ha sido publicado reiteradamente24,25.
La incidencia acumulada de NL, variable entre distintas poblaciones, puede estar motivada por diferencias sociodemográficas, ambientales e inmunogenéticas, y también por los diferentes criterios de inclusión que se utilizan; así, hay reportes en pacientes caucásicos (29,1%), hispanos (60,6%) y afroamericanos (68,9%) estudiados en Estados Unidos; un estudio en 391 pacientes coreanos reportó una frecuencia del 34,8%. Una investigación multinacional que incluyó países de América, Europa y Asia, con un total de 1.827 pacientes, presentó una frecuencia de NL en su seguimiento del 38,3%16,24-26. La incidencia acumulada determinada en nuestro estudio (35,4%) se encuentra entre los valores reportados, pero menor del valor publicado en pacientes afroamericanos e hispanos estudiados en Estados Unidos y del de la cohorte latinoamericana de GLADEL. Consideramos esto atribuible a las diferentes características genéticas de la población cubana24,27.
El hábito de fumar se asoció al desarrollo ulterior de nefritis, lo que pudiera estar relacionado con una mayor presencia de anticuerpos anti-DNAdc que tienen relación patogénica con el desarrollo de NL28. Es una variable modificable, la cual se debe considerar desde el comienzo de la enfermedad y atender con acciones educativas a los pacientes y familiares. La asociación de la pleuresía, el mayor valor de actividad de la enfermedad, así como un mayor número de criterios al diagnóstico y el inicio abrupto, fueron variables que se asociaron a la presencia después de NL y constituyen resultados que han sido reportados en la literatura24.
Los valores bajos de C3 fueron otra variable con elevado nivel pronóstico de desarrollo ulterior de NL. Este hallazgo traduce la activación de la vía alternativa del complemento para que se produzca el daño en la NL. Estudios anteriores han mostrado la asociación entre esta variable y la presencia de anticuerpos anti-DNAdc con la NL29,30.
El estudio tiene sus limitaciones. Se trata de una investigación retrospectiva en la que solo se consideraron variables presentes al establecer el diagnóstico, por lo que no existieron momentos de evaluación en el seguimiento que pudieran haber agregado otras variables, como el caso de los tratamientos y las respuestas a los mismos, los cuales pueden tener influencia en la presentación de la NL. En el caso de los antimaláricos, estudios en población latinoamericana con varios grupos étnicos realizados por Pons-Estel y colaboradores en el marco de la cohorte multinacional de GLADEL encontraron que el uso de estos medicamentos estuvo asociado con menor afección renal24,27.
En conclusión, nosotros mostramos en población cubana que una baja RAG presente al diagnóstico del LES se asocia al riesgo de presentar NL durante la evolución de la enfermedad; por lo demás, es una determinación de relativo bajo costo que, junto con otros indicadores, como niveles bajos de C3 y anticuerpos anti-DNAdc elevados, puede contribuir a identificar pacientes con mayor riesgo de presentar NL desde el momento de su diagnóstico. Es cierto que tanto el C3, los anti-DNAdc, los niveles de albúmina y/o la RAG pudieran estar afectados por una nefropatía subclínica y ya estar marcando la presencia de una afección renal y no predecir su desarrollo. Ello constituye una hipótesis plausible, similar a la establecida cuando se detectan autoanticuerpos en suero antes de que se exprese clínicamente la enfermedad29, pero de manera similar consideramos que el conocimiento de su presencia permite diseñar estrategias preventivas para tratar de evitar la expresión clínica de la nefritis en un caso y de la enfermedad en el otro, y dentro de estas acciones programar la monitorización de los pacientes para detectar oportunamente datos clínicos o de laboratorio de nefritis y poder iniciar tratamiento temprano con las ventajas que esto tiene para el pronóstico a largo plazo de la enfermedad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.