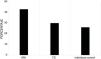Los ANA/DFS70 han atraído el interés por su frecuencia en individuos sin evidencia clínica de enfermedad reumática sistémica autoinmune, no se han evaluado grupos de riesgo genético para artritis reumatoide (AR).
ObjetivoDeterminar la frecuencia de ANA y ANA/DFS70 en familiares consanguíneos (FC) de AR comparada con pacientes con AR temprana (ARt) e individuos control y su asociación con el estado de salud.
MetodologíaEstudio de corte transversal con componente analítico. Análisis de 60 pacientes ARt, 60 FC y 120 individuos control pareados por edad y sexo. Se analizaron ANA-HEp2 y ANA/DFS70. Establecieron las frecuencias absolutas y relativas y asociaciones con modelos de regresión logística, con un nivel de significación del 95%.
ResultadosANA de 43% en ARt, 30% en FC y 25,8% en individuos control a título 1:80. El patrón granular fino denso por Hep2 convencional se encontró en el 12,9% de las muestras positivas y el 1,66% del total de muestras. En ANA/DFS70 (+) en 1,66% en FC y 2,5% de individuos control, representando el 75% de la muestras positivas y el 1,25% del total de las muestras. No hubo detección de ANAS-DFS70 en pacientes con ARt. En ARt hubo asociación entre la presencia de ANA y articulaciones inflamadas (p=0,02), PCR (p=0,01), DAS28PCR (p=0,03) y HAQ (p=0,04). Asociación entre ANA y PCR elevada (p=0,05) en FC. En individuos control entre ANA y articulaciones dolorosas (p=0,02). En individuos ANA-DFS70 observamos asociación con VSG normal p=0,032, FR (-), p=0,044 y ausencia de articulaciones dolorosas, p=0,039.
ConclusionesLa frecuencia de ANA/DFS70 en los grupos estudiados fue baja, ninguno de los pacientes con ARt fue positivo. Se confirma la presencia de ANA/DFS70 solo en individuos sanos sistémicamente.
DFS70 ANAs have attracted interest due to their frequency in individuals with no clinical evidence of systemic autoimmune rheumatic disease, groups with genetic risk for rheumatoid arthritis (RA) were not assessed.
ObjectiveTo determine the frequency of ANA and DFS70 ANA in blood relatives (BR) of people with RA compared to patients with early RA (ERA), and control individuals, and its association with health status.
MethodologyA cross-sectional study with an analytical component. Sixty ERA patients, 60 BR and 120 control individuals paired by age and sex were studied. Hep2-ANA and DFS70 ANA were studied. The absolute and relative frequencies and associations were established using logistic regression models, with a significance level of 95%.
Results43% ANA in ERA, 30% in BR, and 25.8% in control individuals 1:80. The fine dense granular pattern based on conventional Hep2 was found in 12.9% of the positive samples, and 1.66% of the total samples. There was no detection of DFS70 ANAs in patients with ERA. In ERA there was an association between the presence of ANA and inflamed joints (p=.02), CRP (p=.01), DAS28CRP (p=.03) and HAQ (p=.04). There was an association between ANA and elevated CRP (p=.05) in the BR. In the control individuals, there was an association between ANA and painful joints (p=02). In DFS70 ANA individuals we observed an association between a normal ESR p=.032, BR (-), p=.044 and absence of painful joints, p=.039.
ConclusionsThe frequency of DFS70 ANA in the groups studied was low, none of the patients with ERA was positive. The presence of DFS70 ANA was only confirmed in systemically healthy individuals.
La presencia de ANA ha sido motivo de preocupación tanto para clínicos como para pacientes, ante la posibilidad de tener o encontrarse en riesgo de desarrollar algún tipo de enfermedad sistémica autoinmune; más aún si hay familiares de primer grado afectados; llevando generalmente implícito el control y seguimiento tanto clínico como paraclínico.
Durante el 12.° Workshop Internacional de autoanticuerpos y autoinmunidad, se planteó la necesidad de establecer un consenso para la nomenclatura de los diferentes patrones de ANA observados mediante inmunofluorescencia indirecta (IFI)1. En el 2015 se publicó el primer consenso donde se acordó la descripción de los patrones de ANA en 3 grandes grupos: nuclear, citoplasmático y mitótico, estando cada uno de estos a su vez segregados en subgrupos de patrones más específicos. En particular el subtipo granular, incluye a su vez un patrón denominado «granular fino denso (AC-2)»1–3, el cual usualmente tiene como blanco la proteína de 70kDa (DFS70, por sus siglas en inglés) comúnmente conocida como factor de crecimiento derivado del epitelio del cristalino p75 (LEDGFp75)4.
Los anticuerpos anti DFS70/LEDGFp75 (ANA/DFS70) han atraído recientemente el interés por su relativa frecuencia en pacientes con ANA positivos sin evidencia clínica de enfermedad reumática autoinmune sistémica (ERAS). Su presencia ha sido documentada primariamente en pacientes con diversas condiciones inflamatorias no reumáticas y en individuos «aparentemente saludables»5–11. Estos autoanticuerpos están presentes en muy baja frecuencia en pacientes con ERAS5,8–11.
Cuando los anti-DFS70 están presentes en pacientes con ERAS usualmente están acompañados por autoanticuerpos específicos9–11.
Esto ha llevado a la hipótesis que los ANA/DFS70 pueden ser unos marcadores útiles para excluir el diagnóstico de ERAS y un algoritmo para su utilidad clínica ha sido desarrollado7,10,11. Los reportes de prevalencia de ANA/DFS70 en la literatura incluyen principalmente población asiática, europea y norteamericana6,7, son escasos los datos con los que se cuenta en población hispana-latinoamericana. Desde la década de los 80 la Dra. Graciela Alarcón, describe que debido a que en los países latinoamericanos aproximadamente la mitad de la población se encuentra en el grupo de menores de 15 años existen diferencias en la relativa frecuencia de las enfermedades reumáticas. A ello contribuyen también otros factores tales como la composición étnica de los grupos de población y características socioculturales y ambientales inherentes a su condición de países en desarrollo12. Recientemente se encontró que la prevalencia de la AR en Colombia es mayor a lo comúnmente reportado, menor para fibromialgia y gota, y similar para osteoartritis, lupus eritematoso sistémico y espondiloartritis13.
Uno de los estudios realizados en población mexicana encontró una frecuencia del 17% en población sana y muy baja en individuos con sospecha de ERAS14, el único estudio realizado en Colombia15, no incluyó población en riesgo (familiares) y todos sus resultados no fueron concordantes con los hallazgos reportados en otras poblaciones y no incluyeron pacientes con AR en fases tempranas y sus familiares, lo que hace novedosa esta propuesta y sus resultados. La metodología en el estudio anterior solo incluyó detección de la proteína DFS70 sin evaluación previa de los ANA por IFI. El objetivo del presente estudio fue determinar la frecuencia de ANA y ANA/DFS70 en FC de pacientes con AR comparado con pacientes con ARt e individuos control y su asociación con el estado de salud.
Materiales y métodosEstudio de corte transversal con componente analítico. Se incluyeron 240 individuos; 60 pacientes con ARt, 60 FC en primer y segundo grado y 120 individuos control sanos pareados por edad y sexo para cada grupo, tomados a partir de 2 centros de reumatología. El muestreo fue hecho por conveniencia.
Los criterios de inclusión de los pacientes con AR fueron pacientes entre 18-65 años que cumplían los criterios de clasificación ACR/EULAR 2010 con menos de dos años de evolución16 y que tenían tratamiento convencional. El grupo de FC fue tomado de manera aleatoria de una base de datos institucional. Se incluyeron 60 individuos los cuales provenían de 50 familias representadas por un individuo, 9 familias constituidas por 2 individuos (hermanos) y una por sujetos 3 (hermanos). Cuarenta y dos FC en primer grado (34 hijos de madre con AR, 8 de padre con AR), y 18 con segundo grado de consanguinidad (hermanos de paciente con AR) según las recomendaciones de EULAR (individuos con riesgo de AR sobre la base genética)17. El grupo de individuos control fueron personas que vivían en circunstancias laborales o ambientales similares a las de los pacientes. Los criterios de exclusión fueron otra enfermedad autoinmune, enfermedad infecciosa, neoplasias, diabetes, tratamiento con antibióticos, embarazo o lactancia. Todas las personas aceptaron y firmaron consentimiento informado aprobado por el comité de investigación y ética institucional HMC 2017-057.
Se obtuvo un historial médico completo relacionado con AR. La actividad de la enfermedad de la AR se midió por índices de actividad de enfermedad simplificado (SDAI), el Disease Activity Score 28 (DAS28), Routine assessment of patient index data 3 (RAPID3) y multidimensional health assessment questionnaire (MDHAQ), realizado por reumatólogos.
Se evaluaron niveles de proteína C reactiva-PCR de alta sensibilidad por quimioluminiscencia (Immulite 1000, Siemmens®), velocidad de sedimentación globular (VSG) por fluorometría (Prueba 1 THL Ali FAX®), anticuerpos antipéptido cirtrulinado anti-CCp método enzimático (Quanta lite® CCP 3.1 IgG / IgA, INOVA Diagnostics) y factor reumatoide (FR) por turbidimetría por, Spinreact®).
Se realizó la determinación de ANA mediante técnica IFI, el suero se hizo reaccionar sobre las láminas con el sustrato HEp-2 y HEp-2-DFS70 REF 1108, Autoantiboy test System IMCO Diagnostics ®. Knocked out, para el gen psip lo cual previene sitios de unión a la proteína de 70 kd reconocida por estos autoanticuerpos. Estas células modificadas son capaces de reconocer todos los demás autoanticuerpos excepto el DFS7018. Se realizó una dilución inicial de 1/80 a título final, siendo positivas aquellas muestras con fluorescencia con el patrón con tinción granular fina densa en el nucleoplasma de la interfase celular, típicamente excluyendo los nucléolos con una tinción brillante de los cromosomas en fase celular mitótica. Cada test se corrió con sus respectivos controles positivos y negativos.
Se establecieron las frecuencias absolutas y relativas para cada variable y se establecieron asociaciones con modelos de regresión logística bi- y multinomiales entre parámetros de actividad clínica y autoanticuerpos. Se utilizó el paquete estadístico STATA versión 13.0 para Windows, todos los análisis se hicieron con un nivel de significación del 95%.
ResultadosCaracterísticas demográficas y clínicas de pacientes con artritis reumatoide y familiares de artritis reumatoideEl grupo de ARt presentó una media para la edad de 47,7, en un rango entre los 19 y 64 años (desviación estándar, DE: 10,9 años), un peso medio de 65,2 kg, (DE: 16,05 kg), una talla promedio de 1 metro con 60,0 cm (DE: 0,08) y una media de IMC de 25,2 (mínimo de 15,6 y máximo de 40,8) y DE de 5,18. El 81,6% (49/60) de los pacientes fueron de sexo femenino y el 53,3% de los pacientes (32/60) tenían comorbilidades (tabla 1). Solo el 5% (3/60) refirió fumar y el 33,3% (20/60) refirió haber fumado alguna vez en la vida. Del total de pacientes, el 16,6% (10/60) dijeron ser fumadores pasivos.
Características demográficas de los grupos a estudio
| Característica | ARt | Individuos control AR | FC | Individuos control FC |
|---|---|---|---|---|
| Sexo (F) (%) | 81,6 | 81,6 | 76,6 | 75 |
| Edad (años)* | 47,7 | 47,6 | 38,5 | 38,6 |
| Peso (kgs)* | 65,2 | 63,0 | 65,2 | 62,3 |
| Talla (mts)* | 1,60 | 1,59 | 1,62 | 1,61 |
| IMC* | 25,2 | 24,6 | 24,5 | 23,7 |
ARt: artritis reumatoide temprana; FC: familiar consanguíneo de pacientes con AR.
En cuanto a la actividad económica, los pacientes se clasificaron más frecuentemente como empleados con 41,6%, seguido por personas dedicadas al hogar con el 33,3%.
El 80% (48/60) de ellos recibían terapia convencional, de los 48 pacientes que recibían tratamiento farmacológico, el 93,7% (45/48) tomaba metotrexate en combinación con otro fármaco modificador de la enfermedad (FARME). Un 20% (12/60) no estaba recibiendo tratamiento farmacológico. El 75% de los pacientes presentaban más de una articulación dolorosa y solo un 25% negaban dolor articular. Más de la mitad (51,6%) de los pacientes presentaba entre 1 y 5 articulaciones dolorosas en el momento de la evaluación. El 61,6% de los pacientes tuvieron el DAS 28 mayor de 3,2 seguido por 30% con menor o igual a 2,6 y un 8,4% entre 2,7 y 3,2 Con base en la escala visual análoga, se encontró que el 76,7% de los pacientes refirió manifestar dolor. Además, el 68,4% de los pacientes según la escala SDAI se encontraron en actividad moderada, seguido por el 26,6% en actividad baja.
Se incluyeron 60 individuos FC de pacientes con AR con una media de 38,5 años, en un rango de edad entre los 18 y 69 años (DE: 11,8 años), un peso medio de 65,2 kg (DE: 12,27 kg), una talla promedio de 1 metro con 62 cm (DE: 0,08) y una media de IMC de 24,5 (mínimo de 17,6 y máximo de 32) para una DE de 3,34. El 76,6% (46/60) de los sujetos eran de sexo femenino y el 56,7% (34/60) no tenían comorbilidad (tabla 1).
Solo el 5% (3/60) refirió fumar y el 15% (9/60) refirió haber fumado alguna vez en la vida. Del total de FC evaluados, el 11,6% (7/60) dijeron ser fumadores pasivos. Por actividad económica, los individuos se clasificaron más frecuentemente como empleados con 66,6%, seguido por personas dedicadas al hogar y al trabajo independiente con el 13,3% cada uno de ellos. En cuanto al tipo de vivienda 34 de los 60 sujetos manifestaron vivir en casa propia (56,7%), 14 en vivienda común y 12 en arriendo (23,3% y 20%). Por nivel de estudios se encontró que el 65% de los individuos son universitarios.
Desde el punto de evaluación articular, El 60% (36/60) de los individuos no presentaron articulaciones dolorosas y un 40% (24/60) manifestaron más de una articulación dolorosa. Se encontró que la tercera parte de los individuos presentaban entre 1 y 5 articulaciones dolorosas y un 3,3% un número superior. El 83,3% de FC no presentaron inflamación articular (tabla 2).
Distribución de articulaciones inflamadas en el grupo de familiares consanguíneos de pacientes con AR
| N.° articulaciones inflamadas | Frecuencia | Porcentaje (%) |
|---|---|---|
| Ninguna | 50 | 83,3 |
| Hasta 5 articulaciones inflamadas | 9 | 15 |
| De 6 a 10 articulaciones inflamadas | 1 | 1,7 |
| Más de 10 articulaciones inflamadas | 0 | 0 |
| Total | 60 | 100 |
Los grupos anteriormente descritos fueron pareados en edad y sexo con individuos sanos. Como individuos control de los pacientes con ARt se incluyeron 60 individuos con una media de 47,6 años, en un rango de edad entre los 19 y 66 años (DE, 11,2 años), un peso medio de 63,04 kg (DE, 10,26kg), una talla promedio de 1 metro con 59 cm (DE, 0,07) y una media de IMC de 24,66 (mínimo de 17,9 y máximo de 31,6) para una DE de 3,10. El 81,6% (49/60) de los pacientes eran de sexo femenino (tabla 1) y el 50% de los pacientes (30/60) tenían comorbilidad.
Como individuos control de los FC de pacientes con AR se incluyeron 60 individuos con una media de 38,6 años, en un rango de edad entre los 18 y 71 años (DE, 12,0 años), un peso medio de 62,3 kg (DE, 12,33 kg), una talla promedio de 1 metro con 61 cm (DE: 0,08) y una media de IMC de 23,76 (mínimo de 17,5 y máximo de 38,7) para una DE de 3,53. El 75% (45/60) de los pacientes eran de sexo femenino y el 36,7% de los pacientes (22/60) tenían comorbilidad.
Clínicamente el grupo total de individuos control demostró en 72,5% (87/120) no presentar articulaciones dolorosas y un 27,5% (33/120) manifestaron más de una articulación dolorosa. Al categorizar el número de articulaciones dolorosas se encontró que la quinta parte de los individuos presentaban entre 1 y 5 articulaciones dolorosas y un 5% un número superior. El 92,5% de los individuos control no presentaron inflamación articular.
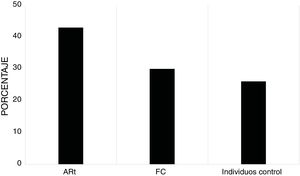
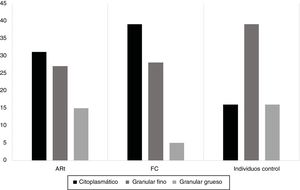
Al efectuar la caracterización del perfil de ANA en pacientes con ARt, FC e individuos control, se encontró positividad para ANA-IFI en 43% pacientes con ARt, 30% en FC y 25,8% en los individuos control (fig. 1). Para todos los grupos de estudio hubo predominio de títulos bajos (1/80) (fig. 2). Los patrones más frecuentes fueron citoplasmático, granular fino y granular grueso, con frecuencias variables en los distintos grupos de estudio, siendo el patrón citoplasmático más frecuente entre los individuos con ARt y FC y el patrón granular fino entre los individuos control (fig. 3).
La frecuencia del patrón ANAs-IFI citoplasmático predominó en los grupos de ARt y FDR seguido del patrón granular fino, a diferencia del grupo control, en quienes predominó el patrón granular fino.ARt: artritis reumatoide temprana; FC: familiar en primer grado de consanguinidad, del inglés First degree relative.
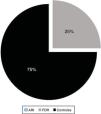
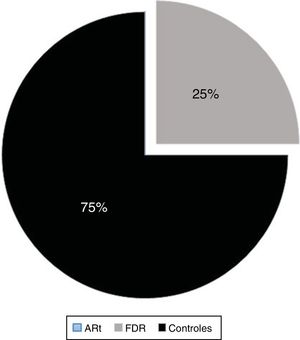
El patrón ANA/DFS70 por IFI convencional se encontró en el 6,6% (5/75) de las muestras reportadas como positivas y solo en el 2,1% (5/240) del total de muestras (tabla 3). En sustrato HEp-2 modificado la frecuencia del patrón granular fino denso fue de 1,66% (n=4/240) en el grupo total evaluado incluyendo ARt, FC e individuos control. En FC fue de 1,66% (1/60) y 2,5% (3/120) en individuos control, representando el 75% de la muestras positivas en el grupo de individuos control (3/4) para este patrón y el 1,25% del total de las muestras (n=3/240). No identificamos dicho patrón en pacientes con ARt (tabla 4 y fig. 4).
Distribución porcentual del patrón granular fino denso por ANA-IFI positivo en sustrato HEp-2 por grupos de estudio
| Grupo de estudio | ANA IFI AC-2 positivo (%) | n (%) | % Total muestras |
|---|---|---|---|
| ARt | 0/18(0) | 0 (0) | 0 |
| F | 1/26(3,8) | 1 (1,66) | 0,41 |
| Controles | 4/31(12,9) | 4 (3,33) | 1,66 |
A2:patrón granular fino denso; ARt: artritis reumatoide temprana; FC: familiar consanguíneo de pacientes con AR.
Distribución porcentual del patrón granular fino denso por ANA-DFS70 en sustrato HEp-2 modificado* por grupos de estudio
| Grupo de estudio | ANA IFI-DFS70 positivo (%) | n (%) | % Total muestras |
|---|---|---|---|
| ARt | 0/4(0) | 0 (0) | 0 |
| FC | 1/4(25) | 1 (1,66) | 0,41 |
| Controles sanos | 3/4(75) | 3 (2,5) | 1,25 |
ARt: artritis reumatoide temprana; FC: familiar consanguíneo de pacientes con AR.
Los individuos positivos para ANA-DFS70 en general fueron mujeres, con nivel de estudios hasta básica primaria. Con diagnóstico de enfermedad periodontal como comorbilidad, promedio para estatura 1,56 metros, peso 58kg e IMC de 23,83. No indicaron antecedentes o consumo de cigarrillo. Los valores de VSG, PCR, FR y anti-CCp fueron normales y negativos. No presentaron articulaciones dolorosas o inflamadas.
Para la determinación de las asociaciones entre variables se diseñaron 12 modelos de regresión logística para variables dependientes cualitativas bi- y multinomiales, obteniendo las siguientes asociaciones de mayor relevancia clínica.
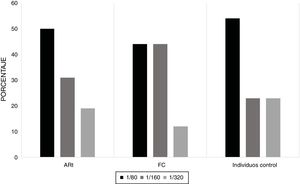
El 50% del total de las muestras ANA mostró títulos de 1/160 y el 50% mayor o igual a 1/320. En pacientes con ARt se observó que hay una relación entre la variable ANA-IFI con respecto a las variable sexo (femenino) con p=0,037, además se observó una tendencia importante entre ANA-IFI y articulaciones inflamadas con un p=0,084 y en el grupo de FC una asociación con valores positivos de PCR (p=0,05).
En el grupo de individuos control para FC hubo una asociación entre ANA-IFI y articulaciones dolorosas (p=0,014). En los individuos control para ARt, observamos relación entre ANA-IFI y el consumo de cigarrillo con un p=0,001 y el índice de discapacidad con un valor p=0,044. Se observó una tendencia a presentar articulaciones inflamadas (p=0,071).
En los individuos ANA-DFS70 positivos observamos asociación con VSG normal con un p=0,032, FR negativo con un p=0,044 y ausencia de articulaciones dolorosas con un p=0,039.
DiscusiónEl ensayo de ANA es comúnmente usado en el laboratorio para indicar la presencia de algún tipo de respuesta autoinmune cuando hay sospecha clínica2,3.
Estudios realizados5,8,11 en los últimos años han encontrado una frecuencia de 7 a 20% de positividad para ANA entre individuos «aparentemente saludables»; con patrón granular fino denso; seguimientos a 5 años de estos individuos no han demostrado evidencia de desarrollo de enfermedad autoinmune pese a presentar en algunos casos títulos elevados de ANA/DFS70, reportando frecuencias tan bajas de ERAS de 0,45% cuando estos se presentan en solitario10.
La presencia de ANA en un individuo sano y en FC de pacientes con ERAS generalmente lleva implícito un seguimiento clínico y paraclínico con el fin de diagnosticar de manera temprana ERAS. De allí la importancia que puede llegar a cobrar la inclusión de este marcador para descartar enfermedad autoinmune11.
Investigadores han reportado un aumento en la prevalencia de trastornos autoinmunes entre parientes de pacientes con AR, miopatías inflamatorias idiopáticas, diabetes mellitus insulinodependiente y lupus eritematoso sistémico entre otros19,20. De allí el interés de incluir el análisis de la determinación de los ANA DFS70 en poblaciones de riesgo como los FC de pacientes con AR.
Los reportes de prevalencia de ANA/DFS70 en la literatura incluyen principalmente población asiática, europea y norteamericana5–7, son escasos los datos con los que se cuenta en población hispana-latinoamericana. Con base en esto se planteó como objetivo general determinar la frecuencia de ANA-IFI y ANA/DFS70 en FC, pacientes con ARt comparados con individuos control sistémicamente sanos, así como efectuar la caracterización clínica de los individuos con autoanticuerpos positivos y evaluar su posible asociación con el estado de salud.
Como era de esperarse la mayoría de los sujetos fueron de sexo femenino de edad media, al parear los grupos de individuos control por edad y sexo si bien la mayoría no tenía comorbilidad importante ni autoinmunidad asociada, llama la atención el antecedente presente o pasado de consumo de tabaco en la tercera parte de esta población.
La frecuencia de positividad para ANA-IFI fue cercana al 31%, siendo relativamente similar a lo reportado en la literatura donde clásicamente se han descrito frecuencias que fluctúan entre el 20%21 y 25%22 en población general. Al hacer el análisis por discriminación de grupos, la frecuencia de positividad para ANA-IFI utilizando como punto de corte 1/80 fue superior en el grupo de ARt donde alcanzó frecuencias hasta de un 43% lo cual concuerda con la literatura23. De resaltar también la positividad para ANA-IFI en la tercera parte de los FC, lo cual ha sido también reportado en otros grupos de FC de enfermedades autoinmunes y de AR, sugiriendo que en nuestra población el condicionante genético pudiese tener una carga de enfermedad superior al factor exposicional24–26.
En todos los grupos poblacionales hubo un predominio de títulos bajos siendo más frecuentemente títulos 1/80, esto concuerda con lo reportado por Wanatabe et al.21 en su estudio llevado en población asiática y Mariz10 donde reportaron frecuencias de este título cercanas al 54% y lo reportado en población mexicana sana27,28.
En cuanto a patrones de ANA-IFI predominaron 3; 2 granulares y 1 citoplasmático, llamando la atención el predominio del patrón citoplasmático en los pacientes con ARt y FC. Por el contrario, en individuos controles, similar a lo descrito por Mariz et al.10, el patrón más frecuente fue el patrón nuclear granular fino, sugiriendo nuevamente que en nuestra población, los epítopes reconocidos ente individuos sanos y AR tradicionalmente involucrados en el desarrollo de la enfermedad autoinmune son diferentes.
La presencia de ANA-IFI se asoció con sexo femenino en pacientes con AR, concordante con lo descrito en la literatura donde para esta enfermedad se estima una relación H: M de 1:3. Además se encontró relación con el antecedente de exposición a cigarrillo para los individuos controles de AR lo cual se ha descrito dentro del desarrollo de autoinmunidad29,30.
De lo anterior, se podría considerar que la frecuencia de positividad para ANA-IFI en individuos sanos sin consanguinidad, la exposición ambiental jugaría un papel preponderante contrario a lo evidenciado en individuos sanos con relación consanguínea, donde el peso genético podría ser más importante que el ambiental31.
En los pacientes con ARt, se encontró asociación entre ANA-IFI y la presencia de articulaciones inflamadas, esto contrasta con lo descrito en la literatura que generalmente no describe la asociación en AR entre la positividad de ANA-IFI y la actividad inflamatoria articular y por el contrario no hubo asociación con la positividad para anti-CCp32.
En FC se encontró una tendencia importante entre la presencia de ANA con valores elevados de PCR y en los individuos controles de este grupo con la presencia de articulaciones dolorosas. Si bien se requerirían estudios adicionales, se podría pensar que la presencia de ANA en individuos sanos con riesgo genético, podría asociarse a daño articular subclínico derivado de la activación de vías de remodelado articular33.
En términos generales el patrón granular fino denso por técnica IFI sustrato HEp-2 convencional se encontró en baja frecuencia en todos los grupos de estudio, siendo más alto en el grupo de controles donde representó el 12,9% de las muestras reportadas como positivas y el 1,66% del total de muestras; frecuencia inferior a la esperada tanto en individuos sanos como en AR10 pero sí concordantes con lo reportado por el grupo Gómez-Puerta17 en el único estudio previo realizado en Colombia y sincrónico con la baja frecuencia de este patrón en pacientes con AR.
Al igual que lo reportado por IFI convencional, en nuestro estudio el patrón granular fino denso por técnica IFI sustrato HEp-2 modificado se encontró en baja frecuencia en todos los grupos de estudio, siendo más alto en el grupo de individuos control donde representó el 75% de las muestras reportadas como positivas y el 1,25% del total de muestras. En los diversos estudios realizados se han reportado frecuencias variables para positividad de ANA/DFS70, la mayoría de ellos realizados en sustratos convencionales16,21. De manera importante se observó que los individuos ANA-DFS70 positivos se asociaron con ausencia de articulaciones dolorosas lo que permitiría en futuros estudios determinar población con riesgo de desarrollar compromiso articular.
El patrón DFS70 resulta de los autoanticuerpos que se unen a la proteína expresada de forma ubicua LEDGF producto del gen p75 o psip1 el cual se observa con frecuencia durante la detección de ANA por IFI-HEp-2, considerado el antígeno más importante contra el que se dirigen estos anticuerpos34; empleando este sustrato encontramos una frecuencia de positividad para ANA-DFS70 del 5% entre los individuos ANA-IFI positivos, del 1,6% del total de muestras estudiadas y del 2,5% en individuos controles sanos. No hay estudios en población colombiana que hayan empleado esta técnica, ya que el único llevado a cabo, solo efectuó la determinación directamente de la proteína por quimioluminiscencia17, de ello se deduce que no hay datos previos para nuestra población en cuanto a títulos y patrones.
La evaluación de los anticuerpos monoespecíficos anti-DFS70 es clínicamente fundamental y desafiante usando el tradicional HEp-2 IFI35. La prevalencia de anti-DFS70 depende del ensayo aplicado y el nivel de atención clínica36,37. Aunque el objetivo de este trabajo no fue comparar los resultados en la detección del patrón DFS70 utilizando ANAS IFI convencional frente al modificado, los resultados obtenidos en este estudio demuestran diferencias en las lecturas que concuerdan con el estudio que apoya la hipótesis de que la falta de estandarización en los kits de IIF junto con la subjetividad de la interpretación del usuario, entre otros factores, contribuyen a la reducción de la aplicación del nuevo algoritmo actual para la detección de individuos con sospecha de enfermedades del tejido conectivo35.
Pese a la baja frecuencia de ANA/DFS70 tanto en sustrato convencional como modificado, solo se observó este patrón en un individuos sanos FC para AR e individuos controles sin relación genética de autoinmunidad, lo cual confirma su positividad en individuos saludables. Corroborado además por las asociaciones con ausencia de marcadores clínicos como VSG y FR negativos y ausencia de articulaciones dolorosas, sugiriendo un estado de bienestar en los individuos que expresan ANA-DFS70 positivos11.
ConclusionesLa frecuencia de ANA/DFS70 en los grupos estudiados fue baja, sin embargo ninguno de los pacientes con ARt incluidos en el estudio fue positivo. Se confirma la presencia de ANA/DFS70 en individuos sanos sistémicamente con o sin riego genético. Las asociaciones con variables clínicas y serológicas encontradas requieren estudios adicionales para demostrar su papel dentro de algoritmos diagnóstico para esta entidad.
FinanciaciónEste protocolo fue apoyado por IMMCO Diagnostic, Dizar Ltda y el Instituto de Ciencia, Tecnología e Innovación, Francisco José de Caldas-COLCIENCIAS (N.o 130865740792-2014).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la señorita Ángela Arias Arias por la colaboración en la edición del manuscrito.