En los pacientes con lupus eritematoso sistémico (LES) la disfunción diastólica del ventrículo izquierdo (DDVI) puede ser la única manifestación de involucro cardiaco anticipando una disfunción sistólica. Se ha visto que la deformación miocárdica de la aurícula izquierda (AI), mediante el strain longitudinal global de la AI (SLGAI), puede llegar a ser de utilidad en valorar la función diastólica.
ObjetivoEvaluar la función de la AI mediante la deformación miocárdica en pacientes con LES. Comparar el strain de la AI en pacientes con LES activos, inactivos y controles.
MétodosSe incluyeron 50 pacientes con LES y se compararon con controles sanos pareados por edad y sexo. Se midió por ecocardiograma transtorácico la deformación miocárdica mediante el SLGAI, el strain de las 3 fases del ciclo de la AI y la tasa de strain. La diferencia entre los grupos se analizó de forma univariante.
ResultadosEl SLGAI en pacientes con LES fue menor que en los controles sanos (41,6% vs. 50,5%; p=0,02), así como también fue menor en las 3 fases del ciclo de la AI. No hubo diferencias en la tasa de strain en ambos grupos (LES 2,5s−1 vs. controles sanos 2,75s−1; p=0,1). También se encontró que el SLGAI fue menor en pacientes activos en comparación con controles e inactivos.
ConclusionesLos pacientes con LES tienen menor deformación miocárdica de la AI, lo que se expresa como una menor función diastólica correlacionando con daño miocárdico subclínico precoz.
In patients with systemic lupus erythematosus (SLE), left ventricle diastolic dysfunction (LVDD) may be the only manifestation of cardiac involvement in anticipation of systolic dysfunction. It has been seen that myocardial deformation of the left atrium (LA), through the LA global longitudinal strain (LAGLS), may be useful in assessing diastolic function.
ObjectiveTo evaluate LA function through myocardial deformation in patients with LES, and compare the LA strain in patients with active, inactive and controls.
MethodsFifty patients with SLE were included and compared with 50 healthy controls paired by age and gender. Myocardial deformation was measured by transthoracic echocardiogram, to investigate the LAGLS, the strain of the three phases of the LA cycle and the strain rate. The differences between groups were compared in univariate analysis.
ResultsLAGLS in SLE patients was less than in the controls (41.6% vs. 50.5%; p=.02), and in the 3 phases of the LA cycle. There were no differences in the LA strain rate in both groups (SLE 2.5s−1 vs. controls 2.75s−1; p=.1). It was also found that the LAGLS was lesser in active patients than controls and inactive.
ConclusionsSLE patients have lower myocardial deformation of the LA, which is expressed as a lower diastolic function correlating with early subclinical myocardial damage.
El lupus eritematoso sistémico (LES) es una enfermedad inflamatoria inmune que se caracteriza por la formación de autoanticuerpos y depósitos de complejos inmunes. La presencia de inflamación crónica puede afectar a múltiples órganos, especialmente al corazón1. El daño en el sistema cardiovascular, además de ser ocasionado primariamente por un proceso autoinmune/inflamatorio, también se ha asociado de manera secundaria con la actividad y la severidad de la enfermedad, así como con el tratamiento inmunosupresor, principalmente el uso de esteroides2.
El involucro cardiaco es una de las mayores complicaciones del LES, y puede afectar todas las estructuras del corazón incluyendo el pericardio, miocardio, válvulas y vasos coronarios con diferentes grados de severidad, siendo la prevalencia reportada en estudios de autopsia del 40 al 70%; y detectada por afectación sintomática solamente en el 5 a 10% de los pacientes, sugiriendo la naturaleza subclínica del daño al miocardio3. En la actualidad la supervivencia de los pacientes con lupus ha mejorado, sin embargo, la morbimortalidad cardiovascular continúa siendo alta, oscilando entre el 17 y 76% en diferentes estudios4.
Existen factores inherentes al LES que se ha propuesto que promueven la enfermedad cardiovascular, como son la presencia de anticuerpos antifosfolípidos, la función renal disminuida, la duración de la enfermedad, el daño crónico a órgano reflejado por el índice de daño del Systemic Lupus International Collaborating Clinics/American College of Rheumatology (SLICC/ACR) damage index, la duración y dosis de esteroides, así como el uso de azatioprina5.
Los pacientes con LES muestran 11 veces mayor riesgo de presentar alteraciones valvulares que la población sana6. Las alteraciones valvulares más frecuentes son las insuficiencias, involucrando principalmente las válvulas aórtica y mitral, y se ha encontrado asociación con la presencia de anticuerpos antifosfolípidos o con el síndrome antifosfolípido secundario. En algunos estudios se ha reportado que los títulos altos de anticuerpos antifosfolípidos se asocian fuertemente con anormalidades cardiacas en pacientes con lupus7,8.
La aurícula izquierda juega un papel importante en mantener la función cardiaca, ya que actúa como reservorio, conductor y bomba9. En casos de disfunción diastólica, ocurren cambios en el llenado ventricular, desencadenando cambios en las fases auriculares para mantener el volumen sistólico ventricular.
El ecocardiograma es una herramienta sencilla y ampliamente disponible para el diagnóstico de enfermedades cardiovasculares que aporta información de la estructura, función y parámetros hemodinámicos10. Se ha reportado que la disfunción diastólica ventricular izquierda (DDVI) es común, ocurre de manera temprana y persistente en los pacientes con LES, pudiendo ser la única manifestación de involucro cardiaco precediendo la disfunción sistólica a gran escala1.
El agrandamiento y disfunción de la aurícula izquierda se ha considerado como un marcador subrogado de la duración y severidad de la disfunción diastólica. Y se ha identificado como potencial indicador de múltiples eventos adversos cardiovasculares, como mayor riesgo de infarto agudo al miocardio, insuficiencia cardiaca, fibrilación auricular y mortalidad11.
Recientemente se ha introducido la deformación miocárdica de la aurícula izquierda como potencial marcador de función diastólica, mediante el strain longitudinal global de la aurícula izquierda (SLGAI) por la técnica speckle tracking por ecocardiografía. Tiene la gran ventaja de ser independiente del ángulo.
La deformación miocárdica de la aurícula izquierda es una propiedad mecánica inherente del corazón, la cual se puede calcular por medio del software del ecocardiograma; esto nos permite valorar qué porcentaje de movimiento en la posición espacial cambia la fibra miocárdica en cada fase del ciclo auricular (reservorio, conducto y bomba); mientras mayor es el porcentaje de deformación, mejor es la función miocárdica. Tiene una gran implicación clínica ya que se ha demostrado que comienza a alterarse antes que otros parámetros de función cardiaca, como el volumen de la aurícula izquierda, la relación E/e’ y la fracción de expulsión del ventrículo izquierdo, lo que nos permite detectar cambios subclínicos en el miocardio. Esta técnica se correlaciona directamente con la función diastólica del ventrículo izquierdo, la cual generalmente presenta disfunción antes de la función sistólica9,11,12. Existen estudios que han demostrado que el strain de la aurícula izquierda se ha asociado como predictor de cardiopatía isquémica, insuficiencia cardiaca, fibrilación auricular y muerte cardiovascular13-15.
Recientemente se describió que el SLGAI está deprimido en pacientes con LES en comparación con controles1, siendo nuestro estudio el segundo en la literatura que investigue estos parámetros.
El objetivo principal de este estudio es evaluar la función de la aurícula izquierda por strain a través de la técnica ecocardiográfica speckle tracking en pacientes con LES y síndrome antifosfolípido asociado y compararlos con controles sanos; además de determinar, como objetivo secundario, si existen factores de riesgo para una función de la aurícula izquierda deprimida en la medición de strain en los pacientes con LES y síndrome antifosfolípido sin síntomas cardiovasculares.
MétodosSe reclutaron pacientes que acudieron al servicio de reumatología del Antiguo Hospital Civil de Guadalajara «Fray Antonio Alcalde» de marzo a agosto del 2018. Todos los pacientes debían ser mayores de 18 años y cumplir criterios de clasificación de LES SLICC 201216 y, además, podían tener diagnóstico de síndrome antifosfolípido secundario según los criterios de clasificación de Sídney 200617 o presencia de anticuerpos antifosfolípidos. Los pacientes fueron pareados con controles sanos por edad y género, definiéndose como control sano aquellos pacientes sin ningún tipo de comorbilidad o enfermedad.
Se excluyeron pacientes con hipertensión arterial de larga evolución con mal control, antecedente de enfermedad valvular conocida, fibrilación auricular o cualquier otra arritmia, diabetes mellitus no controlada, diagnóstico previo de insuficiencia cardiaca, cardiopatía isquémica o pacientes que tuvieran enfermedades autoinmunes de sobreposición.
Se recolectaron del expediente clínico las características clínicas de los pacientes. Se obtuvieron los datos de laboratorio como biometría hemática, química sanguínea, pruebas de función hepática, examen general de orina, proteínas en orina de 24h, perfil de lípidos, además de anticuerpos antinucleares (ANA) (inmunofluorescencia indirecta), anticuerpos específicos (anti-Smith y anti-DNA doble cadena), anticuerpos antifosfolípidos (ELISA), anticoagulante lúpico, IgG e IgM anticardiolipinas y β2 glicoproteína. Se calculó la actividad de la enfermedad con el Mexican Systemic Lupus Erythematosus Disease Activity Index (Mex-SLEDAI)18 al momento de la visita, que fue el día de inclusión al estudio, y se calculó la escala SLICC/ACR damage index (SDI)19 para determinar la presencia de daño crónico por la enfermedad. Se definió como actividad Mex-SLEDAI≥918 y SDI≥1.
Se documentó el tratamiento utilizado en cada paciente, como terapia inmunosupresora, uso de esteroides y antimaláricos.
Las imágenes y cálculos ecocardiográficos fueron realizados en el laboratorio de ecocardiografía del Hospital Civil de Guadalajara «Fray Antonio Alcalde» por 5 cardiólogos, con una variabilidad interobservador de 0,85.
Los ecocardiogramas convencionales se realizaron en un ecocardiograma Siemens ACUSON SC2000 prime con un transductor 4v1c sectorial de 1,25-4,5MHz. Todos los pacientes fueron evaluados con un ecocardiograma bidimensional. Se calculó la fracción de expulsión del ventrículo izquierdo mediante el método biplanar de Simpson en las vistas apicales 4 y 2 cámaras. El volumen indexado de la aurícula izquierda se determinó al final de la sístole ventricular (tamaño máximo de aurícula izquierda) por método biplanar área-longitud en la vista apical de 4 y 2 cámaras, indexando su resultado con la superficie corporal. La relación E/e’ se obtuvo mediante la proporción de la onda E del flujo transmitral y el promedio de las ondas e septal y lateral. La fracción de expulsión de la aurícula izquierda se calculó mediante el software del cálculo del strain. La valvulopatía se definió como la presencia de algún grado de insuficiencia valvular vista con el doppler color en las válvulas aórtica, mitral, pulmonar y tricuspídea. La presencia de derrame pericárdico se buscó en el eje apical 4 cámaras.
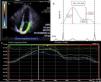
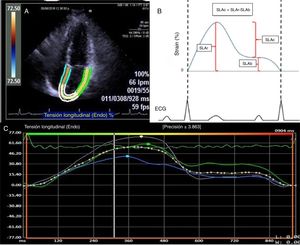
Se determinó la deformación de la aurícula izquierda (fig. 1) mediante el software syngo® Velocity Vector Imaging technology. La vista ecocardiográfica para el estudio fue la apical 4 cámaras. El endocardio de la aurícula izquierda se trazó manualmente al final de la sístole, y los bordes del endocardio fueron rastreados por el software a través del ciclo cardiaco. El software tomó el intervalo R-R del trazo del electrocardiograma para el cálculo de la deformación. La deformación se evaluó como strain longitudinal global y se calcularon 3 valores en la deformación auricular denominados: strain longitudinal de la aurícula de reservorio (SLAr), de conducto (SLAc) y de bomba (SLAb). La SLAr correspondió al valor desde el pico más alto de la fase de reservorio, la SLAb al pico más alto de la fase de bomba y la SLAc a la diferencia entre SLAr y SLAb. Además, se reportó el valor de la tasa de la deformación, definido como strain rate. El SLGAI menor del 35% fue utilizado para definir una deformación de la aurícula deprimida reflejando alteración en la contracción auricular y rigidez20.
A) Imagen en vista apical 4 cámaras donde se determinan los bordes de la aurícula izquierda para el cálculo del strain. B) Representación gráfica del strain de la aurícula izquierda en todo el ciclo auricular. La SLAr correspondió al valor desde el pico más alto de la fase de reservorio, la SLAb al pico más alto de la fase de bomba y la SLAc a la diferencia entre SLAr y SLAb. C) Representación del reporte de strain de aurícula izquierda del software VVI.
SLAr: strain logitudinal aurícula reservorio; SLAb: strain longitudinal aurícula bomba; SLAc: strain logitudinal aurícula conducto.
Las variables numéricas se presentaron como medias y desviación estándar o medianas y rangos intercuartiles, según su distribución por la prueba de Kolmogorov-Smirnov. Las variables categóricas se expresaron como números absolutos y proporciones. Se utilizó t de Student o U de Mann-Whitney para comparación de las variables continuas. Para comparar las variables categóricas se utilizó la χ2. Para comparar múltiples variables cuantitativas con distribución normal se utilizó ANOVA y para no paramétricas se utilizó Kruskal-Wallis. Se realizó análisis univariado y multivariado mediante regresión logística. Las variables que fueron significativas en el análisis univariado se analizaron en el multivariado para identificar las predictoras de un strain de aurícula izquierda anormal; se tomó como variable dependiente el strain de la aurícula izquierda, y las independientes fueron: género, edad, índice de masa corporal, tiempo de evolución, presencia de anticuerpos antifosfolípidos, diabetes mellitus, hipertensión arterial, dislipidemia, nefritis lúpica, uso de esteroides, antimaláricos, azatioprina, metotrexato, ciclofosfamida, micofenolato de mofetilo, rituximab, actividad de la enfermedad y el índice de daño. Se utilizó el paquete estadístico Medcalc versión 18.9 para la evaluación de los datos. Se consideró como estadísticamente significativo una p<0,05.
ResultadosDurante el periodo de estudio se incluyeron 50 pacientes con LES y 50 controles sanos. El género femenino fue el más preponderante en ambos grupos (90% y 86%, respectivamente). La media de edad de los pacientes con LES fue de 34 años (DE±12 años). No hubo diferencias en el índice de masa corporal entre los pacientes con LES y controles sanos. La comorbilidad más frecuente fue la hipertensión arterial, con el 44%. La media de tiempo de evolución de la enfermedad fue de 6 años (DE±5 años). El 22% de los pacientes tenían síndrome antifosfolípido secundario y el 16% de los pacientes presentaron anticuerpos antifosfolípidos circulantes sin tener criterios para síndrome antifosfolípido, siendo el 16% de los pacientes triple positivo. El 72% de los pacientes tenían títulos positivos de ANA 1:640, siendo el patrón moteado fino el más común. El 46% de los pacientes con LES estaban activos al presentar un Mex-SLEDAI mayor de 9. Los dominios afectados más frecuentemente fueron el hematológico (82%), mucocutáneo (76%), musculoesquelético (68%). El 40% de los pacientes incluidos presentaron nefritis lúpica, siendo la clase IV la más frecuente en un 14%. En cuanto al tratamiento, el 44% tomaba esteroides, el 98% antimaláricos, el 28% azatioprina, el 12% metotrexato, el 38% ácido micofenólico, el 34% ciclofosfamida, y el 8% rituximab. Se encontraron diferencias significativas en hemoglobina, leucocitos, neutrófilos, linfocitos, albúmina, glucosa, ácido úrico y las lipoproteínas de alta densidad (HDL) entre los pacientes con LES y los controles (tabla 1).
Características demográficas y clínicas de los pacientes con lupus eritematoso sistémico y controles
| Parámetro | Lupus | Controles sanos | p |
|---|---|---|---|
| N | 50 | 50 | |
| Mujeres | 90% | 86% | 0,75 |
| Edad (años) | 34 (±12) | 32 (±11) | 0,30 |
| IMC (kg/m2) | 24.8 (±5) | 26 (±4,5) | 0,30 |
| HAS | 44% | 0% | <0,0001 |
| DM2 | 6% | 0% | 0,24 |
| Dislipidemia | 14% | 0% | 0,02 |
| Hipotiroidismo | 6% | 0% | 0,24 |
| TVP | 16% | 0% | 0,01 |
| EVC | 4% | 0% | 0,49 |
| Tiempo evolución (años) | 6 (±5) | ||
| SAF secundario | 22% | ||
| Presencia de anticuerpos antifosfolípidos | 16% | ||
| Anticuerpo asociado | |||
| Anticoagulante lúpico | 4% | ||
| IgG anticardiolipinas | 8% | ||
| IgM anticardiolipinas | 4% | ||
| B2 Glicoproteína I | 2% | ||
| Triple positivo | 16% | ||
| ANA | |||
| Anti-DNA ds | 4% | ||
| Anti-Ro | 14% | ||
| Anti-Sm | 72% | ||
| Anti-La | 6% | ||
| Patrón ANA | |||
| Citoplasmático | 4% | ||
| Homogéneo | 26% | ||
| Moteado fino | 60% | ||
| Moteado grueso | 6% | ||
| Mex-SLEDAI | 8,7 (±5) | ||
| Actividad (% activos) | 46% | ||
| SDI | 0,7 (±1,1) | ||
| Dominios | |||
| General | 44% | ||
| Mucocutáneo | 76% | ||
| Neurológico | 16% | ||
| Musculoesquelético | 68% | ||
| Cardiaco | 6% | ||
| Serositis | 26% | ||
| Vasculitis | 6% | ||
| Oftálmico | 2% | ||
| Abdominal | 0% | ||
| Hematológico | 82% | ||
| Renal | 40% | ||
| Clase de biopsia | |||
| Clase I | 2% | ||
| Clase II | 4% | ||
| Clase III | 4% | ||
| Clase IV | 14% | ||
| Clase V | 4% | ||
| Clase V+IV | 2% | ||
| Tratamiento | |||
| Esteroide | 44% | ||
| Antimaláricos | 98% | ||
| Azatioprina | 28% | ||
| Metotrexato | 12% | ||
| Ácido micofenólico | 38% | ||
| Ciclofosfamida | 34% | ||
| Rituximab | 8% | ||
| Laboratorios | |||
| Hemoglobina (g/dl) | 11,8 (±2,4) | 13,5 (±1,3) | 0,003 |
| Leucocitos (mm3) | 5.318 (±2073) | 7.566 (±1.786) | <0,0001 |
| Neutrófilos (mm3) | 3.842 (±3.200) | 4.641 (±1.357) | 0,12 |
| Linfocitos (mm3) | 1.358 (±1.056) | 1.976 (±706) | 0,001 |
| Plaquetas (mm3) | 222 (±91) | 220 (±62) | 0,80 |
| Globulina (g/dl) | 3,3 (±1) | 2,4 (±0,5) | <0,001 |
| Albúmina (g/dl) | 3,3 (±0,9) | 3,8 (±0,7) | 0,002 |
| Creatinina (mg/dl) | 0,8 (±0,4) | 0,7 (±0,2) | 0,50 |
| Urea (mg/dl) | 38,4 (±32) | 31,3 (±11) | 0,11 |
| Glucosa (mg/dl) | 99 (±42) | 82 (±8) | 0,006 |
| Ácido úrico (mg/dl) | 5,3 (±2,9) | 5,6 (±1,4) | 0,05 |
| Colesterol (mg/dl) | 161 (±50) | 153 (±39) | 0,41 |
| Triglicéridos (mg/dl) | 139 (±87) | 113 (±35) | 0,62 |
| LDL (mg/dl) | 86 (±38) | 89 (±35) | 0,70 |
| HDL (mg/dl) | 34 (±12) | 42 (±10) | 0,02 |
ANA: anticuerpos antinucleares; DM2: diabetes mellitus 2; EVC: enfermedad vascular cerebral; HAS: hipertensión arterial; HDL: lipoproteína de alta densidad; IMC: índice de masa corporal; LDL: lipoproteína de baja densidad; Mex-SLEDAI: MexicanSystemic Lupus Erythematosus Disease Activity Index; SAF: síndrome antifosfolípido; SDI: SLICC/ACR damage index; TVP: trombosis venosa profunda.
Dentro de las variables ecocardiográficas estudiadas, se encontró que la función sistólica del ventrículo izquierdo en ambos grupos fue similar, así como también la función sistólica de la aurícula izquierda (tabla 2). Se documentó mayor proporción de derrame pericárdico en pacientes con LES (20% vs. 0%, p=0,003). No existió diferencia en la presencia de algún grado de valvulopatía entre ambos grupos.
Parámetros ecocardiográficos de los pacientes con lupus eritematoso sistémico comparados con controles sanos
| Eco | Lupus | Controles sanos | p |
|---|---|---|---|
| N | 50 | 50 | |
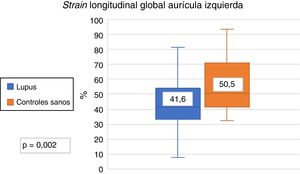
| Strain longitudinal global de la AI (%) | 41,6 (32,3-53,4) | 50,5 (41,7-70,6) | 0,002 |
| Strain reservorio (%) | 41,6 (32,3-53,4) | 50,5 (41,7-70,6) | 0,002 |
| Strain conducto (%) | 26,7 (18,7-39) | 31,4 (26,2-41) | 0,008 |
| Strain bomba (%) | 14,4 (10,3-19) | 17,5 (15,3-21,5) | 0,007 |
| Strain rate (s−1) | 2,5 (2,8-1,9) | 2,7 (3,1-2,1) | 0,11 |
| FEVI (%) | 65 (±9) | 63 (±4) | 0,07 |
| FEAI (%) | 76 (66-82) | 78 (73-85) | 0,10 |
| Valvulopatía | 38% | 22% | 0,12 |
| Derrame pericárdico | 20% | 0% | 0,003 |
| VIAI (ml/m2) | 26,1 (±8,8) | 20,7 (±4,4) | <0,001 |
| Relación E/e’ | 7,9 (±2,6) | 6,4 (±1,8) | 0,001 |
AI: aurícula izquierda; E: velocidad de llenado diastólico temprano del flujo transmitral; é: velocidad tisular del flujo transmitral a nivel del anillo mitral; FEAI: fracción de expulsión de la aurícula izquierda; FEVI: fracción de expulsión del ventrículo izquierdo; VIAI: volumen indexado de la aurícula izquierda.
Dentro de los parámetros de la función diastólica, los pacientes con LES presentaron mayores presiones de llenado del ventrículo izquierdo, expresados mediante la E/e’ (7,5 vs. 6,3, p=0,0003) y el volumen indexado de la aurícula izquierda (24ml/m2 vs. 21ml/m2, p=0,0007).
El SLGAI fue menor en los pacientes con LES en comparación con los controles (41,6% vs. 50,5%, p=0,002) (fig. 2). También fue menor las 3 fases del ciclo de la aurícula izquierda; SLAr (41,6% vs. 50,5%, p=0,002), SLAc (26,7% vs. 31,4%, p=0,008) y SLAb (14,4% y 17,5%, p=0,007). No se encontró diferencia en el strain rate en pacientes con LES y controles sanos (2,5s−1 vs. 2,7s−1). Los resultados encontrados en SLGAI expresan una menor función diastólica en pacientes con LES.
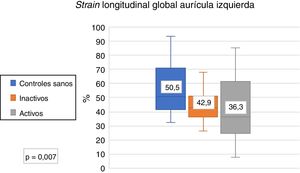
Se compararon los parámetros ecocardiográficos entre controles sanos y LES activo y controles sanos y LES inactivo; se encontró diferencia significativa en el SLGAI (controles sanos 50,5% vs. inactivo 43% vs. activos 36,3%) (fig. 3); en el strain de las 3 fases de la aurícula izquierda; y en el volumen indexado de la aurícula izquierda y E/e’. No se encontró diferencia en strain rate (tabla 3).
Comparación de parámetros ecocardiográficos entre controles y pacientes con lupus eritematoso sistémico por actividad de la enfermedad según el Mex-SLEDAI (activos>9)
| Parámetro | Controles | Activos | p | Inactivos | p |
|---|---|---|---|---|---|
| N | 50 | 23 | 27 | ||
| Strain longitudinal global de la AI (%) | 50,5 (41,7-70,6) | 36,3 (25,3-54,3) | 0,01 | 43 (35,2-52,6) | 0,01 |
| Strain reservorio (%) | 50,5 (41,7-70,6) | 36,3 (25,3-59,8) | 0,01 | 43 (36,7-50,6) | 0,04 |
| Strain conducto (%) | 31,4 (26,2-41) | 22,8 (16,9-40,4) | 0,02 | 27,6 (20,8-35,5) | 0,02 |
| Strain bomba (%) | 17,5 (15,3-21,5) | 13,8 (9,4-19,4) | 0,02 | 16,5 (10,6-19) | 0,04 |
| Strain rate (s−1) | 2,7 (3,1-2,1) | 2,37 (2,8-1,8) | 0,13 | 2,48 (2,8-1,9) | 0,28 |
| FEVI (%) | 62,7 (±4) | 64,7 (±10) | 0,18 | 65,4 (±9) | 0,04 |
| FEAI (%) | 78 (73-85) | 79 (63-82) | 0,38 | 76 (67-81) | 0,10 |
| Valvulopatía | 22% | 47% | 0,06 | 29% | 0,68 |
| Derrame pericárdico | 0% | 34% | 0,0001 | 7% | 0,26 |
| VIAI (ml/m2) | 20,8 (±4,4) | 27,4 (±11,8) | 0,0007 | 24,9 (±5,2) | 0,001 |
| Relación E/e’ | 6,4 (±1,8) | 8,6 (±3,3) | 0,0003 | 7,3 (±1,7) | 0,03 |
AI: aurícula izquierda; E: velocidad de llenado diastólico temprano del flujo transmitral; é: velocidad tisular del flujo transmitral a nivel del anillo mitral; FEAI: fracción de expulsión de la aurícula izquierda; FEVI: fracción de expulsión del ventrículo izquierdo; Mex-SLEDAI: MexicanSystemic Lupus Erythematosus Disease Activity Index; VIAI: volumen indexado de la aurícula izquierda.
Se contrastaron las variables clínicas de los pacientes con LES que presentaron un SLGAI anormal vs. normal (punto de corte 35%); en este se encontraron 35 pacientes con SLGAI normal y 15 anormal (tabla 4); solo se encontraron diferencias significativas respecto a que los pacientes con SLGAI anormal presentaban mayor puntuación de la escala Mex-SLEDAI, y por ende mayor porcentaje de pacientes activos.
Comparación de características clínicas de pacientes con lupus eritematoso sistémico que presentaron strain longitudinal global de aurícula izquierda normal (>35%) y anormal (<35%)
| Parámetro | SLGAI normal | SLGAI anormal | p |
|---|---|---|---|
| N | 35 | 15 | |
| Mujeres | 91% | 86% | 0,91 |
| Edad (años) | 34 (±12) | 35 (±14) | 0,72 |
| IMC (kg/m2) | 25 (±5) | 23 (±4) | 0,19 |
| HAS | 37% | 60% | 0,21 |
| DM2 | 5% | 6% | 0,61 |
| Dislipidemia | 8% | 26% | 0,21 |
| Hipotiroidismo | 8% | 0% | 0,61 |
| TVP | 17% | 13% | 0,75 |
| EVC | 2% | 6% | 0,91 |
| Tiempo evolución (años) | 6 (±5) | 6 (±6) | 0,99 |
| SAF secundario | 22% | 0,2 | 0,88 |
| Presencia de anticuerpos antifosfolípidos | 8% | 33% | 0,07 |
| Triple positividad anticuerpos antifosfolípidos | 20% | 6% | 0,41 |
| Mex-SLEDAI | 7 (±5) | 12 (±6) | 0,002 |
| Actividad (% activos) | 34% | 73% | 0,02 |
| SDI | 0,5 (±0,4) | 1,1 (±1) | 0,07 |
| Tratamiento | |||
| Esteroide | 34% | 67% | 0,07 |
| Antimaláricos | 97% | 100% | 0,65 |
| Azatioprina | 28% | 27% | 0,83 |
| Metotrexato | 17% | 0% | 0,21 |
| Ácido micofenólico | 37% | 40% | 0,89 |
| Ciclofosfamida | 25% | 47% | 0,26 |
| Rituximab | 9% | 23% | 0,43 |
DM2: diabetes mellitus 2; EVC: enfermedad vascular cerebral; HAS: hipertensión arterial; IMC: índice de masa corporal; Mex-SLEDAI: Mexican Systemic Lupus Erythematosus Disease Activity Index; SAF: síndrome antifosfolípido; SDI: SLICC/ACR damage index; SLGAI: strain longitudinal global de la aurícula izquierda; TVP: trombosis venosa profunda.
Se realizó análisis univariado y multivariado (tabla 5) para determinar si las variables influyen independientemente en el SLGAI. Se documentó que en el análisis univariado fueron significativos la presencia de anticuerpos antifosfolípidos circulantes, la presencia de nefritis lúpica, el uso de esteroides y la actividad de la enfermedad. Sin embargo, en el análisis multivariado no hubo diferencia significativa en ninguna de estas.
Análisis univariado y multivariado de los factores asociados a SLGAI<35%
| Parámetro | Análisis univariado OR (IC 95%) | p | Análisis multivariado OR (IC 95%) | p |
|---|---|---|---|---|
| Género (hombres) | 1,6 (0,2-10) | 0,6 | ||
| Edad | 1,5 (0,4-5,3) | 0,5 | ||
| IMC | 0,6 (0,2-2,1) | 0,5 | ||
| Evolución | 0,7 (0,2-2,2) | 0,5 | ||
| Presencia de anticuerpos antifosfolípidos circulantes | 5,3 (1,1-26) | 0,04 | 4 (0,6-24,7) | 0,1 |
| DM2 | 1,2 (0,1-14) | 0,9 | ||
| HAS | 2,5 (0,7-8,7) | 0,1 | ||
| Dislipidemia | 3,9 (0,7-20) | 0,1 | ||
| Nefritis lúpica | 5 (1,3-18) | 0,01 | 2,1 (0,3-14,7) | 0,4 |
| Esteroides | 3,8 (1,1-13,8) | 0,04 | 2,6 (0,5-13,4) | 0,2 |
| Antimaláricos | 1,4 (0,1-34) | 0,9 | ||
| Azatioprina | 0,9 (0,2-3,5) | 0,9 | ||
| Metotrexato | 0,1 (0,01-1,7) | 0,2 | ||
| Ciclofosfamida | 2,5 (0,7-8,9) | 0,2 | ||
| MMF | 1,1 (0,3-3,9) | 0,8 | ||
| Rituximab | 3 (0,5-17) | 0,2 | ||
| Actividad | 5,3 (1,4-20) | 0,01 | 1,5 (0,2-13,3) | 0,7 |
| SDI | 2,5 (0,7-8,9) | 0,1 |
DM2: diabetes mellitus 2; HAS: hipertensión arterial; IC 95%: intervalo de confianza al 95%; IMC: índice de masa corporal; MMF: micofenolato de mofetilo; SDI: SLICC/ACR damage index; SLGAI: strain longitudinal global de la aurícula izquierda; OR: odds ratio.
El objetivo de este estudio fue evaluar la función de la aurícula izquierda por medio de ecocardiografía bidimensional, speckle tracking, un método no invasivo en pacientes con LES sin síntomas cardiacos. Los principales hallazgos encontrados en este estudio fueron que la deformación de la aurícula izquierda estaba alterada y disminuida en pacientes con LES comparados con personas sanas de la misma edad y sexo; y presentando mayor disfunción diastólica. Además, se encontró que, en los pacientes con LES, la deformación de la aurícula era menor cuando presentaban mayor actividad de la enfermedad.
En este estudio se encontró que los pacientes con LES tenían un strain longitudinal global deprimido en comparación con controles sanos, y también presentaban disminución del strain de las 3 fases del ciclo de la aurícula, lo que puede traducirse como una dinámica alterada en la contracción de las fibras miocárdicas de la aurícula secundaria a la disfunción diastólica ventricular y a la rigidez de las fibras miocárdicas de la aurícula por el estado crónico inflamatorio y el depósito de inmunocomplejos21.
Nuestros resultados son parecidos a los de un estudio en el que se utilizó la técnica de speckle tracking en aurícula izquierda en pacientes con LES y se comparó con controles sanos, se incluyeron 60 pacientes en cada grupo. La media de edad de los pacientes con LES fue de 35,8±8,1, la media de SLEDAI 2,3±1,0 y la media de SDI 2,4±1,2. Se encontró que los pacientes con LES presentaban menor strain global en comparación con controles sanos (26,2±9,5% vs. 32,5±9,8%, ambos p<0,05). En este estudio no se encontró diferencias en las dimensiones de la aurícula izquierda y en la E/e’ (33,4±4,3mm vs. 30,6±3,9mm, p=0,23; 8,9±3,5 vs. 7,6±1,7, p=0,06); sin embargo, el volumen indexado de la aurícula izquierda fue mayor en los pacientes con LES (24±8,0 vs. 25,8±7,1, p<0,001). Además, se encontró en el análisis multivariado que el SDI se asoció de manera independiente e inversamente con el strain global, lo que refleja el daño acumulativo en la función cardiaca1; sin embargo, en nuestro estudio esto no fue similar, ya que en el análisis multivariado no fue significativo; esto se pudo deber a que nuestros pacientes tenían un menor SDI y tiempo de evolución de la enfermedad.
Nosotros encontramos que otro de los parámetros clásicos de función diastólica del ventrículo izquierdo, como lo son la E/e’ y el volumen indexado de la aurícula izquierda, fue mayor en pacientes con LES, a diferencia de controles; incluso en aquellos activos también fueron superiores ambos valores, lo que correlaciona con una mayor disfunción diastólica. Este hecho ya había sido descrito anteriormente por Guşetu et al. en un estudio que realizaron con 75 pacientes con LES, donde lo compararon con 73 controles sanos22. Esto también lo documentaron Barutcu et al., quienes estudiaron 50 pacientes con LES comparados con 30 controles y reportaron mayores valores de E/e’ y volumen indexado de la aurícula izquierda; algo relevante fue que en ese estudio se reportó además que los pacientes con LES y anticuerpos anticardiolipinas positivos tuvieron más valores de disfunción diastólica23. Li et al., en un estudio entre 102 pacientes con lupus y 32 controles, utilizaron ecocardiografía 3D para valorar el volumen y función de la aurícula izquierda, y encontraron que los pacientes con LES tenían mayor volumen y una función de la aurícula izquierda más deteriorada, siendo mayor en aquellos pacientes con SDI elevado y mayor actividad de la enfermedad24, similar a nuestros resultados, en donde se documentó que los pacientes con mayor actividad tenían una función de la aurícula izquierda más deteriorada.
Nosotros documentamos que los pacientes con nefritis lúpica pudieran tener asociación con mayor depresión del strain; esto pudiera explicarse ya que la mayoría de los pacientes clasificados como activos tenían mayor presencia de nefritis lúpica. Se ha descrito25 que los pacientes con enfermedad renal crónica tienen un SLGAI deprimido en comparación con controles sanos, secundario a la activación de la vía renina-angiotensina-aldosterona causando fibrosis miocárdica, por lo que esto pudiera explicar que la nefritis lúpica se haya relacionado con mayor depresión del strain de aurícula izquierda en nuestro estudio.
En nuestro estudio se encontró que la presencia de anticuerpos antifosfolípidos circulantes se pudiera relacionar en el análisis univariado con presentar un strain deprimido, lo que indica una mayor disfunción diastólica. Estos hallazgos coinciden con los descritos por Tufano et al. en un estudio con 69 pacientes con síndrome antifosfolípido y 69 controles sanos, en el que demostraron que la presencia de disfunción diastólica se correlacionaba con títulos más altos de anticoagulante lúpico y con tener mayor edad. Además, se encontró que los pacientes con síndrome antifosfolípido secundario presentaban mayor volumen de la aurícula izquierda26.
Nosotros evidenciamos que el uso de esteroides se pudiera asociar en el análisis univariado a presentar SLGAI deprimido. Hattori et al.27 habían descrito en un estudio con modelos murinos el efecto de los esteroides a nivel cardiaco, encontrando que producían hipertensión, fibrosis ventricular e inducían disfunción diastólica del ventrículo izquierdo, por aumento del estrés oxidativo, deficiencia de óxido nítrico, actuando a través de los receptores mineralocorticoides (RM) y glucocorticoides (RG) ampliamente distribuidos en el sistema cardiovascular. Además, se observó la presencia de atrofia de las fibras cardiacas independientemente de la activación de los receptores. Se encontró que estos efectos disminuían cuando se les administró espironolactona.
El deterioro de la función de la aurícula izquierda en pacientes con LES pudiera deberse a la presencia de inflamación sistémica crónica subclínica, aun con niveles bajos de actividad según los índices existentes, secundaria a la presencia de citosinas proinflamatorias circulantes. En un estudio con pacientes con artritis reumatoide28 y en otro estudio con pacientes con espondilitis anquilosante y artritis psoriásica29 se observó que administrar anti-TNF mejoró la función de la aurícula izquierda.
Existe poca literatura acerca del uso de strain de aurícula izquierda en pacientes con LES y su aplicación en la detección de las alteraciones de la función de la aurícula izquierda. Se encontró un solo estudio donde se comparó la función de la aurícula izquierda por strain en pacientes con LES y controles, por lo que este estudio es de utilidad para describir el posible valor de esta nueva técnica de strain de aurícula izquierda en pacientes con LES para identificar cambios subclínicos o incipientes de disfunción diastólica y su detección de manera temprana para implementar acciones que disminuyan la progresión a falla cardiaca con función sistólica preservada en un futuro. Sin embargo, se requieren más estudios con seguimiento a largo plazo y a gran escala para validar la utilidad de esta técnica en el seguimiento de pacientes con LES.
Las limitaciones de este estudio son principalmente el tamaño modesto de la muestra y que no se contó con un seguimiento a largo plazo de los pacientes con ecocardiograma con técnica strain de aurícula izquierda de control posterior a las modificaciones del tratamiento y al cambio en la actividad. Resulta atractivo dar seguimiento a los pacientes durante su evolución con esta técnica y evaluar los cambios en los parámetros y el desenlace en el paciente. Además, la técnica strain depende de la calidad de imagen y del operador, y no se encuentra ampliamente en todos los centros, aunque es una técnica que está adquiriendo importancia para la evaluación cardiaca de los pacientes.
ConclusiónEl LES es una entidad multiorgánica, que afecta también el corazón. En el estudio se encontró que la deformación de la aurícula izquierda y todas las fases del ciclo están alteradas, indicando afectación subclínica del corazón, en pacientes asintomáticos, dentro de la evolución y actividad de la enfermedad; por lo que se recomienda la evaluación cardiaca periódica aun en pacientes asintomáticos, para emplear modificaciones al tratamiento de manera temprana y poder ofrecer un manejo integral a los pacientes, previniendo el remodelamiento de la aurícula y evitando el desarrollo de arritmias y falla cardiaca con fracción de expulsión conservada
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.