La esclerosis sistémica o esclerodermia (SSc) es una patología autoinmune de expresión clínica variable englobada dentro del grupo de enfermedades genéticamente complejas, en la que se conjugan tanto factores ambientales como genéticos. Los genes de la región HLA fueron los primeros asociados con la susceptibilidad a padecer SSc, principalmente los alelos HLA-DRB1¿11/¿06/¿16. Sin embargo, mediante estudios de asociación, diferentes genes candidatos pertenecientes a la tríada autoinmunidad, disfunción endotelial y fibrosis han sido propuestos como genes implicados en la predisposición a esta enfermedad. A pesar de estos avances iniciales, hasta hace muy poco tiempo la mayoría de los estudios han estado dotados de un bajo poder estadístico, debido al pequeño número de pacientes incluidos y la falta de replicación en poblaciones independientes. Recientemente, el desarrollo de las plataformas de genotipado y de análisis de datos ha permitido aplicar al estudio de la genética de enfermedades complejas un nuevo tipo de estrategia conocida como estudios de asociación del genoma completo (GWAS, «genome wide association studies»), que se perfilan como una potente herramienta en el estudio de estas enfermedades multifactoriales. En este trabajo se pretende realizar una revisión de los recientes avances en el estudio de la genética de la esclerodermia, presentando los resultados obtenidos en el análisis de los principales genes candidatos fuera de la región HLA y la contribución de los GWAS a la comprensión de los mecanismos moleculares de esta enfermedad.
Systemic sclerosis or scleroderma (SSc) is an autoimmune pathology with a variable clinical expression grouped within genetically complex diseases, in which environmental and genetical factors combine. Genes of the HLA regions were those first associated with susceptibility to present SSc, mainly the HLA-DRB1¿11/¿06/¿16 allelles. However, through association studies, different candidate genes that belong to the triad of autoimmunity, endothelial disfunction and fibrosis have been proposed as genes implicated in the predisposition to disease. In spite of these initial advances, up until recently most studies have had little statistical power, due to the small number of patients included and the lack of reproduction in independent populations. Recently, the development of genotyping platforms and data analysis has allowed for the application of a new type of strategy known as «genome wide association studies» the analysis of the genetics to complex diseases, which are potent tools in the study of these multifactorial diseases. This paper pretends to perform a review of the recent advances in the study of the genetics of scleroderma, presenting results obtained in the analysis of the main candidate genes outside the HLA regions and the contribution of GWAS to the understanding of the molecular mechanisms of this disease.
La esclerosis sistémica o esclerodermia (SSc) se engloba dentro del grupo de enfermedades genéticamente complejas en las que se cree que la interacción entre factores ambientales y ciertos factores genéticos del individuo dan lugar al desarrollo de la enfermedad. Se han postulado diversos agentes ambientales como posibles desencadenantes de la SSc, sin embargo ninguno de estos factores ambientales se ha definido de forma contundente como el agente causal responsable del desarrollo de la SSc1. En cuanto a los factores genéticos, numerosas evidencias obtenidas en estudios familiares y poblacionales sugieren que juegan un papel esencial en el desarrollo y la expresión clínica de la SSc. Se ha observado un alto grado de agregación familiar para la SSc, estimándose que el riesgo relativo de padecer la enfermedad es 15 veces mayor en hermanos de pacientes y 13 veces mayor en familiares de primer grado de pacientes con SSc2,3. Además, la concordancia para la presencia de auto-anticuerpos específicos de SSc en gemelos monozigóticos es extremadamente elevada, llegando hasta el 90%3. Otro dato que resalta la importancia de los factores genéticos en la susceptibilidad a la SSc es la diferencia que se observa en la prevalencia de la enfermedad dependiendo del grupo étnico. Entre los grupos étnicos en los que la SSc es más prevalente destacan los afro-americanos y una tribu de indios de Oklahoma (Indios Choctaw) en los que la prevalencia de SSc se estima en 469 casos por 100.000 individuos (comparada con 24 casos por 100.000 individuos en la población general)1. Así pues, las características genéticas del individuo parecen jugar un papel esencial en el desarrollo de la SSc. Hasta la fecha, la gran mayoría de estudios dirigidos a la identificación de factores genéticos de susceptibilidad a la SSc se han basado en la estrategia de genes candidatos2. Mediante esta aproximación se seleccionan como genes a estudiar aquellos de los que existen evidencias o hipótesis de que podrían tener una importante implicación en las vías patogénicas que dan lugar al desarrollo de la enfermedad. Comparando la distribución de marcadores genéticos (variaciones en la secuencia de ADN localizados en un lugar concreto del genoma) del gen seleccionado entre un grupo de pacientes bien caracterizado y un grupo de controles sanos se determina la posible existencia de diferencias entre ambos grupos y así se puede establecer la relevancia del gen en la susceptibilidad a la enfermedad. Utilizando esta estrategia se han analizado numerosos genes implicados en la tríada autoinmunidad, disfunción endotelial y fibrosis que da lugar al desarrollo de la patología de la SSc2. Sin embargo, la mayoría de estudios de asociación de genes candidatos llevados a cabo en SSc, se han caracterizado por incluir un número insuficiente de pacientes y controles, hecho que ha limitado enormemente el poder estadístico de estos trabajos y por tanto la fiabilidad y validez de los resultados. Por otra parte, en la mayoría de los casos los resultados obtenidos en un estudio no han sido replicados en poblaciones independientes, añadiendo también como factor limitante la falta de reproducibilidad de los resultados2. También hay que mencionar que la SSc es una enfermedad clínicamente compleja con una gran variedad de manifestaciones clínicas y subtipos, lo que hace aun más difícil la interpretación de los resultados de estudios de asociación. Todos estos hechos han dificultado la identificación de marcadores genéticos claramente implicados en la susceptibilidad a la SSc. De hecho, incluso los genes de la región HLA han sido objeto de discrepancias, aunque la mayoría de estudios llevados a cabo en poblaciones caucásicas han mostrado que los alelos HLA-DRB1¿11, más concretamente el HLA-DRB1¿1104, confieren un alto grado de susceptibilidad a la SSc. Además, también se ha sugerido estos alelos se asocian con la presencia de autoanticuerpos anti topoisomerasa I (Scl70) en poblaciones de distinto origen étnico. En poblaciones afro-americanas son los alelos HLA-DRB1¿08 y no los alelos HLA-DRB1¿11 los que confieren susceptibilidad a la SSc. Así mismo, en indios Choctaw, es el alelo HLA-DRB1¿164. Al tratarse de una enfermedad genéticamente compleja, se espera que en la susceptibilidad a la SSc estén implicados numerosos genes y que cada uno de ellos contribuya de forma modesta en la predisposición genética a esta patología (riesgo relativo en torno al 1,5–2,0), tal como ocurre en muchas otras enfermedades autoinmunes5.
El gran desarrollo de las plataformas de genotipado y de análisis de datos ha permitido en los últimos años aplicar al estudio de la genética de enfermedades complejas un nuevo tipo de estrategia conocida como estudios de asociación del genoma completo (GWAS, «genome wide association studies»)6. En los GWAS se analizan cientos de miles de polimorfismos distribuidos a lo largo de todo el genoma humano7, siendo la principal ventaja de esta aproximación la de partir de un diseño «libre de hipótesis» en el que no se selecciona un gen a priori si no que se aborda todo el genoma. Esto permite la identificación de nuevos genes y rutas involucradas en la predisposición a la enfermedad en cuestión que podrían haber pasado desapercibidas mediante los estudios de genes candidatos. Recientemente se han llevado a cabo un amplio número de GWAS que ya han dado importantes resultados identificando nuevos y sólidos marcadores genéticos y rutas fisiopatológicas asociadas con diversas enfermedades autoinmunes complejas como la artritis reumatoide (RA), el lupus eritematoso sistémico (SLE) o la enfermedad inflamatoria intestinal (IBD)8. Por tanto la aplicación de esta estrategia se espera que contribuya en el futuro a la caracterización de nuevos marcadores genéticos de susceptibilidad a la SSc. Nuestro grupo ha realizado, muy recientemente, el primer GWAS en pacientes de SSc de origen caucásico hasta la fecha, cuyos resultados se comentarán más adelante en el apartado de conclusión.
Principales genes candidatos fuera de la región HLAEl factor de transcripción STAT4Los linfocitos T forman la mayor parte del infiltrado celular que se puede observar en la piel y tejido pulmonar de los pacientes con SSc. Estas células T exhiben una expresión aumentada de marcadores de activación y presentan también signos de expansión dirigida por activación antigénica. La activación y regulación de la actividad de los linfocitos T está regulada por diferentes mecanismos entre los que destaca la activación de la transcripción génica tras la estimulación por ciertas citoquinas9. Los «traductores de señales y activadores de la transcripción» (STAT) son una familia de factores de transcripción que ejercen un papel fundamental dirigiendo la diferenciación de las células T y determinando su patrón de producción de citoquinas. A esta familia de factores de transcripción pertenece STAT4 que está implicado en la regulación de la actividad de las células Th1 y Th17, dos de los subtipos de células T implicadas en la patogénesis de la SSc10–13. El gen STAT4 ha cobrado gran importancia recientemente puesto que se ha identificado como uno de los principales marcadores genéticos asociados con enfermedades autoinmunes como la RA14 y el SLE15,16, el síndrome de Sjögren o la diabetes tipo 1 (T1D)17. Un polimorfismo de un solo nucleótido (SNP) rs7574865, es el responsable de esta predisposición, mostrando los individuos con el alelo de menor frecuencia o el genotipo homocigoto para él, una mayor susceptibilidad a las enfermedades anteriormente mencionadas8. Un trabajo llevado a cabo en un amplio grupo caso-control europeo (1.317 pacientes de SSc y 3.113 controles) demuestra que el gen STAT4 también se comporta como un marcador genético de predisposición a la SSc18. En distintas poblaciones europeas y asiáticas se ha podido observar como esta asociación se corresponde fuertemente con una mayor susceptibilidad a la forma limitada de la SSc (lSSc) (OR 1,54; P<0,0001), mientras que no parece ser tan relevante para la forma difusa de la enfermedad (dSSc)18–20. La hipótesis, aún no confirmada, sobre el papel del gen STAT4 en la susceptibilidad a la SSc, plantea que podría estar relacionado con los altos niveles de IL-12, IL-23 y IL-17 presentes en los pacientes que darían lugar a la activación de la vía STAT4. Una activación prolongada de esta vía debido a las variaciones genéticas en este gen podría dar lugar a una respuesta inflamatoria sostenida y a la expansión y activación de los linfocitos T.
Factores reguladores de la vía del interferón, IRF5Diferentes estudios de expresión génica llevados a cabo en tejidos afectados de pacientes con SSc, han mostrado un aumento de los niveles de expresión de genes inducibles por interferones tipo I2. La expresión de los interferones tipo I está regulada por una familia de factores de transcripción conocida como factores reguladores de interferón o IRF. Se han descrito un elevado número de miembros de la familia de los IRF que juegan un papel esencial en la regulación de la respuesta inmune21. Entre ellos, ha adquirido gran interés el IRF5 ya que se ha identificado como uno de los marcadores genéticos que determinan la susceptibilidad al SLE8. Además se han descrito diferentes variantes genéticas del gen IRF5 que parecen afectar su funcionalidad. Un reciente trabajo ha analizado la contribución de una de las variantes genéticas funcionales del gen IRF5 (rs2004640) de susceptibilidad a la SSc observando que el genotipo TT de este SNP estaba significativamente aumentado en los pacientes con SSc con respecto a los controles. Además se observó cierta tendencia de que este SNP confiere una mayor predisposición en los pacientes con SSc a desarrollar fibrosis pulmonar22. Estos hallazgos se han replicado en población de origen asiático23.
La proteína tirosín fosfatasa PTPN22Por su potencial influencia en la actividad de las células T y por su asociación con otras enfermedades autoinmunes el gen PTPN22 se ha considerado un candidato interesante en la susceptibilidad a la SSc. Sin embargo se han observado resultados controvertidos y los estudios llevados a cabo hasta ahora no han logrado determinar claramente la relevancia del gen PTPN22 en la predisposición genética a la SSc24. En un estudio, aún no publicado, realizado por nuestro grupo se ha confirmado la asociación del alelo T del polimorfismo rs2476601 (también conocido como R620W) en un metaanálisis sobre diferentes poblaciones procedentes de Europa y Norteamérica de origen caucásico (OR=1,15). Se observó además que esta asociación resultaba más fuerte en el subgrupo de pacientes que dieron positivo en la prueba de los autoanticuerpos anticentrómero (OR=1,22). Nuestros datos indican que, aunque la contribución de otros polimorfismos del gen PTPN22 a la susceptibilidad a SSc resulta menos clara, el SNP rs2476601 sí parece jugar un papel en esta patología en general y en un subgrupo definido de pacientes en particular.
La quinasa BLKLos linfocitos B también parecen jugar un importante papel en el desarrollo de la SSc, particularmente mediante la producción de auto-anticuerpos que es uno de los primeros eventos que se presenta en la gran mayoría de pacientes con SSc y que podría estar dando lugar a procesos de daño tisular. La quinasa de linfocitos B, BLK, pertenece a la familia de las Src quinasas y es la única que se expresa exclusivamente en células B y timocitos y no en células T maduras. BLK activa la vía del factor nuclear kB, NFkB, jugando un papel central tanto en la señalización desde el receptor de las células B, BCR, como en el desarrollo de estas células. El gen que codifica BLK, C8orf13-BLK, tiene una expresión ubicua, aunque su función aún no está clara. Este gen se señaló este locus como región de asociación a SLE en dos estudios GWAS, hallazgo replicado en una cohorte japonesa25,26. Un reciente estudio encontró asociación entre el alelo T del polimorfismo rs2736340 con susceptibilidad a esclerodermia en dos grandes cohortes, una española y otra estadounidense. En este mismo trabajo se describió una asociación de la variante A de SNP, rs13277113, a SSc en el meta-análisis de ambas poblaciones27. Además esta asociación también aparece en un estudio independiente realizado en una población japonesa28. Estos estudios sugieren a la región C8orf13-BLK como un nuevo factor de susceptibilidad a SSc.
BANK1BANK1 es el gen codificante de una molécula señalizadora específica de células B (B cell-specific scaffold protein with ankyrin repeats). BANK1 es una proteína adaptadora que constituye un sustrato para la tirosín-kinasa Lyn, promoviendo así la fosforilación de los receptores del fosfoinositol-trisfosfato (IP3R). Se han descrito diferentes variantes funcionales dentro de este gen, así como se ha comprobado su implicación en otras patologías autoinmunes como el SLE29 y AR30. Un reciente estudio, señala la asociación del alelo rs10516487*G y del alelo rs17266594*T con susceptibilidad a SSc en general. Junto a estos polimorfismos, también el alelo rs3733197*G se encuentra asociado a los pacientes pertenecientes al subtipo difuso de la enfermedad. Así como, consecuentemente, estas 3 variantes aparecen asociadas en el subgrupo de pacientes que dieron positivo en la prueba para los autoanticuerpos antitopoisomerasa I31. Un grupo independiente confirmó estos resultados en una cohorte francesa de origen caucásico32. Estos hallazgos sugieren a BANK1 como gen de susceptibilidad a SSc y en particular a los subgrupos dcSSc y anti-topoisomerasa positivos.
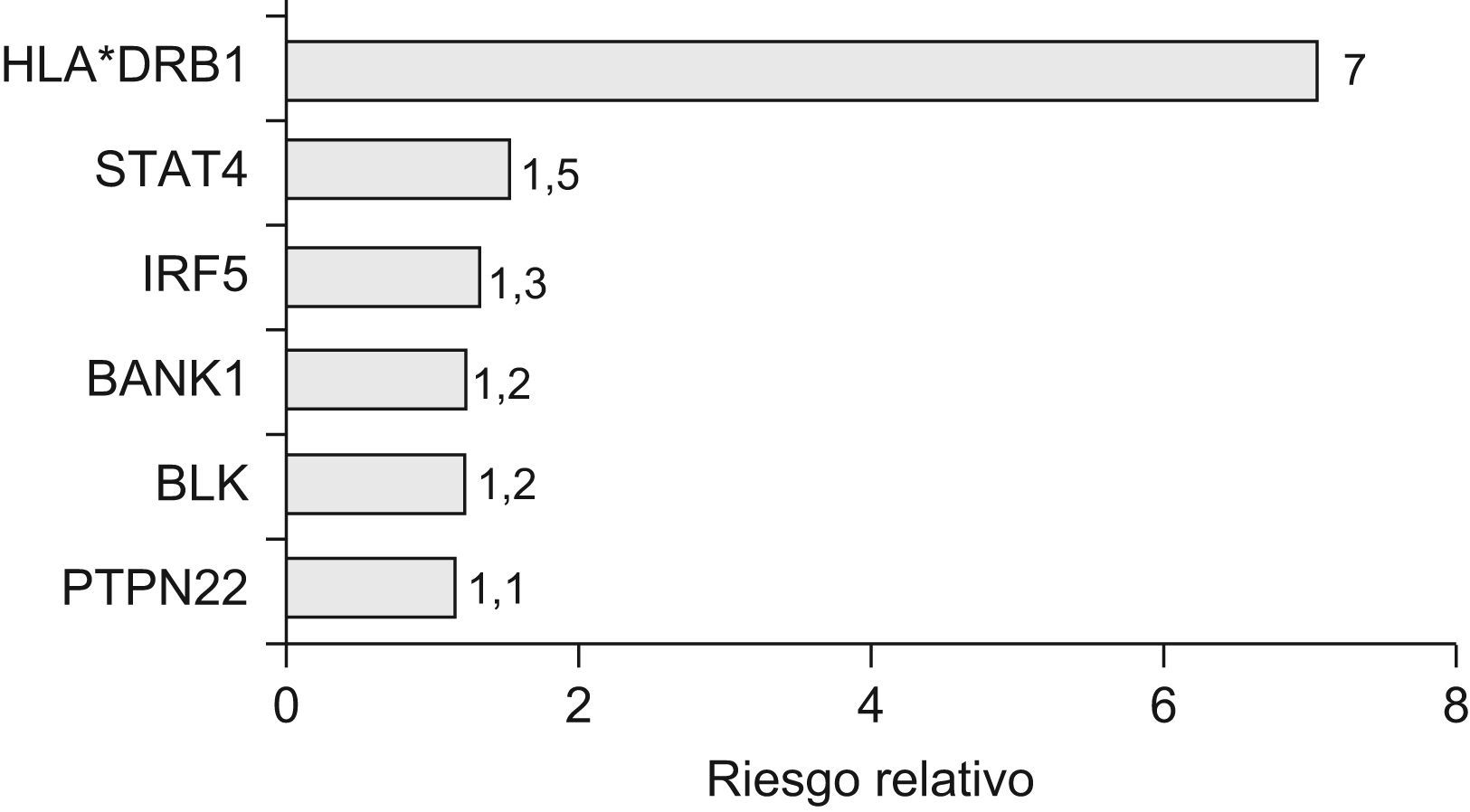
ConclusionesEl conocimiento de los factores genéticos implicados en la predisposición genética a la SSc es por el momento limitado. Aunque se han comentado los hallazgos más representativos en este campo, el número de trabajos en los que se han llevado a cabo estudios de asociación en esta enfermedad es mucho más amplio. Sin embargo, la mayoría de los resultados no han tenido gran trascendencia bien por el bajo número de individuos analizados, bien por la falta de reproducibilidad de las evidencias obtenidas. Actualmente, el nacimiento de nuevos grupos de investigación interdisciplinares y la colaboración a nivel internacional está permitiendo dejar a un lado estas limitaciones y están comenzando a aparecer resultados más consistentes de identificación de nuevos marcadores genéticos de susceptibilidad a la SSc. Este es el caso de los genes STAT4 o IRF5, factores genéticos comunes de autoinmunidad, que también están implicados en la genética de la SSc de forma clara y reproducible en diferentes poblaciones, resaltando además la importancia de la alteración de la vía del interferón en la patogénesis de la SSc. Entre los principales genes candidatos cuya asociación ha sido replicada también se encuentran genes propios de linfocitos B, como BLK y BANK1, subrayando el papel de estas células en la enfermedad (fig. 1).
Queda aún mucho camino por recorrer y se espera que a la luz de las nuevas tecnologías y estrategias en el estudio de la genética de enfermedades complejas, como los estudios de asociación del genoma completo, se identifiquen nuevos marcadores genéticos implicados en la susceptibilidad a la SSc. En esta línea, nuestro grupo ha llevado a cabo recientemente el primer GWAS en pacientes de SSc con ascendencia caucásica. El estudio se realizó en una cohorte compuesta por 2.296 pacientes de SSc (de nacionalidad española, holandesa, alemana o estadounidense), todos diagnosticados bajo los criterios de la ACR y bien caracterizados clínicamente, y 5.171 controles sanos (seleccionados por sexo y edad). El análisis, realizado con diferentes soportes de alto rendimiento de genotipado de la casa comercial Illumina, contó con una cobertura del 81% de la variabilidad, genómica descrita por el Proyecto HapMap. Tras aplicar la estadística y las correcciones necesarias, los resultados confirman la asociación significativa a nivel de GWAS de algunos de los genes candidatos consolidados tales como STAT4 e IRF5, al mismo tiempo que surgen algunos locus novedosos. Algunos de estos nuevos genes candidatos, como CD247, han sido confirmados en una segunda fase de replicación en 9 cohortes independientes procedentes del Reino Unido, Noruega, Alemania, Bélgica, Holanda, Suecia, España, Italia y Estados Unidos (2.753 casos y 4.569 controles sanos)33. A pesar de los recientes avances en el estudio de las bases genéticas de la SSc, aún serán necesarios nuevos esfuerzos y herramientas para confirmar y replicar los nuevos hallazgos. Así como para comprender la base molecular de la aparición de los diferentes fenotipos y manifestaciones clínicas de la enfermedad.
FinanciaciónNuestro trabajo se encuentra financiado por los siguientes proyectos y becas: GEN-FER de Sociedad Española de Reumatología, SAF2009-11110 del Ministerio de Ciencia e Innovación de España, CTS-4977 de la Junta de Andalucía, el Programa RETICS RD08/0075 (RIER) del Instituto de Salud Carlos iii (ISCIII).
Agradecemos a Sofía Vargas, Sonia García y Gema Robledo su excelente apoyo técnico. A todos los clínicos que han contribuido a la colección de muestras biológicas y datos clínicos de los pacientes de esclerodermia, y sin cuya inestimable ayuda no podríamos haber realizado este trabajo. A todos los pacientes, donantes sanos y personal sanitario por su desinteresada colaboración.