La hemorragia alveolar difusa (HAD) es una manifestación rara pero potencialmente fatal en pacientes con lupus eritematoso sistémico (LES). La patogenia de esta manifestación es desconocida, aunque los pacientes se presentan con datos clínicos de actividad del LES en el momento de la hemorragia; estudios de histopatología han implicado depósitos de complejos inmunes e infiltrado celular (capilaritis). El cuadro clínico clásico de la enfermedad consiste en disnea, descenso en la hemoglobina e imágenes radiográficas alveolares difusas habitualmente, con o sin la presencia de hemoptisis. Se han identificado diversos factores asociados a mortalidad, entre los que se encuentran la ventilación mecánica, falla renal e infecciones; estas últimas se han descrito como frecuentes en diversas series, aunque principalmente son bacterianas, también pueden observarse infecciones fúngicas invasivas como aspergilosis. El tratamiento de la HAD se ha basado en pulsos de metilprednisolona; pueden ser útiles también, ciclofosfamida (uso controversial), plasmaféresis, inmunoglobulina y rituximab.
Diffuse alveolar hemorrhage (DAH) in patients with systemic lupus erythematosus is a rare but potentially fatal condition. Although the pathogenesis of this condition is unknown, high disease activity is the main characteristic; moreover, histopathology in some studies showed alveolar immune complex deposits and capillaritis. Clinical features of DAH include dyspnea, a drop in hemoglobin, and diffuse radiographic alveolar images, with or without hemoptysis. Factors associated with mortality include mechanical ventilation, renal failure, and infections. Bacterial infections have been reported frequently in patients with DAH, but also invasive fungal infections including aspergillosis. DAH treatment is based on high dose methylprednisolone; other accepted therapies include cyclophosphamide (controversial), plasmapheresis, immunoglobulin and rituximab.
Han pasado mas de 100 años desde la descripción de Osler en una de las pacientes del grupo de eritema, que se asume presentó hemorragia pulmonar con lupus eritematoso sistémico (LES) 1. La HAD en la actualidad, continúa siendo una de las complicaciones más devastadoras en pacientes con LES; tiene una mortalidad elevada2 y representa un reto diagnóstico y terapéutico para el reumatólogo.
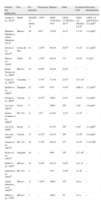
La frecuencia de la enfermedad varía dependiendo de la serie evaluada, desde el 0,63 hasta el 5,4%4 de las cohortes de lupus y desde el 0,55 hasta el 9%2 de los ingresos hospitalarios, el 5,7% de los ingresos a terapias intensivas6 y el 12,3% de autopsias7. Al igual que en el LES, la frecuencia es mayor en mujeres y, aunque la mayoría de las series de casos informan que la hemorragia pulmonar se presenta en etapas tempranas, la media o mediana de evolución del LES en el momento de la HAD va desde 6 meses8 hasta 14,1 años4 (tabla 1).
Series seleccionadas, características demográficas
| Autores, año publicación | País | No. episodios | Frecuencia | Mujeres | Edad | Evolución LES | Descenso hemoglobina |
| Araujo et al., 20129 | Brasil | 28LESJ: 13 LESA: 15 | 1,6%a | LESJ: 77%LESA: 87% | LESJ: 15,3dLESA: 28,7d | LESJ: 2,6 adLESA: 5,6 ad | LESJ: 2,9 g/dLdLESA: 5,5 g/dLd |
| Martínez-Martínez y Abud-Mendoza, 20112 | México | 29 | 9%b | 75,9% | 25,1d | 1,5 ad | 3,4 g/dLd |
| Kwok et al., 201110 | Corea del Sur | 21 | 1,4%b | 90,5% | 29,7d | 5,4 ad | 2,1 g/dLd |
| Shen et al., 201011 | China | 29 | 1,4%b | 86,2% | 31e | 42 me | 32 g/Le |
| Rojas-Serrano et al., 20083 | México | 14 | 0,6%a | 92,8% | 22,4d | – | – |
| Cañas et al., 20076 | Colombia | 7 | 5,7%c | 71,4% | 24,3d | 15,7 md | – |
| Badsha et al., 200412 | Singapur | 22 | 1,5%a | 91% | 31,6d | 0,96 ae | 3,2 g/dLd |
| Chang et al., 20025 | Taiwán | 8 | 0,5%b | 100% | 32,5e | 36 me | 3,0 g/dLe |
| Lee et al., 200113 | Corea | 9 | – | 100% | 26e | 2 me | 1,9 g/dLe |
| Santos-Ocampo et al., 200014 | EE. UU. | 11 | 1%b | 81,8% | 31,1d | 4,5 ad | – |
| Lee et al., 20008 | Korea | 6 | – | 83,3% | 28d | 6 md | 2,1 g/dLd |
| Liu et al., 199815 | Taiwán | 13 | 4,3%b | 92,3% | 26d | 23 md | 2,4 g/dLd |
| Zamora et al., 199716 | EE. UU. | 19 | 3,7%b | 68,4% | 27e | 31 me | 7,1% Htd |
| Koh et et al., 199717 | Singapur | 10 | – | 80% | 25e | 21,5 md | – |
| Barile et al., 19974 | México | 34 | 5,4%b | 94,1% | 34,5d | 14,1 ad | – |
| Schwab et al., 199318 | EE. UU. | 8 | – | 75% | 37,9d | 2,3 ad | – |
| Abud-Mendoza et al., 198519 | México | 12 | 1,6%b | 100% | 25d | 24 m | – |
| Mintz et al., 19787 | México | 7 | – | 100% | 30 | 3,2 a | – |
En la serie de Lee et al.8 los datos fueron extraídos de 6 pacientes con lupus en 10 pacientes con HAD por diferentes causas.
a: años; Ht: hematocrito; LES: lupus eritematoso sistémico; LESA: LES adultos; LESJ: LES juvenil; m: meses; –: no informado.
El conocimiento que tenemos de esta mortal asociación se basa en los informes y las series de casos; la tabla 1 muestra las principales series; la mayoría de los escritos provienen principalmente de países asiáticos y latinoamericanos, en particular de México.
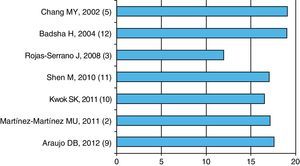
Patogenia y factores de riesgoLa enfermedad activa forma parte de la HAD asociada a LES; como muestra la figura 1, la media o mediana de la actividad de la enfermedad es alta (mayor o igual a 12), lo que indica que la actividad de LES puede ser un factor desencadenante o al menos asociado a la HAD (fig. 1).
Media2,10,11,3 o mediana5,9,12 de actividad de la enfermedad medida por las diferentes escalas (SLEDAI5,9-11,3,12 o SLEDAI-2K2). Se muestra el primer autor, el año y en paréntesis la referencia. Datos extraídos de cada uno de los artículos.
Adicionalmente, en las diferentes series, se destaca la importancia de la actividad de la enfermedad del LES por la elevada frecuencia de nefritis, artritis y afección neuropsiquiátrica; por ejemplo, la nefritis lúpica es informada por la mayoría de las series en más del 70% y en los que se tiene histopatología es muy frecuente la ocurrencia de las clases proliferativas (tabla 2).
Manifestaciones renales, articulares y neuropsiquiátricas en pacientes con HAD descritas por las diferentes series
| Autores, año | Nefritis | Artritis | Lupus NP |
| Araujo et al., 20129 | LESJ: 77%LESA: 80% | LESJ: 69%LESA: 73% | LESJ: 15%LESA: 20% |
| Martínez-Martínez y Abud-Mendoza, 20112 | 100% | 75,9% | 24,1% |
| Kwok et al., 201110 | 76,1% | 33,3% | 47,6% |
| Shen et al., 201011 | 90% | – | – |
| Cañas et al., 20076 | 71,4% | 57,1% | 28,6% |
| Badsha et al., 200412 | 77,3% | 68,2% | 31,8% |
| Chang et al., 20025 | 100% | 25% | 37,5% |
| Lee et al., 200113 | 100% | 33,3% | 22,2% |
| Santos-Ocampo et al., 200014 | 70% | 10% | 10% |
| Lee et al., 20008 | 83,3% | – | 16,7% |
| Liu et al., 199815 | 100% | 15,4% | 61,5% |
| Zamora et al., 199716 | 93% | 15,8% | 42,1% |
| Barile et al., 19974 | 32,4% | 44,1% | 14,7% |
| Abud-Mendoza et al., 198519 | 66,6% | 16,6% | 58,3% |
LESA: LES adultos; LESJ: LES juvenil; NP: neuropsiquiátrico; –: no informado.
Los complejos inmunes se han descrito en pacientes con HAD asociada a LES. Hughson et al.20 hacen una recopilación de la literatura de 20 casos de HAD en pacientes con LES, 15 de los cuales mostraron la denominada hemorragia blanda, los 5 restantes tuvieron capilaritis; además, se identificaron complejos inmunes en la pared alveolar en 11/15 casos de los pacientes con hemorragia blanda y en 3/5 casos de aquellos con capilaritis. En este mismo escrito, los autores describen la similitud entre la histopatología vascular observada en la hemorragia blanda con la microangiopatía renal de la nefritis lúpica20.
Aunque lo mencionado indica la participación de los complejos inmunes como expresión de la actividad de la enfermedad en la patogenia de la enfermedad, Haupt et al.21, en estudio de 120 autopsias de pacientes con LES, en la búsqueda de explicaciones alternas, informaron de 29 pacientes con HAD en los que solo 2/29 (6,9%) no tuvieron otro factor que explicara la HAD; en 5/29 (17,2%) hubo evidencia de aspiración como factor asociado, en 7/29 (24,1%) insuficiencia cardiaca congestiva, en 9/29 (31%) infección y en 6/29 (20,7%) insuficiencia renal. Por lo que consideramos que, adicionalmente a la actividad de la enfermedad, pudiera haber otros factores condicionantes o contribuyentes de la HAD como los ya mencionados.
Las infecciones son frecuentes en HAD asociada a LES y consideramos que merecen un apartado especial dentro de esta revisión.
Se ha informado que la HAD es más frecuente en invierno2; no se sabe la causa de este hecho, sin embargo, existen enfermedades exacerbadas por el frío, incluyendo epistaxis22 y hemoptisis23, por mencionar la asociación con el frío y la hemorragia de vías respiratorias.
Poco se conoce del tipo de respuesta inmunitaria que despierta la HAD en pacientes con LES. En un modelo de HAD inducida por pristano en ratones susceptibles de LES, se ha podido demostrar la participación de la respuesta inmunitaria innata; la gravedad o recuperación del insulto (la HAD) es dependiente de la inmunidad adaptativa con participación importante de las células B24. En este mismo modelo de ratones con LES y hemorragia pulmonar, la hemorragia es precedida por infiltrado de macrófagos y neutrófilos24; aunque, por otro lado, no se demostraron en este modelo depósitos de complejos inmunes25.
Factores de riesgo para el desarrollo de la HAD en pacientes con LES han sido pobremente descritos por las diferentes series. Liu et al. informan de que 4 de 13 pacientes desarrollaron la HAD al tercer día de inicio del tratamiento15, además de que 3 pacientes recibieron ciclofosfamida en el mes previo. En un análisis de 21 pacientes con lupus y HAD y 83 controles con lupus sin HAD, Kwok et al.10, en el análisis univariado, informaron que los pacientes que desarrollaron HAD tuvieron más frecuentemente lupus neuropsiquiátrico, serositis, SLEDAI>10, nefritis e hipertensión pulmonar; en el análisis multivariado, la coexistencia de lupus neuropsiquiátrico y SLEDAI>10 se consideraron factores independientes asociados al desarrollo de HAD. En este mismo estudio no se encontraron autoanticuerpos asociados al desarrollo de HAD. La HAD puede ser la primera manifestación de LES, lo que probablemente sugiere que ésta representa una una manifestación de actividad del LES. Badsha et al. informan de un incremento significativo en la actividad de la enfermedad en el mes previo al desarrollo de la HAD12.
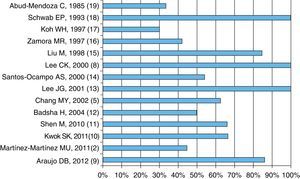
Características clínicasLos criterios de inclusión de pacientes por las diferentes series aquí presentadas incluyen disnea, descenso en la hemoglobina, imágenes radiográficas pulmonares y hemoptisis; todas esas características están casi siempre presentes en los pacientes con HAD y LES; sin embargo, la hemoptisis puede no estar presente hasta en más del 50% de los pacientes, como muestra la figura 2.
Las imágenes radiológicas pulmonares se han descrito como alveolares difusas bilaterales en la mayoría de las series6,26; algunas otras las informan como alvéolo-intersticiales12,14, y que pueden ser unilaterales hasta en 20%14 o en parches desde el 3313 al 42%16. La resolución de los infiltrados radiográficos es informada por Schwab et al. 72 h18. La tomografía de alta resolución tiene mayor sensibilidad que la radiografía convencional en la detección de HAD27.
En cuanto a la biopsia pulmonar, destacan algunos de los primeros estudios de Myers y Katzenstein, quienes describen vasculitis de pequeños vasos o microangitis en 4 pacientes con lupus y destacan como característica esta expresión de la HAD en el LES, así como los depósitos de complejos inmunes28; actualmente, se sabe que no todos los pacientes con HAD asociada a LES muestran capilaritis y que no todos los pacientes con capilaritis tienen depósitos de complejos inmunes asociados al LES20; por ejemplo, Zamora et al.16 informaron de capilaritis en 8 de 10 casos con biopsia (80%); uno de los pacientes tuvo daño alveolar difuso y el otro neumonía infecciosa. Reiteramos que muchos de los pacientes con HAD en LES descritos en la literatura se informan con «hemorragia blanda» o sin capilaritis12.
La difusión de monóxido de carbono es un estudio con utilidad diagnóstica en HAD cuando se encuentra incrementada, hecho que ocurre en el 91% de los pacientes de Badsha et al.12; por su parte, Koh et al.17 la informan en 4 de 5 pacientes en los que se realizó. Hay que destacar que este estudio implica dificultad o imposibilidad para su realización cuando los pacientes se encuentran inestables o con ventilación mecánica, como ocurre frecuentemente en la HAD.
El lavado bronquiolo-alveolar es de utilidad para determinar la concurrencia de infección3, además de servirnos para la identificación de macrófagos cargados con hemosiderina29.
El perfil de autoanticuerpos que incluye anti-ADN, anticoagulante lúpico, anticardiolipina, anti-beta2-GP1, anti-Sm, anti-Ro, anti-La y anti RNP no parece ser diferente en los pacientes con HAD comparado con pacientes con LES sin HAD10.
Se han descrito recurrencias de la enfermedad en grado variable, por lo que el haber tenido un episodio de HAD, incluso después de haber recibido tratamiento adecuado para esta, no excluye que se vuelva presentar otro episodo2,6,9,13-16,30.
Los pacientes que sobreviven pueden presentar alteraciones en las pruebas de función respiratoria31.
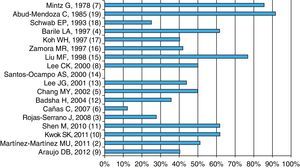
Factores asociados a mortalidadDiversas series de casos han intentado destacar los factores asociados a la mortalidad; aunque la principal condición asociada a mortalidad ha sido la ventilación mecánica2,10,13,16, otros factores asociados son la escala de gravedad APACHE II2,5, la elevación de azoados2,12 y los procesos infecciosos asociados con el evento de HAD10,13,16.
Como muestra la figura 3, la mortalidad parece no haber disminuido con el paso del tiempo; en promedio, es aproximadamente del 50%, aunque hay series, como la de Santos-Ocampo et al.14, que informan de una mortalidad del 0%; en esta serie, solo el 36% requirió de ventilación mecánica, lo cual es un factor asociado a mortalidad, y otras series con mortalidad más alta, informan de mayor frecuencia de ventilación mecánica2,10.
Con la mortalidad también tenemos que evaluar el tratamiento recibido, el cual evaluaremos más adelante en esta revisión.
InfeccionesLas infecciones han sido informadas por diferentes series como factor importante asociado a la HAD y en estos pacientes con HAD y LES alcanzan casi el 60%2,10,11,3. Se han informado infecciones bacterianas, la que incluyen Pseudomonas sp.2,5,11,3,18,32, Staphylococcus aureus2,8,16y citomegalovirus2,3; de las micosis, principalmente Aspergillus2,4,5,11,3,13,16. Es difícil separar si las infecciones fueron en el momento del diagnóstico de la hemorragia pulmonar o una complicación posterior a esta. En este sentido, Rojas-Serrano et al.3 informaron de 14 eventos de HAD en LES, los cuales fueron evaluados durante las primeras 48 h con broncoscopia y lavado bronquiolo-alveolar, con lo que encontraron infección en el 57%; de los agentes infecciosos, destacaron Pseudomonas aeruginosa y Aspergillus fumigatus, con lo que documentaron la presencia de infección al diagnóstico de la hemorragia pulmonar por lo que pudiera ser factor precipitante o contribuyente.
TratamientoLa tabla 3 muestra los principales tratamientos utilizados en las diferentes series, de ellos, 3 son los más frecuentemente empleados: metilprednisolona, ciclofosfamida y plasmaféresis. Los antibióticos se han incluido de forma empírica en varias series2,3.
Tratamientos utilizados en las diferentes series
| Autores, año | mPDN | Ciclofosfamida | Plasmaféresis |
| Araujo et al., 20129 | LESJ: 100%LESA: 100% | LESJ: 69%LESA: 47% | LESJ: 15%LESA: 20% |
| Martínez-Martínez y Abud-Mendoza, 20112 | 100% | 58,6% | 0% |
| Kwok et al., 201110 | 95,2% | 38,1% | 66,6% |
| Shen et al., 201011 | 79,3% | 70,0% | 10,3% |
| Rojas-Serrano et al., 20083 | 57,1% | 7,1% | – |
| Cañas et al., 20076 | 100% | 100% | 57,1% |
| Badsha et al., 200412 | 86,4% | 86,4% | 50% |
| Chang et al., 20025 | 100% | 12,5% | 37,5% |
| Lee et al., 200113 | 66,7% | 33,3% | 0% |
| Santos-Ocampo et al., 200014 | 81,8% | 70% | 45,5% |
| Lee et al., 20008 | 100% | 33,3% | 83,3% |
| Liu et al., 199815 | 76,9% | 15,4% | – |
| Zamora et al., 199716 | 94,7% | 52,6% | 63,2% |
| Koh et al., 199717 | 80% | 70% | 40% |
| Barile et al., 19974 | 73,5% | 5,9% | 5,9% |
| Schwab et al., 199318 | 87,5% | 62,5% | – |
| Abud-Mendoza et al., 198519 | 25% | 8,3% | – |
LESA: LES adultos; LESJ: LES juvenil; mPDN: pulsos de metilprednisolona; –: no informado.
El uso de dosis altas por vía intravenosa o «pulsos» de metilprednisolona es uno de los tratamientos más utilizados en la HAD asociada a LES. En un estudio retrospectivo, Barile et al.4, dividieron a 34 pacientes con HAD asociada a LES en 3 grupos: uno de pacientes que recibieron dosis de prednisona a 1mg/kg, otro pulsos de metilprednisolona de forma «convencional» (3 g en 3 días) y uno más pulsos de metilprednisolona de forma prolongada hasta la resolución (más de 3 g); la supervivencia fue mayor para los pacientes que recibieron los pulsos de forma prolongada y menor para los que solo recibieron prednisona a 1mg/kg.
El uso de la ciclofosfamida es controversial; mientras que Zamora et al. informaron de mortalidad mayor en los pacientes que recibieron el medicamento16, algunas series la utilizan con probable beneficio por la asociación de actividad de la enfermedad con HAD12. Los primeros, Zamora et al.16, informaron de que todos los pacientes que recibieron ciclofosfamida requirieron ventilación mecánica, además de que 6/7 pacientes que murieron presentaban también infección, factores que en el mismo estudio se describen asociados a mortalidad, con lo que es probable que la ciclofosfamida no confiera por sí misma un incremento en la mortalidad, ya que los pacientes que la recibieron tenían más factores asociados a muerte16.
Como muestra la tabla 3, la plasmaféresis ha sido empleada en diversas series; es difícil evaluar su utilidad aislada, puesto que aunque en algunos estudios se informa mortalidad menor del 20%, los pacientes recibieron terapias combinadas con o sin ciclofosfamida6; lo mismo pudiéramos comentar para la inmunoglobulina por vía intravenosa, que se ha utilizado en algunas series, como la de Shen et al.11, y en informes de casos.
Las terapias biológicas para HAD en LES también pudieran asociarse a beneficios que se han reportado en informes de casos, como se ha descrito el probable beneficio de rituximab33-35, aunque en la serie de Martínez-Martínez y Abud-Mendoza no fue de beneficio en 2 pacientes en los que se utilizó2. Hay que destacar que el mecanismo de acción de rituximab sobre autoanticuerpos pudiera no presentarse en forma rápida, como se requiere en la HAD asociada a LES; sin embargo, existen otros mecanismos de acción de la terapia depletora de células B que pudieran ser los implicados en efectos benéficos rápidos, como presentación antigénica o activación de células T reguladoras24,36,37. El rituximab pudiera ser de mayor utilidad para evitar recurrencias2,30.
Otras terapias incluyen trasplante de células mesenquimales de cordón umbilical38, con reporte de beneficio en 4 pacientes por Shi et al. 39. También hay informes con oxigenación de membrana extracorpórea40, factor vii41 y micofenolato de mofetilo42.
Conclusiones y perspectivas futurasA pesar del paso del tiempo y las nuevas terapias, la HAD asociada a LES continúa siendo un reto diagnóstico-terapéutico y con mortalidad elevada; con mortalidad; la identificación de factores asociados a mortalidad y las medidas y las estrategias para disminuirlas o evitarlas pudieran mejorar la tasa de supervivencia. Requerimos de estudios controlados o continuar con la conjunción de series de casos para analizar y evaluar el potencial beneficio de las terapias actuales, que incluyen a las biológicas.
La HAD puede resultar de la unión de factores que, orquestados por la actividad de la enfermedad, concluyen en un proceso potencialmente fatal que puede estar acompañado de infecciones, falla cardiaca y renal, además de las alteraciones de inmunoregulación características del LES. Sugerimos que todo paciente con HAD sea evaluado y vigilado desde el ingreso para descartar procesos infecciosos y que debe recibir terapia integral apropiada, con la inclusión de antibióticos e inmunosupresores, con evaluaciones continuas para la identificación de factores asociados a morbimortalidad.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.