El objetivo de esta revisión sistemática es evaluar la infección por herpes zoster (HZ) publicada en los ensayos clínicos faseII y faseIII de pacientes con AR en tratamiento con inhibidores de JAK (iJAK).
Material y métodosRevisión sistemática de la literatura que evalúa la incidencia de HZ publicada en los ensayos clínicos de los distintos iJAK comercializados o en estudio.
ResultadosLas tasas de HZ variaron entre el 1,51 y 20,22. Los resultados se expresaron principalmente en porcentaje de eventos. Los estudios más recientes categorizaron mejor la incidencia de HZ y su gravedad.
ConclusiónLos iJAK se asocian a mayor riesgo de HZ. Aunque las tasas de HZ de los iJAK selectivos de JAK1 son menores, son necesarios más estudios que confirmen estos resultados.
JAK kinase inhibitors (JAKi) are a new therapeutic option in the treatment of rheumatoid arthritis, but they are not without risks, especially the incidence of herpes zoster (HZ).
Material and methodsSystematic literature review that evaluates the incidence of HZ published in the clinical trials of the different JAKis marketed or under study.
ResultsThe HZ rates ranged between 1.51 and 20.22. The results were expressed mainly as a percentage of events. The most recent studies better categorized the incidence of HZ and its severity.
ConclusionJAKis are associated with an increased risk of HZ. Although the HZ rates of the selective JAK1 JAKis are lower, more studies are needed to confirm these results.
La artritis reumatoide (AR) es una enfermedad inflamatoria sistémica crónica que tiene un impacto significativo en la calidad de vida de los pacientes. El objetivo terapéutico de la AR es conseguir la remisión o la mínima actividad inflamatoria de la enfermedad, para lo que se recomienda realizar un diagnóstico precoz e iniciar tratamiento de forma temprana1,2.
Para alcanzar la remisión o la baja actividad disponemos de un amplio arsenal terapéutico que incluye los fármacos antirreumáticos modificadores de la enfermedad (FAME) sintéticos convencionales (FAMEsc), con el metotrexato como máximo exponente; los FAME biológicos (FAMEb), como los anticuerpos monoclonales o proteínas de fusión dirigidos a moléculas extracelulares, y los más recientemente incorporados FAME sintéticos dirigidos (FAMEsd), los inhibidores de la Janus quinasa (iJAK)1,2.
Los iJAK actúan a nivel intracelular inhibiendo de forma reversible la señal del receptor JAK, una proteína dimérica, vía transductor y activador de la transcripción (STAT) que forma parte de la respuesta inmune. Existen cuatro proteínas que componen los receptores sobre los que pueden actuar estos fármacos inhibiendo su función: JAK1, JAK2, JAK3 y TYK2.
Existen actualmente aprobados 3 iJAK para el tratamiento de AR con actividad inflamatoria moderada o alta: tofacitinib, que inhibe JAK1, JAK3 y, en menor medida, JAK2, aprobado desde 2012; baricitinib, que inhibe JAK1 y JAK2, aprobado desde 2017, y upadacitinib, inhibidor selectivo de JAK1, aprobado en 2019 en Estados Unidos y en 2020 en Europa. En fase de desarrollo se encuentran: filgotinib, inhibidor selectivo de JAK1; peficitinib, inhibidor de pan-JAK, y decernotinib, inhibidor selectivo de JAK3 (y en menor medida de JAK1)3-5. La tabla 1 muestra todos los iJAK citados.
Inhibidores de JAK quinasa disponibles y en estudio en artritis reumatoide
| Fármaco | Nombre comercial | Nombre estudio | Diana | Desarrollo |
|---|---|---|---|---|
| Tofacitinib | Xeljanz® | CP-690,550 | JAK1, JAK3 | Disponible |
| Baricitinib | Olumiant® | LY3009104 | JAK1, JAK2 | Disponible |
| Upadacitinib | Rinvoq® | ABT-494 | JAK1 | Disponible |
| Filgotinib | GLPG0634 | JAK1 | Fase III | |
| Peficitinib | ASP015K | JAK1, JAK3 | Fase III | |
| Decernotinib | VX-509 | Pan-JAK | Fase IIb completada |
En los estudios de desarrollo de los iJAK se han identificado efectos adversos comunes entre las diferentes moléculas y diferenciadores con respecto a los FAMEsc y FAMEb, como son los eventos trombóticos y los herpes zoster (HZ). La reactivación del virus de varicela zoster, con la consiguiente aparición de HZ, se ha confirmado con todos los iJAK, y aunque se conoce que la incidencia es mayor en población japonesa, se desconoce el mecanismo por el cual los iJAK aumentan el riesgo de reactivación de HZ6.
Objetivo del estudioEl objetivo de esta revisión sistemática es evaluar la infección por HZ publicada en los ensayos clínicos faseII y faseIII de pacientes con AR en tratamiento con iJAK7,8.
Material y métodosSe realizó una búsqueda sistemática en la literatura utilizando Medline, Embase y Cochrane. Se estableció como fecha límite de búsqueda el 31 de diciembre de 2019, y se incluyeron exclusivamente artículos en inglés. Se buscaron los mismos términos y fármacos en las 3 bases: «rheumatoid arthritis», «herpes zoster», «JAK inhibitor», «tofacitinib», «baricitinib», «upadacitinib», «filgotinib», «peficitinib» y «decernotinib».
Con el objetivo de obtener la mayor homogeneidad posible entre los estudios se decidió incluir ensayos clínicos faseII y faseIII, así como sus estudios de extensión. Se excluyeron resúmenes de congresos, series de casos y registros de práctica clínica.
Los criterios de inclusión para los estudios disponibles fueron los siguientes:
- •
Pacientes diagnosticados de AR según los criterios del Colegio Americano de Reumatología y/o criterios EULAR9,10.
- •
Fármacos evaluados: tofacitinib, baricitinib, upadacitinib, filgotinib, peficitinib o decernotinib, todos comparados con placebo.
- •
Estudios que incluyeran datos de seguridad sobre infección por HZ.
La búsqueda bibliográfica fue realizada por una investigadora con un formulario que contenía las especificaciones de los criterios previamente definidos de selección y exclusión; en caso de duda, se revisó y decidió por consenso con un segundo investigador. Se analizó la calidad de la evidencia de los estudios seleccionados para el análisis mediante las recomendaciones GRADE (Grading the Quality of Evidence and Assessment of Recommendations). Para evaluar la calidad de la evidencia se tuvo en cuenta el diseño del estudio, el tiempo de seguimiento (al menos 24semanas) y la forma de expresar la aparición de HZ (tasa por cada 100 pacientes/año).
El objetivo principal de nuestro estudio fue evaluar la tasa de infección por HZ en función de las dosis del fármaco administrado, así como con placebo. En caso de que el estudio aportara frecuencias en forma de porcentaje, se realizó una estimación de la tasa de incidencia mediante el número de HZ, de pacientes incluidos y el tiempo de duración del ensayo clínico.
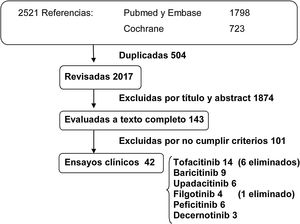
ResultadosLa búsqueda resultó en un total de 2.521 publicaciones. Se eliminaron 504 referencias duplicadas, y de las 2.017 referencias restantes se eliminaron las que no cumplían los criterios del estudio mediante una revisión por título y abstract. Se revisaron 143 publicaciones a texto completo que cumplían los criterios de selección y se incluyeron un total de 42 ensayos clínicos (fig. 1).
Se seleccionaron 14 ensayos clínicos de tofacitinib (4 faseII, 8 faseIII y 2 estudios de extensión); 9 ensayos clínicos de baricitinib (2 faseII, 5 de faseIII y 2 estudios de extensión); 6 ensayos clínicos de upadacitinib (2 faseII y 4 faseIII); 4 ensayos clínicos de filgotinib (3 faseII y 1 faseIII); 6 ensayos clínicos de peficitinib (3 faseII, 2 faseIII y un estudio de extensión), y 3 ensayos clínicos de faseII de peficitinib. En los ensayos clínicos de estos fármacos se ha identificado un mayor número de infecciones oportunistas por virus varicela zoster en comparación con placebo. En el análisis final se descartaron los ensayos clínicos que no aportaban información sobre infección por HZ o lo hacían de forma insuficiente. Se eliminaron 6 ensayos clínicos de tofacitinib (3 faseII y 3 faseIII), todos publicados antes de 2013, y un ensayo clínico faseII de filgotinib publicado en 2017.
En total se incluyen en los ensayos clínicos de tofacitinib (4.678 pacientes), excluyendo las fases de extensión, con un tiempo máximo de seguimiento de 9,5años11-16. Los ensayos de baricitinib incluyeron 3.899 pacientes, excluyendo las fases de extensión, con un tiempo máximo de seguimiento de 2,5años17-22, y los de upadacitinib contaron con 4.012 pacientes, con tiempo máximo de un año23-26. Además, los ensayos de filgotinib incluyeron 1.325 pacientes, con un tiempo máximo de 6meses27-28, y los de peficitinib incluyeron 2.587 pacientes, con un tiempo máximo de seguimiento de un año29. Finalmente, los ensayos de decernotinib incluyeron 605 pacientes y un tiempo máximo de seguimiento de 6meses30.
La inhibición los diferentes tipos JAK puede conllevar diferencias en los perfiles de seguridad entre estos fármacos, lo que podría tener implicaciones clínicas. Por ello analizamos los resultados de forma separada para cada iJAK. Los resultados por cada iJAK se muestran en las tablas 2-5).
Estudios tofacitinib
| Autor, año | Fase estudio, poblaciónDuración media AR (años) | Duración estudio | Pacientes, n | Dosis fármaco mg (n.° pacientes), placebo | Herpes zoster (%) | Tasa eventos por 100 pacientes-año | Calidad de la evidencia | |
|---|---|---|---|---|---|---|---|---|
| 1 | Kremer, 2009 | IIb, Internacional8,7-10,2 | 12 semanas | 264 | 5 (61)10 (69)30 (69)Placebo (65) | 1 (1,6)2 (2,9)2 (2,9)1 (1,5) | 6,5511,611,66,15 | Alta |
| 2 | Van Vollenhoven, 2012ORAL-STANDARD11 | III, Internacional6,9-9,0 | 52 semanas | 717 | Placebo (108)5 (204)10 (201)Adalimumab (204) | 1 (1)6 (3)12 (6)5 (2,5) | 16125 | Alta |
| 3 | Kremer, 2013ORAL-SYNC12 | III, Internacional8,1-10,2 | 52 semanas | 792 | Placebo (159)5 (315)10 (318) | 001 (0,3) | 000,31 | Alta |
| 4 | Lee, 2014ORAL-START13 | III, Internacional2,7-3,4 | 24 meses | 956 | 5 (373)10 (397)Metotrexato (186) | 13 (3,5)18 (4,5)2 (1,1) | 6,979,072,15 | Alta |
| 5 | Fleishmann, 2017ORAL-STRATEGY14 | III, IV, Internacional5,4-6,1 | 12 meses | 1.152 | 5 (386)5+Mtx (378)Ada+Mtx (388) | 5 (1)10 (2)6 (1) | 5,1810,586,18 | Alta |
| 6 | Li, 201815 | OLE, China6,4-9,5 | 12 meses | 408 | 5 (86)10 (86)Placebo (44) | 8 (5,2)3 (7,7)0 | 1,721,510 | Alta |
| 7 | Van der Heijde, 2019 | III, Internacional8,8-9,5 | 24 meses | 797 | 5 (321)10 (316)Placebo (160) | 24 (7)33 (10)11 (6) | 14,9520,8813,75 | Alta |
| 8 | Wollenhaupt, 201916 | OLE, Internacional7,7-8,6 | 9,5 años | 4.481 | 5 (1123)10 (3358) | 119 (10,6)386 (11) | 2,563,36 | Alta |
Estudios sobre baricitinib
| Autor, año | Fase estudio, poblaciónDuración media AR (años) | Duración estudio | Pacientes, n | Dosis fármaco mg (n.° pacientes), placebo | Herpes zoster (%) | Tasa eventos por 100 pacientes-año | Calidad de la evidencia | |
|---|---|---|---|---|---|---|---|---|
| 1 | Keystone, 2015 | IIb, Internacional5,3-6,6 | 24 semanas | 299 | Placebo (98)1 (49)2 (52)4 (52)8 (50) | 00000 | 00000 | Alta |
| 2 | Tanaka, 2016 | IIb, Japón5,06-6,32 | 52 semanas | 145 | Placebo (49)1 (24)2 (24)4 (24)8 (24) | 00000 | 00000 | Alta |
| 3 | Genovese, 2016RA-BEACON17 | III, Internacional14 | 24 semanas | 527 | Placebo (176)2 (174)4 (177) | 2 (1)2 (1)7 (4) | 2,272,37,91 | Alta |
| 4 | Taylor, 2017RA-BEAM18 | III, Internacional10 | 52 semanas | 1.307 | Placebo (488)4 (487)Adalimumab (330) | 2 (0,4)11 (2)5 (1,5) | 0,412,251,51 | Alta |
| 5 | Fleishmann, 2017RA-BEGIN19 | III, Internacional1,3-1,9 | 52 semanas | 584 | Mtx (210)4 (159)4+mtx (215) | 2 (0,9)4 (2,5)5 (2,3) | 0,952,512,36 | Alta |
| 6 | Dougados, 2017RA-BUILD20 | III, Internacional7-8 | 24 semanas | 684 | 2 (229)4 (227)Placebo (228) | 4 (1,7)3 (1,3)0 | 3,492,640 | Alta |
| 7 | Keystone, 201821 | OLE, Internacional5,3-6,6 | 128 semanas | 201 | 4 (169)8 (32) | 7 (4)3 (9) | 2,841,22 | Alta |
| 8 | Tanaka, 2018 | III, Internacional1,3-10 | 24 semanas | 353 | 4 Begin 1044 Beam 249 | 8 (7,7)7 (2,8) | 15,385,62 | Alta |
| 9 | Tanaka, 201822 | OLE, Japón5,5-5,9 | 64 semanas | 142 | 4 (71)8 (71) | 5 (7)6 (9) | 5,636,76 | Alta |
Estudios sobre upadacitinib y filgotinib
| Autor, año | Fase estudio, poblaciónDuración media AR (años) | Duración estudio | Pacientes, n | Dosis fármaco mg (n.° pacientes), placebo | Herpes zoster (%) | Tasa eventos por 100 pacientes-año | Calidad de la evidencia | |
|---|---|---|---|---|---|---|---|---|
| Upadacitinib | ||||||||
| 1 | Kremer, 2016BALANCE I | IIb, Internacional10,9-12,3 | 12 semanas | 276 | Placebo (56)3 (55)6 (55)12 (55)18 (55) | 2 (4)1 (2)01 (2)1 (2) | 14,287,2707,277,27 | Alta |
| 2 | Genovese, 2016BALANCE II | IIb, Internacional3,9-9,3 | 12 semanas | 299 | Placebo (50)3 (50)6 (50)12 (50)18 (50)24 (49) | 01 (2)0002 (4) | 0800016,32 | Alta |
| 3 | Genovese, 2018SELECT-BEYOND23 | III, Internacional12,4-14,5 | 24 semanas | 499 | Placebo (169)15 (165)30 (165) | 2 (1)3 (2)6 (3,6) | 2,373,637,27 | Alta |
| 4 | Burmester, 2018SELECT-NEXT24 | III, Internacional7,2-7,3 | 12 semanas | 661 | Placebo (221)15 (221)30 (219) | 1 (0,4)1 (0,4)2 (0,9) | 1,811,813,65 | Alta |
| 5 | Smolen, 2019SELECT-MONOTHERAPY25 | III, Internacional5,8-7,5 | 14 semanas | 648 | Mtx (216)15 (217)30 (215) | 1 (0,5)3 (1,4)6 (2,8) | 1,855,5311,16 | Alta |
| 6 | Fleishmann 2019,SELECT-COMPARE26 | III, Internacional8 | 48 semanas | 1.629 | Placebo (651)15 (651)Adalimumab (327) | 3 (0,5)5 (0,8)1 (0,3) | 0,921,530,61 | Alta |
| Filgotinib | ||||||||
| 1 | Westhovens, 2017DARWIN I | IIb, Internacional7-8 | 24 semanas | 594 | Placebo (86)50 (168)100 (170)200 (170) | 1 (1,2)1 (0,6)03 (1,8) | 2,321,1903,53 | Alta |
| 2 | Kavanaugh, 2017DARWIN II27 | IIb, Internacional9-10 | 24 semanas | 283 | Placebo (72)50 (72)100 (60)200 (59) | 01 (1,4)00 | 02,7700 | Alta |
| 3 | Genovese, 2019FINCH 228 | III, Internacional9,8-10,3 | 24 semanas | 448 | 200 (147)100 (153)Placebo (148) | 2 (1,4)2 (1,3)0 | 2,722,610 | Alta |
Estudios sobre peficitinib y decernotinib
| Autor, año | Fase estudio, poblaciónDuración media AR (años) | Duración estudio | Pacientes, n | Dosis fármaco mg (n.° pacientes), placebo | Herpes zoster (%) | Tasa eventos por 100 pacientes-año | Calidad de la evidencia | |
|---|---|---|---|---|---|---|---|---|
| Peficitinib | ||||||||
| 1 | Takeuchi, 2016 | IIb, Japón6,92-8,03 | 12 semanas | 281 | Placebo (56)25 (55)50 (57)100 (55)150 (58) | 02 (3,6)02 (3,6)0 | 014,54014,540 | Alta |
| 2 | Genovese, 2017 | IIb, Internacional9,8-11 | 12 semanas | 289 | Placebo (51)25 (59)50 (57)100 (58)150 (64) | 1 (2)0000 | 7,840000 | Alta |
| 3 | Kivitz 2017 | IIb, Internacional7,2-8,1 | 12 semanas | 378 | Placebo (72)25 (67)50 (78)100 (84)150 (78) | 0002 (2,4)1 (1,3) | 0009,525,13 | Alta |
| 4 | Genovese, 2019 | OLE, Internacional7,2-11 | 24 meses | 611 | Pbo-25 (116)25-25 (112)50-25 (124)100-25 (128)150-25 (131) | 2 (1,8)2 (1,8)4 (3,2)2 (1,6)5 (3,8) | 0,860,891,610,781,9 | Alta |
| 5 | Takeuchi, 201929 | III, Japón4,30-4,41 | 52 semanas | 519 | Placebo (170)100 (175)150 (174) | 2 (1,2)13 (7,5)6 (3,5) | 3,28,33,8 | Alta |
| 6 | Tanaka, 2019 | III, Japón6,98-10,4 | 52 semanas | 509 | Placebo (102)100 (104)150 (102)Etanercept (201) | 05 (4,8)4 (3,9)5 (2,5) | 05,84,42,6 | Alta |
| Decernotinib | ||||||||
| 1 | Fleishmann, 2015 | IIa, Internacional6,3-10 | 12 semanas | 204 | Placebo (41)25 (41)50 (41)100 (40)150 (41) | 0003 (7,5)0 | 000300 | Alta |
| 2 | Genovese, 201630 | IIb, Internacional6,5-8,1 | 24 semanas | 358 | Placebo (71)100 (71)150 (72)200 (72)100/12h (72) | 00001 (1,4) | 00002,77 | Alta |
| 3 | Genovese 2016 | IIb, Internacional6,8-10,8 | 12 semanas | 43 | Placebo (12)100 (11)200 (10)300 (10) | 0000 | 0000 | Alta |
En la evaluación de la evidencia, pese a que todos los estudios tuvieron un nivel alto, en gran medida por tratarse de ensayos clínicos aleatorizados, destacaron algunos que tuvieron un mayor tiempo de seguimiento y presentaron sus resultados de HZ en tasas15,16,21,29. Además, las dosis mayores de iJAK incluidas en los ensayos clínicos, no comercializadas, se asociaron a mayor riesgo de HZ, doblando el riesgo en algunos casos23-25.
DiscusiónEn general, todos los iJAK tienen como efecto secundario el aumento en el número de infecciones oportunistas por HZ, como probable efecto de clase de este grupo terapéutico. Es necesario destacar que la tasa de infección por HZ está fuertemente influenciada por el carácter endémico de VVZ según el área geográfica de la población de estudio, de manera que estaba claramente aumentada en Asia y en India, siendo menor en Europa y en Norteamérica.
Después de la comercialización de los dos primeros iJAK (tofacitinib y baricitinib), los últimos estudios se centran en fármacos más selectivos con la capacidad de inhibir la actividad de solo una JAK, JAK1, con el objetivo de mejorar el perfil de seguridad minimizando los efectos de JAK2 y JAK3. En la mayoría de iJAK los datos de incidencia de HZ fueron similares entre las distintas dosis de cada fármaco, aunque esta afirmación solo podríamos sustentarla tras realizar un estudio estadístico de esta observación, que escapa al objetivo de nuestro estudio. Sin embargo, sí se refleja una incidencia mayor con upadacitinib 30mg en comparación con la dosis comercializada de 15mg diarios23-26.
Aunque nuestro estudio no pretendía comparar la calidad de la recogida del HZ como complicación del tratamiento del HZ, sí es destacable que los primeros ensayos clínicos publicados (no incluidos en la evaluación final por este motivo) no especificaron la presencia de herpes ni clasificaron su gravedad. Sin embargo, los estudios publicados más recientemente, conocedores del riesgo de HZ producido por los iJAK, detallan mejor los casos de HZ, clasificándolos por gravedad en muchos casos. Este aspecto sin duda influye en mayor o menor medida en la diferencia de los casos reportados.
Por otra parte, hay que tener en cuenta que existen otros factores que pueden influir en el desarrollo de HZ en estos pacientes, como son el tratamiento concomitante con corticoides a dosis altas, los antecedentes de infección por HZ, el estado de inmunosupresión asociado a la propia enfermedad y las posibles enfermedades asociadas, entre otros aspectos. De hecho, en los ensayos de upadacitinib se recogió el uso y la dosis de corticoides sin demostrar influencia en la aparición de HZ, probablemente por uso de dosis bajas, de menos de 7,5mg/día23-26.
Los datos sobre el perfil de seguridad de JAK1, en relación con la infección por HZ, parecen ser consistentes con los ya conocidos y observados previamente con tofacitinib y baricitinib11-22. Aunque los resultados de los ensayos clínicos de fármacos selectivos de JAK1 parecen sugerir una tasa menor de HZ, es deseable el diseño de ensayos clínicos que comparen directamente los distintos iJAK disponibles, junto con comparaciones indirectas de vida real y registros, para ayudar a comprender mejor el potencial beneficio real de la inhibición selectiva de JAK1 con respecto al bloqueo de otras JAK.
Otro aspecto que habría que valorar es la vacunación de los pacientes antes del inicio del tratamiento. Actualmente la vacunación no se encuentra incluida en el calendario vacunal, y la gran mayoría de los pacientes no están vacunados de HZ. En alguno de los trabajos incluidos los autores mencionan este aspecto, concluyendo que no parece influir en el desarrollo posterior de HZ, algo que es muy relevante pero que también escapa al objetivo de nuestro estudio.
Nuestro estudio no está exento de limitaciones. Al tratarse de una revisión sistemática de ensayos clínicos, la validez externa de los resultados aquí expresados puede ser limitada, al no incluirse datos de registros. Por otra parte, la selección de los estudios incluidos fue realizada por un solo investigador, aunque las dudas se discutieron entre dos investigadores. Los resultados de incidencia de HZ se presentaron de forma dispar entre los diferentes estudios, la mayoría en porcentajes y algunos en tasas, lo que, junto con la variabilidad de la duración de cada estudio, hace que la comparación entre estudios deba hacerse con precaución. Por último, no se ha realizado un metaanálisis de los estudios incluidos debido a la heterogeneidad en la forma de reportar los datos de HZ, lo que limita la interpretación de los resultados.
ConclusionesLos iJAK se asocian a la aparición de infección oportunista por HZ, que varía en función de la población de estudio, aunque parece constante entre los distintos iJAK. Se ha propuesto que la inhibición selectiva de JAK1 asocia un menor riesgo de HZ en comparación con otros iJAK, pero son necesarios más estudios, ensayos clínicos y registros para sustentar esta conclusión.
Conflicto de interesesNo existen conflictos de intereses de los autores respecto al desarrollo de este trabajo.