La artritis reumatoide (AR) es una enfermedad autoinmunitaria sistémica caracterizada por sinovitis y destrucción progresiva del cartílago articular y hueso subyacente, junto con diversas manifestaciones extraarticulares. Las citocinas actúan como mediadores solubles responsables del proceso inflamatorio. El bloqueo terapéutico mediante anticuerpos monoclonales de las citocinas proinflamatorias factor de necrosis tumoral-alfa y la interleucina 1ha demostrado una clara eficacia sobre la inflamación y las manifestaciones clínicas de la AR, si bien no son eficaces en todos los pacientes. Se presenta una revisión de nuevas citocinas relevantes en la fisiopatología de la AR que representan potenciales biomarcadores inflamatorios de la AR. El reto actual consiste en desarrollar biomarcadores que permitan un diagnóstico más precoz, marcadores pronósticos y nuevos candidatos terapéuticos. La administración combinada de varias de ellas podría permitir una aproximación personalizada de estas terapias.
Rheumatoid arthritis (RA) is a systemic autoimmune disease characterized by synovitis and progressive destruction of the joint cartilage and underlying bone, together with diverse extra-articular manifestations. Cytokines act as soluble effector mediators of the inflammatory process. Therapeutic neutralization with monoclonal antibodies against the pro-inflammatory cytokines TNF-alpha and interleukin 1 (IL-1) has shown a clear efficacy on inflammation and clinical manifestations of RA, although a percentage of patients do not respond. This review covers new relevant cytokines in the RA physiopathology and potential biomarkers of inflammation. The current challenge is to develop biomarkers that enable an earlier diagnosis, as well as prognostic markers and new therapeutic candidates. Combined administration of several of these cytokines could eventually address a personalized treatment approach for each patient.
La artritis reumatoide (AR) es una enfermedad inflamatoria crónica de etiología autoinmunitaria que afecta en la actualidad a 200.000 personas en España, con 6.500 nuevos pacientes anuales en nuestro país. Se caracteriza por la inflamación de la membrana sinovial y la destrucción progresiva del cartílago articular y del hueso, con alteraciones estructurales, dolor y la consiguiente limitación funcional1. El proceso inflamatorio está mediado fundamentalmente por la producción de mediadores solubles, en su mayoría citocinas, pero también factores de crecimiento y quimiocinas, cuyo efecto final es la destrucción del cartílago y el hueso subyacente, así como diversas manifestaciones extraarticulares.
Las citocinas son proteínas o glucoproteínas de bajo peso molecular (< 30kD) con vida media corta, producidas principalmente por las células del sistema inmunológico, así como también por determinadas células de otros tejidos, y son mediadores fundamentales de la transmisión de señales intercelulares.
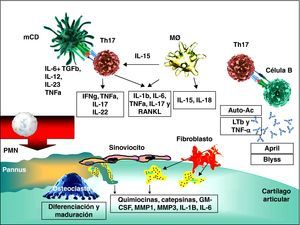
Los factores etiológicos de la AR son poco conocidos, pero se ha avanzado mucho en el estudio de los mecanismos que intervienen en su fisiopatología. En la membrana sinovial que tapiza la superficie articular y las vainas tendinosas se produce una infiltración por diversas células inflamatorias, entre las que los linfocitos Th17, secretores de la citocina con mayor efecto proinflamatorio, la interleucina (IL-17), parecen desempeñar un papel iniciador, interaccionando con células dendríticas (CD), macrófagos y linfocitos B2 (fig. 1). Los macrófagos son células fundamentales en la fisiopatología y la magnitud de su infiltración se correlaciona con los síntomas, probablemente debido a la secreción de mediadores proinflamatorios claves, como el factor de necrosis tumoral alfa (TNF-α) y la IL-1β, implicadas en la perpetuación de la inflamación crónica en la AR3. Los fibroblastos sinoviales son inicialmente activados por el microambiente local y posteriormente adquieren un fenotipo seudomaligno con regulación al alta de oncogenes, inhibición de la apoptosis y secreción de citocinas, quimiocinas, metaloproteinasas de la matriz y catepsinas, que median el proceso inflamatorio crónico y catalizan la destrucción articular4. Los linfocitos B actúan mediante la producción de autoanticuerpos (células plasmáticas sinoviales), como células activadoras de los linfocitos T en su función de células presentadoras de antígeno (APC) y de activación de fibroblastos mediante la secreción de TNF-α y linfotoxina β. Además, se forman folículos linfoides en el tejido sinovial, lo que sugiere que la presentación de antígenos tiene lugar localmente, mientras que en otros pacientes los linfocitos B se distribuyen en agregados o difusamente. Por último, se produce una activación e hiperplasia de los mastocitos a nivel articular. El tejido inflamatorio o pannus adquiere la capacidad de invadir y destruir el cartílago articular adyacente. La activación de los osteoclastos del hueso periarticular conduce a la resorción y se forman las erosiones óseas características de la enfermedad5. La función de las células T CD4+ reguladoras está disminuida, lo que contribuye al desequilibrio entre los brazos efector y regulador de la inmunidad.
Esquema de la fisiopatología de la artritis reumatoide. Interacción de las principales células implicadas en la fisiopatología de la sinovitis y resorción ósea, culminando en la liberación de enzimas y daño tisular. Adaptado de Isaacs et al8.
La angiogénesis se refiere a la formación de nuevos capilares o neovascularización a partir de vasos preexistentes, a diferencia de la vasculogénesis o formación de capilares de novo a partir de células precursoras endoteliales. La angiogénesis es un proceso precoz y crítico en la fisiopatología de la AR, que depende de la activación, la migración y la proliferación de células endoteliales, con un papel importante de la IL-17.
La AR puede afectar también otros órganos o sistemas, induciendo inflamación y fibrosis, arteriosclerosis precoz o manifestaciones sistémicas, como astenia marcada, anemia y osteoporosis, causa importante de comorbilidad y mortalidad en estos pacientes.
La citocinas proinflamatorias actúan como moléculas efectoras fundamentales: el TNF-α y la IL-1 son los principales componentes del proceso inflamatorio y parecen actuar sinérgicamente, por lo que se definieron como las primeras dianas terapéuticas6. El TNF-α es un estímulo importante para las células productoras de mediadores inflamatorios (citocinas, metaloproteinasas, óxido nítrico, prostaglandina E2, etc.), mientras que la IL-1β media la destrucción de cartílago y hueso (a través de la secreción de metaloproteinasas, disminución de la síntesis de glucosaminoglucanos, etc.)7. Los inhibidores naturales de las citocinas proinflamatorias, tales como el antagonista del receptor de la IL-1 (IL1-Ra), sIL1-RI, sIL1-RII, sTNF-RI, sTNF-RII, están incrementados, pero no lo suficiente como para contrarrestar el efecto antiinflamatorio.
Las terapias biológicas disponibles en la actualidad, dirigidas fundamentalmente frente a citocinas o a moléculas expresadas en determinadas células implicadas en la etiopatogenia de la AR, han transformado radicalmente la evolución de la enfermedad, permitiendo a los pacientes mantener su independencia funcional y mejorando su calidad de vida. El mayor reto actual consiste en identificar biomarcadores que permitan un diagnóstico más precoz, marcadores pronósticos y nuevas dianas terapéuticas más eficaces que permitan optimizar el tratamiento de manera individualizada8.
Citocinas y receptores de citocinas expresadas en los tejidos de la articulaciónLa secreción de citocinas constituye un mecanismo fundamental en la modulación de la respuesta inmunológica. El patrón de secreción de estas moléculas determina el tipo de respuesta inmunológica que se confrontará con un antígeno particular9. Las células en la membrana sinovial inflamada y en el pannus elaboran citocinas, como TNF-α, IL-1, IL-6, IL-17 e IL-23, que contribuyen a la inflamación y que pueden afectar directamente al hueso10. Además de potenciar la actividad de otras citocinas proinflamatorias, la IL-17 estimula la diferenciación de los osteoclastos e induce la degradación directa de los proteoglucanos del cartílago in vivo y ex vivo. Los mastocitos son las células que presentan más receptores a la IL-17a en la membrana sinovial11. La IL-23 se expresa intensamente en las articulaciones inflamadas, induciendo la producción de IL-17 en el modelo murino de la AR.
Nuevas citocinas relevantes en la patogenia de la artritis reumatoideInterleucina 18La IL-18, también denominada factor inductor del interferón (IFN)-γ, es miembro de la superfamilia de las IL-1 (tabla 1), con potente actividad favorecedora de la diferenciación Th1, en efecto sinérgico con IL-12 e IL-15. Es sintetizada por macrófagos, células de Kupfer, queratinocitos, condrocitos articulares, sinoviocitos y osteoblastos. La IL-18 induce la activación de linfocitos T citotóxicos y células NK, induciendo a su vez la secreción de IFN-γ por dichas células e incrementando el efecto de la IL-12. A su vez, el IFN-γ y la IL-18 estimulan la activación de los monocitos por contacto celular directo con linfocitos T activados, e incrementan la secreción de IL-1β y TNF-α de manera dependiente de la dosis, que promueven la quimiotaxis de neutrófilos mediada por IL-8. La sobreproducción de IL-1β y TNF-α conduce a la estimulación de los sinoviocitos, contribuyendo aún más a la destrucción articular. Más aún, esta citocina induce la expresión de quimiocinas CXC por los fibroblastos de la sinovial, estimula la angiogénesis y está implicada en el reclutamiento de neutrófilos mediante la regulación al alta de VCAM-1 e ICAM-1.
Citocinas en la etiopatogenia de la artritis reumatoide
| Citocina | Subunidades | Célula | Función |
| Familia IL-1 | |||
| IL-18 | α y β | MФ | Estímulo de células NK y linfocitos T, induciendo la secreción de IFN-γ |
| Familia IL-12 | |||
| IL-23 | p19, p40 | MФ, CDs | Estimula la producción de IL-1β y TNF-α, regulación al alta de MMP9, expansión y supervivencia de Th17 |
| IL-27 | p28, EB13 | MФ, CDs | Aumenta la patología autoinmunitaria, suprime la actividad patogénica Th17, estimula la proliferación dependiente de STAT3 |
| IL-35 | p35, EB13 | MФ, CD | Suprime la diferenciación Th17, proliferación de células T CD4+ efectoras |
| Familia IL-17 | |||
| IL-21 | T CD4, NKT | Diferenciación del linfocito B, activación de linfocito T y células NK | |
CD: células dendríticas; MФ: macrófagos; MMP9: metaloproteinasas 9.
Adaptada de Paradowska-Gorycka et al13.
Se ha descrito un aumento de los niveles de IL-18 en el líquido sinovial (LS) y en el suero de pacientes con AR, más marcado en LS, sugiriendo la producción local de esta citocina. Varios estudios sugieren que los niveles de IL-18 son un buen marcador de actividad de la enfermedad, demostrando correlación con los reactantes de fase aguda. En biopsias de membrana sinovial, se ha encontrado una expresión elevada de IL-18 en el 80% de los pacientes con AR, expresión que se correlaciona con los niveles de IL-1β y TNF-α, con la infiltración por macrófagos, con los sistemas de puntuación de inflamación y con la VSG. Los niveles de IL-18 en la enfermedad de Still del adulto se correlacionaron con la puntuación para la actividad clínica y fueron marcadores predictivos de disfunción hepática.
La IL-18 parece estar fuertemente asociada con desarrollo de las manifestaciones sistémicas. Los niveles de IL-18 se encuentran extremadamente elevados en la enfermedad de Still, del orden de 1.000 veces superior a las concentraciones normales y en otras enfermedades inflamatorias crónicas como la AR. Se correlacionan con los niveles de ferritina y con los marcadores de gravedad de la enfermedad. Un reciente estudio ha observado una correlación con los niveles de IL-1 e IL-18 y enfermedad cardiovascular asociada a AR12. De hecho, la IL-18 es un factor predictivo independiente de mortalidad en la enfermedad vascular coronaria.
Interleucina 23Pertenece a la familia de las IL-6/IL-12 (tabla 1), promoviendo efectos proinflamatorios y respuestas inflamatorias sinérgicamente con la IL-1213. La IL-23 es uno de los factores esenciales para la supervivencia y/o expansión de los linfocitos Th17, que producen IL-17, IL-17F, IL-6, IL-22, TNF-α y GM-CSF (factor estimulador de colonias de granulocitos y macrófagos). Por otra parte, la IL-23 induce la secreción de IL-17 por células no-T. La interacción entre la IL-23 y la IL-17 desempeña un papel fundamental en la inflamación autoinmunitaria sinovial en las fases precoces de la AR, así como en la fase destructiva de la AR, promoviendo la osteoclastogénesis. Este último efecto se debe, a su vez, a la inducción de la expresión del activador del receptor de NF-kB (RANK) en precursores mieloides y de su ligando RANKL en linfocitos colaboradores (Th). Induce un incremento de la secreción de TNF-α y las quimiocinas CXCL1 y CXCL5, que contribuyen al reclutamiento de neutrófilos.
La IL-23 induce la expresión de ciclooxigenasa 2, que induce a su vez la producción de prostaglandina E2, que contribuye al reclutamiento de neutrófilos estimulando a su vez la producción de IL-23 y bloqueando el eje IL-12/IFN-γ.
La IL-23 y la IL-17 parecen activar directamente una subpoblación de CD, monocitos y macrófagos a producir mediadores proinflamatorios, como TNF-α o IL-1β, o IL-6 que incrementan la producción de quimiocinas CXCL1 y CXCL8 por los neutrófilos y del activador de granulocitos CCL4 e IL-1 e IL-6 por los eosinófilos. También se ha descrito que este eje regula el aumento de producción de MMP9 y favorece la angiogénesis, pero disminuye la infiltración por linfocitos T CD8+. Además, el eje IL-23/IL-17 ejerce un control de retroalimentación positiva sobre su propia producción en los fibroblastos sinoviales, perpetuando la inflamación sinovial en la AR.
Los inductores naturales de producción de IL-23 son las infecciones bacterianas y algunos virus, si bien puede modularse por las respuestas inmunológicas adaptativas. Su producción está finamente regulada por combinaciones de citocinas (dosis bajas de TGF-β, junto con IL-6 e IL-21) incrementan la expresión del receptor de IL-23 (IL-23R) y favorece la diferenciación Th17, mientras que dosis altas de TGF-β inhiben la expresión de IL-23R. La IL-23 no es necesaria para el desarrollo inicial de una respuesta Th17, pero amplía o estabiliza el fenotipo Th17. La IL-23 estimula la producción de IL-1β y TNF-α a través de su subunidad p19 en sinoviocitos, que se encuentra sobreexpresada en la AR. La IL-23 induce además la osteoclastogénesis por dos vías independientes: actuando directamente sobre precursores mieloides induciendo la expresión de RANK, y regulando al alta indirectamente la expresión del ligando de RANK (RANKL) por los osteoblastos.
Se ha descrito un incremento de IL-17 e IL-23p19 ARN y de las proteínas en el LS, suero y tejido sinovial de pacientes con AR, estando ambos ausentes en pacientes sanos o con artrosis. Las concentraciones son mayores en los pacientes con erosiones óseas. La IL-23 se ha correlacionado con el número de articulaciones inflamadas, la puntuación DAS28 y los niveles séricos de IL-17.
Interleucina 27La IL-27 es miembro de la familia IL-6/IL-12 y desempeña un papel doble que comprende un amplio rango de propiedades pro y antiinflamatorias14. Se produce IL-27 en las APC, incluidos monocitos/macrófagos, CD y linfocitos B en presencia de infección por bacterias comensales gramnegativas o grampositivas e IFN-α.
La IL-27 induce efectos pleiotrópicos diversos sobre numerosas células del sistema inmunológico, que incluyen linfocitos T, B, NK, CD y monocitos/macrófagos, que expresan constitutivamente el complejo IL-27R (WSX-1/TCCR y gp130). La IL-27 media la diferenciación Th1, suprime la proliferación de linfocitos Th17, estimula la actividad T citotóxica, induce el cambio de isotipo de inmunoglobulinas en el linfocito B, así como diversos efectos sobre las células del sistema inmunológico innato.
Durante la inflamación, los neutrófilos son reclutados rápidamente de la circulación periférica. Este proceso depende de la interacción neutrófilo-endotelio, que comprende una variedad de eventos moleculares. La IL-27 suprime la actividad de adhesión de los neutrófilos humanos, disminuye la producción de radicales de oxígeno y los componentes de gránulos citotóxicos en neutrófilos.
Trabajos recientes indican que la IL-27 está implicada en la regulación de la respuesta Th1715, por lo que podría tener un potencial terapéutico en la AR. Sin embargo, el mecanismo de supresión de la respuesta Th17 parece estar mediado a través de la inducción de respuestas Th1 y secreción de IFN-γ. El receptor de la IL-27 es un heterodímero constituido por la glucoproteína gp130 y WSX-1. La señalización a través de IL-27 y su receptor induce la transcripción de los factores STAT1 y T-bet que, a su vez, activan los genes del receptor de la IL-12 y del IFN-γ. El IFN-γ inhibe la producción de IL-17. Un estudio reciente demuestra que la IL-27 expande linfocitos T reguladores inducidos, que producen la citocina antiinflamatoria IL-10.
Finalmente, Wong et al16 han demostrado in vitro que la IL-27 tiene un efecto sinérgico con TNF-α e IL-1β en la inducción de quimiocinas VCAM-1 e ICAM-1. Esta inducción es selectiva sobre los sinoviocitos de pacientes con AR y no aparece en los sinoviocitos de controles sanos. LA IL-27 induce también la secreción de CCL5, CXCL9 y CXCL10 por sinoviocitos, quimiocinas potentes que atraen linfocitos Th1 y macrófagos a la articulación. Estos autores demuestran que la IL-27 induciría la secreción de la MMP-1 en pacientes con AR.
Interleucina 32La IL-32 es una citocina proinflamatoria con seis isoformas, inicialmente denominada tránscrito NK4 por encontrarse en células NK y en linfocitos T activados. El receptor de la IL-32 es la proteinasa-3 (PR3) y el IFN-γ producido por estas células es un potente inductor de la actividad de PR3. Posteriormente, se observó que las células epiteliales son una fuente muy importante de IL-32. Los sinoviocitos con forma de fibroblastos en la AR producen gran cantidad de IL-32 y su expresión de ARNm fue específicamente alta en AR comparada con otros procesos inflamatorios articulares, lo que apoya un papel fisiopatológico de esta citocina en la AR. Hay evidencias directas de la implicación de la IL-32 en la fisiopatología de la AR. La IL-32 se expresa en la membrana sinovial de biopsias de pacientes con AR y se correlaciona con marcadores de inflamación sistémica como la VSG, con índices de inflamación sinovial y con la presencia de TNF-α, IL-1β e IL-18.
TWEAKLa citocina tumor necrosis factor-like weak inducer of apoptosis (TWEAK, Apo3L, TNFSF12) es una citocina pleiotrópica de la superfamilia del TNF que regula un amplio rango de procesos celulares que incluyen la proliferación y migración celular, la muerte celular, la angiogénesis y la inflamación. TWEAK se expresa como una proteína de membrana y como una proteína soluble de 168 aminoácidos (18kDa) que resulta de la proteólisis de TWEAK de membrana. TWEAK se une a Fn14, receptor de superficie celular altamente inducible que actúa a través de la vía de señalización del factor nuclear κB (NF-κB). TWEAK induce la liberación de citocinas y quimiocinas proinflamatorias, IL-6, IL-8, MMP-1, MCP-1y RANTES (regulated on activation normal T-cell expressed and secreted) por los sinoviocitos; regula al alta la expresión de la molécula adhesión intracelular ICAM-1 en fibroblastos sinoviales. El eje TWEAK–Fn14 regula varios procesos fisiológicos; en especial parece desempeñar un papel importante en la reparación tisular después de una lesión aguda. TWEAK–Fn14 se encuentran significativamente elevados en el suero de pacientes con AR respecto a controles sanos y sus niveles se correlacionaron con la concentración de TNF-α sérica y con la puntuación DAS28. La inhibición de TWEAK mediante anticuerpos neutralizantes mejoró las manifestaciones clínicas y las alteraciones histológicas en modelos murinos de AR, reduciendo la proliferación de los sinoviocitos y la angiogénesis.
Interleucina 35La IL-35 es una citocina heterodimérica perteneciente a la familia de la IL-12 (tabla 1), compuesta por las subunidades EBI3 (gen 3 inducido por el virus de Epstein-Barr) e IL-12p35. Se conoce poco sobre su actividad biológica. Se produce en linfocitos T CD4+ reguladores (Treg) y se ha demostrado que induce la expansión de las Treg y la secreción de IL-10, siendo necesaria para alcanzar la máxima función supresora de éstas. Asimismo, se ha demostrado que la IL-35 es capaz de inhibir la actividad de los linfocitos Th17 in vitro, lo que la hace un candidato interesante como diana terapéutica. En modelos murinos, la IL-35 suprimió eficazmente la artritis inducida por colágeno a través de la supresión de la producción de IL-17, si bien incrementó la síntesis de IFN-γ. La expresión ectópica de IL-35 confiere capacidad reguladora a los linfocitos T vírgenes, mientras que la IL-35 recombinante suprime la proliferación de los linfocitos T.
Linfocitos B en la patogenia de la artritis reumatoide: APRIL y BlySLa AR se caracteriza por la presencia de autoanticuerpos, como el factor reumatoide, y otros autoanticuerpos presentes en el suero y en el LS, como los anticuerpos frente a proteínas citrulinadas, relacionados con la destrucción articular y con manifestaciones extraarticulares17. El factor estimulador del linfocito B (BLyS) y APRIL (ligando inductor de la proliferación) son dos citocinas de la súper-familia del TNF que actúan como reguladores potentes de la supervivencia y diferenciación del linfocito B. BlyS y APRIL se expresan por linfocitos T, macrófagos, CD y osteoclastos. El bloqueo de BLyS mejora la artritis experimental, debido a la supresión de la diferenciación Th17. Los niveles elevados de APRIL se correlacionan con el número de células plasmáticas en la articulación, con los niveles de autoanticuerpos de isotipo IgM y con la secreción de citocinas proinflamatorias por los fibroblastos de la sinovial de pacientes con AR. Se han observado complejos heterodiméricos de APRIL y BLyS en el suero de pacientes con AR comparados con controles sanos, y sus concentraciones en el LS se correlacionaban independientemente con la organización linfoide en la sinovial, en las que las CD parecen ser la principal fuente de ambos factores, y con la actividad clínica medida por el índice DAS28.
AdipocinasLas adipocitocinas o adipocinas son proteínas bioactivas del tejido adiposo blanco que están comenzando a explorarse como mediadores de la respuesta inmunológica y de la inflamación, además de regular el metabolismo de la glucosa y lipídico, la homeostasis energética y la función cardiovascular, si bien las actividades precisas de cada una de ellas no son bien conocidas18. La mayoría de las adipocinas, como la leptina, la vistatina y la resistina, parecen tener propiedades proinflamatorias, mientras que la adiponectina se considera antiinflamatoria.
Conclusiones y perspectivas futurasEl eje IL-23/IL-17 es esencial tanto en el inicio de la AR como en la fase destructiva ósea y se correlaciona directamente con otras citocinas proinflamatorias (IL-1β y TNF-α) y antiinflamatorias. La IL-18 podría utilizarse como marcador predictivo de afectación cardiovascular, comorbilidad importante en la AR. El bloqueo de los factores de proliferación y la supervivencia del linfocito B, BlyS y APRIL puede ser útil en el tratamiento de la AR y están en curso ensayos en fase III. Por último, las proteínas bioactivas del tejido adiposo blanco o adipocinas pueden representar nuevos candidatos proinflamatorios con potencial terapéutico en la AR y manifestaciones inflamatorias sistémicas asociadas, como alteraciones metabólicas y cardiovasculares. Otra aproximación terapéutica paralela es la expansión de los linfocitos T reguladores. El estudio de las citocinas abre interesantes perspectivas al conocimiento de los procesos autoinmunitarios y a estrategias terapéuticas que podrían combinar algunos de estos factores solubles y que permitan personalizar el tratamiento según el perfil de cada paciente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.