El lupus eritematoso sistémico (LES) es una enfermedad multisistémica poseedora de una gran variedad de presentaciones clínicas. Se han descrito enfermedades monogénicas que predisponen la aparición de LES. Como ejemplos tenemos a los defectos en los genes reguladores de la expresión de interferón alfa o a nivel del complemento, que presentan comportamientos clínicos particulares. Estos defectos presentan una presentación y severidad distintas, por lo que se puede argumentar que el lupus no es una sola enfermedad sino varias. El tratamiento se podría individualizar dependiendo del defecto subyacente que genere el subtipo de lupus.
Systemic lupus erythematosus (SLE) is a multisystemic disease with a variety of clinical presentations. Monogenic predisposing conditions to the development of this disease have been described. As examples, an impaired expression of interferon-α regulated genes or complement deficiencies have been reported in patients with SLE, with particular clinical presentations. Those defects present particular presentations and a different severity, making an argument that lupus is not a single disease but many. Treatment could be individualized depending on the underlying defect generating the subtype of the disease.
El lupus eritematoso sistémico (LES) es una enfermedad multisistémica poseedora de una gran variedad de presentaciones clínicas, causada por la producción de autoanticuerpos, la activación de complemento y el depósito de complejos inmunes1. La investigación en LES es increíblemente intensa, y desde 1946 se han publicado alrededor de 56.000 manuscritos tocando este tópico.
Del 20 al 30% de los pacientes con lupus comienzan en edad pediátrica, con la diferencia de que la relación mujer:hombre es menos marcada en el niño (4:1, a diferencia de 9:1 en el adulto) y su gravedad es mayor2,3. Webb et al.4 reportaron un fenotipo más severo de LES en pacientes con inicio en edad pediátrica (LESp), con mayor incidencia de proteinuria, rash malar, anticuerpos anti-ADN doble cadena (anti-ADNdc), anemia hemolítica, artritis y leucopenia en comparación con LES de inicio en la edad adulta. Es aquí donde comenzamos a observar diferencias en el cuadro clínico de lo que hoy conocemos como lupus. Otra gran diferencia al iniciarse en edad pediátrica es su marcada asociación con inmunodeficiencias primarias (IDP)5-7. En este sentido, es interesante el estudio realizado por Liphaus et al.8, en el que analizaron a 72 pacientes con LESp, buscando intencionadamente alguna IDP, y encontraron un defecto en 16 pacientes (22%). Tres pacientes presentaban deficiencia de C2, 3 pacientes deficiencia de C4, otros 2 deficiencia de C1q, 4 deficiencia de IgG2, 3 deficiencia de IgA, 3 deficiencia de IgM y uno deficiencia simultánea de C2, IgA y C4. Es de notar que en este grupo de pacientes el índice de actividad era mucho más alto comparado con el resto de los pacientes, por lo que los autores sugieren que en casos de LESp severo es necesario buscar IDP subyacente8.
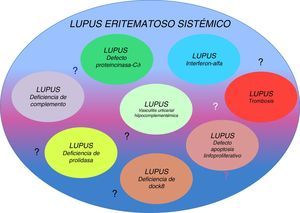
Se han identificado factores genéticos que influyen de manera fundamental en el desarrollo de esta enfermedad. Los gemelos monocigotos tienen de un 20 a un 40% más de riesgo de desarrollar LES, mientras que los heterocigotos solo de un 2 a un 5%, sugiriendo la importancia de defectos genéticos como condicionantes de esta enfermedad, aunque no se tiene un patrón de herencia asociado. Si bien el patrón de herencia es complejo, existe la posibilidad de que sean diversas enfermedades catalogadas como una sola. Tener varios orígenes genéticos explicaría la variedad de fenotipos encontrados en la clínica (de ahí derivan probablemente los reportes de casos determinados como lupus-like)7,9. Ocasionalmente el LES se ha asociado a defectos monogénicos con comportamientos clínicos bien definidos (tabla 1). La relación que tienen los defectos genéticos con el sistema inmune y el desarrollo de LES es un tema que se comienza a descubrir9. En esta revisión pretendemos dar argumentos para apoyar el concepto de la existencia de varias enfermedades distintas (enfermedades lúpicas o subtipos de lupus) englobadas en lo que hoy por hoy conocemos como LES (fig. 1).
Defectos monogénicos asociados a lupus eritematoso sistémico
| Mutación | Mecanismo | Manifestaciones clínicas |
|---|---|---|
| Deficiencias de complemento (C1q, C1r, C1s, C2, C4) | Infección crónica Alteración en depuración de los cuerpos apoptóticos y de complejos inmunes | Infecciones recurrentes Inicio temprano Manifestaciones cutáneas prominentes Ausencia anti-ADNdc |
| Deficiencia de PKCδ | Proliferación exagerada de linfocitos-B (apoptosis) | Hepatoesplenomegalia Linfadenopatía Infección por EBV o CMV |
| Deficiencia de prolidasa | Alteración en C1q | Infecciones recurrentes IgE elevada Manifestaciones cutáneas (Telangiectasias) Dismorfias faciales |
| Interferonopatía (TREX1, IFIH1, ADAR) | Aumento de IFNα | Lupus pernio Calcificación ganglios basales |
| RASopatía (vía RAS/MAPK) | Leucoproliferación Defecto en apoptosis | Más pericarditis Poca afección cutánea Esplenomegalia, linfadenopatía Asociación con síndrome de Noonan Riesgo de malignidad |
| Mutación DNASE1L3 | Alteración en la remoción de ADN | Urticaria, vasculitis cutánea, dolor abdominal recurrente, uveítis, epiescleritis, glomerulonefritis con autoanticuerpos anti-C1q |
CMV: citomegalovirus; EBV: virus Epstein-Barr.
Es sabido que los pacientes con defectos en las fases iniciales de las vías de complemento (C1q, C2 y C4) tienen una mayor predisposición para desarrollar enfermedades autoinmunes. De hecho se considera a la deficiencia de C1q como el factor genético de riesgo más fuerte y a la deficiencia de la fracción C2 como la más frecuentemente asociada a LES10-12. Como dato clínico está el hecho de que el lupus generalmente se inicia tempranamente y no hay predominio en la incidencia de géneros. Además, se asocia a la presencia de infecciones recurrentes. ¿Por qué los pacientes con deficiencias de complemento desarrollan más autoinmunidad? Hay varios factores que podrían actuar solos o en conjunto: 1)como consecuencia de activación inmune constante por una infección viral crónica; 2)una asociación con HLA al encontrarse los componentes del complemento C2, C4 y factor B en el complejo principal de histocompatibilidad; 3)la importancia del complemento en la tolerancia inmune; 4)el papel del complemento en la solubilización de los complejos inmunes al disminuir su tamaño y aumentar su depuración de la circulación; los complejos inmunes unidos a C3b se unen al receptor de C3b localizado en los eritrocitos (CD35), los cuales son transportados de esta manera a las células de Kupffer en el hígado y así evitar su depósito renal, y 5)el papel del complemento en la depuración de cuerpos apoptóticos, particularmente C1q, que al encontrarse alterada genera una mayor exposición a autoantígenos13-17.
Hay diferencias entre las enfermedades reumatológicas de los pacientes con deficiencia de complemento comparados con los que no tienen dicha deficiencia. Un ejemplo es que los pacientes con deficiencia de C2 presentan más dermatitis por fotosensibilidad, poca positividad de anticuerpos anti-ADNdc y altos títulos anti-Ro18-20. Por otro lado, los pacientes con deficiencia de C1q presentan un inicio muy temprano, manifestaciones cutáneas prominentes y daño importante a órganos blanco con cerebritis y nefritis21,22.
Existen múltiples mutaciones que ocurren en cada uno de los 3 genes responsables de la deficiencia de C1q, que se encuentran en el brazo largo del cromosoma121.
Aproximadamente 38 familias han sido reportadas con deficiencia de C1q confirmada, y se calcula que el 90% desarrolla LES21. En un reporte de 41 pacientes, la mayoría de ellos presentaba rash (98%) y la glomerulonefritis era también frecuente (39%). Interesantemente, los anti-ADNdc son comúnmente negativos23.
El caso reportado por Arkwright et al.24 es particularmente relevante: un paciente masculino de 17años de edad con antecedentes de consanguinidad y muertes por infecciones en sus hermanos, en quien se detectó deficiencia de C1q y LES. Fue sometido a un trasplante de células madre hematopoyéticas, con curación del LES. La mayoría de los factores del complemento son proteínas que tienen su origen en el hígado, por ello no es habitual que los pacientes que cursan con este tipo de IDP se sometan a trasplante de células madre hematopoyéticas; sin embargo, el argumento para haber realizado el trasplante en el paciente antes mencionado es la producción de C1q en los monocitos, con la consecuente resolución del cuadro24.
La deficiencia de C2 es la deficiencia homocigota más común, con una prevalencia de 1:20.000. El 10-20% de los casos se ha asociado con LES. El cuadro principal de los pacientes con deficiencia de C2 son las infecciones; aproximadamente el 50% de los pacientes presentan susceptibilidad para sufrir procesos infecciosos, particularmente sepsis, meningitis, artritis y osteomielitis por encapsulados (Haemophilus influenzae, neumococo, meningococo). Cuando desarrollan autoinmunidad, el órgano más afectado es el cardiovascular, con anticuerpos anticardiolipinas frecuentemente positivos. La ateroesclerosis prematura es causa de muerte además de los procesos infecciosos. Otras deficiencias como la de C4 y de properdina también se han asociado al desarrollo de LES. La deficiencia de C3 se asocia también a infecciones recurrentes, pero de igual forma puede dar datos de lupus como fiebre, rash, glomerulonefritis y artritis hasta en 28% de los pacientes. Se ha reportado que el uso de plasma fresco congelado podría ser una alternativa terapéutica en estos pacientes, así como rituximab25.
Lupus eritematoso sistémico: ¿una interferonopatía?El comportamiento de los interferones (IFN)-tipo 1 es muy variable, dependiente de las enfermedades a las que se relacione; es decir, mientras que en pacientes con esclerosis múltiple y artritis tienen un efecto inhibidor de la respuesta Th17 y por ende de la actividad de la enfermedad, en LES tienen la capacidad de inducir actividad de la misma por diversos mecanismos26-31. Los IFN tipo1 comprenden alrededor de 13 moléculas, incluyendo al IFNα, IFNβ, IFN¿, IFNκ, IFNω, y los genes que las codifican se localizan en el cromosoma9. Los IFN tienen la capacidad de activar la respuesta inmune innata a través de los receptores tipo Toll-3, 7, 8 y 9. Sus principales sitios de producción son las células nucleadas, las células dendríticas plasmocitoides y los monocitos. Se ha identificado en pacientes con LES que estas citocinas tienen la capacidad de inducir la producción de complejos inmunes dirigidos contra ácidos nucleicos, esto mediante factores reguladores de IFN28.
Los efectos del IFNα en población sana involucran la maduración de células dendríticas, activación de células natural killer, incremento en la respuesta inmune de tipo Th1, aumento en linfocitos-T CD8, elevación de células de memoria, incremento de Blys (BAFF) y mejoría en la respuesta de inmunoglobulinas. Mientras que en pacientes con LES elevan los niveles de Blys, por otro lado disminuyen las células reguladoras (CD4-FoxP3)32.
Un ejemplo clínico que involucra un defecto genético bien establecido, y que incluye la asociación entre LES e IFN, es el síndrome de Aicardi-Goutières (SAG), descrito originalmente en 1984 por Jean Aicardi y Françoise Goutières, quienes detectaron pacientes con vasculitis calcificante, leucodistrofia y encefalopatía progresiva en ausencia de infección por síndrome de TORCH (Toxoplasma gondii, Otros [HIV, Treponema pallidum, etc.), Rubeola, Citomegalovirus [CMV], virus Herpes). En 1988, Pierre Lebon detectó niveles elevados de IFNα y linfocitosis en el líquido cefalorraquídeo de pacientes con este síndrome; incluso el IFNα se considera marcador prenatal para sospechar esta enfermedad33,34.
En el año 2006, Yannick Crow y Andrew Jackson y sus colaboradores identificaron mutaciones en 4 diferentes genes: TREX1, RNASEH2B, RNASEH2C y RNASEH2A; posteriormente se describió otra mutación, conocida como SAMHD1. Se calcula que estos 5 defectos corresponden al 90% de las mutaciones conocidas como causa de SAG35. Más recientemente se han identificado otros genes involucrados: SAMHD1, ADAR e IFIH1.
Ramantani et al.28 describen en una revisión de 26 pacientes con diagnóstico de SAG una alta prevalencia de manifestaciones asociadas a LES (60%), tales como trombocitopenia, leucopenia, anticuerpos antinucleares positivos, lesiones eritematosas, lupus pernio, úlceras orales y artritis. Esto hace sospechar que el mismo defecto genético que predispone a SAG tiene un impacto sobre el sistema inmune que implica un factor de riesgo para desarrollar lupus. El común denominador entre el SAG y el LES actualmente conocido son las alteraciones en el metabolismo de los IFN, concretamente el IFNα, ya que está bien establecida la correlación entre los niveles elevados de esta citocina y la actividad lúpica. Se han descrito pacientes que presentan SAG y LES simultáneamente32,36, además de mutaciones heterocigotas en TREX1 en lupus no sindrómico37-39. La mutación de TREX1 se ha relacionado con un espectro autoinmune desde el SAG, lupus pernio familiar, leucodistrofia cerebral con vasculitis retiniana y el propio LES. El gen TREX1 codifica una exonucleasa de ADN y su mutación genera una degradación de ADN disfuncional40-43. Lo mismo sucede con mutaciones en IFIH1, con un espectro amplio en relación a fenotipos encontrados. Se encontró dicho defecto en una paciente con LES de 16años de inicio temprano y refractario al tratamiento44. Más aún, por medio de secuenciación de todo el exoma se detectó la mutación patogénica en otra paciente con LES de 4años con afección cerebral40. En una serie en la que se caracterizó el defecto molecular en una gran cantidad de pacientes con SAG, solo 4 presentaron LES (2ADAR, 2IFIH1), por lo que se infiere que la frecuencia es baja. Algunos pacientes mostraban úlceras orales, artropatía progresiva o vasculopatía intracraneal, por lo que el espectro de manifestaciones inflamatorias es extenso45.
Stimulator of interferon genes (STING) es una proteína transmembranal que reside como dímero en el retículo endoplásmico de las células epiteliales, endoteliales, macrófagos y células dendríticas. Es esencial para la producción de citocinas como los IFN tipo-1 en respuesta a patógenos relacionados con ADN de doble cadena. Defectos en STING han sido relacionados con algunas formas de LES. Cuatro miembros de una familia presentaron un síndrome inflamatorio sistémico con vasculopatía, fibrosis pulmonar y autoinmunidad46. El caso índice mostraba fiebre, rash malar, enfermedad pulmonar con producción de autoanticuerpos ANA positivo y anti-ADNdc positivo. Una línea de investigación actual es la evaluación de terapia dirigida contra IFNα en el LES (rontalizumab)47-49.
RASopatíasEn hasta el 30% de los cánceres humanos se han encontrado mutaciones somáticas con ganancia de función en miembros de la subfamilia RAS de guanosintrifosfatasas. Se han descrito variantes del síndrome linfoproliferativo autoinmune con mutaciones en NRAS y KRAS, pertenecientes a esta familia50-57. Se ha denominado a esta entidad enfermedad leucoproliferativa autoinmune asociada a RAS, y los pacientes presentan esplenomegalia, linfadenopatía, citopenias autoinmunes, hipergammaglobulinemia, así como infecciones recurrentes. Existe una pérdida de la homeostasis de los leucocitos con afección en la apoptosis. Las RASopatías son un grupo de enfermedades definidas genéticamente que involucran el síndrome de Noonan (SN) y otras enfermedades relacionadas. Estos síndromes se caracterizan por defectos en el neurodesarrollo que resultan en mutaciones en genes que codifican componentes o reguladores de la vía RAS/MAPK57. Existen en la literatura casos de SN con defectos monogénicos asociados al desarrollo de LES52–56. Tal es el caso de un varón de 13años con diagnóstico de SN y pérdida de cabello, con una mutación bien definida en SHOC2, que presentó pericarditis, poliartritis, linfadenopatías masivas, hepatoesplenomegalia, anticuerpos antinucleares positivos y anticuerpos anti-ADNdc positivos, recibió tratamiento con aspirina e hidroxicloroquina, presentando remisión de los síntomas salvo la hepatoesplenomegalia y las linfadenopatías57. Es por ello que Bader-Meunier sugiere que algunos pacientes con LES podrían sufrir de una RASopatías52,53.
Deficiencia proteincinasa-CδBelot et al.58 publicaron los casos de 3 pacientes producto de padres consanguíneos quienes reunían criterios de LES. Uno de ellos presentó un cuadro sugestivo de síndrome linfoproliferativo autoinmune con hepatoesplenomegalia y linfadenopatía. Todos los pacientes presentaban nefritis, con ANA y anti-ADNdc positivos, algunos con involucro cutáneo, articular, neurológico y hematológico. La proteincinasa-Cδ (PKCδ) es una serin/treonina cinasa implicada en el control de la proliferación celular y la apoptosis, y su ausencia se asocia con una proliferación de linfocitos-B desmedida. Es importante destacar que los pacientes no presentaban infecciones recurrentes59. Por otro lado, Kuehn et al.59 reportan otro caso con deficiencia de PKCδ: un varón mexicano proveniente de una comunidad endogámica, quien sí presenta infecciones recurrentes (otitis, sinusitis) además de infección crónica por virus Epstein-Barr. Este paciente mostró datos de síndrome linfoproliferativo autoinmune con hepatoesplenomegalia, linfadenopatía, elevación de transaminasas e hipergammaglobulinemia, pero aunque no se catalogó como LES, destacamos la presencia de rash malar y anticuerpos ANA y anti-Sm positivos en el paciente. Kiykim et al.60 reportan a un varón de 3 años producto de padres consanguíneos con un cuadro desde edad temprana con fiebre intermitente, miositis, alopecia, fotosensibilidad, hipotonía, linfadenopatía cervical y hepatoesplenomegalia. La biopsia cutánea reveló lupus. El paciente sufrió de infección por CMV y la función de células-NK se documentó como disminuida. El estudio genético determinó una nueva mutación en PKCδ. Es de destacar la respuesta espectacular según los autores a la hidroxicloroquina, en conjunto con trimetoprim y gammaglobulina intravenosa. Así, pues, en este subtipo de LES predomina la linfoproliferación, con hepatoesplenomegalia y, en algunos casos, susceptibilidad para sufrir infecciones.
Deficiencia de prolidasaOtro defecto genético que puede condicionar LES es la deficiencia de prolidasa, una enfermedad extremadamente rara con una incidencia estimada de uno por millón de nacimientos. Alrededor de 70 pacientes han sido descritos en la literatura. Su patrón de herencia es autosómica recesiva y se caracteriza por lesiones cutáneas crónicas, esplenomegalia, facies peculiar, retraso mental, afección multisistémica (esofágica, pulmonar), iminodipeptiduria y elevación de inmunoglobulinas, particularmente la IgE. La prolidasa es una dipeptidasa ubicuamente distribuida involucrada en las etapas tardías de degradación de las proteínas endógenas y de la dieta61-65. Es fundamental en el catabolismo del colágeno al estar involucrada en la hidrólisis de péptidos que contienen prolina o hidroxiprolina. En la patogénesis se han postulado alteraciones en el metabolismo del tejido conectivo generando angiopatía o alguna alteración en C1q que contiene altas cantidades de prolina. Se ha documentado un papel importante de la prolidasa en la maduración y la activación del receptor de IFN tipo-1. Se atribuye a la alteración en la expresión de este receptor la susceptibilidad de estos pacientes para presentar infecciones recurrentes (neumonías, sinusitis, otitis, infecciones por CMV y herpes virus). El diagnóstico definitivo se realiza al documentar la mutación en el gen PEPD. Las manifestaciones dermatológicas más frecuentemente reportadas son las úlceras cutáneas recalcitrantes en piernas, además de telangiectasias y fotosensibilidad61. La edad de presentación puede ser desde el nacimiento hasta los 22 años. Se han descrito pacientes con este defecto que presentan hipocomplementemia, anti-ADNdc positivo, anti-Sm positivo que son característicos de LES. Se recomienda, pues, considerar este diagnóstico en pacientes con LES e infecciones recurrentes, dismorfias faciales, retraso en el desarrollo, lesiones cutáneas e IgE elevada61-65.
Lupus e hipogammaglobulinemiaDe forma típica, los pacientes con LES presentan hipergammaglobulinemia66. Rankin e Isenberg67 han reportado que hasta el 5% de los pacientes con LES presentan deficiencia selectiva de IgA. Los pacientes con LES pueden presentar de forma concomitante deficiencia de anticuerpos o desarrollarla posteriormente. Siempre será importante evaluar si no existe pérdida de IgG a nivel renal secundario a síndrome nefrótico. Por otro lado, hay varios casos asociados a la presencia de inmunodeficiencia común variable. La inmunodeficiencia común variable es la inmunodeficiencia primaria sintomática más común, y el diagnóstico se basa en la reducción de los niveles de IgG, pero también de IgA y/o de IgM (a diferencia de las pérdidas renales, en las que solo IgG disminuye), con alteración en la producción de anticuerpos específicos68-71.
Vasculitis urticarial hipocomplementémicaLa vasculitis urticarial hipocomplementémica se caracteriza por urticaria recurrente, vasculitis cutánea, artritis y glomerulonefritis. Se menciona que frecuentemente se asocia a LES en más del 50% de los casos. Habitualmente se presenta en la tercera y cuarta décadas de la vida. Las características particulares de esta enfermedad son la uveítis, la epiescleritis, el dolor abdominal recurrente y una glomerulonefritis agresiva con niveles bajos de C1q y autoanticuerpos anti-C1q. Sigue debatiéndose el hecho de considerar a esta enfermedad como entidad independiente o un subtipo particular de LES. En esta patología se identificaron mutaciones en DNASE1L3 (pérdida de función) en una familia con 3 niños afectados72. La proteína codificada por DNASE1IL3 es homóloga a DNasa-1 y funciona como endonucleasa rompiendo el ADN. Esta es responsable de remover el ADN de antígenos nucleares. De forma notable, los pacientes reportados con la mutación cumplían criterios para LES73. En todos ellos se encontraron autoanticuerpos anti-C1q, mientras que en LES solo se presentan en el 30-35%. En nuestra experiencia la gammaglobulina intravenosa ha sido una opción terapéutica eficaz en conjunto con el tratamiento habitual74. Toda esta controversia conceptual alrededor de esta enfermedad es otro argumento más para apoyar la hipótesis de la existencia de varias enfermedades «lúpicas» (o subtipos de lupus).
Otras inmunodeficienciasLa deficiencia de DOCK8 condiciona lo que se conoce como síndrome de hiper-IgE autosómico recesivo, una susceptibilidad para infecciones virales, bacterianas, fúngicas y por protozoarios, además de enfermedades atópicas con elevación de los niveles de IgE.
DOCK8 es normalmente expresada en células del sistema inmune y condiciona varios efectos sobre los linfocitos. La pérdida de expresión de DOCK8 causa defectos en la proliferación de linfocitosT, en la producción de citocinas antivirales, disminución en IL-17 (importante para la defensa contra hongos), además de condicionar un incremento en la producción de citocinas asociadas a la respuesta inmune de tipo Th2 con eccema y eosinofilia. Los pacientes muestran clínicamente susceptibilidad para presentar infecciones virales (particularmente cutáneas, herpes, verrugas o molusco contagioso) y autoinmunidad (vasculitis, anemia hemolítica autoinmune)75-78.
Hay reportados 3 casos de LES asociado a síndrome de hiper-IgE en población pediátrica. El primero es un varón asiático de 11 años con diagnóstico de síndrome de hiper-IgE a los 6 meses de edad75-77. El segundo es un caso de una niña de 5 años con antecedente de consanguinidad en los padres, blefaritis herpética, piodermitis, eccema, neumonías de repetición y otitis media purulenta, con niveles elevados de IgE y deficiencia de DOCK8, quien desarrolla artritis, lupus discoide, lesiones purpúricas en zonas expuestas al sol, anticuerpos antinucleares positivos, anticuerpos anti-ADNdc positivos y una biopsia de piel compatible con lupus eritematoso crónico. El tratamiento administrado fue a base de hidroxicloroquina y antibióticos profilácticos, y hasta el momento de su publicación se encontraba en protocolo de trasplante de células pluripotenciales. Hace años reportamos a una tercer paciente mexicana de 10 años de edad con síndrome de hiper-IgE y LES con síndrome antifosfolípidos secundario (infarto cerebral); es de destacar que la paciente presentaba infecciones recurrentes76,77.
Los pacientes con enfermedad granulomatosa crónica (EGC) y las madres portadoras de la enfermedad se encuentran predispuestos para desarrollar varias formas de lupus79-81. Una hipótesis para explicar este fenómeno involucra a una apoptosis de neutrófilos defectuosa con generación de autoanticuerpos81. Chou et al.82 reportan a una paciente producto de padres consanguíneos, con diarrea crónica y artralgias, quien a los 8 años desarrolla LES con hepatoesplenomegalia, transaminasas elevadas y anemia hemolítica autoinmune con ANA y anti-ADNdc positivos. Al realizar secuenciación del exoma completo se identificó mutación en NCF2, del complejo NADPH oxidasa (EGC).
Recientemente se han reconocido enfermedades monogénicas condicionantes de autoinmunidad. Las mutaciones en RAG1 y 2 en humanos condicionan un espectro amplio de fenotipos desde la ausencia de linfocitosT y B con una inmunodeficiencia combinada severa hasta enfermedad autoinmune tardía o granulomas. El fenotipo autoinmune puede ser muy variable, desde citopenias hasta vasculitis destructiva. La pérdida de tolerancia es por una edición del receptor de linfocitos alterada, y se ha descrito que los pacientes con deficiencia en RAG generan una variedad importante de autoanticuerpos, incluyendo los que son característicos de LES83. Es importante destacar que los pacientes con esta enfermedad generan anticuerpos anti-IFN, y se asocia con infecciones virales importantes. Estos mismos anticuerpos anti-IFN se han descrito en pacientes con LES84. Recientemente se describió una paciente con mutaciones en RAG2 y LES. Se trata de una mujer de 44 años con poliartritis, Raynaud, síntomas sicca, serositis, rash y nefritis, además de hipocomplementemia y positividad para anti-Sm, anti-RNP, anti-Ro y ADNdc85. Curiosamente, no solo tenía linfopeniaT sino B, e infecciones recurrentes. También se han encontrado pacientes con LES que presentan mutaciones en FasL. Wu et al.86 describen a un paciente con mutación en FasL y sugieren considerar esta entidad al encontrar un paciente con LES y linfadenopatía marcada (además de las entidades mencionadas anteriormente). Hemos observado un caso de susceptibilidad mendeliana para enfermedad por micobacteria (defecto cadena beta receptor IL-12) con meningitis tuberculosa y LES87. Esta asociación llama la atención, ya que contradictoriamente en modelos animales la deficiencia de IL-23 protege contra del desarrollo de lupus88. Si bien los fenómenos autoinmunes son frecuentes en los pacientes con síndrome de Wiskott-Aldrich, solo ha sido reportado un caso asociado a LES89.
En pacientes con LES se han reportado polimorfismos en cytotoxicT lymphocyte antigen-4 (CTLA-4), proteína reguladora primordial de la respuesta inmune90. Su pérdida es fatal en ratones. Por otro lado, se ha encontrado que existen familias con un síndrome de inmunodeficiencia con autoinmunidad generado por mutaciones heterocigotas de CTLA-491,92. Si bien los pacientes no fueron diagnosticados como lupus, la autoinmunidad era importante, con citopenias, enteropatía e infiltrado pulmonar granulomatoso. Los pacientes además cursan con infecciones e hipogammaglobulinemia91,92. Es de esperar que los pacientes con haploinsuficiencia de CTLA-4 se beneficien con proteínas de fusión solubles CTLA-4 (abatacept y betacept) que inhiben la activación inmune. Abatacept ha mostrado cierta utilidad en LES, aunque los resultados han sido inconsistentes93. Es por ello que, en un futuro, el hecho de documentar el defecto particular en cada paciente con lupus podría dirigir más coherentemente el tratamiento.
Finalmente, se ha determinado que el síndrome de Evans (anemia hemolítica autoinmune y púrpura trombocitopénica) de inicio temprano con inmunodeficiencia e inmunosenescencia prematura está relacionado con deficiencia de tripeptidil-peptidasa94.
ConclusionesExisten múltiples diferencias entre LES y LESp, principalmente la cronicidad, la severidad y la asociación con IDP, lo que sugiere la posibilidad de que el LES y el LESp sean en muchos aspectos diferentes.
Es posible que el LES de inicio temprano no sea una sola enfermedad, sino que ocasionalmente comprenda un grupo heterogéneo de diferentes defectos monogénicos con susceptibilidad para sufrir infecciones e involucrar diferentes órganos95.
Conforme se describen las manifestaciones en las IDP, se detallan cada vez más mutaciones hipomórficas con fenotipos atenuados cuya presentación es en la edad adulta, por lo que es posible que suceda lo mismo con los defectos encontrados en LES (o se encuentren nuevas mutaciones distintas)96.
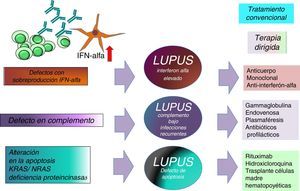
La asociación entre niveles elevados de IFN y alteraciones en la respuesta inmune de tipo Th17 es un área en estudio por su impacto en el desarrollo de LES y con implicaciones terapéuticas importantes17,21. El conocimiento del tipo de LES al que nos enfrentamos podría ayudar a la elección de un tratamiento más dirigido (gammaglobulina intravenosa, anticuerpos anti-IFNα, abatacept, rituximab, hidroxicloroquina, antibióticos profilácticos o trasplante de células madre hematopoyéticas) (fig. 2).
Finalmente, en todo paciente con LESp severo que curse con infecciones que ponen en riesgo su vida, recurrentes o por gérmenes poco habituales (Pneumocystis jiroveci, tuberculosis, candidiasis, aspergilosis, coccidiodomicosis, CMV) asociados con niveles extremadamente bajos de complemento y/o consanguinidad, se debe realizar un abordaje para descartar alguna IDP condicionante de la enfermedad23. Así, en este sentido lupus no es una sola enfermedad sino varias enfermedades con etiología, gravedades, presentaciones y tratamientos distintos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.