La artritis reumatoide (AR) es una enfermedad autoinmune sistémica caracterizada por la presencia de autoanticuerpos. Las investigaciones sobre los mecanismos patogénicos implicados en las enfermedades autoinmunes sistémicas se centran en gran medida en la participación del sistema inmunitario adaptativo con las respuestas desreguladas de las células T y B. Sin embargo, en los últimos años, ha aumentado la evidencia del importante papel que juega el sistema inmunitario innato, en particular los neutrófilos, en estas enfermedades, particularmente en la AR. Las trampas extracelulares de neutrófilos (NET) son estructuras extracelulares compuestas por cromatina remodelada y concentrada con ADN, histonas y proteínas de los neutrófilos y son un mecanismo de acción de los neutrófilos que se describió por primera vez en 2004. Se ha estudiado que pueden desempeñar un papel patogénico en la AR y podrían ser fuente de autoantígenos e incrementar la respuesta inmunológica en forma de autoanticuerpos en esta enfermedad. También se ha estudiado el posible papel de las NET y otros marcadores de activación neutrofílica como biomarcadores de actividad en la AR y otras enfermedades inmunomediadas.
En el presente artículo se revisa el papel de las NET en la AR. Se revisa el papel del neutrófilo y los últimos avances en NET, especialmente en su participación en los fenómenos de autoinmunidad en la AR. Por último, se hace una revisión de la literatura sobre la determinación de NET en sangre periférica y su relación como biomarcador de actividad de la AR y su posible papel para monitorizar la enfermedad.
Rheumatoid arthritis (RA) is a systemic autoimmune disease characterized by the presence of autoantibodies. Research on the pathogenic mechanisms involved in systemic autoimmune diseases has largely focused on the involvement of the adaptive immune system with dysregulated responses of T and B cells. However, in recent years, there is increasing evidence of the significant role played by the innate immune system, particularly neutrophils, in these diseases, particularly in RA. Neutrophil extracellular traps (NETs) are extracellular structures composed of remodeled and concentrated chromatin with DNA, histones, and neutrophil proteins, and were first described in 2004. It has been studied that NETs may play a pathogenic role in RA and could be a source of autoantigens, increasing the immune response in the form of autoantibodies in this disease. The possible role of NETs and other markers of neutrophil activation as biomarkers of activity in RA and other immune-mediated diseases has also been studied.
This article reviews the role of NETs in RA. It discusses the role of neutrophils and the latest advances in NETs, especially their involvement in autoimmune phenomena in RA. Finally, a literature review is conducted on the determination of NETs in peripheral blood and their relationship as a biomarker of RA activity, as well as their potential role in disease monitoring.
Las enfermedades reumáticas autoinmunes son un grupo de trastornos inflamatorios causados por la pérdida de la capacidad del sistema inmunitario para diferenciar lo propio de lo ajeno, con lo que responde generando una respuesta inflamatoria que daña varios tejidos y órganos como el riñón, los vasos sanguíneos o las articulaciones1. Estas enfermedades incluyen la artritis reumatoide (AR), el lupus eritematoso sistémico (LES), la vasculitis asociada a anticuerpos citoplasmáticos de neutrófilos (VAA), el síndrome antifosfolípido (SAF) y las miopatías inflamatorias idiopáticas (MII). Las enfermedades autoinmunes sistémicas son muy heterogéneas en cuanto a su presentación clínica, pero tienen en común que se caracterizan por una importante desregulación de las respuestas inmunitarias innata y adaptativa y porque muchas de ellas se asocian al desarrollo de autoanticuerpos dirigidos contra antígenos intra- y extracelulares2.
Las investigaciones sobre los mecanismos patogénicos implicados en las enfermedades autoinmunes sistémicas se centran en gran medida en las respuestas desreguladas de las células T y B. Sin embargo, son los neutrófilos activados de forma inapropiada los que tienen un mayor potencial para causar daño en los tejidos locales, tanto por su presencia en grandes cantidades en los focos de inflamación como por la liberación de su contenido citotóxico directamente en los tejidos del huésped3. En los últimos años ha aumentado la evidencia sobre la importancia de estas células en la respuesta inflamatoria propia de las enfermedades autoinmunes sistémicas.
El papel preponderante de los neutrófilos en la autoinmunidad se manifiesta en la infiltración significativa de neutrófilos en los tejidos afectos y en la generación de autoanticuerpos dirigidos contra sus componentes. Se ha observado una disfunción de los neutrófilos, que se manifiesta por una producción elevada de especies reactivas de oxígeno (ROS) y de citocinas, como el factor de necrosis tumoral α (TNF-α) y la interleucina 6 (IL-6)4,5, además de una activación inapropiada de la cascada del complemento y células dendríticas6. En las enfermedades autoinmunes, esta disfunción genera un ambiente altamente inflamatorio que provoca modificaciones antigénicas de las proteínas, lo que, a su vez, desencadena la activación de las células inmunitarias adaptativas y la producción de anticuerpos específicos para autoantígenos7. En concreto en la AR, cada vez hay más certeza de que los neutrófilos desempeñan un papel muy importante tanto en el inicio como en la perpetuación de la enfermedad, por sus efectos directos sobre la membrana sinovial y por su papel en la modulación de la respuesta inmunitaria8,9.
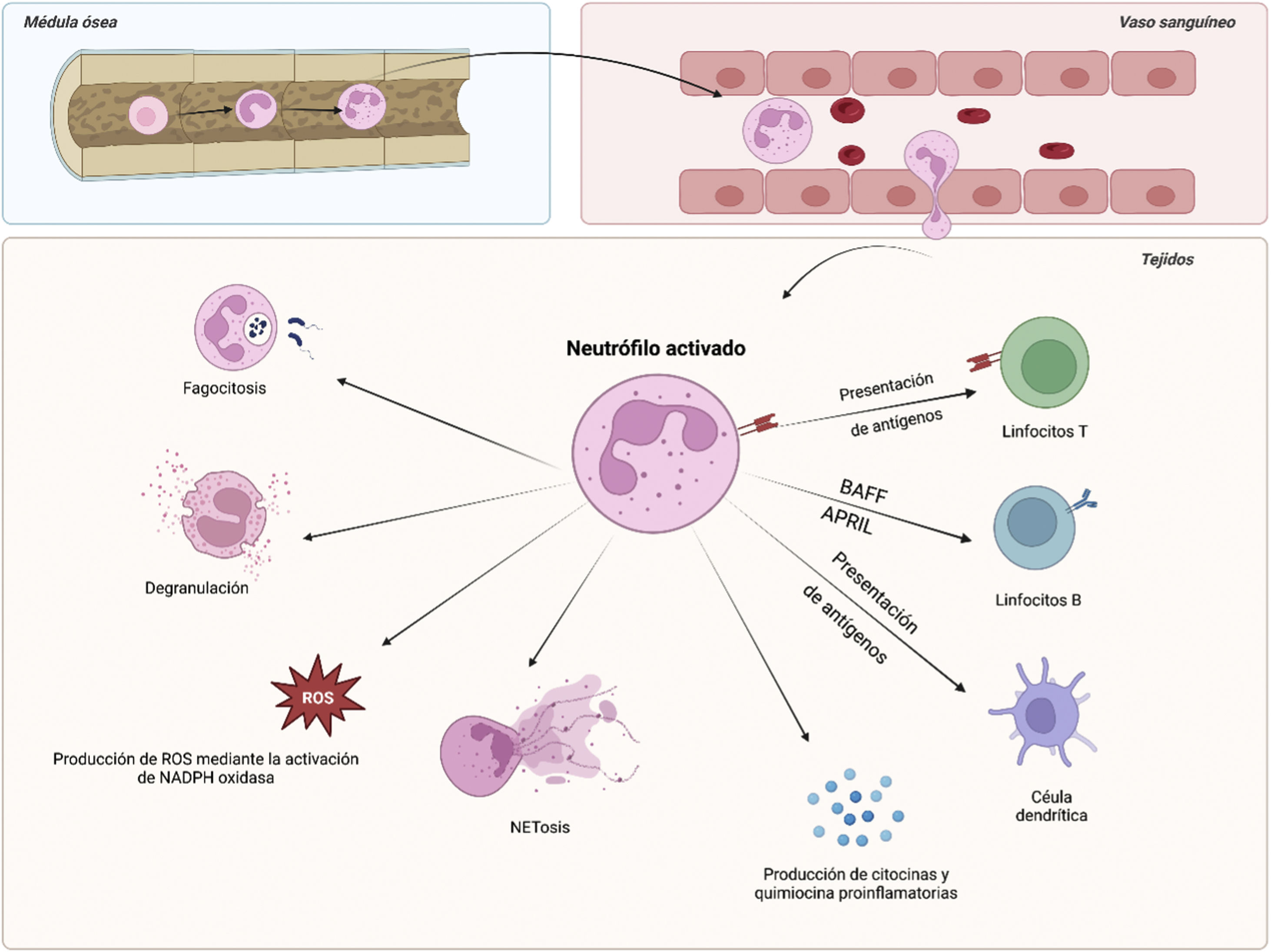
Neutrófilos: funciones fisiológicas en la respuesta inmuneLos neutrófilos son los leucocitos más abundantes en la circulación. Son células especializadas del sistema inmunitario innato que desempeñan un papel fundamental en la defensa del huésped contra los microorganismos. Los recientes avances tecnológicos han permitido constatar que los neutrófilos son mucho más versátiles y heterogéneos de lo que se creía. Ahora se reconoce que no solo son células efectoras contra patógenos invasivos, sino que desempeñan un papel activo orquestando el progreso de la inflamación mediante la regulación de las funciones de otras células del sistema inmunitario innato y adaptativo10.
Los neutrófilos son células que se originan en la médula ósea a partir de precursores mieloides residentes en respuesta al factor estimulante de colonias de granulocitos. Las moléculas de adhesión celular, como las integrinas y las selectinas, se consideran esenciales en el proceso de egresión de los neutrófilos de la médula ósea. En condiciones homeostáticas y en ausencia de estímulos inflamatorios, los neutrófilos maduros patrullan por el torrente sanguíneo, donde permanecen durante un periodo relativamente corto (6-12h) antes de morir. Durante este tiempo en circulación, contribuyen a diversas funciones fisiológicas como la angiogénesis, la coagulación y la reparación tisular11. Si el neutrófilo circulante encuentra una señal de peligro (microbios, metabolitos de patógenos, productos de daño tisular) se activa y responde principalmente a moléculas clasificadas como patrones moleculares asociados a patógenos o a patrones moleculares asociados a peligros a través de una variedad de receptores de reconocimiento de patrones, incluidos los receptores de tipo Toll (TLR). La interleucina 8 (IL-8) es la citocina que actúa como la principal quimiocina que señala la migración de neutrófilos hacia un entorno inflamatorio11.
Los neutrófilos «atacan a primera vista» y erradican rápidamente los patógenos invasivos mediante diversas estrategias. Estas incluyen la fagocitosis, la desgranulación (mediante la liberación de péptidos antimicrobianos granulares, como la mieloperoxidasa [MPO], la elastasa de neutrófilo [EN] y las metaloproteinasas de matriz) o la producción de ROS mediante la activación de la NADPH oxidasa12. También desempeñan un papel importante como reguladores de la respuesta inmunitaria adaptativa secretando una amplia gama de citocinas y quimiocinas que pueden regular la función de casi todas las demás células inmunitarias. Los neutrófilos activados aumentan la expresión de receptores de la membrana plasmática, como el complejo mayor de histocompatibilidad de clase II, lo que les permite presentar antígenos a las células T. Además, la captación de neutrófilos apoptóticos por las células dendríticas aumenta los niveles de presentación de antígenos7. En lo que respecta a las células B, los neutrófilos sintetizan citocinas cruciales para su desarrollo, como el factor activador de las células B o el ligando inductor de la proliferación A (fig. 1)7.
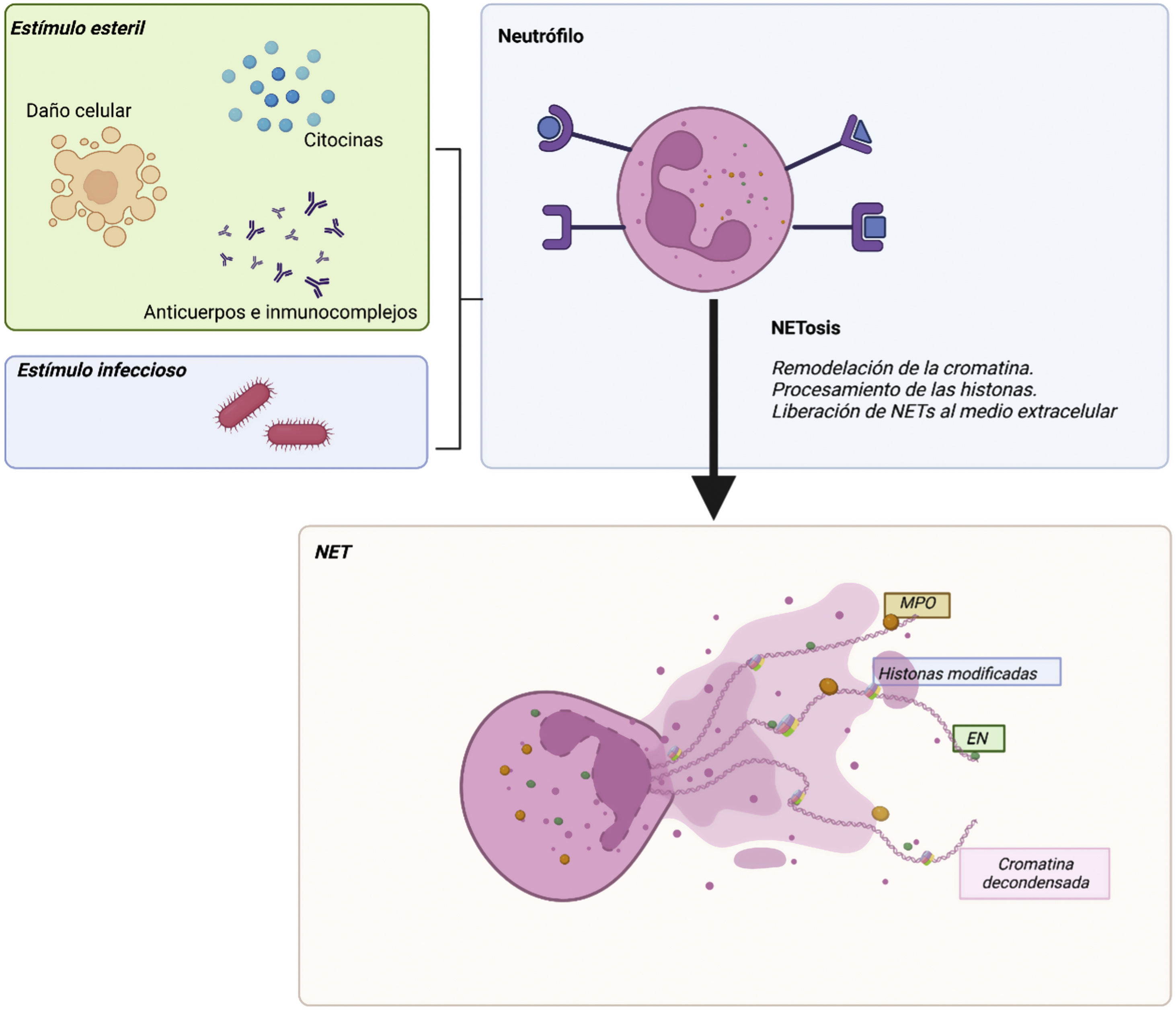
Trampas extracelulares de neutrófilos (NET)En 2004 se describió un nuevo mecanismo de acción de los neutrófilos: las trampas extracelulares de neutrófilos (NET)13. Las NET se definen como estructuras extracelulares que contienen ADN, histonas y proteínas de los neutrófilos como la MPO, la EN, la calprotectina o la calgranulina, expulsadas de los neutrófilos en respuesta a estímulos infecciosos o inflamatorios. Durante la formación de las NET, los neutrófilos sufren una remodelación de la cromatina mediante el procesamiento de las histonas por proteasas y la cromatina remodelada se une después a proteínas y enzimas antimicrobianas para, a continuación, ser liberada al medio extracelular y formar una red (fig. 2). Las NET se producen en zonas inflamatorias y tienen una vida media corta debido a la degradación por las DNasas locales10.
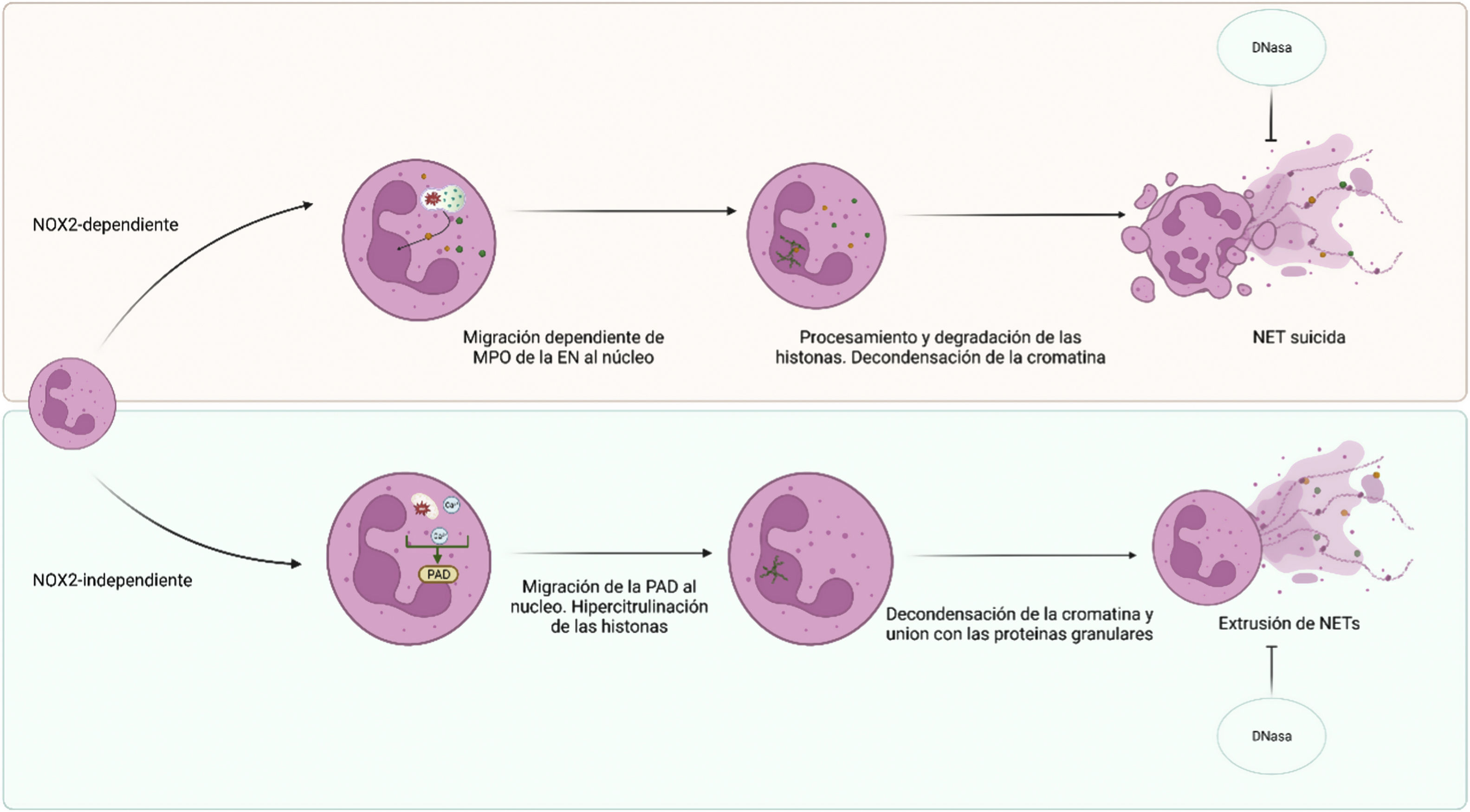
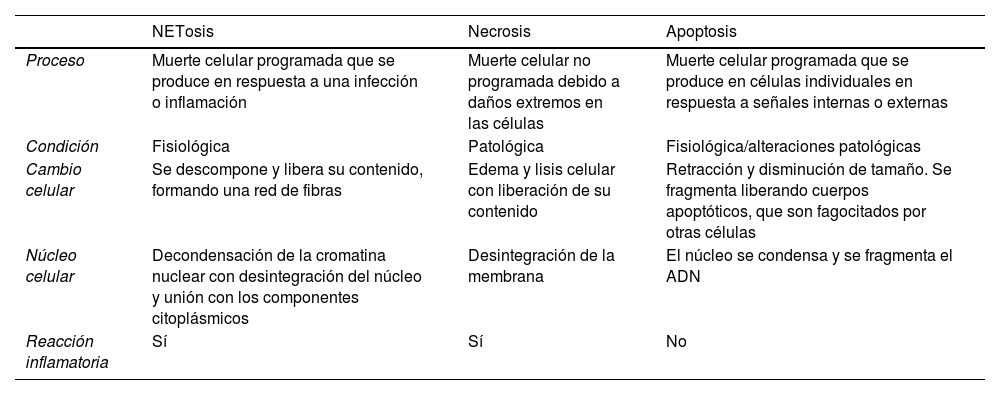
No están claros cuáles son los acontecimientos que conducen a la producción de NET en lugar de la fagocitosis, ni existe consenso sobre los mecanismos por los que se generan14. Se han descrito al menos 2métodos de decondensación de la cromatina que conducen a la formación de NET (NETosis): dependiente de NOX2 e independiente15 de NOX2. La NETosis dependiente de NOX2, también denominada NETosis suicida, se produce mediante la activación de NOX2 y la producción de ROS intrafagosomales. Esto provoca un aumento de la permeabilidad de la membrana intracelular, la NADPH oxiadaoxidasa estimula la MPO, que induce el desplazamiento de la EN al núcleo, donde se procesan y degradan histonas, lo que lleva a la decondensación de la cromatina y a la liberación de NET16. La NETosis suicida es, pues, un tipo de muerte celular diferente de la apoptosis y la necrosis. La necrosis se produce cuando las células sufren daños extremos y se produce una muerte celular no programada. Por otro lado, la apoptosis es un proceso de muerte celular programada que desempeña una función importante en la eliminación de células dañadas o potencialmente peligrosas. En cambio, la NETosis es un mecanismo de defensa que se activa como respuesta a la presencia de patógenos y otros estímulos inflamatorios (tabla 1)17,18.
Características diferenciales entre los 3tipos de muerte celular: NETosis, necrosis y apoptosis
| NETosis | Necrosis | Apoptosis | |
|---|---|---|---|
| Proceso | Muerte celular programada que se produce en respuesta a una infección o inflamación | Muerte celular no programada debido a daños extremos en las células | Muerte celular programada que se produce en células individuales en respuesta a señales internas o externas |
| Condición | Fisiológica | Patológica | Fisiológica/alteraciones patológicas |
| Cambio celular | Se descompone y libera su contenido, formando una red de fibras | Edema y lisis celular con liberación de su contenido | Retracción y disminución de tamaño. Se fragmenta liberando cuerpos apoptóticos, que son fagocitados por otras células |
| Núcleo celular | Decondensación de la cromatina nuclear con desintegración del núcleo y unión con los componentes citoplásmicos | Desintegración de la membrana | El núcleo se condensa y se fragmenta el ADN |
| Reacción inflamatoria | Sí | Sí | No |
La NETosis independiente de NOX2 no requiere la producción de ROS por NOX2. En este caso, las ROS mitocondriales se combinan con el aumento del nivel de calcio intracelular para activar las enzimas peptidil arginasa deiminasa (PAD) (por ejemplo, PAD4), lo que provoca la hipercitrulinación de las histonas, la decondensación de la cromatina y la liberación de NET10 (fig. 3).
Se ha descrito que varios agentes inflamatorios inducen la liberación de NET, como la IL-8, lipopolisacáridos, óxido nítrico o TNF-α10. Se cree que, en función del estímulo, el tipo de NETosis que se produce será diferente, así como sus funciones19.
Durante la fase de resolución de la inflamación, las NET son eliminadas una vez que han cumplido su función defensiva. Esta eliminación es mediada por células fagocíticas y otros mecanismos, que degradan y eliminan las estructuras del medio extracelular. Las señales que promueven la eliminación de las NET incluyen la producción de factores antiinflamatorios, como la IL-10 y la resolvina D1, y la activación de la vía del receptor de lipoproteína de baja densidad relacionado con la proteína 1 en las células fagocíticas, que promueve la fagocitosis y degradación de las NET. Las DNasas son enzimas que normalmente degradan el ADN liberado por células apoptóticas para prevenir la inflamación. También tienen un papel importante en la eliminación de las NET. En particular, la DNasa1, presente en los lisosomas de las células fagocíticas, que es capaz de degradar el ADN presente en las NET. La deficiencia de DNasas ha sido implicada en la acumulación de las NET en los tejidos y la perpetuación de la inflamación en enfermedades autoinmunes y otros trastornos inflamatorios crónicos20.
La persistencia de las NET y la falta de eliminación contribuyen a la cronicidad de la inflamación y la perpetuación de la enfermedad19. Por lo tanto, la regulación adecuada de la eliminación de las NET es esencial para mantener la homeostasis del sistema inmunitario y prevenir la cronicidad de la inflamación.
NET y autoinmunidadDurante años, las enfermedades autoinmunes sistémicas se asociaron principalmente a defectos en las respuestas inmunitarias adaptativas. No obstante, en las últimas 2décadas, diversos estudios han puesto de manifiesto el importante papel de células del sistema inmune innato, como los neutrófilos, en estas enfermedades21,22. En particular, se ha prestado especial atención a la formación de NET como estado de activación de los neutrófilos asociado a la autoinmunidad23.
Las NET son un mecanismo de defensa alternativo utilizado por los neutrófilos para capturar y, posiblemente, eliminar microbios, pero que también tienen un papel importante en la regulación de la respuesta inmunitaria y en el mantenimiento de la homeostasis del organismo13. La producción excesiva de NET y la activación inadecuada de las células inmunitarias pueden tener consecuencias negativas y contribuir a la patogenia de diferentes enfermedades inflamatorias inmunomediadas.
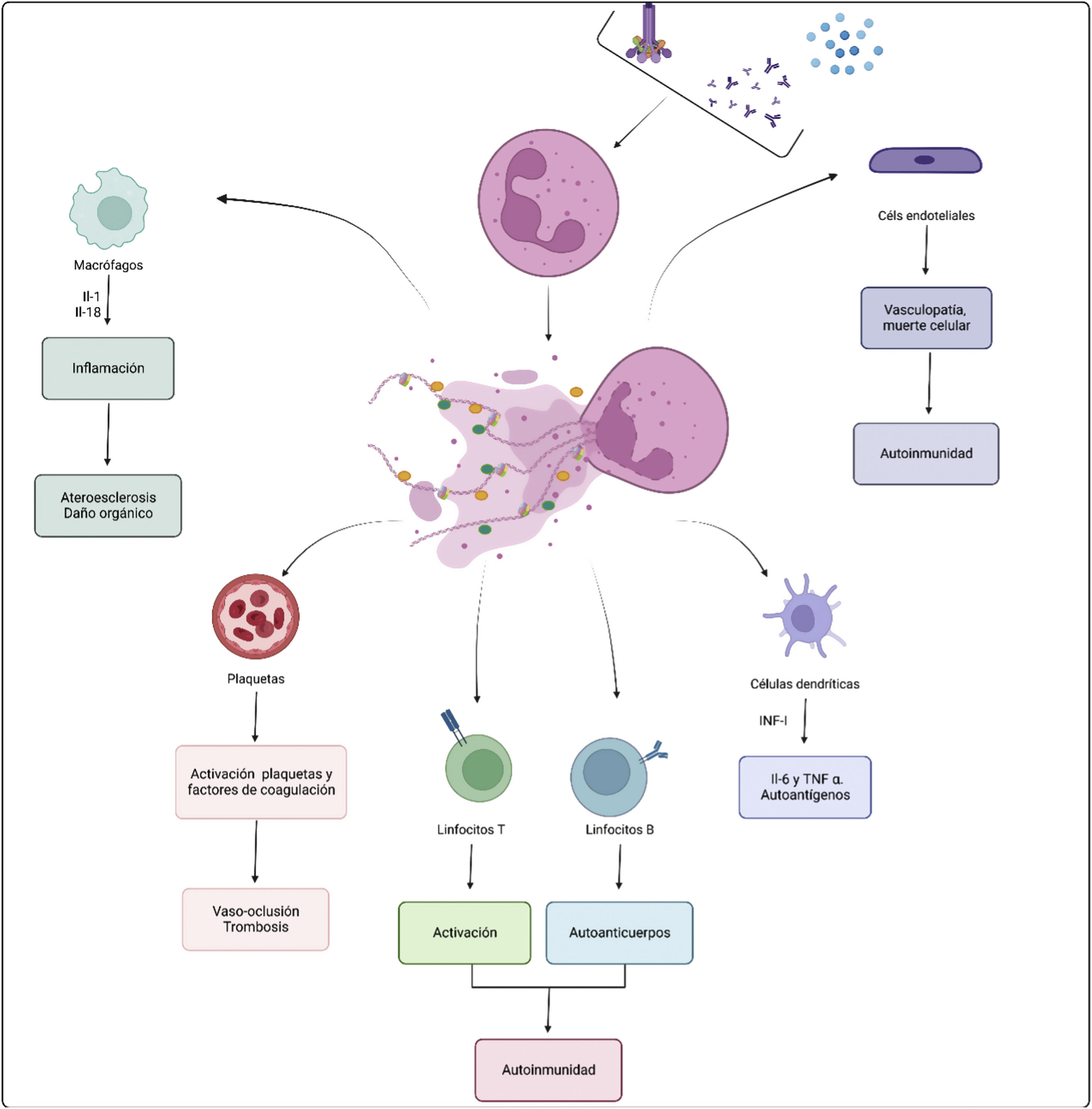
Las NET transportan proteínas inmunoestimuladoras que activan otras células inmunitarias y promueven la inducción de vías de señalización importantes para la respuesta inmune24. Contienen muchas moléculas liberadas por los neutrófilos, incluyendo autoantígenos, que son dianas conocidas de la autoinmunidad sistémica. Estos autoantígenos incluyen proteínas modificadas postraduccionalmente, como las histonas, que se han encontrado metiladas, acetiladas, carbamiladas y citrulinadas3,25; ADN de doble cadena, o proteínas como la MPO, proteinasa 3 (PR3) o EN10.
Los péptidos presentes en las NET estimulan la activación del inflamasoma NLRP3 en los macrófagos, lo que provoca la liberación de citocinas inflamatorias como IL-1 e IL-18, que promueven, a su vez, la activación de los neutrófilos y la formación de más NET. Además, son capaces de activar las células dendríticas plasmocitoides haciendo que sinteticen interferones de tipo I (IFN-I) y desencadenen la liberación de citocinas proinflamatorias, como la IL-6 y el TNF-α26,27. Por otro lado, se ha señalado que las NET promueven la polarización de las células T hacia un fenotipo proinflamatorio, lo que contribuye a inducir la respuesta inflamatoria sistémica20. Las proteínas unidas a NET, como las metaloproteinasas de matriz y las histonas, favorecen la vasculopatía al dañar las células endoteliales. Las NET, a su vez, promueven la expresión del factor tisular, que activa las plaquetas y los factores de coagulación, favoreciendo así la trombosis. Los autoanticuerpos, los complejos inmunes, los autoantígenos, los factores de activación del complemento y las citocinas pueden activar neutrófilos e inducir NETosis (fig. 4).
Relación entre NET y autoinmunidad. Las NET transportan proteínas inmunoestimuladoras que pueden activar otras células inmunitarias (macrófagos, células dendríticas, linfocitos); además, contienen autoantígenos que pueden desencadenar respuestas autoinmunes mediadas por autoanticuerpos. Por otro lado, las proteínas unidas a NET pueden dañar las células endoteliales y promover la trombosis. Los autoanticuerpos, los complejos inmunes, los autoantígenos, los factores de activación del complemento y las citocinas pueden activar neutrófilos e inducir NETosis.
Figura creada con Biorender.
La NETosis exacerbada se ha vinculado con varias enfermedades autoinmunes sistémicas, como la AR, el LES, las VAA, las MII y el SAF, así como con la formación de trombos en pacientes con enfermedades reumáticas28. En estas enfermedades, una combinación de factores que afectan a la activación de los neutrófilos, la formación y eliminación de NET y la producción de autoantígenos modificados contribuye a su desarrollo.
Se ha observado que en pacientes con LES existe un desequilibrio entre la formación y la eliminación de NET, lo que juega un importante papel en la perpetuación de la autoinmunidad, exacerbación de la enfermedad y manifestaciones orgánicas29. Muchas proteínas presentes en las NET también se correlacionan con la actividad de la enfermedad del LES y desempeñan un papel directo en el daño tisular3. En piel y glomérulos de pacientes con LES se ha detectado la presencia de NET10. Varios estudios han encontrado alteraciones en la actividad de las DNasas de estos pacientes30,31. La alteración en la degradación de las NET se considera que marca un paso temprano en la patogenia de la enfermedad y que es un factor clave en la rotura de la tolerancia inmunitaria normal32.
En las VAA también se ha observado una NETosis exacerbada, habiéndose encontrado en estos pacientes un aumento de los productos de los NET en la circulación33. Los pacientes con VAA producen autoanticuerpos contra proteínas localizadas en el citoplasma de los neutrófilos (ANCA), dirigidos principalmente contra la PR3 y la MPO34, moléculas presentes en las NET. Además, se ha descrito que la estimulación de neutrófilos con ANCA puede inducir la NETosis35.
En pacientes con MII se han encontrado mayores niveles de NET circulantes por un aumento de la NETosis y una degradación alterada, probablemente mediada por la presencia de anticuerpos séricos contra la DNasa136. Se ha señalado que la determinación de las NET en sangre podría ser útil para valorar la actividad de la miopatía, ya que se ha encontrado una asociación con manifestaciones y gravedad específicas de la enfermedad37,38. Además, estudios experimentales in vitro han encontrado que los anticuerpos específicos de la miositis, incluidos los anticuerpos contra MDA5, pueden inducir directamente la formación de NET39.
Otras de las enfermedades inmunomediadas relacionadas con la NETosis es el SAF. Los neutrófilos de los pacientes con SAF presentan un fenotipo inflamatorio que favorece la formación de trombos vasculares, lo que potencia la unión de los neutrófilos a las células endoteliales de la pared vascular40. La formación de NET en los vasos sanguíneos forma un andamiaje para la agregación plaquetaria y la acumulación de trombos, dañando aún más las células endoteliales y contribuyendo a la regulación al alza de las moléculas de adhesión28. Los pacientes con SAF presentan un nivel elevado de ADN libre de células y restos de NET en la circulación y en los tejidos afectados, debido a la capacidad del suero y los anticuerpos de pacientes con SAF para promover la formación de NET e inhibir la degradación de estas estructuras41.
En general, estas observaciones señalan que la desregulación de las vías de los neutrófilos y la formación de NET puede tener un papel patogénico en las enfermedades inmunomediadas, incluida la inducción de respuestas autoinmunes y daños tisulares durante la actividad de la enfermedad, por lo que la determinación de los productos derivados de la NETosis en sangre periférica podría tener utilidad. Sin embargo, es poca la evidencia actual y hacen falta más estudios al respecto.
Neutrófilos en la artritis reumatoideLa AR es una enfermedad autoinmune crónica, inflamatoria y sistémica caracterizada por inflamación, hiperplasia sinovial y destrucción del cartílago articular42. Por su carácter autoinmune sistémico, la AR presenta manifestaciones sistémicas, como trastornos vasculares o pulmonares43. Se han descrito 2familias de autoanticuerpos característicos de la AR: el factor reumatoide, un anticuerpo dirigido contra la porción Fc de la inmunoglobulina, y los anticuerpos antiproteínas/péptidos citrulinados (ACPA)7.
Los neutrófilos contribuyen a la inflamación y al daño tisular cuando son activados de forma inapropiada por citocinas, quimiocinas y autoanticuerpos44. En los últimos años ha aumentado la evidencia que describe a los neutrófilos como células críticas en la patogenia de la AR y ha resurgido en la última década el interés por el papel de estas células14. Así, modelos experimentales de AR han demostrado claramente que la depleción de neutrófilos o su inhibición funcional son capaces de disminuir la inflamación y el daño óseo19.
Se ha observado que los neutrófilos de pacientes con AR presentan una funcionalidad significativamente diferente a la de los de individuos sanos. Estas células se encuentran en un estado proinflamatorio predispuesto a la producción de ROS, a diferencia de los neutrófilos circulantes en individuos sanos. Además, se han identificado notables diferencias en la expresión de genes y proteínas entre los neutrófilos de sangre periférica de pacientes con AR y sus equivalentes en individuos sanos, incluyendo niveles más elevados de TNF y PR39.
Los neutrófilos activados se encuentran en grandes cantidades tanto en el líquido sinovial de la AR como en el pannus y tienen el potencial de causar daño en las articulaciones. Son las células predominantes en el líquido sinovial de pacientes con AR y secretan un repertorio de citocinas y quimiocinas, entre las que se incluyen el ligando de RANK (RANKL) y el BAAF (también conocido como BLyS), que están implicados en la activación de los osteoclastos y los linfocitos B, respectivamente14. Además, los neutrófilos del líquido sinovial de la AR expresan moléculas MHC de clase II y presentan el antígeno a los linfocitos T, una función inmunitaria que comparten con los macrófagos y las células dendríticas.
Las condiciones existentes en la articulación sinovial, como la hipoxia y la presencia de citocinas antiapoptóticas (como el TNF, el factor estimulante de colonias de macrófagos y el factor estimulante de colonias de granulocitos o la IL-8) así como los autoanticuerpos, aumentan la supervivencia de los neutrófilos hasta varios días9,45. Esta activación mantenida causa daño en el tejido del huésped mediante la liberación ROS y la degranulación de proteínas citotóxicas. En la AR, las proteínas de los gránulos de los neutrófilos se encuentran en concentraciones elevadas en el líquido sinovial y son causantes del daño al cartílago y al tejido, de la activación de citocinas y receptores solubles, la inhibición de la proliferación de condrocitos y la activación de la proliferación e invasión de sinoviocitos. Es importante destacar que estas proteínas actuan sinérgicamente para perpetuar la inflamación y el daño en la articulación en la AR9.
Los neutrófilos activados también secretan S100A9/S100A8 (calprotectina), una proteína miembro de la familia de proteínas S100 que desempeña un papel importante en el desarrollo de la cascada inflamatoria en la AR como desencadenante de la quimiotaxis, migración de fagocitos y la modulación de diversas funciones de los macrófagos. Actúa como un importante factor proinflamatorio de la inmunidad innata, como patrones moleculares asociados a peligros endógenos a través de la activación de TLR4, por cuya vía también pueden inducir NETosis46. Es bien conocido y estudiado el papel de la calprotectina como biomarcador de actividad de la AR y como marcador pronóstico de progresión radiológica y de respuesta terapéutica a determinada terapia antirreumática dirigida (FAMEd)47-52.
NET en la artritis reumatoideEn los últimos años ha habido un creciente interés en el papel de las NET y la NETosis en la AR. Se cree que estas estructuras podrían tener un papel inflamatorio en la enfermedad, tanto de forma local en la articulación como en otros tejidos53, y estar implicadas en el inicio y perpetuación de la enfermedad a través de la exposición a autoantígenos53-55. Se ha visto que los neutrófilos obtenidos de pacientes con AR presentan una mayor formación de NET de manera espontánea y que esto se correlaciona con los niveles de ACPA53,56.
Uno de los principales factores que predispone a la NETosis exacerbada es el medio proinflamatorio que se encuentra presente en los tejidos afectados por la AR. Este ambiente inflamatorio generado por diferentes células, como los fibroblastos sinoviales (FLS), las células dendríticas y los macrófagos, que liberan citocinas proinflamatorias como el TNF-α, IL-1β e interferón-γ (IFN-γ), activan los neutrófilos y promueven su migración hacia las articulaciones inflamadas. Una vez allí, los neutrófilos son sometidos a una estimulación continua por parte del ambiente proinflamatorio, lo que desencadena la liberación de NET. Se ha visto como la exposición de neutrófilos a sueros de pacientes con AR, especialmente las muestras con niveles elevados de ACPA y factor reumatoide, así como a las citocinas inflamatorias IL-17A y TNF, inducen la formación de NET en neutrófilos aislados de pacientes con AR. Además, los neutrófilos de los pacientes con AR presentan una mayor susceptibilidad a la formación de NET en comparación con los neutrófilos de personas sanas al ser estimulados53.
Los ACPA son muy específicos de la AR y se unen a diferentes proteínas, como la vimentina modificada, histonas, fibrinógeno y α-enolasa. Estos anticuerpos son de varios subtipos y forman complejos inmunes patogénicos en las articulaciones, en las que favorecen la inflamación y la erosión ósea57. Los neutrófilos son una fuente importante de antígenos citrulinados, ya que producen enzimas, como PAD4, que catalizan la modificación de arginina a citrulina. Los estudios experimentales han demostrado que la citrulinación de las histonas a través de PAD4 es un paso esencial en la descondensación de la cromatina durante la formación de NET58.
Las enzimas PAD están presentes en las NET en forma activa y son detectables en la sinovial reumatoide. En presencia de calcio, modifican proteínas en el espacio extracelular, además de sus dianas intracelulares, creando así epítopos adicionales para la generación de ACPA24. En la membrana sinovial, los productos de las NET, incluidas las proteínas citrulinadas, pueden ser internalizados por FLS, que aumentan expresión de las moléculas MHC de clase II y presentan péptidos derivados de NET a las células T CD4+, creando un vínculo con la respuesta inmunitaria adaptativa en la AR59. De hecho, la administración intraarticular de FLS cargados con NET a ratones humanizados conduce a la inducción de respuestas de células T antígeno-específicas, generación de ACPA y daño articular60, lo que apoya la idea de que la interacción entre FLS y NET in vivo tiene consecuencias patogénicas. Además, la EN derivada de NET altera la estructura del cartílago y promueve su citrulinación, lo que puede provocar inflamación sinovial al aumentar su inmunogenicidad y la producción de autoanticuerpos61.
Las NET también se han descrito como importante fuente de proteínas carbamiladas en los pacientes con AR62. Los anticuerpos contra proteínas carbamiladas (anti-CarP) son frecuentes en pacientes con AR y se asocian a un aumento de la destrucción articular, mortalidad y enfermedad pulmonar intersticial63,64. Estos anticuerpos forman complejos inmunes que activan la resorción ósea por los osteoclastos, lo que indica una relación causal con el daño óseo en la AR25. Recientemente, en un estudio llevado a cabo en ratones HLA-DRB1*04:01, se demostró que la administración de NET con proteínas carbamiladas estimulaba la rápida diferenciación de monocitos a osteoclastos, mediada por la señalización del TLR4 y proteínas asociadas a las NET, incluyendo histonas y EN. Además, se encontró que las histonas carbamiladas aumentaban el número de osteoclastos y se correlacionaban con la resorción ósea activa y los marcadores inflamatorios en el plasma y el líquido sinovial. Estos resultados también indican que las NET desempeñan un papel directo en la erosión ósea asociada a la AR65.
En definitiva, los neutrófilos parecen tener un papel inflamatorio central en la AR, tanto en la articulación como, probablemente, también en otros tejidos. Es posible que desempeñen un papel en el inicio y perpetuación de la exposición a antígenos mediante la formación de NET, ya que estas estructuras son una fuente importante de autoantígenos modificados que pueden promover respuestas proinflamatorias, así como una inmunidad adaptativa patógena.
Determinación de las NET en la artritis reumatoideCómo se determinan las NETLa capacidad de detectar NET podría ser un potencial biomarcador complementario para pacientes con enfermedades que presentan una mayor tasa de formación de NET, como la AR. No hay forma estandarizada para la determinación de las NET. Pueden detectarse en fluidos como la sangre o el esputo66.
Es difícil identificar y cuantificar las NET en sangre periférica debido a su corta vida útil como consecuencia de la degradación por las DNasas locales. La técnica más utilizada para la determinación de NET en plasma es su detección indirecta, con productos derivados de las NET, como el ADN libre circulante, o complejos ADN-productos derivados de las NET como histonas citrulinadas (como citH3), NE y MPO66,67. La técnica más utilizada para la determinación de las NET en sangre periférica es el ensayo inmunoenzimático (ELISA) tipo «sándwich»67. Este método implica utilizar anticuerpos específicos para detectar los niveles de proteínas asociadas con las NET. Además, los ensayos de ELISA son prácticos para la detección de NET en grandes cohortes de pacientes y muestras clínicas, pues permiten el estudio de varios pacientes a la vez13,26,68,69.
La evidencia disponible indica que la detección cuantitativa de los productos derivados de NET podría ser una herramienta complementaria útil para identificar a los individuos con AR y para monitorizar a los pacientes70. Sin embargo, para que los NET sirvan como herramientas de cribado, es necesario realizar estudios que normalicen y definan los niveles normales y los patológicos.
Valor diagnóstico de la determinación de NET en sangre periféricaRecientemente, algunos estudios se han centrado en la detección de las posibles vías de señalización que conducen al aumento de la formación de NET en la AR. Con ello se pretende determinar si los productos de la formación de NET son útiles para el diagnóstico54. Los niveles de productos de degradación de las NET, como el ADN libre circulante, nucleosomas libres, complejos ADN-EN y complejos MPO-ADN, están aumentados en la sangre periférica de los pacientes con AR71.
Estudios in vitro muestran que en la AR existe un aumento espontáneo en la formación de NET72. La determinación de productos derivados de las NET en sangre periférica, como nucleosomas libres o los complejos ADN-MPO, muestran un alto valor para el diagnóstico de la AR, con alta sensibilidad y especificidad56,72. El nivel sérico de anticuerpos anti-NET (ANETA) es significativamente mayor en la AR, en especial en pacientes con factor reumatoide positivo73.
La detección cuantitativa de los productos derivados de NET podría ser una herramienta complementaria útil para identificar a los individuos en riesgo y para monitorizar a los pacientes con AR. Varios estudios experimentales han encontrado que los niveles en sangre periférica de NET están más elevados en la AR que en controles sanos56,71,74-76, por lo que se considera que podrían tener cierto valor diagnóstico complementario en casos sospechosos de AR71.
NET como marcadores de actividad de la enfermedadLa búsqueda de biomarcadores séricos de actividad inflamatoria en pacientes con AR es un área de especial interés y objeto de múltiples investigaciones en los últimos años. Los reactantes de fase aguda clásicos (PCR y VSG) no siempre reflejan el grado de sinovitis activa en los pacientes con AR y se ven influidos por diversas causas77. Los marcadores de actividad de los neutrófilos podrían ser de utilidad como biomarcadores que reflejen de manera más exacta el estado de la enfermedad en los pacientes con AR.
La calprotectina (S100A8/S100A9) es una proteína con actividad inflamatoria que se expresa principalmente en los neutrófilos y es liberada al medio extracelular en respuesta a estímulos inflamatorios78. Está presente en grandes cantidades en la sinovial reumatoide79. Puede determinarse en el plasma y el suero, y se correlaciona estrechamente con la actividad inflamatoria en la AR. La calprotectina parece reflejar de forma más exacta el estado clínico del paciente, incluyendo la remisión clínica o la baja actividad de la enfermedad51,52,80. Es, además, un biomarcador pronóstico de progresión radiológica80, un marcador de respuesta terapéutica a determinados FAME dirigidos81 y es útil para predecir un brote de la enfermedad82. La calprotectina reflejaría de forma más exacta que la PCR el estado inflamatorio (medido como grado de sinovitis) de los pacientes con AR tratados con tocilizumab (TCZ) o inhibidores de JAK49,50.
La medición de los NET como marcador de actividad de los neutrófilos con utilidad como posible marcador de actividad de la AR ha surgido como una tendencia emergente en la investigación. Se ha realizado una revisión de la literatura sobre la relación entre NET y actividad de la AR (Appendix A). En la tabla 2 se presentan los diferentes estudios en los que se analiza la utilidad de la medición de NET y NETosis en sangre periférica como marcador de actividad de la enfermedad en pacientes con AR.
Resumen de artículos incluidos en la revisión
| Diseño | Método de estudio NET/NETosis en sangre periférica | Resultados (NET y actividad AR) | Notas | |
|---|---|---|---|---|
| Oliveira et al.74 | Estudio transversal retrospectivo con 164 pacientes con AR y 76 controles sanos | ELISA complejo anti-ADN/MPO (Quant-iT™ PicoGreen® dsDNA Assay Kit [Invitrogen, Carlsbad, EE. UU.]). Concentración de NET en plasma | Pacientes con alta actividad de la enfermedad presentan concentraciones de NET en plasma más elevados en comparación con individuos con baja actividad. Sin diferencia estadísticamente significativa entre moderada y alta o moderada y baja | Estudio que valora la enfermedad periodontal. Las concentraciones de NET también están directamente asociadas con los parámetros clínicos periodontales |
| Luque-Tévar et al.75 | Estudio prospectivo con 104 pacientes con AR y 29 controles sanos.Los pacientes con AR eran pacientes con fallo a FAME convencional, sin uso previo de anti-TNF y que iban a iniciar tratamiento con anti-TNF.Se hacía valoración antes y a los 3 y 6 meses de inicio | ELISA PLUS (Roche, Sigma-Aldrich, St Louis, EE. UU.) en suero utilizando anticuerpos monoclonales frente a ADN de doble cadena o histonas.IF ELISA complejo anti-ADN/EN (HumanPMN Elastase ELISA Kit (Abcam, Cambridge, Reino Unido) en suero | Ambos remanentes de NET presentaron correlación con los parámetros clínicos, inflamatorios y de estrés oxidativo en pacientes con AR. Los pacientes que responden al tratamiento con anti-TNF presentan una reducción mayor en los parámetros en estudio (incluidos NETosis). Correlación positiva entre los cambios en los parámetros moleculares y la mejora en la actividad medida por DAS28 | |
| Wang et al.84 | Estudio prospectivo con 74 pacientes con AR y 50 controles sanos AR | ELISA complejos ADN/MPO en suero (PicoGreen dsDNA Quantitation Kit (American Invitrogen) | Sin correlación entre la reducción los niveles de NET y el DAS28 | Estudio que valora la acupuntura como terapia adyuvante para el tratamiento de la AR (asociado a FAME convencional) |
| Bach et al76. | Estudio multicéntrico con 2 partes: transversal: 2 cohortes de AR y grupo control sanos; longitudinal: 205 AR con seguimiento medio de 8 años. Grupo control de sanos | ELISA complejo anti-ADN/MPO (miden absorbancia con BioTEK). En plasma | Sin asociación entre los NET en plasma y la actividad de la AR. En los seropositivos, sí que tenía una sensibilidad de 68,6 y especificidad de 75% para diferenciar remisión de actividad. La PCR no, con lo que concluyen que podría tener un papel para control de la actividad, sobre todo en los seropositivos | |
| Wang et al.56 | Estudio transversal con 74 pacientes con AR y 50 controles sanos | ELISA complejo anti-ADN/MPO en suero | Sin asociación con los parámetros de actividad clínicos ni laboratorio | |
| Kaneko et al.62 | Estudio retrospectivo de casos y controles con 40 pacientes con AR y peridontitis; 30 pacientes con peridontitis y 43 controles sanos | ELISA complejo anti-AND/MPO (Cell Biolabs Laboratories, INC. San Diego, EE. UU.). Suero | Correlación significativamente positiva entre los NET y el DAS28-PCR | Estudio que valora la enfermedad periodontal. Las concentraciones de NET también están directamente asociadas con los parámetros clínicos periodontales. Estudio que por primera vez muestra que los niveles circulantes de CarP y NET se asocian con la gravedad de la periodontitis y se ven influidos por el tratamiento periodontal en pacientes con AR |
| Pérez-Sánchez et al.71 | Estudio con 2partes: transversal de 106 pacientes con AR y 40 controles sanos; prospectivo: 2 cohortes de AR tratadas con tocilizumab o con infliximab, seguidas durante 6 meses | ELISA cuantificación de nuleosomas libres en suero ELISA PLUS (Roche Diagnostics, Basel, Suiza) utilizando anticuerpos monoclonales frente a ADN de doble cadena o histonas | Pacientes sin biológico: NET son más altos si enfermedad activa. Curvas ROC muestran que sirven para identificar a pacientes activos.Relación directa entre los niveles de nucleosomas libres de células y los parámetros clínicos, inflamatorios (PCR y VSG), actividad (DAS28) y de estrés oxidativo. Anti-TNFa y anti-IL-6R disminuyeron la NETosis y redujeron su perfil inflamatorio | |
| Ruiz-Limón et al.85 | Estudio prospectivo.20 pacientes con AR activa y fallo a FAME convencional, que iban a iniciar tratamiento biológico con tocilizumab | ELISA cuantificación de nucleosomas libres mediante ELISA PLUS (Roche Diagnostics, Basel, Suiza) utilizando anticuerpos monoclonales frente a ADN de doble cadena o histonas | Liberación disminuida de nucleosomas libres de células en el suero de pacientes con AR después del tratamiento con tocilizumab | Primer estudio que evalúa el efecto directo de la tocilizumab sobre monocitos y neutrófilos de pacientes con AR |
| Fagerhol et al.83 | Estudio transversal; 100 pacientes con mieloma múltiple; 8 pacientes con AR | IF ELISA híbrido dual en plasma:complejos anti-calprotectina/S100A12 y anti-calprotectina/histona | Correlación positiva entre PCR y NET en pacientes con AR |
anti-ADN/EN: complejos anti-DNA/elastasa de neutrófilos; anti-ADN/MPO: complejos anti-ADN/mieloperoxidasa; AR: artritis reumatoide; CARP: anticuerpos antiproteínas carbamiladas; DAS28: disease activity score (índice de actividad de la enfermedad); FAME: fármaco modificador de enfermedad; NET: trampas extracelulares de neutrófilos; PCR: proteína C reactiva; VSG: velocidad de sedimentación globular.
Se han llevado a cabo varios estudios para evaluar si las NET pueden ser utilizadas como un marcador de actividad de la enfermedad en pacientes con AR y se han encontrado resultados contradictorios. En algunos trabajos han encontrado relación entre los niveles de restos de NET en sangre periférica y actividad de la enfermedad62,71,74,75, mientras que en otros esta asociación no ha quedado confirmada56,83,84.
Pérez-Sánchez et al. analizaron en sangre periférica NET (ELISA nucleosomas y EN y MPO) en 106 pacientes con AR y observaron como los complejos derivados de las NET estaban fuertemente correlacionados con la actividad clínica de la enfermedad (medida por DAS28 y con los reactantes de fase aguda, tanto PCR como VSG), además de correlacionarse con los marcadores de estrés oxidativo. Mediante análisis de curvas ROC, la concentración de las NET permitió identificar pacientes con AR activa71. En otro estudio, utilizando también la determinación de nucleosomas por ELISA y anticuerpos monoclonales frente a nucleosomas, además de complejos anti-ADN/EN, se observó una correlación positiva con parámetros de actividad75. En otros 2estudios en los que se utilizó la determinación del complejo anti-ADN/MPO para estudiar los NET en pacientes con AR y enfermedad peridontal, encontraron una asociación entre los niveles de las NET y los índices compuestos de actividad de la AR DAS28 VSG74 y DAS28 PCR, aunque era solo moderada62.
No obstante, hay otros grupos que describen resultados negativos. En 2016, Fagerhol et al. publicaron un estudio innovador en el que se evaluó el uso de un nuevo método híbrido de ELISA para detectar complejos anticalprotectina/S100A12 y anticalprotectina/histona (productos derivados de los NET) en pacientes con 2enfermedades inflamatorias: AR y mieloma múltiple83. Este estudio incluyó solo a 8 pacientes con AR. Encontraron una correlación positiva moderada entre los niveles de remanentes de las NET y PCR únicamente. Sin embargo, no encontraron relación con ningún otro parámetro de actividad, ni clínico ni de laboratorio83. En un estudio transversal con 74 pacientes con AR y 50 controles sanos que evaluó la relación entre los niveles de remanente de NET en suero (midiendo el complejo anti-ADN/MPO por ELISA) y diferentes índices de actividad en pacientes con AR no se observó correlación con la actividad de la enfermedad56. En un estudio en población china tampoco se encontró asociación entre los niveles de NET y la actividad de la AR84.
NET y respuesta terapéuticaEn 2016, Ruiz-Limón et al. diseñaron un estudio para valorar el efecto del TCZ sobre los factores protrombóticos de la AR. Uno de los parámetros estudiados fueron las NET. Incluyeron a 20 pacientes con AR activa que no habían recibido nunca FAME biológico, a los que se les indicó tratamiento con TCZ durante 6 meses. Se determinó la concentración sérica de los nucleosomas utilizando un ELISA frente a nucleosomas en suero. Encontraron mejoría en la actividad de la AR tras el inicio del tratamiento con TCZ y que esto se relacionaba con una reducción de las NET. Este resultado coincidía con lo observado en los estudios in vitro. Al exponer a TCZ a los neutrófilos aislados de los pacientes antes del inicio del tratamiento biológico, se confirmó la especificidad de los efectos de esta terapia sobre la reducción de la NETosis de los neutrófilos. Este fue el primer estudio que evaluó el efecto directo de TCZ sobre neutrófilos y NET de pacientes con AR85.
En un trabajo posterior se utilizaron las NET para evaluar los efectos de fármacos biológicos como los anti-TNF (infliximab) y antirreceptor de la IL-6 (TCZ) en la formación de NET71. Estudiaron a 106 pacientes con AR. Encontraron que ambos fármacos biológicos causaban un efecto significativo en la inhibición de NETosis (con una menor concentración de derivados de las NET en sangre periférica) con una reducción paralela de la actividad inflamatoria, así como como de la expresión de mediadores inflamatorios clave después de 6meses de tratamiento. Estos resultados estaban en concordancia con los experimentos in vitro, en los que encontraron que la exposición de los neutrófilos de controles sanos y de pacientes con AR a plasma de pacientes con AR promovía un aumento significativo en la extrusión de fibras de ADN y que esto podía ser prevenido con la exposición a infliximab y TCZ71.
Un estudio publicado en el año 2020 proponía un modelo integrativo de valoración de la enfermedad de acuerdo con cambios en parámetros serológicos relacionados con la inflamación, la NETosis, el estrés oxidativo y los micro-ARN después de tratamiento con anti-TNF. Los pacientes que respondían al tratamiento anti-TNF presentaban una reducción en los parámetros inflamatorios, incluida la concentración de las NET (determinando los complejos anti-ADN/EN y nucleosomas)75.
Así pues, los productos derivados de las NET podrían tener un papel en la valoración de la eficacia terapéutica en pacientes con AR.
NET y periodontitisLa asociación entre la AR y la enfermedad periodontal ha sido el centro de numerosas investigaciones debido a sus características patológicas comunes86. Las NET son un mecanismo antimicrobiano que podría tener su papel en la patogenia de la gingivitis y la periodontitis87. Existen ciertas evidencias de una conexión entre las NET, la enfermedad periodontal y la AR88.
En 2018 Kaneko et al. mostraron que la concentración del complejo anti-ADN/MPO (producto derivado de las NET) en sangre periférica se asociaba con la gravedad de la periodontitis y de la AR. Encontraron una correlación positiva, aunque moderada, entre los productos derivados de las NET y la actividad de la AR medida por DAS28 PCR. El tratamiento de la periodontitis condicionó una reducción de los niveles de las NET y de la actividad de la AR medido por DAS28 PCR. Estas diferencias fueron estadísticamente significativas, aunque clínicamente poco relevantes. Cabe destacar que este es el primer estudio que relaciona niveles de anticuerpos anticarbamilados con NET y enfermedad periodontal en pacientes con AR61.
En un estudio transversal reciente72 en 164 pacientes con AR, se encontró que las concentraciones de las NET en plasma se correlacionaban con los parámetros clínicos de la enfermedad periodontal y con los de la actividad de la AR. El tratamiento periodontal no quirúrgico demostró que era eficaz en la reducción de las NET en plasma, coincidiendo con la mejora los parámetros clínicos de estas enfermedades.
LimitacionesHay varias limitaciones a la hora de comparar estudios sobre NET como marcador de actividad de la AR.
En primer lugar, la variedad de los métodos de medición utilizados en los diferentes estudios. Aunque existen recomendaciones, no contamos con un método estandarizado para la medición de las NET, por lo que no hay una homogeneidad en los trabajos de investigación, lo que dificulta su comparación. Por otra parte, el estudio en sangre periférica de la NETosis con la cuantificación de los restos de NET utilizando diferentes complejos proteicos es compleja y no deja de ser una valoración indirecta del proceso. Además, los complejos proteicos utilizados para medir los restos de NET pueden no ser específicos de los productos de la NETosis, lo que puede dar lugar a falsos positivos o negativos.
También hay que tener en cuenta que los neutrófilos son células altamente activas y sensibles a estímulos externos y que la manipulación de la sangre periférica durante la obtención y procesamiento de la muestra puede desencadenar su activación y la generación de NET. La generación espontánea de NET durante la obtención y procesamiento de la muestra resultará en una sobrestimación de los niveles de NET en la sangre periférica y, por tanto, en una interpretación errónea de los resultados. Por ello, es importante tomar medidas para minimizar la generación espontánea de NET durante la obtención y procesamiento de la muestra.
Otra de las limitaciones es el pequeño tamaño muestral de algunos estudios, lo que limita la capacidad de generalizar los resultados a la población. Varios son estudios exploratorios. Además, las poblaciones de pacientes incluidas en los trabajos eran diferentes: en el tipo de AR, el tiempo de evolución y la gravedad de la enfermedad, el tratamiento previo, entre otros, lo que puede afectar los resultados. Faltan estudios en poblaciones específicas, con especial atención, en nuestra opinión, a los tratamientos recibidos por los pacientes. En vista de los resultados observados creemos que los fármacos biológicos juegan un papel relevante en la NETosis.
Por otro lado, faltan estudios longitudinales. La mayoría de los estudios son transversales, por lo que no permiten seguir la evolución de la enfermedad a largo plazo ni establecer una relación causa-efecto entre los niveles de NET y la actividad de la enfermedad.
ConclusionesAlgunos estudios de los últimos años indican que la inmunidad innata y, especialmente los neutrófilos, desempeñarían un papel importante en la patogenia de la AR y otras enfermedades inmunomediadas. Recientes investigaciones ponen de manifiesto que el proceso de NETosis y la formación de las NET podría ser una vía que estaría involucrada no solo en la defensa a agentes patógenos sino también como responsable de la exposición a proteínas autoantigénicas con un papel relevante en el desarrollo de la autoinmunidad, así como en la perpetuación del proceso inflamatorio. Sin embargo, son necesarios más estudios para poder afirmar que las NET juegan un papel principal en la patogenia de la enfermedad y que no son solo un hallazgo secundario asociado al proceso inflamatorio. El papel de la determinación de NET en la monitorización de la actividad de la enfermedad y el efecto de las distintas terapias antirreumáticas está por determinar. El papel de los neutrófilos, y más específicamente del proceso de NETosis, va a seguir siendo un área de creciente interés en la investigación de las enfermedades reumáticas en los próximos años.
FinanciaciónLa presente revisión no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Mercedes Guerra Rodríguez, documentalista de la Sociedad Española de Reumatología, por la ayuda en la búsqueda bibliográfica.