El presente artículo muestra la evidencia y recomendaciones de la eficacia y seguridad de las terapias hasta hoy aprobadas y disponibles en México para el tratamiento de la osteoporosis en su etapa severa o establecida, con la finalidad de establecer una postura terapéutica acerca de la eficacia y seguridad para esta etapa del padecimiento, de acuerdo con las cédulas descriptivas del Cuadro Básico y Catálogo de Medicamentos del Sector Salud en México.
MétodosSe realizó una revisión sistemática y narrativa de la evidencia de teriparatida y denosumab, desde su perfil farmacológico, efectividad y seguridad derivado de ensayos clínicos, además de un análisis de las recomendaciones generales de las principales guías de práctica clínica nacionales e internacionales.
ResultadosLa evidencia establece que teriparatida y denosumab pertenecen a clases terapéuticas distintas, con mecanismos de acción biológicamente opuestos e indicaciones de uso claramente diferenciadas en sus respectivas cédulas, por lo cual no son sustituibles ni intercambiables en la terapia de osteoporosis severa. Ambas representan la mejor opción disponible hasta el momento para esta etapa del padecimiento. Son similares en su eficacia de prevención de nuevas fracturas vertebrales por fragilidad, con un RR de 0,35 (IC 95%: 0,22-0,55) para teriparatida, y de 0,32 (IC 95%: 0,26-0,41) para denosumab. La reducción absoluta del riesgo es mayor con teriparatida 9,3% (21 meses) que con denosumab 4,8% (36 meses).
ConclusionesNuestros resultados concuerdan con las recomendaciones disponibles en las principales guías de práctica clínica nacionales e internacionales, por lo que son propuestas ambas terapias como consecutivas y nunca como sustitutivas.
This article presents evidence and recommendations regarding the efficacy and safety of the approved and available therapies in Mexico to treat severe or established osteoporosis with the aim of developing a position regarding therapeutics in this stage of the disease, according to the descriptive cards of the National Drug Formulary of the National General Health Council of Mexico.
MethodsWe performed a systematic and narrative review of the evidence of teriparatide and denosumab, from their pharmacological profile, effectiveness, and safety derived from clinical trials, as well as an analysis of the general recommendations of the national and international clinical practice guidelines.
ResultsThe evidence establishes that teriparatide and denosumab belong to different therapeutic classes, with biologically opposed mechanisms of action and indications of use, which are clearly differentiated in their respective national codes, therefore these drugs cannot be substitutable or interchangeable in severe osteoporosis therapy. Both represent the best options currently available for this stage of the disease; being similar in their efficacy in preventing new vertebral fragility fractures, with an RR of .35 (CI 95%; .22-.55) for teriparatide, and .32 (CI 95%: .26-.41) for denosumab. The absolute risk reduction is higher with teriparatide 9.3% (21 months) compared with denosumab at 4.8% (36 months).
ConclusionsOur results agree with the recommendations available in national and international clinical practice guidelines, with both therapies proposed as a sequential, but not a substitute, treatment.
Actualmente la osteoporosis (OP) representa un problema de salud pública, debido a la ocurrencia de fracturas y deterioro de la calidad de vida en pacientes alrededor del mundo1,2. Una de sus etapas más graves es la OP severa o establecida, la cual es definida por la Organización Mundial de la Salud como la presencia de una fractura previa y valores de densitometría ósea (DMO) iguales o menores a −2,5 DE con respecto a la media, analizados con DXA3. La prevalencia de OP y fracturas aumenta con la edad: 20% en población de 50-59 años; 46% en población de 60-69 años; 59% en población de 70-79 años y 69% en población > 80 años4. Las fracturas vertebrales y de cadera ejercen una mayor influencia sobre las tasas de mortalidad5,6. Mundialmente el impacto económico de estas fracturas es importante7. En México durante el 2010 el costo directo ocasionado por las más de 75.000 fracturas por fragilidad fue estimado en 256,2 millones de dólares y se prevé un crecimiento real del 41,7% en dicho rubro para el año 20208.
Existen 2enfoques farmacológicos para el tratamiento de pacientes con OP dirigidos a la reducción del riesgo de fractura9: el tratamiento anabólico, que estimula la formación de hueso, y el tratamiento antirresortivo, que disminuye la resorción ósea10,11. Dentro de las opciones terapéuticas disponibles en la edición 2016 del Cuadro Básico y Catálogo de Medicamentos del Sector Salud en México (CBCMSS), cuya elaboración es una de las principales atribuciones del Consejo de Salubridad General, órgano colegiado de carácter constitucional y máxima autoridad sanitaria del país12, existen diversas opciones de tratamiento, que incluyen dentro de la primera línea a los bifosfonatos, el calcitriol y la calcitonina. Sin embargo, cuando existe falla terapéutica a los medicamentos de primera línea o bien cuando el paciente presenta una OP severa, se encuentran indicados los medicamentos de segunda línea.
La falla terapéutica se caracteriza por: 1) presentar 2o más fracturas por fragilidad incidentes; 2) presentar una fractura incidente y niveles séricos basales elevados de β-telopéptido carboxilo terminal del colágeno tipo I (βCTX) o de propéptido N-terminal del procolágeno tipo I (PINP) sin reducción significativa durante el tratamiento, una disminución significativa en DMO o ambos y 3) presentar reducción no significativa en βCTX o PINP y disminución significativa en DMO13.
Actualmente, en México solo teriparatida y denosumab son los fármacos cuya cédula descriptiva en CBCMSS lleva implícita su indicación para uso en pacientes con OP severa o bien en pacientes con falla terapéutica a los agentes de primera línea. En el CBCMSS, teriparatida es una hormona con actividad anabólica que forma parte del grupo 5 (endocrinología y metabolismo) que está indicada para mujeres y hombres con OP con fracturas previas de cadera o de columna, alto riesgo de nuevas fracturas y que no han respondido al tratamiento con calcitriol o bifosfonatos. Por otro lado, denosumab es un anticuerpo monoclonal que forma parte también del grupo 5 y, además, del grupo 17 (oncología) y está indicado para mujeres posmenopáusicas intolerantes a bifosfonatos orales, con fractura previa o con alto riesgo de fractura12. Por tanto, el presente documento se enfoca de forma exclusiva a estos 2medicamentos.
El objetivo del presente artículo fue realizar una revisión tanto sistemática como narrativa de la evidencia de estos fármacos, así como mostrar la comparación farmacológica de eficacia, efectividad y seguridad entre teriparatida y denosumab y analizar las recomendaciones establecidas para la OP severa en las guías de tratamiento nacionales e internacionales. Este documento engloba la postura de 3sociedades al respecto: la Asociación de Metabolismo Óseo y Mineral, el Colegio Mexicano de Ortopedia y Traumatología y el Colegio Mexicano de Reumatología.
MétodosPara la revisión farmacológica de los medicamentos, las diferencias en los mecanismos de acción, farmacocinética, farmacodinamia y perfil de seguridad y tolerabilidad se realizó una revisión especializada en 2plataformas, Micromedex®, Truven Health Analytics14, y la plataforma VigiBase®15, que es la base global de reporte de reacciones adversas de la Organización Mundial de la Salud para ambos medicamentos.
Para el análisis de la efectividad, eficacia y seguridad se realizó una revisión sistemática de la literatura enfocada en la búsqueda de los ensayos clínicos aleatorizados de ambos fármacos, comparado con placebo u otra molécula a partir de los siguientes términos: Severe osteoporosis/established osteoporosis (teriparatida/denosumab); Severe osteoporosis denosumab or teriparatide; Severe osteoporosis and teriparatida or denosumab, en las siguientes bibliotecas electrónicas: PubMed, Cochrane Library y TripDatabase (hasta mayo de 2017). Dos investigadores realizaron un cribado por título, resumen y texto completo en paralelo y de forma independiente, que resolvieron las discrepancias con la intervención de un tercer investigador.
Los criterios de inclusión fueron de acuerdo con el acrónimo PICO. Población: personas de sexo femenino adultas diagnosticadas con OP que estuvieran recibiendo tratamiento farmacológico. Intervenciones: teriparatida o denosumab, bajo sus esquemas de dosificación y aplicación aprobados. Comparadores: comparados con placebo. Medición de desenlaces de ocurrencia de fracturas (por sitio anatómico) y eventos adversos que condujeron a la suspensión del estudio. La calidad metodológica se evaluó aplicando los criterios del Programa para el Desarrollo de Habilidades en Valoración Crítica en su versión en español (CASPe)16.
Finalmente, para el análisis de las recomendaciones en la terapia de OP severa, se consideraron las guías de práctica clínica y consensos nacionales: CENETEC 20139, AMMOM 201517, Grupos interdisciplinarios 201518 y CENAPRECE 201719, así como instituciones internacionales como ESCEO/IOF Europa 201320, NOGG Reino Unido 201721, NICE actualizada 2010 y 201722, Hauté Autorite de Sánte Francia 201423, AACE/ACE USA 201624.
ResultadosComparación farmacológicaTeriparatida es una hormona polipeptídica sintética conformada por los primeros 34 aminoácidos de la hormona paratiroidea humana (PTH)25, los cuales le confieren su actividad biológica26, mimetizando las acciones de la PTH endógena, que resultan en un efecto catabólico del hueso. Sin embargo, cuando se administra en dosis bajas y de manera intermitente, resulta en propiedades anabólicas en el sistema óseo27-30. Administrada en inyección subcutánea de 20μg una vez al día, las concentraciones séricas alcanzan su máximo a los 30min y disminuyen a cifras no detectables después de 3h. La biodisponibilidad de teriparatida es del 95% en promedio, con un tiempo de vida media de una hora, con una eliminación de 62 L/h en mujeres y de 94 L/h en hombres. La eliminación se hace por medio de mecanismos enzimáticos inespecíficos en el hígado, seguida de su excreción vía renal (tabla 1)25.
Principales diferencias farmacológicas entre teriparatida y denosumab
| Farmacología | Teriparatida | Denosumab |
| Código ATC | H05AA02 - TeriparatidaH-Preparaciones hormonales sistémicasH05-Homeostasis del calcioH05A-Hormonas paratiroideas y análogosH05AA-Hormonas paratiroideas y análogos | M05BX04 - DenosumabM-Sistema musculoesqueléticoM05-Fármacos para el tratamiento de enfermedades del huesoM05B-Fármacos que afectan la estructura del hueso y la mineralizaciónMB05BX-Otros fármacos que afectan la estructura ósea y la mineralización |
| Estructura | Cadena polipeptídica | Anticuerpo monoclonal |
| Peso molecular | 4.117,7 Daltones | 144.700,0 Daltones |
| Descripción | Hormona polipeptídica sintética que se conforma por los aminoácidos 1 al 34 de la hormona paratiroidea humana (PTH). Es la región N-terminal biológicamente activa de la PTH | Anticuerpo monoclonal IgG2 totalmente humanizado específico para RANKL (ligando del receptor del factor nuclear kappa-B) |
| Dosis | 20μg una vez al día hasta 18 meses | 60mg una vez cada 6 meses |
| Vía | Subcutánea | Subcutánea |
| Farmacodinamia | ||
| Mecanismo de acción | Mimetiza el mecanismo de acción de la PTH, estimulando la formación del hueso por efecto directo sobre los osteoblastos y sobre la absorción intestinal de calcio | Se une específicamente a RANKL, impide la formación del complejo RANKL-RANK y ocasiona indirectamente una disminución en la formación y actividad de osteoclastos |
| Farmacocinética | ||
| Absorción | ||
| Biodisponibilidad (administración subcutánea) | 95% | 61% |
| Concentración plasmática máxima (Cmax) | Aproximadamente 140 pg/mL | 6μg/ml (rango de 1 a 17μg/ml) |
| Tiempo máximo, para alcanzar la Cmax (Tmax) | 20-30 min | 10 días (rango de 2 a 28 días) |
| Distribución | ||
| Unión a proteínas | Sí. Se asume que se transporta igual que la hormona paratiroidea (PTH, por sus siglas en inglés), a través de la fracción alfa-globulina | No disponible, aunque se considera que el comportamiento es igual a otros anticuerpos monoclonales, los cuales no tienen unión a proteínas |
| Volumen de distribución (Vd) | 0,1 L/kg (intravenoso) | No se indican valores, sin embargo, se ha mencionado que baja la distribución extravascular |
| Metabolismo | ||
| Sitio de metabolismo | HepáticoSe asume que se metaboliza igual que la PTH, a través de enzimas hepáticas proteolíticas | El metabolismo puede ser mediado por 3mecanismos:a) Proteólisis por el hígado y por sistema reticuloendotelialb) Eliminación mediada por marcadoresc) Endocitosis no específica seguida de una degradación intracelular. En este tipo de mecanismo puede presentarse la protección de la parte Fc, ocasionando un aumento del tiempo de vida media |
| Excreción | ||
| Depuración renal | 90%Se asume una depuración renal similar a la de la PTH | Debido a su peso molecular, denosumab no se excreta por orina, es metabolizado a péptidos y aminoácidos que pueden ser reutilizados para la síntesis proteica de novo |
| Depuración total | Mujeres: 62 L/h Hombres: 94 L/h | No disponible |
Denosumab es un anticuerpo monoclonal humano de origen ADN recombinante que se une a la citosina RANKL (ligando del receptor activador del factor nuclear k B), que previene su unión con los receptores de membrana del osteoclasto RANK (receptor activador de NFκB). Con la reducción de la unión RANKL-RANK, se inhibe la formación del osteoclasto maduro y con ello se promueve una disminución en la resorción ósea31-33. Con dichas características se simula el efecto de la osteoprotegerina, fundamental para la capacidad de la resorción ósea34. Después de una dosis subcutánea de 60mg, la biodisponibilidad es del 61%, la concentración máxima en suero (Cmáx) es de 6μg/ml (rango de 1 a 17μg/ml) en un promedio de 10 días (rango de 2 a 28 días), con una vida media de 26 días (rango de 6 a 52 días) (tabla 1)35.
Principales diferencias farmacológicas entre teriparatida y denosumabExisten notables diferencias entre ambos agentes en todos los niveles de clasificación de acuerdo con el Sistema de Clasificación Anatómica, Terapéutica, Química (ATC, por su sigla en inglés)36. Con propiedades farmacocinéticas y farmacodinámicas que difieren entre sí radicalmente en términos de farmacóforo, actividad biológica, mecanística y química (tabla 1).
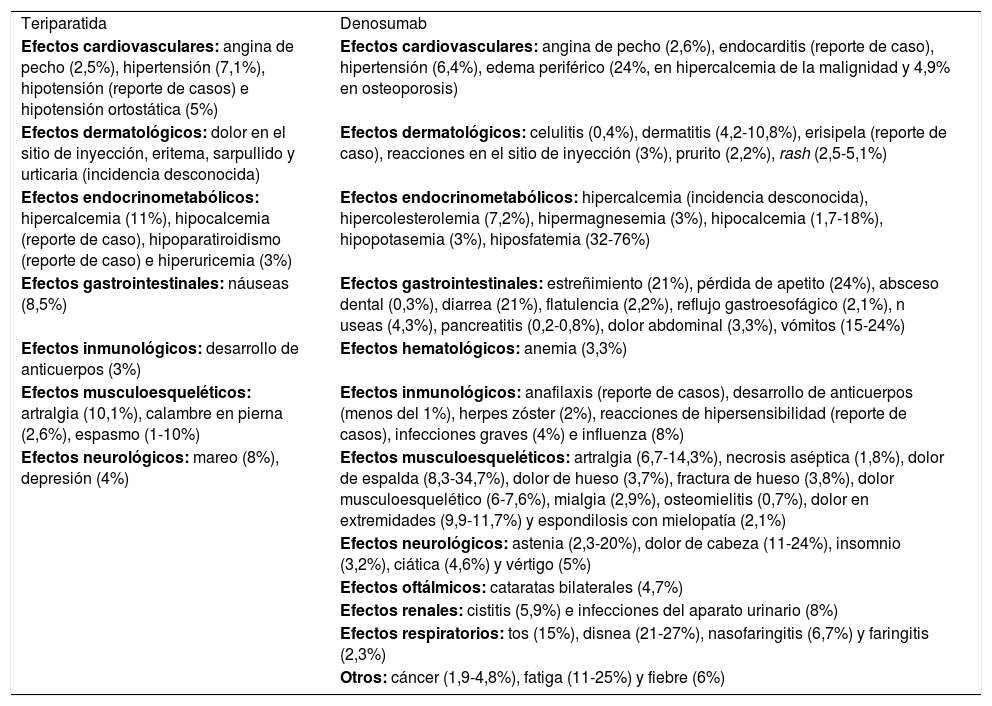
Perfil de seguridad y tolerabilidadLa seguridad se puede determinar por la frecuencia y severidad de las reacciones adversas. En el caso de denosumab, se incluyen los eventos adversos reportados para las indicaciones terapéuticas de este medicamento, no solo los estudios de OP. Las reacciones adversas más frecuentes a denosumab incluyen estreñimiento, ciática, erupciones exantémicas, dolor en miembros, cataratas, entre otras. Cabe mencionar la osteonecrosis mandibular (1-2%) y las fracturas atípicas (reporte de serie de casos) asociadas, eventos graves que ameritan la suspensión del tratamiento37-39. Las reacciones adversas a teriparatida más frecuentes incluyen náuseas, dolor de miembros, mareo e hiperuricemia25,35. Al realizar la consulta especializada en Micromedex®, se observan diferencias y similitudes en la incidencia de seguridad y tolerabilidad a cada uno de estos medicamentos (tabla 2)14. Al evaluar las reacciones adversas reportadas en VigiBase® hasta mayo de 2017, se encuentra que el número de reportes generados durante los últimos 27 años para teriparatida es de 95.175, y en un periodo de 14 años es de 50.680 para denosumab.
Descripción de reacciones adversas reportadas por sistemas, para teriparatida y denosumab
| Teriparatida | Denosumab |
| Efectos cardiovasculares: angina de pecho (2,5%), hipertensión (7,1%), hipotensión (reporte de casos) e hipotensión ortostática (5%) | Efectos cardiovasculares: angina de pecho (2,6%), endocarditis (reporte de caso), hipertensión (6,4%), edema periférico (24%, en hipercalcemia de la malignidad y 4,9% en osteoporosis) |
| Efectos dermatológicos: dolor en el sitio de inyección, eritema, sarpullido y urticaria (incidencia desconocida) | Efectos dermatológicos: celulitis (0,4%), dermatitis (4,2-10,8%), erisipela (reporte de caso), reacciones en el sitio de inyección (3%), prurito (2,2%), rash (2,5-5,1%) |
| Efectos endocrinometabólicos: hipercalcemia (11%), hipocalcemia (reporte de caso), hipoparatiroidismo (reporte de caso) e hiperuricemia (3%) | Efectos endocrinometabólicos: hipercalcemia (incidencia desconocida), hipercolesterolemia (7,2%), hipermagnesemia (3%), hipocalcemia (1,7-18%), hipopotasemia (3%), hiposfatemia (32-76%) |
| Efectos gastrointestinales: náuseas (8,5%) | Efectos gastrointestinales: estreñimiento (21%), pérdida de apetito (24%), absceso dental (0,3%), diarrea (21%), flatulencia (2,2%), reflujo gastroesofágico (2,1%), n useas (4,3%), pancreatitis (0,2-0,8%), dolor abdominal (3,3%), vómitos (15-24%) |
| Efectos inmunológicos: desarrollo de anticuerpos (3%) | Efectos hematológicos: anemia (3,3%) |
| Efectos musculoesqueléticos: artralgia (10,1%), calambre en pierna (2,6%), espasmo (1-10%) | Efectos inmunológicos: anafilaxis (reporte de casos), desarrollo de anticuerpos (menos del 1%), herpes zóster (2%), reacciones de hipersensibilidad (reporte de casos), infecciones graves (4%) e influenza (8%) |
| Efectos neurológicos: mareo (8%), depresión (4%) | Efectos musculoesqueléticos: artralgia (6,7-14,3%), necrosis aséptica (1,8%), dolor de espalda (8,3-34,7%), dolor de hueso (3,7%), fractura de hueso (3,8%), dolor musculoesquelético (6-7,6%), mialgia (2,9%), osteomielitis (0,7%), dolor en extremidades (9,9-11,7%) y espondilosis con mielopatía (2,1%) |
| Efectos neurológicos: astenia (2,3-20%), dolor de cabeza (11-24%), insomnio (3,2%), ciática (4,6%) y vértigo (5%) | |
| Efectos oftálmicos: cataratas bilaterales (4,7%) | |
| Efectos renales: cistitis (5,9%) e infecciones del aparato urinario (8%) | |
| Efectos respiratorios: tos (15%), disnea (21-27%), nasofaringitis (6,7%) y faringitis (2,3%) | |
| Otros: cáncer (1,9-4,8%), fatiga (11-25%) y fiebre (6%) |
Fuente: Basada en información de Micromedex®14.
De las bibliotecas electrónicas consultadas, analizando un total de 411 referencias originales, se obtuvieron 2estudios (kappa 0,40-0,80; p < 0,0001), ambos con calidad metodológica alta (10 de 11 ítems CASPe).
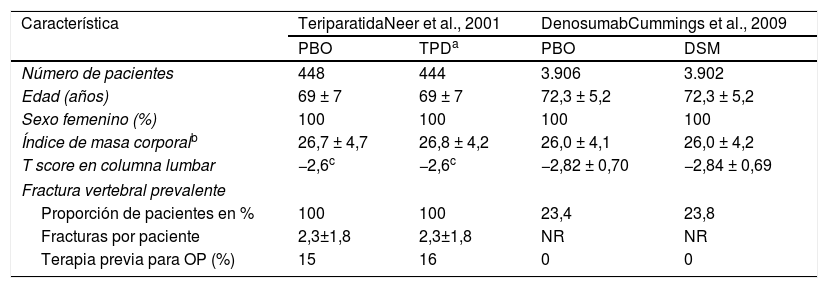
Los 2ensayos clínicos seleccionados corresponden a los estudios pivotales de teriparatida29 y denosumab40: cabe destacar que la proporción de pacientes con fractura vertebral prevalente varió notablemente entre estos estudios. El estudio de teriparatida29 incluyó a pacientes con presencia de al menos una fractura moderada o 2leves no causadas por traumatismos en vértebras29, mientras que el estudio de denosumab solo incluyó un 24% de pacientes con esta característica37,40. Otra diferencia importante fue que entre el 15 y el 16% de las pacientes en el estudio de teriparatida había recibido terapia previa para OP no especificada29, no así para el estudio de denosumab. Sin embargo, el resto de las características basales como edad, sexo, índice de masa corporal y T score en columna lumbar fueron comparables40 (tabla 3).
Características basales relevantes en los ensayos clínicos seleccionados
| Característica | TeriparatidaNeer et al., 2001 | DenosumabCummings et al., 2009 | ||
| PBO | TPDa | PBO | DSM | |
| Número de pacientes | 448 | 444 | 3.906 | 3.902 |
| Edad (años) | 69 ± 7 | 69 ± 7 | 72,3 ± 5,2 | 72,3 ± 5,2 |
| Sexo femenino (%) | 100 | 100 | 100 | 100 |
| Índice de masa corporalb | 26,7 ± 4,7 | 26,8 ± 4,2 | 26,0 ± 4,1 | 26,0 ± 4,2 |
| T score en columna lumbar | −2,6c | −2,6c | −2,82 ± 0,70 | −2,84 ± 0,69 |
| Fractura vertebral prevalente | ||||
| Proporción de pacientes en % | 100 | 100 | 23,4 | 23,8 |
| Fracturas por paciente | 2,3±1,8 | 2,3±1,8 | NR | NR |
| Terapia previa para OP (%) | 15 | 16 | 0 | 0 |
DSM: denosumab; NR: no reportado; OP: osteoporosis; PBO: placebo; TPD: teriparatida.
Datos reportados que incluyen el símbolo ± indican promedio (izquierda) y desviación estándar (derecha).
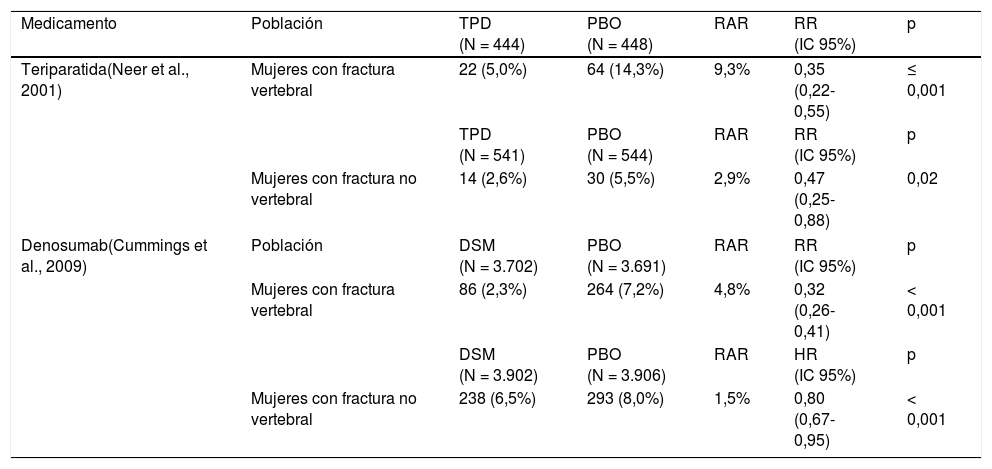
La medida primaria de eficacia en ambos estudios fue una reducción estadísticamente significativa en la aparición de nuevas fracturas vertebrales por fragilidad (tabla 4). La comparación contra placebo mostró un RR de 0,35 (IC 95%: 0,22-0,55) para teriparatida y de 0,32 (IC 95%: 0,26-0,41) para denosumab. La reducción absoluta del riesgo (RAR) fue más alta con teriparatida que con denosumab (9,3 vs. 4,8%), a pesar de que el tiempo de seguimiento fue menor en el estudio de teriparatida (21 meses) que en el de denosumab (36 meses)29,40.
Comparación de eficacia para prevenir fracturas vertebrales y no vertebrales por fragilidad
| Medicamento | Población | TPD (N = 444) | PBO (N = 448) | RAR | RR (IC 95%) | p |
| Teriparatida(Neer et al., 2001) | Mujeres con fractura vertebral | 22 (5,0%) | 64 (14,3%) | 9,3% | 0,35 (0,22-0,55) | ≤ 0,001 |
| TPD (N = 541) | PBO (N = 544) | RAR | RR (IC 95%) | p | ||
| Mujeres con fractura no vertebral | 14 (2,6%) | 30 (5,5%) | 2,9% | 0,47 (0,25-0,88) | 0,02 | |
| Denosumab(Cummings et al., 2009) | Población | DSM (N = 3.702) | PBO (N = 3.691) | RAR | RR (IC 95%) | p |
| Mujeres con fractura vertebral | 86 (2,3%) | 264 (7,2%) | 4,8% | 0,32 (0,26-0,41) | < 0,001 | |
| DSM (N = 3.902) | PBO (N = 3.906) | RAR | HR (IC 95%) | p | ||
| Mujeres con fractura no vertebral | 238 (6,5%) | 293 (8,0%) | 1,5% | 0,80 (0,67-0,95) | < 0,001 | |
DSM: denosumab; PBO: placebo; RAR: reducción absoluta del riesgo; RR: razón de riesgo o riesgo relativo; TPD: teriparatida.
Tiempos de seguimiento: estudio de teriparatida (21 meses), estudio de denosumab (36 meses).
La ocurrencia de fracturas no vertebrales por fragilidad constituyó una medida secundaria de eficacia en ambos estudios (tabla 4)29,40. En ambos casos se logró reducir significativamente su incidencia, aunque la estimación puntual varió de forma importante: RR 0,47 (IC 95%: 0,25-0,88) con teriparatida y HR 0,80 (IC 95%: 0,67-0,96) con denosumab. Lo anterior implica que teriparatida redujo en un 53% la incidencia de fracturas no vertebrales por fragilidad, mientras que la disminución obtenida con denosumab fue del 20%. La RAR fue también más elevada con teriparatida que con denosumab (2,9 vs. 1,5%). Otra diferencia que considerar es que las estimaciones de riesgo en el estudio de denosumab proceden de un análisis de Kaplan-Meier40, en tanto que las correspondientes a teriparatida son proporciones simples29. Denosumab mostró una reducción en el riesgo de fractura de cadera por fragilidad de HR 0,60 (IC 95%: 0,37-0,97). El estudio de teriparatida señala que el número de eventos de fractura no vertebral por fragilidad específicos por sitio anatómico fue demasiado bajo como para estimar con precisión su incidencia, y que la estimación puntual de RR para fractura de cadera frente a placebo fue de 0,25, lo que representa una reducción del 75%29.
Ambos estudios categorizaron los eventos adversos de manera distinta, si bien tenían en común la clasificación de «eventos adversos que condujeron al abandono de la terapia», que se muestra en la tabla 5. Como se puede apreciar, las incidencias puntuales son semejantes entre ambos agentes y en ninguno de los 2casos las diferencias resultaron estadísticamente significativas.
Comparación de incidencia de eventos adversos que condujeron al abandono de la terapia
| Referencia: Neer et al. 2001 | TPD (N = 541) | PBO (N = 544) | RR (IC 95%) | p |
| Mujeres con fractura | 35 (6,5%) | 32 (5,9%) | 1,10 (0,69-1,75) | 0,688 |
| Referencia: Cummings et al. 2009 | DSM (N = 3.886) | PBO (N = 3.876) | RR (IC 95%) | p |
| Mujeres con fractura | 192 (4,9%) | 202 (5,2%) | 0,95 (0,78-1,15) | 0,55 |
Efectos adversos definidos como aquellos que condujeron a abandono de la terapia de estudio.
DSM: denosumab; PBO: placebo; RR: razón de riesgo o riesgo relativo; TPD: teriparatida.
Tiempos de seguimiento: estudio de teriparatida (21 meses), estudio de denosumab (36 meses).
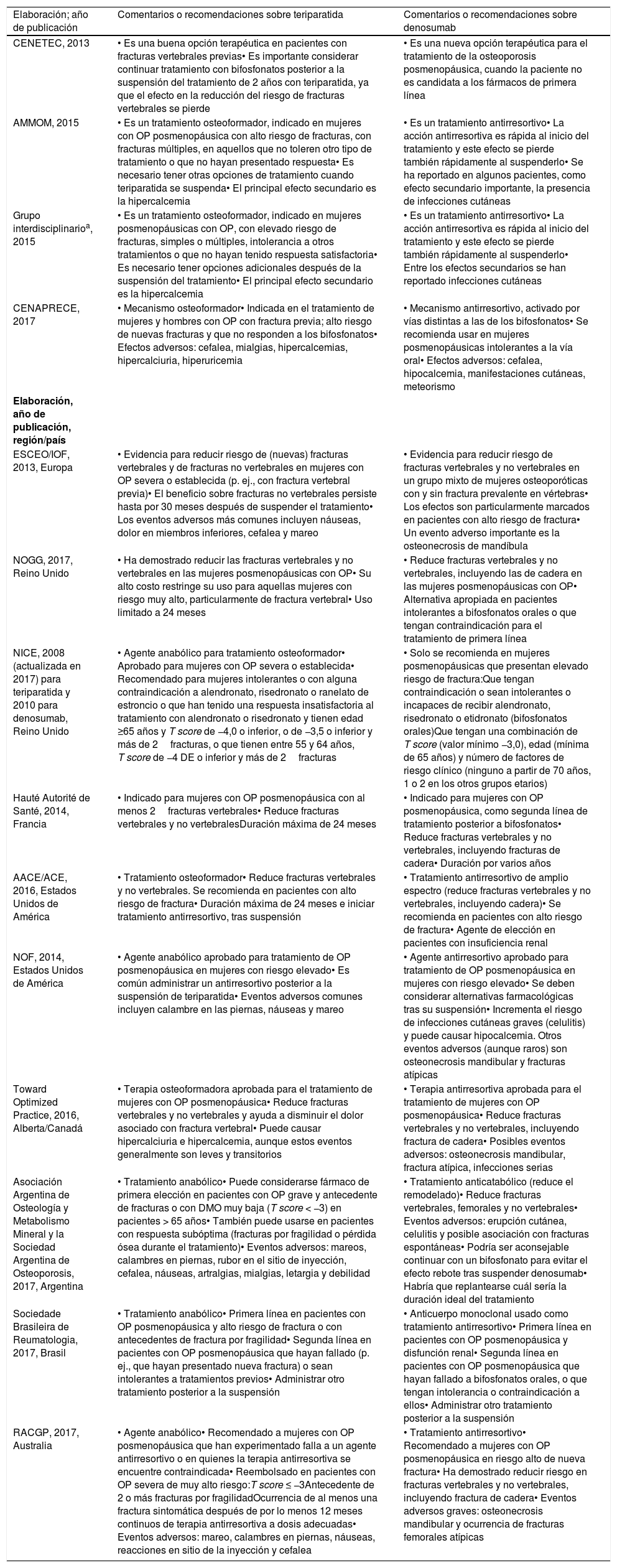
Las 4guías consultadas distinguen claramente los mecanismos de acción de ambos agentes, definiendo a teriparatida como osteoformador y a denosumab como antirresortivo. Todas enfatizan que teriparatida se debe administrar en población de alto riesgo, como lo son mujeres con OP y quienes presentan fracturas previas, es decir, con OP severa. Para denosumab, la recomendación es emplearlo en mujeres no candidatas a los fármacos de primera línea. Todas las recomendaciones coinciden en la necesidad de administrar tratamiento subsecuente tras la suspensión de teriparatida o denosumab (tabla 6).
Resumen de las principales guías de práctica clínica nacionales e internacionales: Información en mujeres posmenopáusicas
| Elaboración; año de publicación | Comentarios o recomendaciones sobre teriparatida | Comentarios o recomendaciones sobre denosumab |
| CENETEC, 2013 | • Es una buena opción terapéutica en pacientes con fracturas vertebrales previas• Es importante considerar continuar tratamiento con bifosfonatos posterior a la suspensión del tratamiento de 2 años con teriparatida, ya que el efecto en la reducción del riesgo de fracturas vertebrales se pierde | • Es una nueva opción terapéutica para el tratamiento de la osteoporosis posmenopáusica, cuando la paciente no es candidata a los fármacos de primera línea |
| AMMOM, 2015 | • Es un tratamiento osteoformador, indicado en mujeres con OP posmenopáusica con alto riesgo de fracturas, con fracturas múltiples, en aquellos que no toleren otro tipo de tratamiento o que no hayan presentado respuesta• Es necesario tener otras opciones de tratamiento cuando teriparatida se suspenda• El principal efecto secundario es la hipercalcemia | • Es un tratamiento antirresortivo• La acción antirresortiva es rápida al inicio del tratamiento y este efecto se pierde también rápidamente al suspenderlo• Se ha reportado en algunos pacientes, como efecto secundario importante, la presencia de infecciones cutáneas |
| Grupo interdisciplinarioa, 2015 | • Es un tratamiento osteoformador, indicado en mujeres posmenopáusicas con OP, con elevado riesgo de fracturas, simples o múltiples, intolerancia a otros tratamientos o que no hayan tenido respuesta satisfactoria• Es necesario tener opciones adicionales después de la suspensión del tratamiento• El principal efecto secundario es la hipercalcemia | • Es un tratamiento antirresortivo• La acción antirresortiva es rápida al inicio del tratamiento y este efecto se pierde también rápidamente al suspenderlo• Entre los efectos secundarios se han reportado infecciones cutáneas |
| CENAPRECE, 2017 | • Mecanismo osteoformador• Indicada en el tratamiento de mujeres y hombres con OP con fractura previa; alto riesgo de nuevas fracturas y que no responden a los bifosfonatos• Efectos adversos: cefalea, mialgias, hipercalcemias, hipercalciuria, hiperuricemia | • Mecanismo antirresortivo, activado por vías distintas a las de los bifosfonatos• Se recomienda usar en mujeres posmenopáusicas intolerantes a la vía oral• Efectos adversos: cefalea, hipocalcemia, manifestaciones cutáneas, meteorismo |
| Elaboración, año de publicación, región/país | ||
| ESCEO/IOF, 2013, Europa | • Evidencia para reducir riesgo de (nuevas) fracturas vertebrales y de fracturas no vertebrales en mujeres con OP severa o establecida (p. ej., con fractura vertebral previa)• El beneficio sobre fracturas no vertebrales persiste hasta por 30 meses después de suspender el tratamiento• Los eventos adversos más comunes incluyen náuseas, dolor en miembros inferiores, cefalea y mareo | • Evidencia para reducir riesgo de fracturas vertebrales y no vertebrales en un grupo mixto de mujeres osteoporóticas con y sin fractura prevalente en vértebras• Los efectos son particularmente marcados en pacientes con alto riesgo de fractura• Un evento adverso importante es la osteonecrosis de mandíbula |
| NOGG, 2017, Reino Unido | • Ha demostrado reducir las fracturas vertebrales y no vertebrales en las mujeres posmenopáusicas con OP• Su alto costo restringe su uso para aquellas mujeres con riesgo muy alto, particularmente de fractura vertebral• Uso limitado a 24 meses | • Reduce fracturas vertebrales y no vertebrales, incluyendo las de cadera en las mujeres posmenopáusicas con OP• Alternativa apropiada en pacientes intolerantes a bifosfonatos orales o que tengan contraindicación para el tratamiento de primera línea |
| NICE, 2008 (actualizada en 2017) para teriparatida y 2010 para denosumab, Reino Unido | • Agente anabólico para tratamiento osteoformador• Aprobado para mujeres con OP severa o establecida• Recomendado para mujeres intolerantes o con alguna contraindicación a alendronato, risedronato o ranelato de estroncio o que han tenido una respuesta insatisfactoria al tratamiento con alendronato o risedronato y tienen edad ≥65 años y T score de −4,0 o inferior, o de −3,5 o inferior y más de 2fracturas, o que tienen entre 55 y 64 años, T score de −4 DE o inferior y más de 2fracturas | • Solo se recomienda en mujeres posmenopáusicas que presentan elevado riesgo de fractura:Que tengan contraindicación o sean intolerantes o incapaces de recibir alendronato, risedronato o etidronato (bifosfonatos orales)Que tengan una combinación de T score (valor mínimo −3,0), edad (mínima de 65 años) y número de factores de riesgo clínico (ninguno a partir de 70 años, 1 o 2 en los otros grupos etarios) |
| Hauté Autorité de Santé, 2014, Francia | • Indicado para mujeres con OP posmenopáusica con al menos 2fracturas vertebrales• Reduce fracturas vertebrales y no vertebralesDuración máxima de 24 meses | • Indicado para mujeres con OP posmenopáusica, como segunda línea de tratamiento posterior a bifosfonatos• Reduce fracturas vertebrales y no vertebrales, incluyendo fracturas de cadera• Duración por varios años |
| AACE/ACE, 2016, Estados Unidos de América | • Tratamiento osteoformador• Reduce fracturas vertebrales y no vertebrales. Se recomienda en pacientes con alto riesgo de fractura• Duración máxima de 24 meses e iniciar tratamiento antirresortivo, tras suspensión | • Tratamiento antirresortivo de amplio espectro (reduce fracturas vertebrales y no vertebrales, incluyendo cadera)• Se recomienda en pacientes con alto riesgo de fractura• Agente de elección en pacientes con insuficiencia renal |
| NOF, 2014, Estados Unidos de América | • Agente anabólico aprobado para tratamiento de OP posmenopáusica en mujeres con riesgo elevado• Es común administrar un antirresortivo posterior a la suspensión de teriparatida• Eventos adversos comunes incluyen calambre en las piernas, náuseas y mareo | • Agente antirresortivo aprobado para tratamiento de OP posmenopáusica en mujeres con riesgo elevado• Se deben considerar alternativas farmacológicas tras su suspensión• Incrementa el riesgo de infecciones cutáneas graves (celulitis) y puede causar hipocalcemia. Otros eventos adversos (aunque raros) son osteonecrosis mandibular y fracturas atípicas |
| Toward Optimized Practice, 2016, Alberta/Canadá | • Terapia osteoformadora aprobada para el tratamiento de mujeres con OP posmenopáusica• Reduce fracturas vertebrales y no vertebrales y ayuda a disminuir el dolor asociado con fractura vertebral• Puede causar hipercalciuria e hipercalcemia, aunque estos eventos generalmente son leves y transitorios | • Terapia antirresortiva aprobada para el tratamiento de mujeres con OP posmenopáusica• Reduce fracturas vertebrales y no vertebrales, incluyendo fractura de cadera• Posibles eventos adversos: osteonecrosis mandibular, fractura atípica, infecciones serias |
| Asociación Argentina de Osteología y Metabolismo Mineral y la Sociedad Argentina de Osteoporosis, 2017, Argentina | • Tratamiento anabólico• Puede considerarse fármaco de primera elección en pacientes con OP grave y antecedente de fracturas o con DMO muy baja (T score < −3) en pacientes > 65 años• También puede usarse en pacientes con respuesta subóptima (fracturas por fragilidad o pérdida ósea durante el tratamiento)• Eventos adversos: mareos, calambres en piernas, rubor en el sitio de inyección, cefalea, náuseas, artralgias, mialgias, letargia y debilidad | • Tratamiento anticatabólico (reduce el remodelado)• Reduce fracturas vertebrales, femorales y no vertebrales• Eventos adversos: erupción cutánea, celulitis y posible asociación con fracturas espontáneas• Podría ser aconsejable continuar con un bifosfonato para evitar el efecto rebote tras suspender denosumab• Habría que replantearse cuál sería la duración ideal del tratamiento |
| Sociedade Brasileira de Reumatologia, 2017, Brasil | • Tratamiento anabólico• Primera línea en pacientes con OP posmenopáusica y alto riesgo de fractura o con antecedentes de fractura por fragilidad• Segunda línea en pacientes con OP posmenopáusica que hayan fallado (p. ej., que hayan presentado nueva fractura) o sean intolerantes a tratamientos previos• Administrar otro tratamiento posterior a la suspensión | • Anticuerpo monoclonal usado como tratamiento antirresortivo• Primera línea en pacientes con OP posmenopáusica y disfunción renal• Segunda línea en pacientes con OP posmenopáusica que hayan fallado a bifosfonatos orales, o que tengan intolerancia o contraindicación a ellos• Administrar otro tratamiento posterior a la suspensión |
| RACGP, 2017, Australia | • Agente anabólico• Recomendado a mujeres con OP posmenopáusica que han experimentado falla a un agente antirresortivo o en quienes la terapia antirresortiva se encuentre contraindicada• Reembolsado en pacientes con OP severa de muy alto riesgo:T score ≤ −3Antecedente de 2 o más fracturas por fragilidadOcurrencia de al menos una fractura sintomática después de por lo menos 12 meses continuos de terapia antirresortiva a dosis adecuadas• Eventos adversos: mareo, calambres en piernas, náuseas, reacciones en sitio de la inyección y cefalea | • Tratamiento antirresortivo• Recomendado a mujeres con OP posmenopáusica en riesgo alto de nueva fractura• Ha demostrado reducir riesgo en fracturas vertebrales y no vertebrales, incluyendo fractura de cadera• Eventos adversos graves: osteonecrosis mandibular y ocurrencia de fracturas femorales atípicas |
AACE/ACE: The American Association of Clinical Endocrinologists/American College of Endocrinology; AMMOM: Asociación Mexicana de Metabolismo Óseo y Mineral A.C.; CENAPRECE: Centro Nacional de Programas Preventivos y Control de Enfermedades; CENETEC: Centro Nacional de Excelencia Tecnológica en Salud; ESCEO: European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis; IOF: International Osteoporosis Foundation; NICE: National Institute for Health and Care Excellence; NOF: National Osteoporosis Foundation; NOGG: The National Osteoporosis Guideline Group; OP: osteoporosis; RACGP: The Royal Australian College of General Practitioners.
Las principales guías identificadas en el ámbito internacional (Norteamerica, Europa, Sudamerica y Australia) refieren21-24,41-45 la diferencia de ambos fármacos por sus mecanismos de acción y enfoque de tratamiento (osteoformador y antirresortivo). Las guías consultadas recomiendan teriparatida en pacientes de alto o muy alto riesgo de fractura, ya sea como primera o segunda línea, tras la falla con agentes antirresortivos o en algunos casos a intolerancia. Se recomienda usar denosumab como alternativa de primera línea en pacientes de alto riesgo y como agente de elección en pacientes con insuficiencia renal. La mayoría de los autores coincide en recomendar su empleo en caso de intolerancia o contraindicación a bifosfonatos (tabla 6).
Discusión y conclusionesEn el presente documento se resumen los 2enfoques de tratamiento farmacológico para la OP severa: el anabólico (osteoformador) de teriparatida y el catabólico (antirresortivo) de denosumab. Igualmente, se resumen las indicaciones puntuales para su administración de acuerdo con las cédulas descriptivas del CBCMSS, los eventos adversos de acuerdo con las plataformas de Micromedex® y VigiBase® y, finalmente, se resumen las indicaciones terapéuticas publicadas en las diferentes guías nacionales e internacionales para esta entidad.
Teriparatida, una hormona polipeptídica sintética, estimula directamente a los osteoblastos para la formación de nuevo hueso; mientras que el denosumab, un anticuerpo monoclonal, inhibe la osteoclastogénesis. Ambos medicamentos han probado su eficacia antifractura con suficiencia, pero por sus diferentes mecanismos de acción, el intercambio terapéutico o sustitución terapéutica no están indicados. Los criterios para sustitución terapéutica no son aplicables cuando se trata de 2medicamentos que pertenecen a clases terapéuticas distintas de acuerdo con la clasificación ATC y, por ello, difieren en su composición farmacológica, por lo que pueden originar perfiles de eficacia y seguridad heterogéneos y poco comparables entre sí.
Por otra parte, los resultados de las comparaciones indirectas y metaanálisis en red que involucren los ensayos clínicos pivotales de teriparatida y denosumab deben ser tomados con cautela debido a las diferencias en algunas características basales de los pacientes reclutados que son fundamentales (p. ej., porcentaje de mujeres con fractura previa)46,47.
Teriparatida está indicada en hombres y mujeres con OP severa, alto riesgo de nuevas fracturas, riesgo de fractura inminente o en aquellos que no han respondido al tratamiento con calcitriol o bifosfonatos. El denosumab está indicado para mujeres posmenopáusicas intolerantes a bifosfonatos, mujeres con fractura previa y con riesgo de fracturas subsecuentes y para la prevención de complicaciones óseas (fracturas patológicas, radioterapia de hueso, compresión de médula espinal o cirugía ósea), en pacientes con cáncer de mama con metástasis ósea y con signos de deterioro de la función renal12.
Es importante notar que existe coincidencia interinstitucional en cuanto a los criterios y principales recomendaciones emitidas por las guías de práctica clínica nacionales e internacionales. Sin embargo, no existen datos que permitan determinar el nivel de apego de prescripción a las cédulas por parte de los facultativos.
Ambos fármacos tienen un perfil de seguridad aceptable, ya que las reacciones adversas más frecuentes son leves y moderadas y no ponen en riesgo la vida del paciente. Si bien el número de reportes de sospecha de reacciones adversas es aproximadamente el doble para teriparatida (95.175 en 27 años) que para denosumab (50.680 en 14 años). Eso podría ser atribuido a la diferencia de años de comercialización, aunado al énfasis en la notificación de reacciones adversas, especialmente con productos innovadores, en la última década. Por último, debiera contemplarse la existencia de medicamentos que per se presentan más reacciones adversas.
Las recomendaciones emitidas en guías nacionales e internacionales observan un patrón general en cuanto a la indicación de ambos fármacos para la terapia de OP severa en pacientes con respuesta inadecuada a bifosfonatos. No obstante, no se puede afirmar que sean sustituibles por las razones antes mencionadas. Por tanto, su indicación deberá ser individualizada y basarse en las características del paciente, como edad, sitio de fracturas previas, perfil de riesgo, tratamientos anteriores y el efecto deseado, tratando de obtener mejores resultados clínicos.
Es importante destacar que en investigaciones recientes sobre la secuencia del tratamiento en OP en pacientes con riesgo inminente de fractura, entendiendo como riesgo inminente el primer año después de una fractura vertebral o de cadera48, se ha demostrado que la utilización de teriparatida se recomienda primordialmente como formador de hueso, seguida de la transición al uso de denosumab o de algún bifosfonato, dado el beneficio en la ganancia de DMO con esta secuencia49,50.
Una de las fortalezas del presente estudio que permite emitir una postura sobre el tratamiento de la OP severa radica en haber utilizado metodologías de búsquedas bibliográficas sólidas y haber consultado bases de datos confiables, así como la incorporación de investigadores especialistas en diversas áreas del conocimiento, lo que permitió un abordaje integral y multidisciplinario.
Dada la naturaleza de los estudios de resumen, el presente trabajo tiene como principal limitación la inclusión de estudios con alta heterogeneidad en las características de la población incluida, deficiencia atribuida a la disponibilidad de estudios primarios.
La postura de este grupo de trabajo basada en la evidencia publicada se puede sintetizar en los siguientes puntos: a) ambos medicamentos cuentan con evidencia de alta calidad de acuerdo con CASPe y están indicados en el tratamiento de OP severa o establecida, b) la teriparatida y el denosumab pertenecen a clases terapéuticas distintas, con mecanismos de acción biológicamente opuestos e indicaciones de uso claramente diferenciadas en sus respectivas cédulas descriptivas del CBCMSS por lo cual, c) estos medicamentos no deben intercambiarse ni sustituirse en la terapia de OP severa.
FinanciaciónEl presente proyecto fue realizado mediante un grant irrestricto con número 4100501768 de Eli Lilly & Compañía de México, S.A. de C.V. en el que los autores tuvimos autonomía plena en el desarrollo.
Este estudio se realizó por un grupo multidisciplinario de expertos en metodología de revisiones sistemáticas y un grupo de expertos en el tema. Esta revisión fue avalada por el Colegio Mexicano de Reumatología, el Colegio Mexicano de Ortopedia y la Asociación Mexicana de Metabolismo Óseo y Mineral.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.