El desenlace de la infección por SARS-CoV-2 (COVID-19) afecta fundamentalmente al campo pulmonar, ocasionando un cuadro de síndrome de distrés respiratorio agudo (SDRA). Este proceso es un cuadro inflamatorio protagonizado por una cascada de citocinas bajo el amparo del inflamasoma NLRP3, responsable principal de la destrucción alveolar. De entre todas las citocinas que se desencadenan en este cuadro destaca la IL-1ß. Anakinra es un potente fármaco biológico, capaz de bloquear esta IL-1ß. Proponemos su uso, de cara a controlar el SDRA secundario a la infección por COVID-19.
The outcome of the SARS-CoV-2 (COVID-19) infection fundamentally affects the lung field, causing acute respiratory distress syndrome (ARDS). This process is an inflammatory picture, involving an NLRP3 inflamosome-triggered cytokine storm, the main player in alveolar destruction. IL-1 beta stands out among the cytokines that are triggered in this picture. Anakinra is a potent biological drug, capable of blocking this IL-1ß. We propose its use in controlling ARDS secondary to COVID-19 infection.
Una de las complicaciones más graves de los pacientes infectados por COVID-19 es un cuadro de fracaso cardiopulmonar denominado síndrome de distrés respiratorio agudo (SDRA)1.
Desde 1995 han sido varios los autores que apuntan el papel central de la IL-1 Beta (IL-1β) en la cascada inflamatoria del SDRA2,3. Existen 2 publicaciones que incluyen más de 20 pacientes, en las que se observan niveles elevados en plasma y lavado broncoalveolar de IL-1β. A estas publicaciones se unen otras muchas que describen un incremento de innumerables citocinas proinflamatorias (IL-1, IL-6, TNF-alfa, IL-8, etc.) en el interior del alveolo de aquellos pacientes con SDRA4.
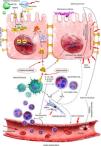
En 2018, Aranda-Valderrama y Kaynar, publican un modelo para conocer el flujo de citocinas y células proinflamatorias existentes en el alveolo pulmonar de aquellos pacientes afectados por SDRA5. Se observa como en el interior de los macrófagos alveolares, IL-1β inactiva (pro IL-1β) progresa hacia IL-1β activa (fig. 1). Esta IL-1β genera una activación del macrófago alveolar, y con ello desencadena la liberación de moléculas proinflamatorias tales como IL-6, IL-18, TNF, G-CSF y CCCL2.
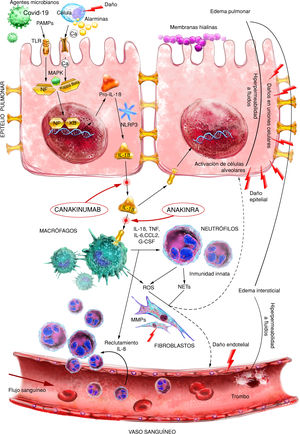
Patogénesis del síndrome de distrés respiratorio agudo (SDRA) que se desencadena después de una lesión inicial que interactúa a través de receptores de alarmina y TLR que activan factores de transcripción nuclear, incluido NF-κB. Posteriormente, una potente respuesta inmune aguda desencadenada principalmente por IL-1ß provoca la activación y el reclutamiento de macrófagos/neutrófilos. La respuesta inmune mediada por células produce daño tisular, lo que permite el desarrollo de edema y daño epitelial.
IL: interleucina; MAPK: proteína quinasa activada por mitógeno; MMPs: metaloproteinasas de la matriz extracelular; NETs: trampas extracelulares de neutrófilos; PAMPS: patrón molecular asociado a patógenos; ROS: especies reactivas de oxígeno; TLR: receptor tipo toll.
Fuente: versión adaptada del original de Aranda-Valderrama P. et al. Ilustrador científico: Miguel Soto.
En el 2006, He et. al. estudiaron el elevado número de citocinas inflamatorias existentes en pacientes con SDRA secundario a la infección por un coronavirus (CoV). En las autopsias de estos pacientes se demostró elevación de MCP-1, TGF-β1, TNF-α, IL-1β e IL-66.
En esta y otras publicaciones7, también se analiza al inflamasoma NLPR3 y su influencia en la activación de macrófagos alveolares en pacientes con SDRA. Se trata de un complejo de proteínas que interactúan de forma unidireccional generando una cascada inflamatoria. La inmunidad innata responde a la infección y al daño tisular activando a esta plataforma molecular. En las investigaciones clínicas con humanos, se han descrito cuatro clases de inflamasomas relacionados con procesos inflamatorios: NLRP1, NLRC4, NLRP3 y AIM-28. De ellos, NLRP3 es el mejor estudiado. Los inflamasomas tienen como finalidad común el procesamiento y activación de la caspasa-1, enzima responsable de la maduración de pro-IL-1β y pro-IL-189,10.
Este grupo proteico puede detectar patrones moleculares vinculados a un peligro potencial, ya sean señales endógenas (DAMPs) o exógenas (PAMPs) que activan diversas rutas de señalización intracelular, principalmente a través de los receptores de membrana Toll-like receptors (TLRs), que culmina con la activación de diferentes factores de transcripción proinflamatorios como el factor nuclear kappa B (NF-kB) o la proteína activadora 1 (AP-1). Estas señales de peligro también pueden dar lugar a la activación del inflamasoma y la maduración de IL-1β e IL-18 (fig. 2). El inflamasoma NLRP3 puede causar daño epitelial y endotelial en el parénquima pulmonar, ocasionando alteraciones respiratorias graves tales como SDRA y lesión pulmonar aguda (ALI), con la posible consecuencia de una neumonía grave11.
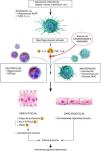
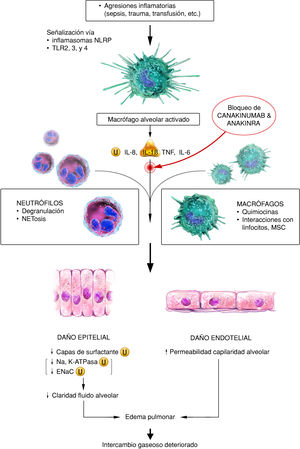
Fisiopatología del SDRA. El estímulo inflamatorio inicial activa a macrófagos alveolares a través de señalización TLR y NLRP. Los macrófagos alveolares activados liberan citosinas proinflamatorias y reclutan macrófagos circulantes y neutrófilos a los sitios lesionados. Esta afluencia de neutrófilos y macrófagos activados persistentemente causan daños extensos en epitelios y endotelios pulmonares, lo que da como resultado un deterioro barrera alveolar-capilar.
ENaC: canal de sodio epitelial; Na: sodio; NET: trampas extracelulares de neutrófilos; TLR: receptor tipo toll; U: ubiquinización.
Fuente: versión adaptada del original de Seung Hye Han. et al. Ilustrador científico: Miguel Soto.
Es probable que la infección por COVID-19 pueda ocasionar una respuesta inmune violenta y a su vez activar al inflamasoma NLRP3 en los macrófagos alveolares, causando una «tormenta de citocinas» potencialmente mortal, de entre las que destaca IL-1β.
Actualmente contamos con un fármaco llamado anakinra, que neutraliza la actividad biológica de la interleucina-1 alfa y ß al inhibir, por mecanismos competitivos su unión al receptor de tipo i de la interleucina-1. Otra molécula disponible es canakinumab, que se une con alta afinidad específicamente a la IL-1β y neutraliza su actividad biológica mediante el bloqueo de la interacción con los receptores IL-1, lo que permite prevenir la activación del gen, inducida por IL-1β y la producción de mediadores inflamatorios.
Estos fármacos capaces de bloquear la actividad de la IL-1β, han demostrado eficacia en el tratamiento de enfermedades autoinflamatorias como enfermedad inflamatoria multisistémica de inicio neonatal (CINCA), síndrome de Muckle-Wells (MWS), síndrome autoinflamatorio familiar por frío (FCAS), enfermedad de Still y enfermedades asociada a las criopirinas, una rara enfermedad genética causada por una mutación autosómica dominante en el gen NLRP312,13.
Relacionar la presencia de un inflamasoma NLRP3 en el origen de la cascada inflamatoria de un cuadro de SDRA es un hecho, que la literatura médica se ha encargado de confirmar11,12. El camino iniciador de la IL-1β la convierte en una diana específica y central para poder controlar el cuadro proinflamatorio generado en el alveolo pulmonar. Constituye así una posible diana terapéutica en aquellos pacientes que tras la infección por COVID-19 pueden progresar hacia el SDRA. El uso de anakinra (anti IL 1β R) o canakinumab (anti-IL-1β) constituyen una opción terapéutica para controlar la inflamación alveolar secundaria a infección por COVID-1914,15.
No obstante, son fármacos distintos con farmacocinéticas y farmadinámicas igualmente diferentes. La concentración sérica máxima (Cmáx) de canakinumab se produce aproximadamente a los 7 días tras una administración única de 150mg por vía subcutánea a pacientes con síndrome periódico asociado a criopirinas (CAPS adultos). La semivida terminal media es de 26 días y los valores medios de concentración plasmástica máxima (Cmáx) después de una única dosis subcutánea de 150mg en un paciente adulto común de CAPS (70kg) es de15,9μg/ml y una biodisponibilidad absoluta administrado por vía subcutánea del 66%15. Anakinra, en cambio tiene una biodisponibilidad absoluta del 95% para adultos sanos después de un bolo de 70mg de inyección subcutánea. Las Cmáx de anakinra se producen generalmente de 3 a 7h tras la administración subcutánea de dosis clínicamente relevantes (1-2mg/kg/día) y la vida media terminal oscila de 4 a 6h. Por ello, es un fármaco de vida media más corta que el canakinumab y, por tanto, con grandes posibilidades de ser usada en una situación de urgencia clínica como es el SDRA por COVID-1914.
Es probable que el uso de terapias biológicas inmunosupresoras sea uno de los caminos que hagan controlar el SDRA por COVID-19. Pero más allá del potencial individual de cada molécula, habrá que plantear otros escenarios en el que incluso se puedan adicionar 2 o más de estas líneas de tratamiento. Pese a que necesitamos ensayos clínicos aleatorizados que nos hagan avanzar en la seguridad y la eficacia del anakinra en el SDRA por COVID-19, se debe considerar esta opción cuando los tratamientos actuales sean ineficaces o no estén disponibles.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.