Actualmente no se cuenta con instrumentos clinimétricos para la medición de la gravedad del síndrome de Cushing iatrógeno (SCI). Sonino et al. crearon un índice clínico de gravedad del síndrome de Cushing endógeno (IGC), pero no ha sido aplicado a pacientes con SCI.
ObjetivoValidar y determinar la utilidad del IGC y su correlación con variables clínicas en pacientes reumatológicos con uso de glucocorticoides (GC) de forma continua.
Sujetos y métodosSe incluyó a pacientes con antecedentes de uso de GC sistémicos de forma continua indicados para el tratamiento de la enfermedad reumatológica, por lo menos durante 4 semanas. Todos los pacientes rellenaron un cuestionario sobre datos sociodemográficos, características de los GC empleados, la forma de uso y la presencia o ausencia de eventos adversos. Se aplicó el IGC por 2 observadores de forma independiente. Se calculó la consistencia, la concordancia interobservador y un análisis de componentes principales.
ResultadosSe estudió a 32 pacientes con edad promedio de 35,72±12,8 años; 29 eran mujeres (90,6%). La calificación promedio del IGC por el primer observador fue de 3,50±2,02 y la del segundo observador fue de 2,31±1,75 (p=0,004). La concordancia interobservador fue baja en los ítems con definiciones imprecisas, por lo cual se modificaron las definiciones para mejorar su desempeño. Los puntajes del IGC correlacionaron con la presencia de efectos adversos y el tipo de dosis utilizada.
ConclusionesEl IGC tiene una adecuada correlación con manifestaciones clínicas en pacientes con uso crónico de GC. Las características clinimétricas del cuestionario mejoraron al estandarizar las definiciones de variables clínicas subjetivas.
Currently there are no clinimetric instruments for the measurement of the severity of iatrogenic Cushing's syndrome (ICS). Sonino et al. created a clinical severity index of endogenous Cushing's disease (CSI) but it has not been applied to patients with ICS.
ObjectiveTo validate and determine the utility of the CSI and its correlation with clinical variables in rheumatological patients with continuous use of glucocorticoids (GC).
Subjects and methodsPatients with a history of continuous systemic GC use (for at least 4 weeks) indicated for treatment of rheumatological disease were included. All the patients filled out a questionnaire on sociodemographic data, characteristics of the CG used; the way of use and the presence or absence of adverse events. The CSI was applied by 2 observers independently. Consistency, interobserver concordance and principal component analysis were calculated.
ResultsA total of 32 patients with an average age of 35.72±12.8 years were studied; 29 were women (90.6%). The average CSI score by the first observer was 3.50±2.02, and by the second observer was 2.31±1.75 (p=.004). The interobserver concordance was low in the items with imprecise definitions; for which modifications were made in the definitions to improve their performance. The CSI scores correlated with the presence of adverse effects and the type of dose used.
ConclusionsThe CSI has an adequate correlation with clinical manifestations in patients with chronic use of GC. The clinimetric characteristics of the questionnaire improved by standardising the definitions of subjective clinical variables.
El síndrome de Cushing iatrogénico (SCI) se debe a la exposición crónica a un exceso de glucocorticoides (GC) sintéticos que inhiben la función del eje hipotálamo-hipófisis-suprarrenal1. El cuadro clínico es multisistémico y los signos y síntomas aparecen de forma progresiva en función del tiempo de uso y de la dosis. Las manifestaciones clínicas más frecuentes son la obesidad central (90%), que afecta la cara, cuello, tronco y abdomen y genera la «facies de luna llena» y la «giba de búfalo». En la piel pueden presentarse hematomas (35%), acné (35%), estrías (50%) e hirsutismo (75%). Puede desarrollarse hipertensión arterial en el 85% de los casos, intolerancia a la glucosa en el 75% y diabetes en el 20%. Los pacientes pueden desarrollar osteoporosis, miopatía proximal y alteraciones neuropsiquiátricas1-3.
Actualmente no se cuenta con instrumentos clinimétricos para la medición de la gravedad del SCI. Sonino et al. crearon un índice clínico de gravedad de Cushing endógeno (IGC) (Cushing's syndrome severity index o CSI). Es un índice que incluye 8 ítems que se califican de 0 a 3, con un puntaje de 0-164. La graduación de los signos clínicos se basó en el juicio y experiencia del médico. La validación se realizó en 14 pacientes con síndrome de Cushing endocrinológico evaluados de manera independiente por 2endocrinólogos antes y después del tratamiento. La calificación promedio obtenida antes del tratamiento fue de 8,5±2,7 (observador 1) y de 8,4±2,8 (observador 2) y después del tratamiento de 1,9±1,6 para los 2observadores (p <0,001) en ambos casos. La concordancia interobservador medida por kappa fue de 0,45 (piel) a 1,00 (hipertensión arterial, diabetes mellitus e hipopotasemia). El coeficiente de correlación intraclase fue de 0,95 antes del tratamiento y de 0,87 después, con una adecuada discriminación posterior a tratamiento (p <0,001). El IGC correlacionó con el nivel de cortisol urinario y con 2escalas globales: una de gravedad y otra de cambio al tratamiento medidas por el médico. Este instrumento no se ha empleado en pacientes con SCI, por lo que se desconocen sus características clinimétricas en este grupo de pacientes, aunque se espera que sean similares a las de los pacientes con síndrome de Cushing endógeno.
El objetivo de este estudio fue validar y determinar la utilidad del IGC y su correlación con variables clínicas en pacientes reumatológicos con uso de GC de forma continua.
Sujetos y métodosSe realizó la traducción directa al español del IGC por 2traductores bilingües cuya lengua materna era el español. Posteriormente se escogió una de las traducciones en una reunión de consenso con base en la equivalencia lingüística y semántica. Después se encargó una traducción inversa (retrotraducción) a un traductor bilingüe cuya lengua materna era el inglés, sin conocimiento previo del instrumento, y su traducción se comparó con el instrumento original. En una reunión de consenso se determinó la versión que se utilizó en el presente estudio (anexo I).
Se seleccionó a pacientes con enfermedades reumatológicas, tanto hospitalizados como de consulta externa, en un período de 6 meses. Se incluyó a pacientes mayores de 18 años, que aceptaron participar en el estudio, con antecedentes de uso de GC sistémicos de forma continua indicados para el tratamiento de la enfermedad reumatológica, o por autoprescripción, por lo menos durante 4 semanas y se agruparon con base en la dosis de GC: bajas si eran ≤7,5mg de prednisona, dosis medias si eran>7,5 y hasta 30mg de prednisona al día y dosis altas a las mayores de 30mg al día5. Todos los pacientes rellenaron un cuestionario dirigido por un encuestador, que abarcaba tanto datos sociodemográficos como las características de los GC empleados, la forma de uso y la presencia o ausencia de eventos adversos.
Se calcularon las dosis diarias y acumuladas en miligramos de prednisona o equivalente. Para valorar la concordancia interobservador 2 observadores aplicaron el IGC de forma independiente el mismo día que acudió el paciente a su consulta. A todos los pacientes se les midió el cortisol sérico en ayunas por quimioluminiscencia, con valores de referencia de 50 a 250 ng/ml. La calidad de vida se midió en todos con el EuroQoL 5D, con una escala visual análoga de salud global del paciente de 0 a 100.
Modificaciones al índice de gravedad del síndrome CushingLas variables clínicas como obesidad central, alteraciones cutáneas y debilidad muscular se redefinieron y, en lugar de usar calificaciones poco objetivas por apreciación del observador, se crearon definiciones más objetivas.
En el ítem 1 (distribución de la grasa) se decidió usar el índice cintura/cadera como medida de obesidad central6. Se consideraron valores normales de <0,95 en hombres y <0,85 en mujeres; obesidad central leve de 0,95 a 1,0 en hombres y de 0,85 a 0,90 en mujeres y obesidad central marcada a valores de>1,0 en hombres y>0,95 en mujeres. La existencia de facies de luna llena fue considerada una agravante que aumentó un punto en las categorías de normal (0), leve/moderada (1) y sin cambios en la categoría grave (2). En el ítem 2 (lesiones cutáneas) se decidió usar de forma arbitraria la regla de los 9, utilizada en quemaduras7 para determinar la extensión de las lesiones, y se consideró que la afección ≤18% de la superficie corporal era una afección leve y una>18% era una afección grave. En el ítem 3 (debilidad muscular) se utilizó la escala de Daniels de fuerza muscular, en la que la ausencia de contracción es 0, la contracción sin movimiento es 1, el movimiento activo a favor de la gravedad es 2, el movimiento activo que vence gravedad es 3, el movimiento activo que vence gravedad y resistencia parcial es 4 y la fuerza normal es 5. En el índice se consideró debilidad muscular ausente (grado 5), debilidad muscular leve/moderada (grados 3 a 4) y grave (grados 0 a 2). El resto de los ítems se conservó sin cambios (anexo II).
Para el análisis estadístico, se utilizó estadística descriptiva y se calcularon las medidas de tendencia central y de dispersión (medias y desviación estándar para variables numéricas y frecuencias para variables categóricas y nominales). Para las comparaciones se utilizó la prueba de χ2 o de Wilcoxon para las variables no paramétricas y la prueba de t de Student o ANOVA para las variables numéricas. La significación estadística se consideró menor a 0,05. Para la concordancia interobservador se utilizó kappa para los ítems y coeficiente de correlación intraclase para la calificación global. La homogeneidad entre los ítems se midió con el αde Cronbach. El análisis de componentes principales se hizo utilizando el estadístico Kaiser-Meyer-Olkin y se emplearon rotaciones ortogonal (varimax) y oblicua (promax) para determinar la uni- o multidimensionalidad del índice.
ResultadosSe estudió a 32 pacientes con edad promedio de 35,72±12,8 años, de los cuales, 29 eran mujeres (90,6%). La escolaridad promedio fue de 10,94±3,66 años. Los diagnósticos reumatológicos principales fueron: lupus eritematoso sistémico en 14 pacientes (43,8%), artritis reumatoide en 9 (28,1%), vasculitis primaria en 4 (12,5%), gota en 3 (9,4%), enfermedad humana por modelantes en uno (3,1%) y síndrome de hombro doloroso en un paciente (3,1%). La calificación promedio del EuroQoL 5D fue de 0,83±0,21. La EVA de salud global medida por los pacientes fue de 72,4±23,7mm.
Características del uso de glucocorticoidesLos principales GC utilizados (algunos utilizaron más de uno) fueron prednisona en 23 pacientes (71,9%), 6 pacientes con dexametasona (18,8%), 5 con betametasona (15,6%), 2 con deflazacort (6,3%), 6 con administración de metilprednisolona intravenosa (18,8%) y 3 con parametasona (9,3%). La principal vía de administración de los GC fue oral en 20 pacientes (62,5%), en 3 la vía intramuscular (9,4%) y en 9 pacientes (28,1%) se administraron los GC por vías combinadas (oral e intramuscular o intravenosa). La mediana de tiempo de uso de GC fue de 7,85 (1,50-144 meses). La mediana de la dosis diaria fue de 19 (0,23-665) mg/día. La mediana de la dosis acumulada de GC fue de 4.962,5 (170-54.000) mg.
Con base en la dosis diaria de prednisona o equivalente se dividieron en 3 grupos. El grupo de dosis bajas (n=10) tuvo una ingesta promedio de 4,89±2,11mg/día. En el grupo de dosis medias (n=11), la ingesta promedio fue de 16,67±6,03mg/día. Finalmente, en el grupo de dosis altas (n=11), la ingesta promedio fue de 184,66±240,9mg/día (p=0,010).
La razón de uso señalada por el paciente fue por actividad de la enfermedad de base en 20 casos (62,5%) y por dolor en el resto.
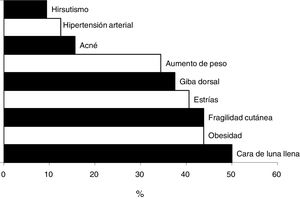
Solo a 11 pacientes (34,4%) el médico que prescribió el GC les informó acerca de los efectos adversos posibles. Después de la valoración por el médico, se reportaron efectos adversos secundarios al uso de GC en 28 pacientes (87,5%) con una mediana de 2 (1-7) de efectos adversos (fig. 1).
En 12 pacientes (37,5%) se reportó una suspensión brusca del tratamiento con GC y, de ellos, en 8 (67%) se reportaron manifestaciones de supresión.
El valor promedio de cortisol en el grupo de dosis bajas fue de 38,45±123,78 ng/ml y en los de dosis medias a altas fue de 9,6±9,6 ng/ml (p <0,000). El cortisol sérico correlacionó con la dosis acumulada de GC (r=0,75; p=0,013).
Resultados de la aplicación del índice de gravedad del síndrome CushingLa calificación promedio del IGC por el primer observador fue de 3,50±2,02 y del segundo observador fue de 2,31±1,75 (p=0,004).
El α de Cronbach de los 8 ítems del IGC del primer observador fue de 0,53 y de 0,42 para el segundo observador. El coeficiente de correlación intraclase de la calificación global de ambos observadores fue de 0,895. En la tabla 1 se observa que varios ítems, al ser eliminados, podrían mejorar la consistencia global del índice, por lo que podrían ser redundantes.
Consistencia del indice de gravedad en síndrome de Cushing
| Ítems IGC (CSI) | Alfa de Cronbach si se elimina el elementoObservador 1 | Alfa de Cronbach si se elimina el elementoObservador 2 |
|---|---|---|
| Distribución de la grasa | 0,312 | 0,297 |
| Lesiones cutáneas | 0,439 | 0,292 |
| Debilidad muscular | 0,504 | 0,481 |
| Trastornos del estado de ánimo | 0,456 | 0,491 |
| Hipertensión | 0,583 | 0,479 |
| Diabetes | 0,402 | 0,337 |
| Hipocalemia | 0,550 | 0,459 |
| Alteraciones relacionadas con el género | 0,608 | 0,499 |
| Alfa de Cronbach Total | 0,531 | 0,424 |
IGC: índice de gravedad de Cushing (CSI: Cushing's syndrome severity index).
Las calificaciones promedio y la concordancia interobservador de cada uno de los ítems que comprende el IGC, así como la significación estadística, se describen en la tabla 2.
Variabilidad interobservador del IGC
| IGC | |||||
|---|---|---|---|---|---|
| Ítem | Observador 1Media (DE) | Observador 2Media (DE) | p | Kappa | Kappa con modificaciones |
| 1 | 0,84 (0,85) | 0,78 (0,87) | 0,423 | 0,707 | 0,54 |
| 2 | 0,84 (0,57) | 0,59 (0,67) | 0,018 | 0,375 | 0,81 |
| 3 | 0,06 (0,25) | 0,13 (0,34) | 0,325 | 0,273 | 0,80 |
| 4 | 0,75 (0,44) | 0,19 (0,40) | 0,000 | 0,048 | 1,00 |
| 5 | 0,16 (0,52) | 0,16 (0,52) | 1,0 | 1,0 | 1,00 |
| 6 | 0,16 (0,37) | 0,16 (0,37) | 1,0 | 1,0 | 1,00 |
| 7 | 0,03 (0,18) | 0,03 (0,18) | 1,0 | 1,0 | 1,00 |
| 8 | 0,59 (0,67) | 0,44 (0,56) | 0,057 | 0,772 | 0,82 |
| Total | 3,50 (2,02) | 2,31 (1,75) | 0,000 | 0,132 | 0,55 |
IGC: índice de gravedad en síndrome de Cushing.
Los ítems 2 y 4 fueron los que tuvieron una menor concordancia.
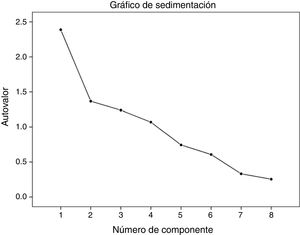
En el análisis de componentes principales se encontraron 4 componentes que explicaron el 75,8% de la variabilidad (fig. 2). La matriz de componentes y las rotaciones colocaron en el primer componente los ítems 1, 2 y 6; en el componente 2, los ítems 3 y 5; en el componente 3, los ítems 4 y 7 y en el componente 4 el ítem 8.
Al estratificar a los pacientes por la dosis de GC empleada, se observó que los pacientes con uso de dosis altas tuvieron mayores puntajes del IGC que los de dosis bajas y medias. También se observó una tendencia de un puntaje significativamente mayor del primer investigador en relación con el segundo (tabla 3).
Los puntajes del IGC correlacionaron de forma inversa con el EuroQoL5D con r=−0,50 (p=0,015), pero no correlacionaron con la EVA de salud global del paciente ni con los niveles de cortisol, las dosis diarias, la dosis acumulada ni con el tiempo de uso, pero sí con la presencia de efectos adversos y el tipo de dosis utilizada (tabla 4).
Correlación del IGC con variables relacionadas con el uso de glucocorticoides y presencia de efectos adversos
| Característica | IGC observador 1r(p) | IGC observador 2r (p) |
|---|---|---|
| Dosis diaria | 0,30 (0,10) | 0,30 (0,11) |
| Dosis acumulada | 0,22 (0,25) | 0,32 (0,08) |
| Tiempo de uso | 0,16 (0,40) | 0,13 (0,49) |
| Tipo de dosis | 0,49 (0,006) | 0,55 (0,002) |
| Número de efectos adversos | 0,70 (0,000) | 0,61 (0,000) |
| Presencia de efectos adversos | 0,44 (0,000) | 0,32 (0,088) |
IGC: índice de gravedad en síndrome de Cushing.
Efectos de las modificaciones: El IGC modificado tuvo calificaciones promedio de 3,30±2,5. El αde Cronbach mejoró a 0,68 y la concordancia interobservador también mejoró de forma significativa (tabla 2). Con estas modificaciones, en el análisis de componentes principales se redujo a 3 componentes que explican el 69,36% de la varianza. En el primer componente se ubican los ítems 3, 5, 6 y 7; en el componente 2 los ítems 1, 2 y 8 y finalmente en el componente 3 solo el ítem 4.
DiscusiónLos pacientes con enfermedades reumatológicas usan con frecuencia GC debido a su efecto antiinflamatorio e inmunomodulador. Se estima que los GC se utilizan de forma crónica en el 0,5-1% de la población general y en el 2,5% de los adultos mayores8 y es prescrito en más del 50% de pacientes con artritis reumatoide o lupus eritematoso sistémico. Los efectos indeseables al uso de GC se relacionan con la dosis, duración del tratamiento; alteraciones en el metabolismo y velocidad de excreción del fármaco, hipoalbuminemia y, tal vez, factores idiosincrásicos; aunque existen pocos estudios al respecto9-11. Uno de los efectos adversos asociados al uso de GC es el SCI, que se presenta en un alto porcentaje de los pacientes en tratamiento con dichos fármacos. A pesar de la frecuencia no existen instrumentos clinimétricos para su valoración.
El IGC (CSI) fue creado para valorar la respuesta al tratamiento en pacientes con síndrome de Cushing endógeno, y se ha demostrado su utilidad en este grupo de pacientes4, aunque no se había aplicado en pacientes con SCI.
Al aplicar este índice en pacientes con uso crónico de GC (sin demostrar la inhibición del eje hipotálamo-hipófisis-suprarrenal, ya que solo se pudo medir el cortisol sérico pero no ACTH) se encontró una calificación promedio de 3,50±2,02 en el primer observador y de 2,3±1,75 en el segundo observador, cifras menores a las reportadas por Sonino et al.4, cuyas calificaciones promedio fueron de 8,5±2,7 y de 8,4±2,8 para el primero y segundo observador, respectivamente, lo que podría justificarse por el hecho de que estos pacientes tenían un síndrome de Cushing florido y en nuestro caso no todos los pacientes tenían facies característica y solo se incluyeron con base en el antecedente de uso de GC.
Al igual que en la valoración inicial de este instrumento por sus autores, nosotros encontramos una concordancia interobservador perfecta (kappa 1) en las variables de laboratorio como hiperglucemia o hipercalemia asi como en la determinación de hipertensión arterial, aunque en nuestro estudio la concordancia interobservador en variables más subjetivas como lesiones cutáneas, distribución de la grasa, alteraciones de la conducta o alteraciones sexuales fue más baja (0,048 a 0,375) de la reportada por Sonino et al. (0,45 a 0,61). La posible explicación de este fenómeno es que estas variables no tienen una definición estricta y son calificadas de manera subjetiva por el médico. Al modificar las definiciones, se mejoraron de forma significativa las kappas de estos ítems y el αde Cronbach global. En el análisis por componentes principales se demostró que no es un índice unidimensional ya que está formado de 4 componentes en su versión original y por 3 componentes en la versión modificada.
No se encontró una adecuada correlación de la calificación del IGC con los niveles de cortisol, la dosis diaria, dosis acumulada ni en el tiempo de uso de GC, pero sí con el tipo de dosis (alta, media o baja) utilizada e incluso se encontraron diferencias significativas de la calificación del IGC entre los que usaron dosis altas y los de dosis bajas y medias. También hubo una adecuada correlación del IGC con la presencia y número de efectos adversos, aunque esto era esperado, pues los ítems del IGC son efectos adversos estratificados con base en su gravedad.
En relación con la presencia de efectos adversos, se reportaron en el 93,3% de nuestra muestra, cifra similar a la reportada en un estudio poblacional con uso de GC a dosis bajas durante ≥ 60 días que incluyó a 2.446 personas con una dosis diaria promedio de prednisona o equivalente de 16±14mg y reportó que el 90% de los pacientes tuvo al menos un efecto adverso asociado8.
Algunas de las limitaciones de nuestro estudio son el hecho de que no se midieron los niveles de ACTH en nuestros pacientes para demostrar inhibición del eje hipotálamo-hipófisis-suprarrenal y poder así correlacionar la puntuación del IGC con esta variable, además no se hizo una búsqueda intencionada de efectos adversos, como la realización de densitometría ósea o revisión oftalmológica. También la heterogeneidad de enfermedades estudiadas y uso de diferentes glucocorticoides y vías de administración pueden sesgar los resultados del estudio. El objetivo principal fue validar el instrumento para poder usarlo en una población mayor para obtener mejores resultados e incluso emplearlo de forma prospectiva para valorar la sensibilidad al cambio del IGC.
ConclusionesEl IGC tiene una adecuada correlación con manifestaciones clínicas en pacientes con uso crónico de GC. El cuestionario mejoró al estandarizar las definiciones de variables clínicas subjetivas, por lo que se recomienda esta versión. Es un índice sencillo con buena reproducibilidad que puede ser útil en la valoración de pacientes con SCI.
FinanciaciónNinguno de los autores recibió apoyos financieros ni otros beneficios de fuentes comerciales para el trabajo reportado en este manuscrito.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.