Describir la estrategia terapéutica óptima de uso de metotrexato en AR sobre dosis inicial, vía de administración, incremento y disminución de dosis, seguimiento del paciente y uso de ácido fólico/folínico.
Material y métodoOnce expertos plantearon los interrogantes clínicos a resolver. Se realizó una búsqueda bibliográfica sistemática. Los contenidos fueron seleccionados en una sesión de trabajo y el nivel de acuerdo se estableció posteriormente en una ronda de consenso vía correo.
ResultadosLa dosis de inicio de metotrexato no debe ser <10mg/semana, preferentemente por vía oral, considerando la vía parenteral como alternativa según el cumplimento, ineficacia o efectos secundarios gastrointestinales, polimedicación, obesidad (si requiere dosis >20mg/semana), preferencias del paciente, enfermedad muy activa o para evitar errores de medicación. Se cambiará a la vía parenteral cuando haya ineficacia, toxicidad gastrointestinal, incumplimiento o por coste-efectividad antes de pasar a fármacos más caros; y a la inversa, según preferencias del paciente, intolerancia a inyectables, reducción de dosis <7,5mg/semana, ineficacia, bajo cumplimiento o efectos adversos gastrointestinales. Se realizará escalada rápida de dosis si la respuesta es inadecuada hasta los 15-20 o, incluso, 25mg/semana en unas 8 semanas, con incrementos de 2,5-5mg. La reducción se realizará según la dosis a la que estuviera el paciente, con disminuciones de 2,5-5mg cada 3-6 meses. El seguimiento del paciente deberá realizarse cada 1-1,5 meses hasta la estabilidad y luego cada 1-3 meses.
ConclusionesEste documento pretende resolver algunos interrogantes clínicos habituales y facilitar la toma de decisiones en la AR tratada con metotrexato.
To describe the optimal therapeutic strategy for use of methotrexate in RA patients over the initial dose, route of administration, dose increase and decrease, patient monitoring, and use of folic/folinic acid.
Material and methodEleven clinical experts proposed some questions to be solved. A systematic literature search was conducted. The contents were selected in a work session and subsequently validated via email to establish the level of agreement.
ResultsThe initial dose of methotrexate should not be <10mg/week, preferably orally, but considering the parenteral route as an alternative due to compliance, non effectiveness of treatment or gastrointestinal side effects, polypharmacy, obesity (if required doses are >20mg/week), patient preference, very active disease or to avoid administration errors. Changing to a parenteral administration is proposed when the oral route is not effective enough, gastrointestinal toxicity appears, there is non-compliance or due to cost-effectiveness reasons before using more expensive drugs. On the contrary, due to patient preferences, intolerance to injections, dose reduction <7.5mg/week, non effectiveness of the route, poor compliance or gastrointestinal side effects. There should be a rapid dose escalation if inadequate responses occurr up to 15-20 or even 25mg/week in about 8 weeks, with increments of 2.5-5mg. The reduction will be carried out according to the dose the patient had, with decreases of 2.5-5mg every 3-6 months. Patient monitoring should be performed every 1-1.5 months until stability and then every 1-3 months.
ConclusionsThis document pretends to solve some common clinical questions and facilitate decision-making in RA patients treated with methotrexate.
El uso correcto de los fármacos antirreumáticos modificadores de la enfermedad (FAME) ha mejorado el pronóstico de la AR en función de su utilización precoz y la fijación de un objetivo terapéutico concreto, buscando alcanzar la remisión o los mínimos grados de actividad inflamatoria posibles1–3. En este sentido la EULAR recomienda que se debería comenzar el tratamiento con FAME tan pronto como se establezca el diagnóstico de AR4.
El metotrexato (MTX) se lleva utilizando más de 20 años en el tratamiento de la artritis reumatoide. Las características que convierten al MTX en FAME de primera elección están relacionadas con su bajo precio, su perfil de seguridad favorable, su influencia en el enlentecimiento de la progresión radiológica, una experiencia clínica con altas tasas de respuesta y de continuidad terapéutica, y su disponibilidad y versatilidad de dosis y vías de administración. Por lo tanto, tras el diagnóstico de la enfermedad su indicación en primera línea de tratamiento y de forma temprana está claramente definida, como bien recomiendan diversas sociedades4–6, siendo además idóneo como fármaco de anclaje para las terapias combinadas7.
Sin embargo, sigue existiendo una gran variabilidad en la práctica clínica de nuestro país en lo que respecta a las dosis de inicio, la velocidad y pauta de escalado de esta dosis, selección de las vías de administración y dosificación en el uso concomitante del ácido fólico o folínico en pacientes con AR. Esto es debido a que mucha de la práctica asistencial que ejercemos podría no estar claramente sustentada por los adecuados ensayos clínicos.
El objetivo del presente trabajo es establecer unas recomendaciones para la toma de decisiones en el tratamiento con MTX de la AR del adulto, sobre la base de la evidencia científica disponible.
Material y métodosPara la elaboración del documento de consenso se estableció un grupo de expertos que elaboró las recomendaciones (GER), formado por 11 reumatólogos de hospitales del Sistema Nacional de Salud español. El GER trabajó de acuerdo con la base metodológica propuesta por el Plan de calidad del Ministerio de Sanidad y Consumo, en su documento de referencia «Elaboración de guías de práctica clínica en el Sistema Nacional de Salud»8.
El trabajo del GER en los contenidos referentes a la utilización del MTX en el tratamiento de la AR del adulto se realizó a partir de una metodología participativa y estructurada, en la que los miembros del GER identificaron 3 grandes bloques temáticos: a) criterios de indicación; b) dosis y vía de administración inicial y cambios de las mismas a lo largo del tratamiento; y c) criterios para la modificación de las dosis y retirada del MTX. Sobre estos contenidos se elaboró un índice pormenorizado de interrogantes clínicos a resolver, al que posteriormente se le aplicó la metodología PICO, con el fin de facilitar y ordenar el proceso de búsqueda bibliográfica, así como la posterior elaboración de las recomendaciones específicas, en respuesta a cada cuestión planteada. La revisión sistemática de la literatura utilizó como fuentes básicas de consulta originales que contuvieran ensayos clínicos, estudios de cohortes, protocolos de actuación y artículos de revisión y guías clínicas. Los criterios filtro y límites de búsqueda los estableció el GER. El objetivo de todo ello fue hacer viable una lectura crítica actualizada y que recogiera los aspectos fundamentales de la evidencia científica disponible. La búsqueda se realizó para trabajos publicados a partir de 1995, tanto en inglés como en castellano, en bases de datos como Pubmed, Librería Cochrane, Trip data base y los resúmenes de los congresos de la Sociedad Española de Reumatología (2005-2012), The European League Againts Rheumatism (2012) y el American College of Rheumatology (2010-2011), así como en la última actualización disponible de las fichas técnicas de MTX, tanto para formulaciones orales como parenterales (fig. 1).
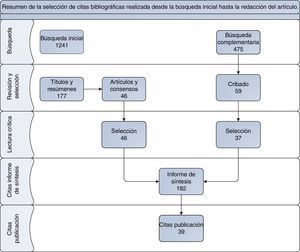
El resultado inicial de la búsqueda alcanzó los 1.241 artículos. Se seleccionaron los artículos relevantes en 2 fases. La primera priorizó los títulos y resúmenes (177), y la segunda priorizó los consensos, revisiones sistemáticas y artículos específicos, más actualizados (46). El GER consideró necesario realizar de forma muy específica una búsqueda complementaria, en determinados ámbitos de atención terapéutica, que no estaban suficientemente definidos en la estrategia de búsqueda inicial (tabla 1). Al predominar los artículos de revisión y guías clínicas de actuación las referencias del informe de síntesis de la literatura se ampliaron por la información referida a un total de 182 citas bibliográficas.
Resultados de la ampliación específica de la búsqueda en temas concretos
| Bloque | Matriz | Cribado | Selección |
|---|---|---|---|
| 1. La eficacia y la toxicidad de los FAME (hidroxicloroquina y leflunomida) con MTX | 84 | 20 | 16 |
| 2. Uso de AAS a dosis de antiagregante conjuntamente con MTX | 16 | 7 | 2 |
| 3-5. Uso de MTX en deseo de embarazo, embarazo y lactancia | 166 | 9 | 4 |
| 6. Uso de MTX en infección intercurrente, por VHC, VHB, VIH, tuberculosis | 42 | 14 | 11 |
| 7. Uso de MTX en cirugía menor y mayor | 123 | 5 | 1 |
| 8. Uso de MTX en vacunación | 13 | 2 | 2 |
| 9. Desescalado: en asociación con un biológico, ¿qué se debería reducir primero? | 17 | 1 | 1 |
| 10. Fraccionamiento de dosis de MTX | 14 | 1 | 0 |
| Total artículos | 475 | 59 | 37 |
La categorización de los niveles de evidencia (NE) y grados de recomendación (GR) se realizó a partir de los criterios del sistema Scottish Intercollegiate Guidelines Network (SIGN)9 que para temas de diagnóstico utiliza los criterios del «Centro de medicina basada en la evidencia de Oxford» (CMBE). Para las recomendaciones que ya tenían NE y/o GR en otros documentos previos se mantuvieron los originales, referenciándolo en cada caso.
El documento de síntesis de las evidencias se evaluó en una sesión presencial participativa, en la que se propusieron 37 recomendaciones y 14 evidencias. Este documento se remitió a los miembros del GER para su valoración individual y votación de su conformidad, en considerar dichas recomendaciones como idóneas respuestas a los interrogantes clínicos planteados. Finalmente, se establecieron como recomendaciones formales validadas las 12 recomendaciones que alcanzaron un acuerdo (A) superior al 70%.
ResultadosA partir de la búsqueda bibliográfica referida y de los artículos priorizados por el GER de forma específica, se elaboró este documento de respuesta a los interrogantes clínicos planteados, que persigue reducir la variabilidad en la utilización de MTX en el tratamiento de la AR del adulto. En este original se presentan las 12 recomendaciones que alcanzaron un mayor acuerdo entre los miembros del GER. De estas, 10 tienen su base científica en 28 de las referencias citadas, mientras que 2 se corresponden a recomendaciones, basadas a partir de la experiencia y opinión especializada del GER.
¿Con qué dosis de metotrexato se debe iniciar el tratamiento de la artritis reumatoide?Es conocido que la eficacia de MTX es dosis dependiente. Resultados de algunos estudios indicaron que una dosis inicial de 7,5mg/semana era a menudo ineficaz y que, en muchos casos, requería un aumento de la dosis después de 6 semanas10,11. Además, una dosis de partida de 12,5 a 20mg/semana fue más efectiva que la dosis de 5-7,5mg/semana, sin diferencias de seguridad12. Por ello, algunos expertos recomiendan una dosis inicial mínima de, al menos, 10mg/semana, aunque es más complicado establecer acuerdos firmes respecto a qué dosis óptima inicial recomendar. No obstante, una revisión sistemática13 defiende una dosis inicial óptima de 10-15mg/semana por vía oral teniendo en cuenta las características específicas de cada paciente. En función de estas evidencias se establece una dosis no inferior a 10mg/semana; aunque también puedan considerarse dosis inferiores según las circunstancias del paciente (comorbilidades, bajo peso, edad, función renal, hepática).
Recomendación 1: para AR la dosis de partida de MTX no debe ser inferior a 10mg/semana y se debe determinar sobre la base de la gravedad de la enfermedad y factores pronósticos relacionados con el paciente14 (NE: 1b/2 [Shekelle]15; GR: C [Shekelle]15; A: 82%).
¿Por qué vía se debe administrar inicialmente el metotrexato?La selección de la vía de administración inicial puede ser compartida entre médico y paciente. Generalmente, el paciente suele preferir la vía oral. Distintos estudios muestran que la biodisponibilidad relativa del MTX por vía oral en comparación con la intramuscular es buena a dosis bajas, pero disminuye a dosis mayores (tabla 1)16–18. Si consideramos que la relación de la biodisponibilidad entre dosis orales y parenterales es de 1 para dosis totales de 7,5mg, pasa a ser de 0,85 (rango 0,77-0,93) cuando la dosis total administrada alcanza los 10-15mg y baja a 0,64 (rango 0,21-0,94) para dosis de 15 a 20mg. Por eso, a dosis menores de 20mg/semana, la facilidad de manejo y el bajo coste del MTX oral lo posicionan como vía preferencial de administración en AR14; en cambio, a partir de 15mg/semana no hay evidencias de que la vía oral sea mejor que la parenteral.
Sin embargo, hay situaciones en las que se considerará de elección la vía parenteral desde el inicio: pacientes polimedicados, con sobrepeso u obesidad (pues las dosis a administrar son más altas), con bajo cumplimiento terapéutico, por preferencia del propio paciente, para reducir determinados efectos adversos gastrointestinales o para evitar errores de medicación. Además, datos experimentales parecen evidenciar que la administración subcutánea (sc) de inicio es especialmente útil en pacientes con enfermedad activa (DAS 28≥4), de larga evolución19.
Recomendación 2: en pacientes con AR se recomienda iniciar el tratamiento con MTX de preferencia por vía oral. No obstante, se debe considerar la vía intramuscular o sc en pacientes con mal cumplimiento, eficacia insuficiente o efectos secundarios gastrointestinales14 (NE: 4 [SIGN]9; GR: D [SIGN]9; A: 91%).
¿Cuándo se debe cambiar la vía de administración?Cambio de vía oral a subcutáneaAlgunos estudios han sugerido que en pacientes con mal cumplimiento, eficacia insuficiente y/o efectos secundarios gastrointestinales (cuando el MTX se administra por vía oral) se debe considerar el cambio a la vía parenteral20–23, ya que se pueden obtener mejores resultados de eficacia. El cambio de vía oral a sc en pacientes con toxicidad o falta de respuesta se ha mostrado útil, alcanzando respuestas de hasta un 30% superiores en los criterios ACR2019. Además, este cambio en pacientes con respuesta inadecuada podría ser coste-efectivo, ya que puede evitar o retrasar la terapia con agentes biológicos23–25.
Recomendación 3: en pacientes con AR tratados con MTX por vía oral las evidencias disponibles justifican el cambio a la vía de administración sc cuando se expresa una falta de respuesta terapéutica frente a la actividad de la enfermedad, o toxicidad gastrointestinal, o se objetiva incumplimiento terapéutico, dado que la vía sc se asocia a mejores resultados de respuesta terapéutica25 (NE: 4 [SIGN]9; GR: D [SIGN]9; A: 100%).
Recomendación 4: por su mejor coste-efectividad algunos estudios sugieren la idoneidad del cambio de administración de MTX oral a parenteral en pacientes con una respuesta inadecuada, ya que las evidencias demuestran que así se evita o retrasa la posterior terapia con agentes biológicos23,25,26 (NE: 4 [SIGN]9; GR: D [SIGN]9; A: 82%).
Cambio de vía subcutánea a oralExisten razones que justifican el cambio de la vía sc a la oral: intolerancia a la administración sc, preferencias del paciente, reducción de dosis a menos de 7,5mg o incumplimiento terapéutico.
Además, se ha observado que si tras haber cambiado de vía sc a oral se desea volver a la vía sc la tasa de respuesta puede ser inferior con respecto a la primera tanda de MTX parenteral19,21.
Recomendación 5: algunos criterios clínico-asistenciales pueden justificar el cambio de la vía de administración de MTX sc a oral en pacientes con AR: preferencias del paciente, intolerancia a la vía de administración sc, disminución de la dosis a niveles <7,5mg/semana, o bajo cumplimiento terapéutico14 (NE: 4,[SIGN]9; GR: D/√ [SIGN]9; A: 82%).
¿Cómo se debe realizar el incremento de la dosis de metotrexato? Pauta y cronologíaAlgunos estudios muestran que dosis iniciales de 25mg/semana por vía oral o estrategias terapéuticas iniciales de escalada rápida de dosis con 5mg/mes hasta los 25-30mg/semana se asocian a una mayor eficacia; aunque con mayor toxicidad en comparación con las pautas iniciales de 5-15mg/semana o estrategias de escalado lento con 5mg/3 meses12,27,28. Estos resultados apoyan que alcanzar dosis altas (25-30mg/semana) en un período corto de tiempo resulta efectivo, pero puede producir más acontecimientos adversos13. Asimismo, debe tenerse en cuenta que otros estudios con estrategias más agresivas frente a la pauta convencional de escalado no han mostrado diferencias estadísticamente significativas en la respuesta terapéutica29,30.
Por otra parte, en el rango de dosis de 2,5 a 30mg/semana de MTX es fácil alcanzar la titulación de dosis con pequeños incrementos de 2,5mg que ofrecen incluso las nuevas formulaciones para administración parenteral. Estas son útiles ante problemas de tolerancia por escalado rápido de dosis y por falta de eficacia con la formulación oral31,32.
Tras evaluar estas evidencias, el panel de expertos validó 2 recomendaciones:
Recomendación 6: una vez establecida la dosis inicial de MTX, si no se consigue con ella la respuesta adecuada en pacientes con AR, se debe proceder a un incremento rápido de su dosis hasta alcanzar los 15-20 o, incluso, 25mg/semana en unas 8 semanas. Antes de realizar un incremento de dosis se debe establecer un periodo de observación clínico-terapéutico de 4 semanas, con la dosis precedente para determinar si esta es o no eficaz. En caso de insuficiente respuesta clínica se recomiendan incrementos de 2,5mg a 5mg cada 2 a 6 semanas, según sea la gravedad clínica, hasta completar un máximo de 25mg semanales24 (NE: 5 [Oxford]33; GR: D [Oxford]33; A: 100%).
En caso de no obtener respuesta tras 8 semanas con la dosis máxima de MTX se deberá interrumpir el tratamiento, tal como indica la ficha técnica de MTX.
¿Cómo se debe realizar el descenso de la dosis de metotrexato? Pauta y cronología. Vía de administraciónDebido a la escasez de evidencias relacionadas con la reducción de dosis de MTX, los expertos acordaron elaborar recomendaciones propias. El objetivo del desescalado es alcanzar la mínima dosis efectiva que mantenga una remisión completa (DAS28<2,6).
Recomendación 7: se recomienda el desescalado cuando haya remisión completa mantenida durante un periodo de tiempo, dependiente de la dosis:
- •
Dosis ≥25mg/semana: se iniciará la reducción de dosis cuando exista remisión mantenida al menos 6 meses.
- •
Dosis <25mg/semana: se iniciará la reducción de dosis cuando exista remisión mantenida al menos 6-12 meses (NE: 4 [SIGN]9; GR: D/√ [SIGN]9; A: 91%).
Recomendación 8: en pacientes con AR, como pauta general del desescalado terapéutico de MTX se recomienda realizar reducciones de 2,5-5mg cada 3-6 meses (NE: 4 [SIGN]9; GR: D/√ [SIGN]9; A: 91%).
Tal como se ha mencionado antes, estudios previos19 muestran las consecuencias que podrían derivarse de los cambios de vía de administración. Por ello, se acuerda:
Recomendación 9: se recomienda mantener la vía que lleve el paciente en el momento de la toma de decisión (NE: 4 [SIGN]9; GR: D/√ [SIGN]9; A: 100%).
No obstante, las dosis por debajo de 15mg son candidatas a vía oral. Por ello, se acuerda:
Recomendación 10: al llegar a dosis <15mg se considera adecuado ofrecer el cambio de sc a oral, con la excepción de intolerancia previa a la vía oral o cuando se sospecha una mejora en la eficacia, relacionada con la vía de administración (NE: 4 [SIGN]9; GR: D/√ [SIGN]9; A: 91%).
Sin embargo, si durante el proceso de desescalado se realiza un cambio de vía de parenteral a oral puede ser necesario incrementar la dosis oral en 2,5-5mg/semana con respecto a la dosis parenteral, para mantener la eficacia del tratamiento.
¿Cuáles son las recomendaciones de evaluación y seguimiento para el paciente con artritis reumatoide que recibe metotrexato?Una monitorización intensiva de la actividad inflamatoria y seguridad del tratamiento de la AR en las fases iniciales de su evolución se relaciona con mejores resultados en la remisión y el control de la actividad inflamatoria de la enfermedad13,34,35. A partir de las directrices ACR36 respecto a la periodicidad adecuada en la monitorización de estos pacientes, Visser et al.13 establecen los parámetros a revisar y la periodicidad, aunque para esta última existen menos evidencias.
Recomendación 11: al iniciar un proceso de aumento de dosis en la terapia con MTX se debe realizar el control analítico de ALT con/sin AST, creatinina y hemograma completo cada mes o mes y medio hasta alcanzar una dosis estable. A partir de la estabilidad clínica y terapéutica se recomienda realizar el seguimiento cada 1-3 meses, observando posibles efectos secundarios y evolución de factores de riesgo en cada visita13 (NE: 4 [Oxford]33; GR: C [Oxford]33; A: 91%).
¿Cuál debe ser la suplementación con ácido fólico en pacientes con artritis reumatoide tratados con metotrexato?El MTX reduce la inflamación por un mecanismo relacionado con el metabolismo del ácido fólico. En algunas personas tratadas con MTX puede existir un déficit de ácido fólico, por lo que la prescripción de ácido fólico o folínico puede mejorar la tolerancia y seguridad del MTX (úlceras orales, molestias gastrointestinales, diarreas, trastornos hematológicos, elevación de transaminasas). El ácido fólico o folínico se tomará en un comprimido de 5mg a la semana, separando la toma al menos un día de la administración del MTX37,38.
La suplementación de rutina con ácido fólico/folínico no afecta en general la eficacia del MTX, aunque los datos de un estudio sugieren que el uso de estos suplementos podría conllevar un aumento ligero de la dosis de MTX para mantener la eficacia39.
Recomendación 12: en pacientes con AR tratados con MTX se recomienda la administración de 5mg de ácido fólico/semana, separando la toma con la de MTX 24h14 (NE: 1a/1b [Shekelle]15; GR: A [Shekelle]15; A: 100%).
DiscusiónEste consenso ha sido realizado con la intención de facilitar la toma de decisiones en la práctica clínica de los médicos implicados en el manejo del paciente con AR tratado con MTX, piedra angular del tratamiento de la AR. La optimización es un proceso que permite modificar un sistema para incrementar su eficiencia o el uso de los recursos disponibles. Este ha sido claramente el objetivo de nuestro consenso, intentando mejorar el perfil de utilización clínica de este fármaco.
Basándonos en los interrogantes clínicos previos se han encontrado evidencias disponibles sobre la dosis inicial de MTX a utilizar10–14,19–26, la vía de administración (y sus posibles intercambios)14,19, escalado terapéutico12,14,24,27,28,31,32,35 y monitorización óptima del paciente con MTX13,36. En función de ellas el panel de expertos ha formulado la recomendaciones correspondientes, insistiendo en aspectos tales como que se debe iniciar a dosis plenas y escalar de forma rápida para conseguir rápidamente el control de la enfermedad. También recalcamos la utilidad que tiene la valoración adecuada de la vía de administración, adaptándola en cada momento a las características del individuo y la situación clínica de la enfermedad.
A modo de conclusión, este documento ofrece unas recomendaciones en el manejo de MTX en pacientes con AR y, especialmente, en el proceso de disminución de dosis, que pueden facilitar al clínico la toma de decisiones y homogeneizar las diferentes formas de proceder.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEl estudio ha podido desarrollarse gracias a una beca sin restricciones ofrecida por Gebro Pharma, S.A.
Conflicto de interesesEl Dr. Jesús Tornero Molina ha recibido pagos por proyectos de investigación y conferencias de Abbvie, Gebro, Pfizer y Roche.
El Dr. Jordi Carbonell declara tener contrato de asesoría con Gebro.
El resto de autores declara que no existe ningún conflicto de intereses relacionado con el artículo.
A Manel Alepuz y Verónica Albert, de Gestió Organització Comunicació, S. A. por su apoyo en la conducción de la metodología utilizada para la elaboración del estudio.